El melanoma desmoplásico (MD) representa entre el 0,4-4% de todos los melanomas. Se presenta como un tumor constituido predominantemente por melanocitos fusiformes amelanóticos inmersos en un estroma colágeno abundante. Se clasifica en MD puro o mixto, basándose en la proporción de melanoma desmoplásico frente a la del melanoma no desmoplásico presente en el tumor infiltrante. En el MD puro el componente desmoplásico representa más del 90% del melanoma infiltrante mientras que, en el MD combinado o mixto, el componente desmoplásico representa menos del 90%.
El MD es más frecuente en varones (ratio 1,7-2:1); la edad media al diagnóstico oscila entre 66-69 años y suele localizarse en áreas de fotoexposición crónica, a menudo asociado a un lentigo maligno. Su reconocimiento clínico es difícil ya que se presenta como una pápula o placa no pigmentada, indurada y de bordes mal definidos, que recuerda a una cicatriz.
El MD es un tumor con una alta tendencia a la recurrencia local y en el caso del MD puro, una baja tendencia a la diseminación ganglionar. Sin embargo, en las series más contemporáneas, su pronóstico global parece ser similar al de melanomas no desmoplásicos (MND) del mismo grosor. Su abordaje clínico posee algunos matices diferenciales, en comparación al resto de melanomas, que se revisan en el presente trabajo.
Desmoplastic melanoma (DM) accounts for 0.4% to 4% of all melanomas. These skin tumors are mainly formed by amelanotic spindled melanocytes immersed in an abundant collagen stroma and are classified as pure when the desmoplastic component accounts for at least 90% of the invasive tumor and as mixed or combined otherwise. DMs are more common in men (male to female ratio, 1.7 to 2:1), and the mean age at diagnosis is 66 to 69 years. The tumors tend to occur in chronically sun-exposed areas, often in association with lentigo maligna, and are difficult to recognize because they can resemble a scar, presenting as a firm, unpigmented papule or plaque with poorly defined borders. DMs also have a strong tendency to recur locally, and pure variants rarely spread to the lymph nodes. Nonetheless, recently published series suggest that patients with DM have a similar prognosis to those with nondesmoplastic melanoma of the same thickness. The clinical management of DM varies in certain aspects from that of other melanomas and is reviewed in this article.
El melanoma desmoplásico (MD) es una variante infrecuente de melanoma caracterizado tanto por su peculiar histología como por su comportamiento biológico distinto. Fue descrito por Conley en 1971 como un tumor paucicelular constituido por células fusiformes con poca atipia y un abundante estroma colagenizado1. En cuanto a su pronóstico, es controvertido tanto en lo que se refiere al riesgo de diseminación ganglionar como a su impacto en la supervivencia2–4. El objetivo de esta revisión narrativa es ofrecer al lector una información actualizada y práctica del manejo de este tumor.
Material y métodoPara la revisión bibliográfica se realizó una búsqueda en Pubmed, EMBASE y Google Académico. La estrategia utilizada fue «desmoplastic melanoma», añadiendo diferentes términos en función del subapartado estudiado. Las referencias de los artículos elegidos fueron revisadas con el fin de identificar otros artículos relevantes.
EpidemiologíaEl MD es una variante poco frecuente de melanoma representando menos del 4% de todos los melanomas5,6. En un estudio retrospectivo reciente basado en los casos de MD diagnosticados en Holanda entre los años 2000 a 2014 se determinó que solo el 0,4% de todos los melanomas eran MD7. En un trabajo basado en datos de la National Cancer Institute's Surveillance, Epidemiology and End Results (SEER), se estimó una incidencia de 0,2 por cada 100.000 habitantes-año, con un incremento de un 4,6% anual5. Este incremento se atribuyó a la relación del MD con la fotoexposición, al envejecimiento de la población y a la mejora en su diagnóstico.
El MD es más frecuente en varones, con una ratio hombre:mujer de aproximadamente 1,7-2:15,8,9. La edad media al diagnóstico se sitúa entre 66-69 años, edad sensiblemente superior a la considerada para los melanomas no desmoplásicos (MND) que se sitúa alrededor de los 60 años5,8–10.
De forma similar al lentigo maligno (LM) y al lentigo maligno melanoma (LMM), el MD tiende a aparecer en áreas de exposición solar crónica, siendo las localizaciones más frecuentes la cabeza y el cuello (50% de los casos), seguido del tronco (20-25%) y las extremidades (20-25%). No obstante, han sido comunicados casos de MD tanto en las mucosas11 como en localización acral12, donde la fotoexposicion crónica no influiría como factor desencadenante.
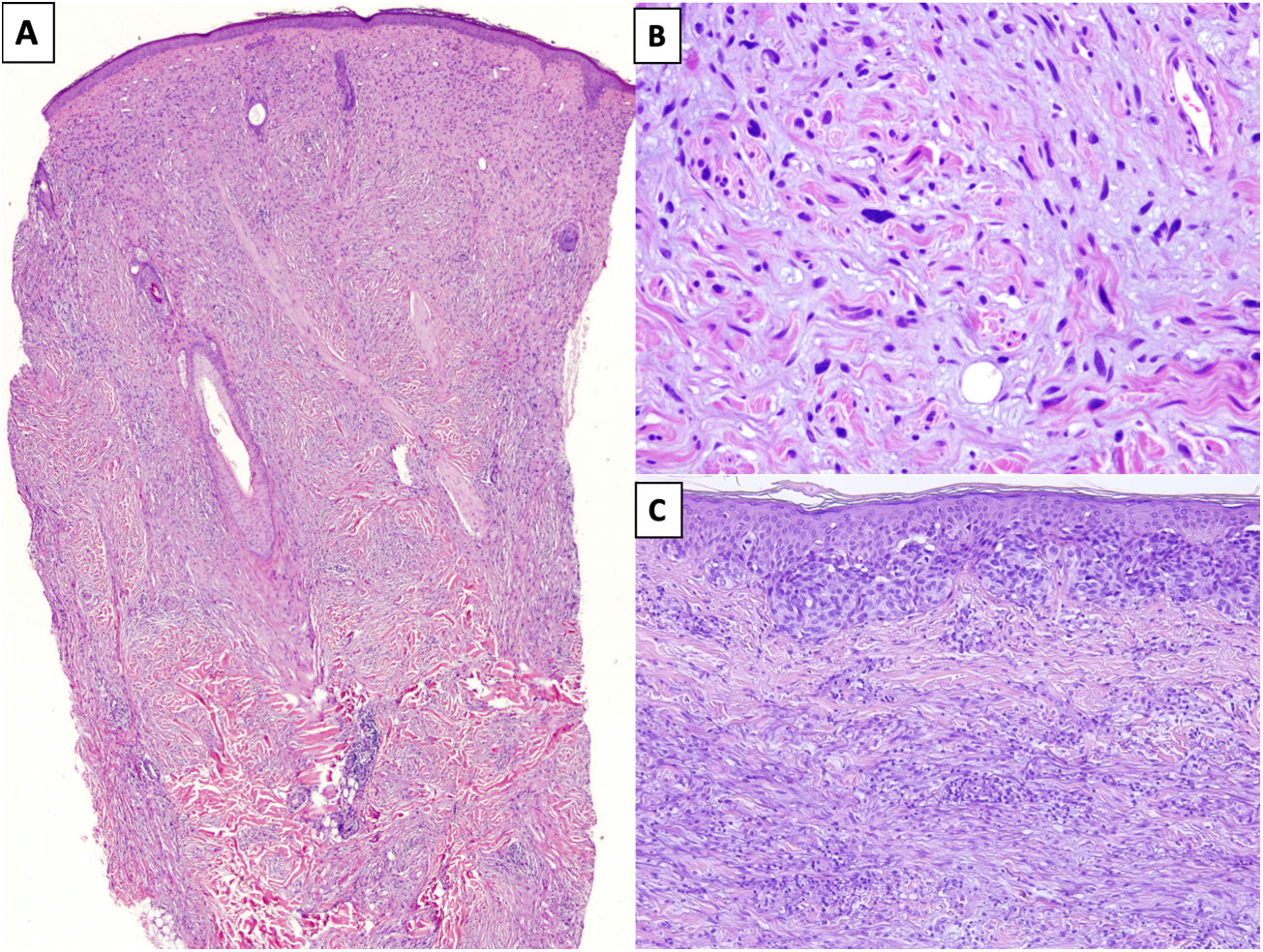
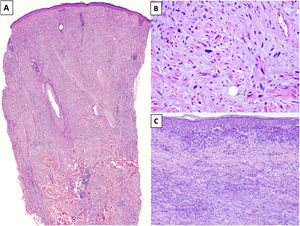
HistopatologíaEl MD es un tipo de melanoma infiltrante constituido predominantemente por melanocitos fusiformes amelanóticos inmersos en un estroma muy colagenizado1,8. Su aspecto morfológico característico es el de una neoplasia dérmica de silueta irregular, contorno mal definido y paucicelular, en la que la densidad melanocitaria es escasa o moderada y predomina el estroma de colágeno (fig. 1A). Típicamente, las células tumorales se disponen entre los haces de colágeno de forma aislada y desorganizada13. Los melanocitos suelen ser fusiformes y no pigmentados, parecidos a los fibroblastos, con citoplasmas y membranas citoplasmáticas mal definidas. La atipia citológica puede variar de mínima a moderada y las mitosis son infrecuentes (fig. 1B).
A) Melanoma desmoplásico (MD) infiltrando en profundidad, alcanzando la dermis reticular profunda (HEx20). B) MD con melanocitos fusiformes con algunos núcleos grandes e hipercromáticos, dispuestos de forma aislada y desorganizada en un estroma ligeramente fibromixoide (HEx200). C) MD asociado a un melanoma in situ (HEx200).
En casi la mitad de los casos, la epidermis suprayacente no muestra alteraciones o estas son mínimas14, y la apariencia es la de una neoplasia fibrosa o mesenquimal. En el 50% restante, se identifica una proliferación melanocítica atípica en la unión dermoepidérmica o un melanoma in situ, habitualmente tipo LM15 (fig. 1C). En estos casos, el aspecto puede ser el de un melanoma in situ o el de una lesión melanocítica juncional con una cicatriz prominente subyacente16,17.
El diagnóstico histológico del MD es difícil. La apariencia inocente y engañosa del tumor y la superficialidad de algunas biopsias hacen que este pueda pasar desapercibido o que sea confundido con otros procesos. El MD debe distinguirse de procesos o neoplasias benignas como una cicatriz, un dermatofibroma, un neurofibroma o un nevus desmoplásico, pero también de neoplasias malignas como un carcinoma sarcomatoide desmoplásico, un fibroxantoma atípico, un dermatofibrosarcoma protuberans, un fibrosarcoma, un leiomiosarcoma o un tumor maligno de la vaina del nervio periférico, entre otros.
Las técnicas de inmunohistoquímica pueden ser muy útiles en el diagnóstico diferencial, pero en algunos casos no nos ayudan. En esta última situación es importante fijarse en las características morfológicas que son frecuentes en los MD, aunque no específicas, para poder llegar al diagnóstico, y son las siguientes:
- –
El MD suele extenderse en profundidad, en muchos casos infiltra toda la dermis y alcanza el tejido subcutáneo18.
- –
Es frecuente la presencia de estroma fibromixoide19.
- –
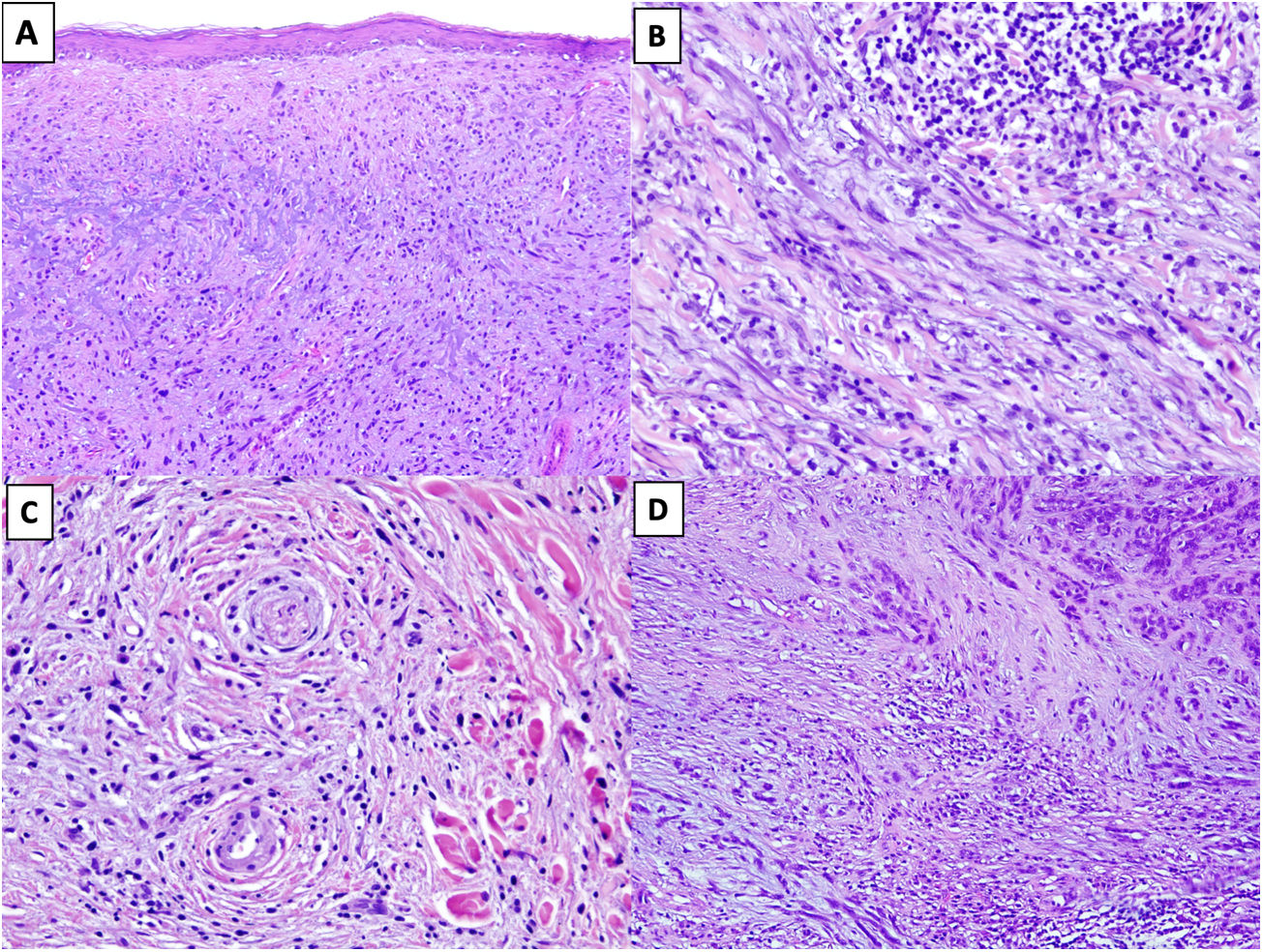
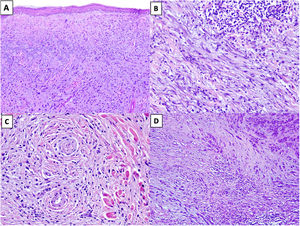
En un 80% de los casos se observa elastosis actínica en la dermis superficial20, reflejo del daño solar en zonas fotoexpuestas. Una buena clave diagnóstica es identificar agregados de material elastótico atrapado en el seno del tumor, incluso en su porción profunda, lo que no ocurre en las lesiones con las que nos podemos plantear el diagnóstico diferencial (fig. 2A)16.
Figura 2.A) MD con elastosis actínica y atrapamiento de material elastótico (HEx100). B) MD con un agregado nodular de linfocitos (HEx200). C) MD con invasión perineural. (HEx200). D) MD combinado. En el extremo superior derecho se identifica el componente de melanoma no desmoplásico formado por nidos compactos de melanocitos epitelioides. En la región inferior, se observa el componente desmoplásico que representa menos del 90% del tumor infiltrante (HEx100).
(0.55MB). - –
La presencia de pequeños agregados de linfocitos en el tumor, en el borde de infiltración y alrededor de los nervios, puede ser muy útil para sospechar un MD en los casos más paucicelulares y con atipia mínima (fig. 2B)21.
- –
Es frecuente el neurotropismo (invasión perineural o intraneural), presente en un 30% de los MD (fig. 2C)22. En ocasiones, también pueden mostrar transformación neural, considerada en la actualidad como una forma de neurotropismo23.
- –
Siempre se podrán identificar, aunque sea de forma muy focal, algunos melanocitos con núcleos grandes e hipercromáticos.
- –
Se trata de un tumor predominantemente amelanótico y es muy inusual la pigmentación difusa.
En 2004 Busam et al.13 propusieron clasificar el melanoma desmoplásico en MD puro o mixto, basándose en la proporción de melanoma desmoplásico frente a la del melanoma no desmoplásico en el tumor infiltrante. En el MD puro se requería que, por lo menos, el 90% del componente infiltrante fuera desmoplásico (asociado a un estroma fibroso). Sin embargo, en el MD mixto, el componente desmoplásico representaba menos del 90% del tumor infiltrante, y se acompañaba de un componente de melanoma no desmoplásico, constituido por grupos cohesivos de melanocitos epitelioides y/o fusocelulares sin estroma fibroso intercelular (fig. 2D).
Los subtipos histológicos del MD muestran, además, otras diferencias microscópicas. Los MD mixtos suelen ser más celulares, revelan más atipia citológica y presentan mayor índice mitótico y proliferativo (KI67) que los MD puros. Por el contrario, es más frecuente observar neurotropismo y diferenciación neural en los MD puros que en los MD mixtos13,24.
Además, los autores demostraron que la clasificación histológica del MD en puro y mixto podría tener implicaciones pronósticas, de lo que se derivaban manejos diferentes, lo que pone de relieve la importancia de clasificarlos correctamente. En algunos casos, especialmente en MD más celulares, identificar el componente desmoplásico con la tinción de hematoxilina-eosina puede ser difícil y conducir a errores en su tipificación.
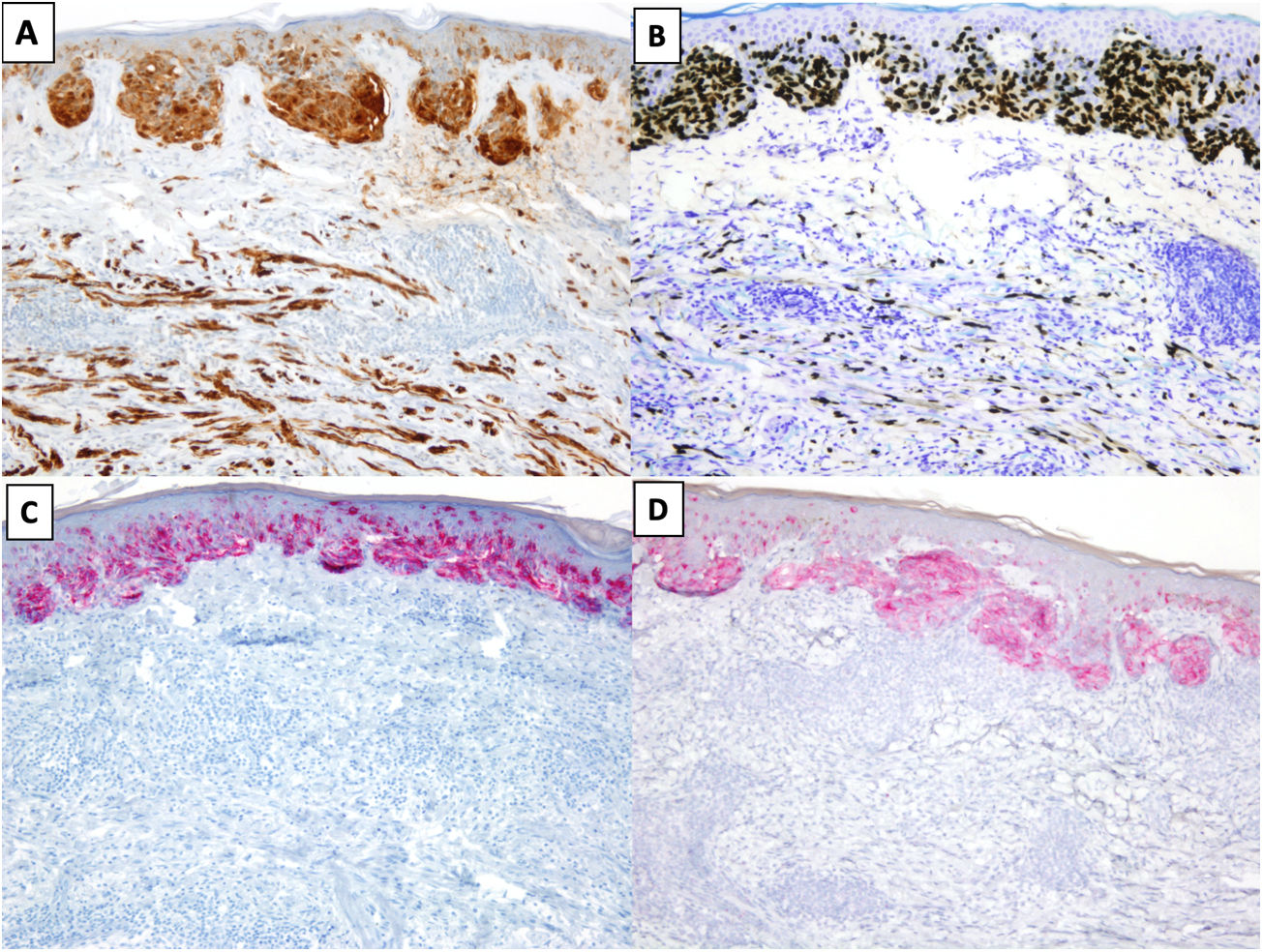
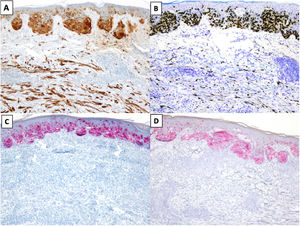
El perfil inmunohistoquímico más habitual del MD es que los melanocitos muestren positividad para S100, SOX10 y Nerve Growth Factor Receptor (NGFR) (75%), y negatividad para los marcadores de diferenciación melanocítica HMB45, tirosinasa, MiTF y melan-A (MART1) (fig. 3)25. Es importante correlacionar la positividad observada con la morfología, especialmente en piezas de re-exéresis, dado que la positividad para S10026 y SOX-1027 también puede observarse en células estromales e inflamatorias, y NGFR también se expresa en las células mioepiteliales, fibroblastos, miofibroblastos reactivos y fibras nerviosas28. Debe tenerse en cuenta que, en algunos casos, la positividad para SOX10 y/o S100 logra ser mínima o estar ausente, y no por ello debe descartarse la posibilidad de un MD29. A diferencia del MD, los melanocitos del melanoma in situ o del componente no desmoplásico de un MD mixto muestran positividad para HMB-45, tirosinasa, MITF y melan-A (Mart1), y no muestran expresión de NGFR. A diferencia de otros subtipos de melanoma donde su expresión es más frecuente, solo el 35% de los MD expresa PReferentially expressed Antigen in MElanoma (PRAME)30.
MD asociado a un melanoma in situ de extensión superficial. A) y B). Tinciones inmunohistoquímicas de S100 (x100) y SOX10 (x100): en ambas tinciones se observa positividad en las células del MD y del melanoma in situ. C) y D) Tinciones inmunohistoquímicas de melanA (x100) y HMB-45 (x100): en ambas tinciones se identifica expresión en el melanoma in situ y ausencia de expresión en el MD.
La mayoría de los MD localizados en zonas con severo daño actínico tienen cargas mutacionales muy elevadas con una fuerte firma de radiación UV. En el MD suelen estar ausentes las mutaciones activadoras en la vía de señalización de las MAPK más frecuentes en otros tipos de melanomas (como la mutación de BRAF V600E). En cambio, son frecuentes las mutaciones en los genes NF1 (55%)31, TP53 (48%) y CDKN2A (47%), y pueden observarse mutaciones activadoras en la vía de las MAPK menos frecuentes, como la amplificación del gen del receptor de la tirosina quinasa (EGFR, MET y ERBB2) y la inactivación de CBL32. Algunas de estas alteraciones podrían ser potenciales dianas terapéuticas.
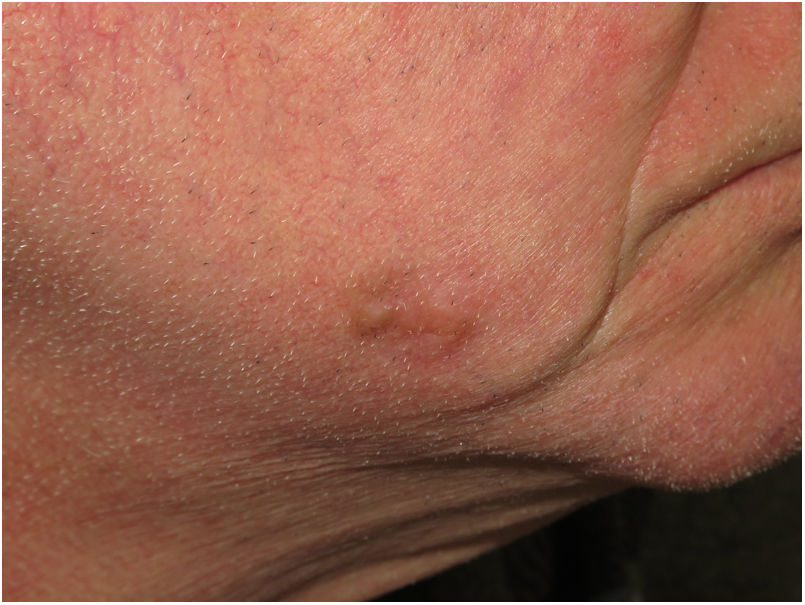
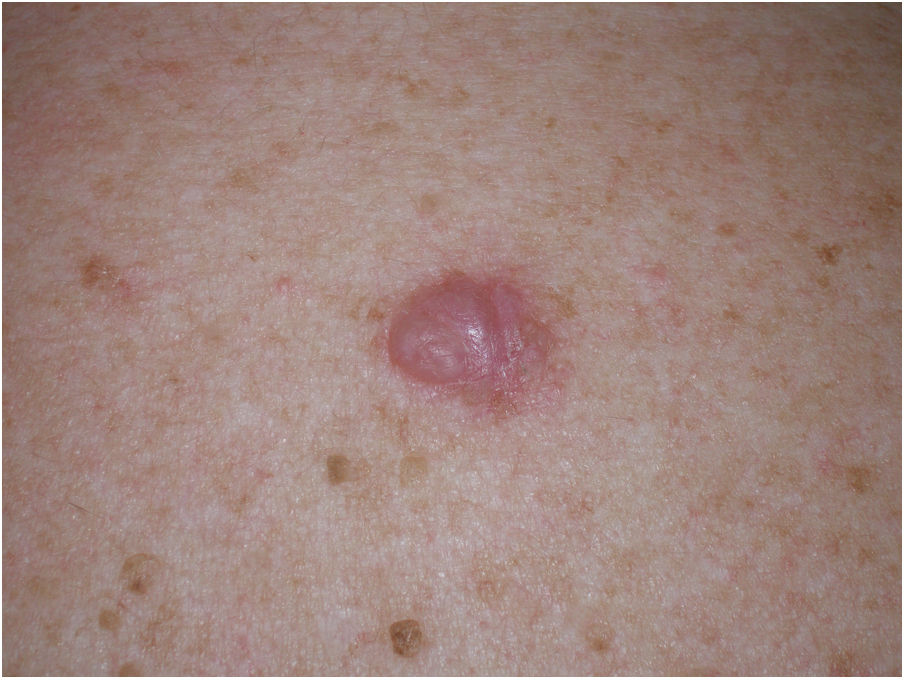
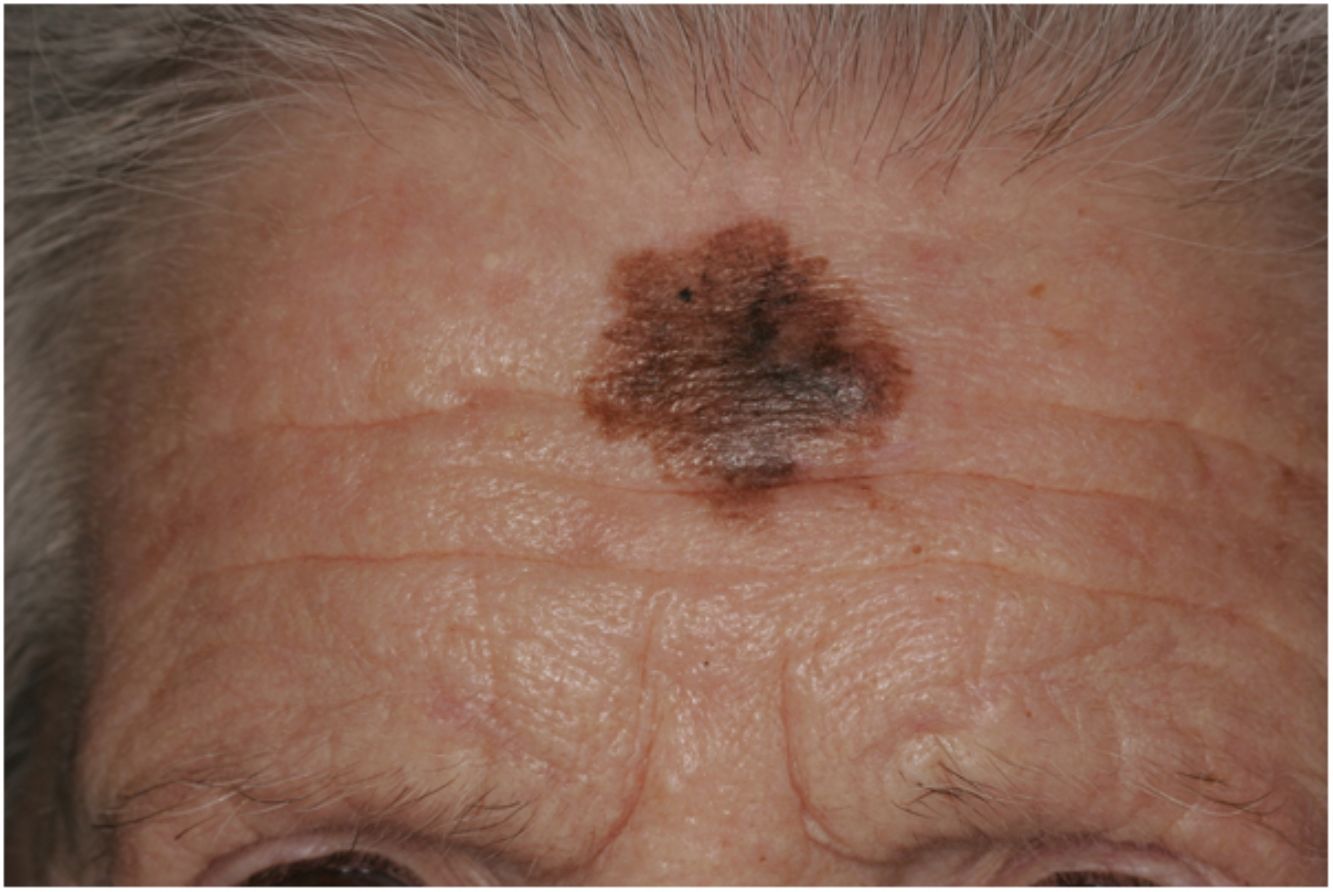
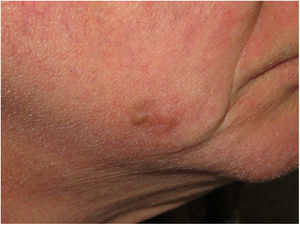
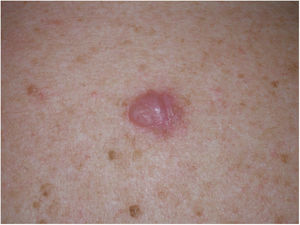
Presentación clínicaEl MD suele presentarse como una pápula o placa no pigmentada, indurada y de bordes mal definidos, localizada en piel con daño actínico (fig. 4). Solo en menos de un tercio (27%) de los casos el diagnóstico de sospecha inicial es el de melanoma maligno20. Clínicamente se confunde con frecuencia con lesiones cutáneas benignas como tejido cicatrizal, dermatofibroma, neurofibroma, nevus melanocítico intradérmico o tumores cutáneos malignos no melanocíticos como el carcinoma basocelular o el carcinoma escamoso (fig. 5).
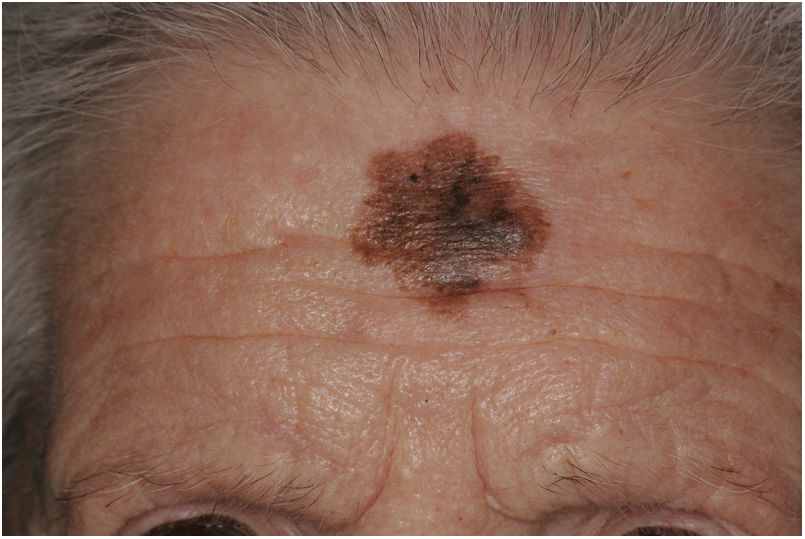
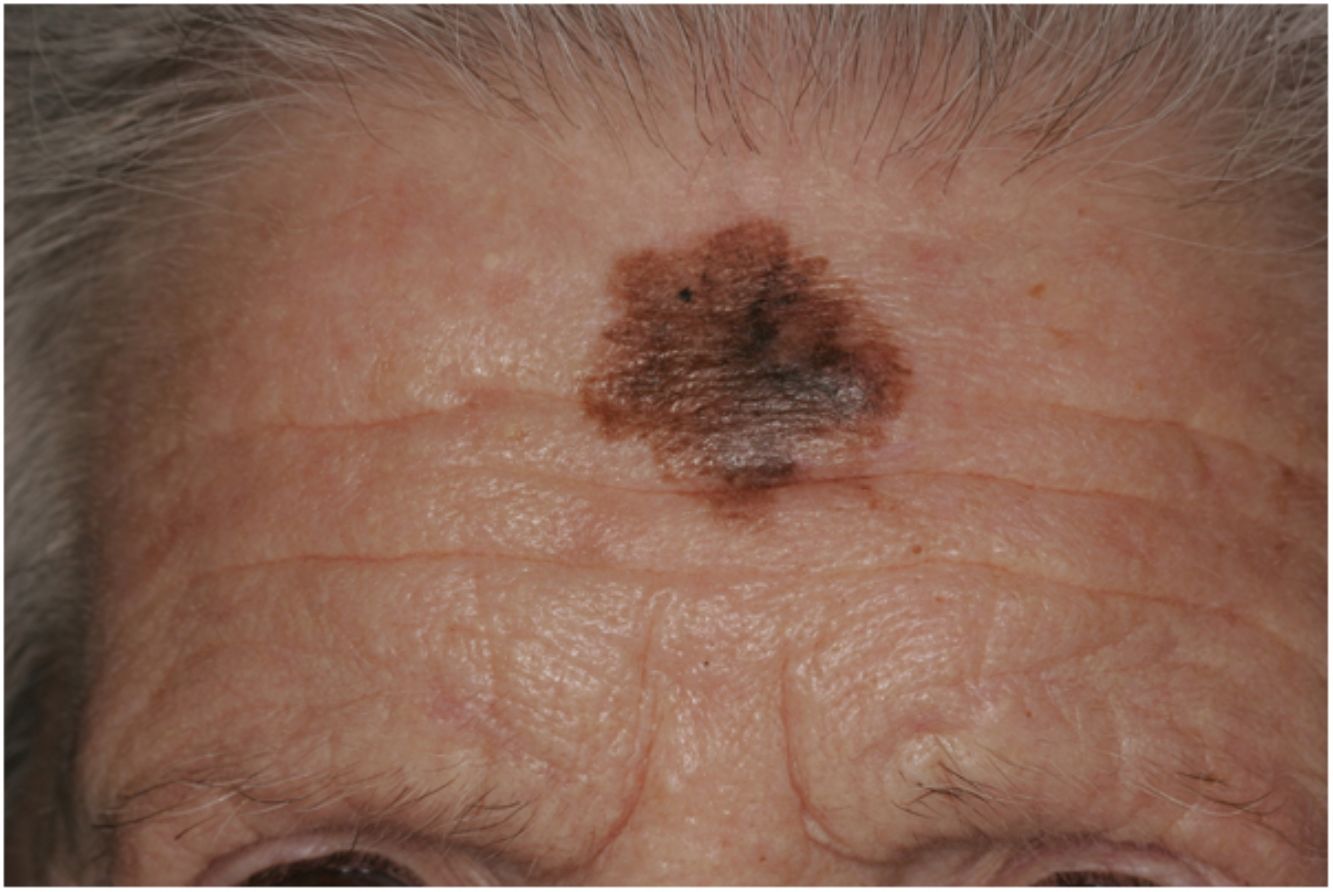
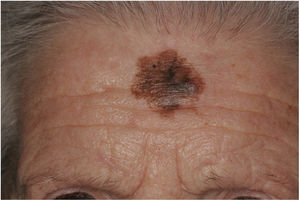
La diferenciación del MD en los subtipos mixto y puro también conlleva diferencias en su presentación clínica13. Así, la presencia de un componente epidérmico en forma de LM, LMM o melanoma de extensión superficial parece estar presente en el 80-100% de los casos de subtipo combinado. Por este motivo, con el fin de descartar la presencia de un nódulo subcutáneo indurado sugestivo de DM, se recomienda la palpación de lesiones sospechosas de LMM (fig. 6)15.
La lesión epidérmica asociada es menos frecuente en el MD puro (63-80% de los casos) que suele presentarse en forma de nódulo o placa subcutánea indurada sin cambios en superficie lo que explica que el diagnóstico del MD puro se retrase, en general, y a la vez tenga un grosor mayor que el MD mixto20,33. Tanto el MD puro como el combinado se caracterizan por un mayor espesor al diagnóstico que el del melanoma convencional, con un índice de Breslow medio entre 2,5-6,5 mm y un nivel de Clark IV y V en la mayoría de los casos5,10,20,34.
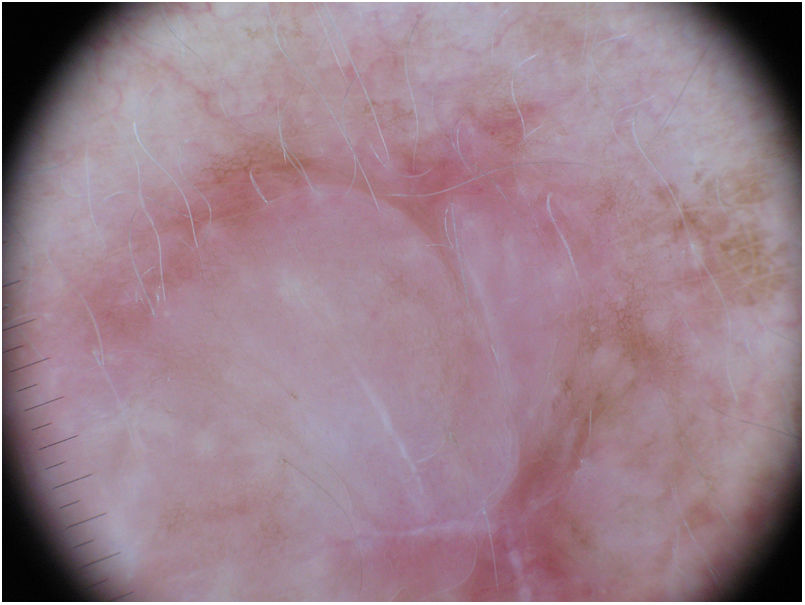
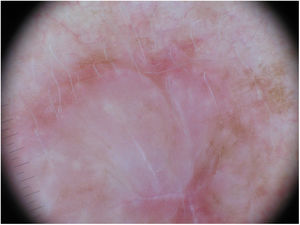
La utilización de la dermatoscopia puede ser de utilidad en el diagnóstico de MD. La ausencia de un retículo pigmentado junto con la presencia de estructuras de regresión con áreas blanquecinas cicatrizales y gránulos (peppering), así como patrones vasculares atípicos deberían alertar sobre un posible MD35. Jaimes et al. describieron en un estudio de 37 casos que la presencia de color rosado vascular, los vasos polimorfos, la presencia de gránulos y la hiperpigmentación asimétrica perifolicular eran las características dermatoscópicas más frecuentes del MD33. Solo el 43% de las lesiones presentaban estructuras específicas de lesión melanocítica como glóbulos (44%), retículo pigmentado (38%), pseudoretículo (25%) o un retículo invertido (6%) (fig. 7). No obstante, en otras series, todos los casos analizados presentaban al menos una característica específica de melanoma15,33,36. Lógicamente en el subtipo de MD mixto, asociado con mayor frecuencia a un componente epidérmico, se evidenció un mayor número y variedad de características especificas de melanoma y hallazgos dermatoscópicos asociados a LM como el patrón anular–granular y las líneas poligonales33.
Aún hay pocos datos que apoyen la utilidad de la microscopia confocal de reflectancia (MCR) en el diagnóstico del MD. En un estudio de 14 casos de MD con exploración mediante MCR y posterior análisis histopatológico, Maher et al. observaron la presencia de características especificas de melanoma en la MCR (células pagetoides, células con atipia y células nucleadas en dermis) con una frecuencia similar a la que encontraríamos en otros subtipos de melanoma36. Por el contrario, la detección de abundantes células fusiformes entremezcladas con fibras de colágeno en la dermis superficial parece relacionarse con en el diagnóstico específico del MD36.
PronósticoLa evidencia actual sugeriría que el comportamiento del MD es distinto al del melanoma convencional3,37. El MD presentaría un mayor riesgo de recurrencia local a la vez que una menor tasa de metástasis ganglionar3,34,38. Así el riesgo de afectación ganglionar sería menor al de MND de similar grosor3,37, con un riesgo de afectación del ganglio centinela que varía en función de la serie entre 0 y 18,2%3. Es difícil establecer el pronóstico real del MD, existen conclusiones contradictorias entre los distintos estudios y muchos de ellos no distinguen entre los subtipos de MD. No obstante, la mayoría de los trabajos recientes no encuentran diferencias significativas en la supervivencia respecto a los MND del mismo grosor3,6,20,37,39,40. La impresión de que el MD puro tendría una menor tendencia a las metástasis a distancia que el MD mixto, y por tanto una mejor supervivencia, no ha sido demostrada de forma constante. Si bien Maurichi et al. encontraron diferencias significativas entre la supervivencia global en función del subtipo de MD (61,3% para el MD mixto vs. 79,5% para el MD puro)39, trabajos posteriores no han corroborado estos hallazgos7,41. Cuando ocurren, las metástasis a distancia se han relacionado con recurrencias previas y lesiones profundas, siendo el pulmón la localización más frecuente para las mismas34.
La mayoría de los trabajos coinciden que los MD tienen un riesgo elevado de recurrencia local, de entre un 10-14% aproximadamente37,39,42,43, y esta diferencia es mayor en los MD puros que en los MD mixtos 39. Algunos autores atribuyen esta mayor agresividad local de los MD puros al retraso en el diagnóstico dada la rareza y la presentación atípica de estos tumores y otros factores como su frecuente invasión perineural y la extirpación con márgenes quirúrgicos insuficientes en muchos de los casos20,37.
Existen algunos factores que podrían condicionar un comportamiento más agresivo del MD. Shi et al.38, en un estudio retrospectivo de 3.657 casos de MD, encontraron que una edad superior a 68 años y el sexo masculino son factores pronóstico independientes relacionados con una peor supervivencia tanto global como libre de enfermedad. Aunque algunos trabajos respaldan estos hallazgos31,36,40, otras series no encuentran diferencias para la supervivencia libre de enfermedad37,44,45. Otro factor de mal pronóstico descrito en los MD es la invasión perineural6,46, encontrando una correlación significativa con un mayor espesor de Breslow en los casos que presentan invasión perineural20.
Estrategias terapéuticas en el melanoma desmoplásicoCirugíaMúltiples estudios han demostrado que en el melanoma cutáneo primario la exéresis amplia (2 o más cm) en melanomas ≤ 2 mm de grosor no aumenta la supervivencia39,47. Sin embargo, los MD suelen tener en el momento del diagnóstico un grosor mayor que los melanomas convencionales, por lo que requieren márgenes amplios de 2 cm con mayor frecuencia. Este hecho tiene una especial importancia teniendo en cuenta la mayor tasa de recurrencia local descrita en los MD6,34,42.
Una serie australiana6 mostró una tasa menor de recurrencia en lesiones extirpadas con ≥ 2 cm frente a lesiones extirpadas con < 1 cm. En la misma línea Maurichi et al.39 evaluaron el pronóstico basándose en los diferentes subtipos de MD y los diversos márgenes quirúrgicos utilizados. Los pacientes con MD puro con Breslow ≤ 2 mm extirpados con 1 cm de margen tuvieron un peor pronóstico, con tasas de recurrencia más altas y peor supervivencia global a los cinco años, comparado con los que fueron tratados con 2 cm de margen quirúrgico. Sin embargo, el pronóstico fue similar entre pacientes con MD puro y Breslow ≤ 2 mm y MD puro con Breslow > 2 mm que fueron tratados con 2 cm de margen quirúrgico. Para los MD mixtos, no hubo diferencias significativas en el pronóstico en función del margen quirúrgico otorgado.
Por todo ello, en MD puros se debe considerar un margen quirúrgico de 2 cm incluso en lesiones < 2 mm de grosor (más controvertido parecería en lesiones de grosor < 1 mm para los que no hay estudios que evalúen la posibilidad de establecer un margen de 1 cm3). Es decir, el margen quirúrgico amplio debería priorizarse siempre que sea posible en MD puros para evitar recurrencias locales, pero se debe tener en cuenta que en muchos casos esto puede verse condicionado porque las lesiones frecuentemente se localizan en cabeza y cuello, en áreas anatómicas complejas15.
Biopsia selectiva del ganglio centinelaLa indicación de la biopsia selectiva del ganglio centinela (BSGC) en el MD es controvertida. Actualmente la utilidad de la BSGC en melanoma es identificar aquellos pacientes con un peor pronóstico y a los que se podría ofrecer un tratamiento adyuvante. La evidencia de su utilidad en el MD se obtiene de series de casos retrospectivas. En varias de ellas se evidencian claras diferencias en la supervivencia específica del melanoma en función del estado del ganglio centinela (GC)5,37,40,44.
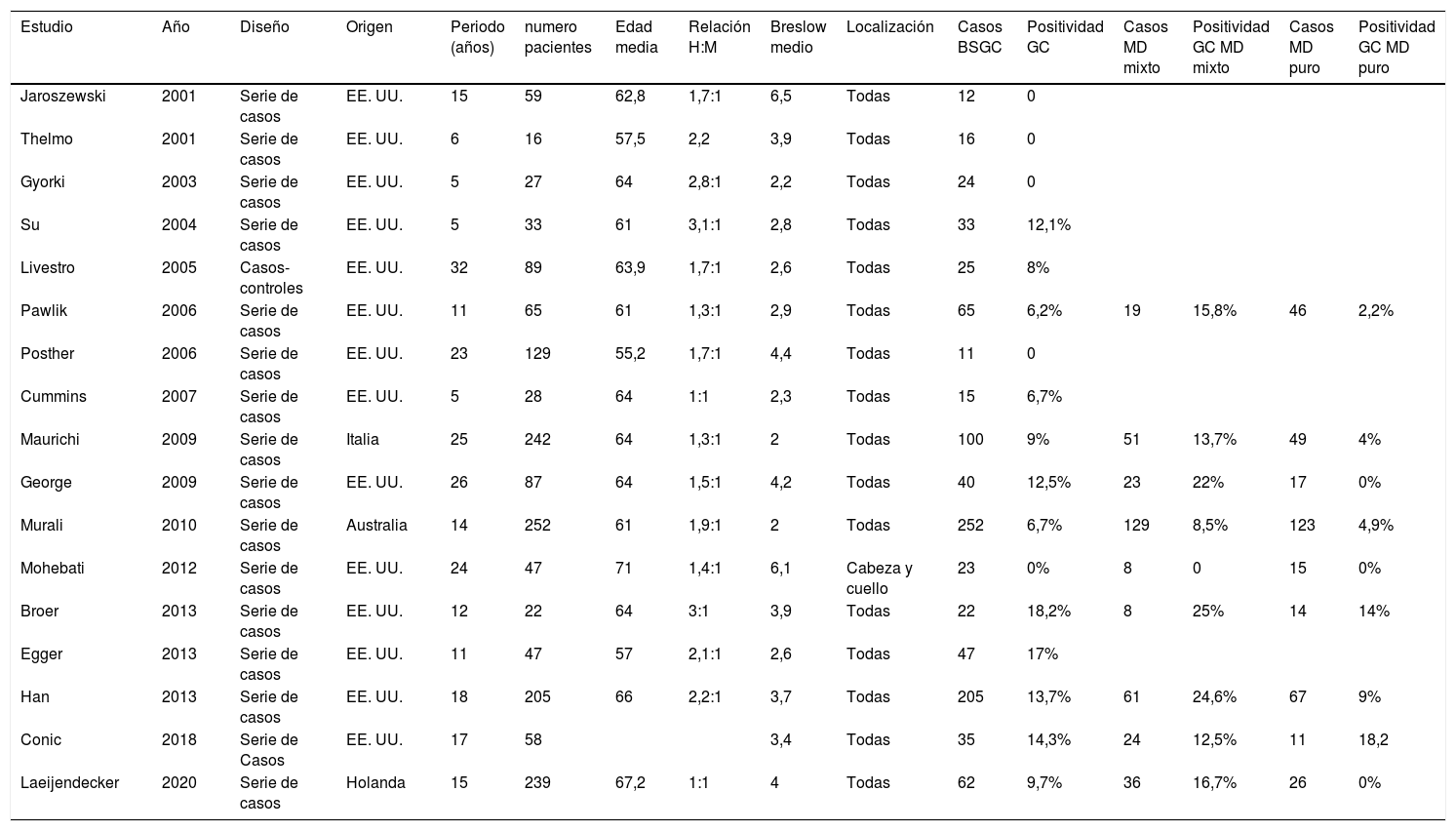
Una probabilidad del 5% de afectación del GC es el umbral a partir del cual suele considerar la indicación de la BSGC48. En las series más recientes sobre melanoma desmoplásico el porcentaje de afectación del GC varia entre 0–18,2%7,37,39–43,49–58 (tabla 1). Debe destacarse que los cinco trabajos que reportan un 0% de afectación del GC son series de menos de 25 pacientes42,43,49,50,55. En la revisión sistemática realizada por Dunne et al. publicada en 2017 y que recogía los estudios publicados hasta la fecha la tasa de afectación del GC fue del 6,5%59.
Series de casos que evalúan la BSGC en el MD
| Estudio | Año | Diseño | Origen | Periodo (años) | numero pacientes | Edad media | Relación H:M | Breslow medio | Localización | Casos BSGC | Positividad GC | Casos MD mixto | Positividad GC MD mixto | Casos MD puro | Positividad GC MD puro |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Jaroszewski | 2001 | Serie de casos | EE. UU. | 15 | 59 | 62,8 | 1,7:1 | 6,5 | Todas | 12 | 0 | ||||
| Thelmo | 2001 | Serie de casos | EE. UU. | 6 | 16 | 57,5 | 2,2 | 3,9 | Todas | 16 | 0 | ||||
| Gyorki | 2003 | Serie de casos | EE. UU. | 5 | 27 | 64 | 2,8:1 | 2,2 | Todas | 24 | 0 | ||||
| Su | 2004 | Serie de casos | EE. UU. | 5 | 33 | 61 | 3,1:1 | 2,8 | Todas | 33 | 12,1% | ||||
| Livestro | 2005 | Casos-controles | EE. UU. | 32 | 89 | 63,9 | 1,7:1 | 2,6 | Todas | 25 | 8% | ||||
| Pawlik | 2006 | Serie de casos | EE. UU. | 11 | 65 | 61 | 1,3:1 | 2,9 | Todas | 65 | 6,2% | 19 | 15,8% | 46 | 2,2% |
| Posther | 2006 | Serie de casos | EE. UU. | 23 | 129 | 55,2 | 1,7:1 | 4,4 | Todas | 11 | 0 | ||||
| Cummins | 2007 | Serie de casos | EE. UU. | 5 | 28 | 64 | 1:1 | 2,3 | Todas | 15 | 6,7% | ||||
| Maurichi | 2009 | Serie de casos | Italia | 25 | 242 | 64 | 1,3:1 | 2 | Todas | 100 | 9% | 51 | 13,7% | 49 | 4% |
| George | 2009 | Serie de casos | EE. UU. | 26 | 87 | 64 | 1,5:1 | 4,2 | Todas | 40 | 12,5% | 23 | 22% | 17 | 0% |
| Murali | 2010 | Serie de casos | Australia | 14 | 252 | 61 | 1,9:1 | 2 | Todas | 252 | 6,7% | 129 | 8,5% | 123 | 4,9% |
| Mohebati | 2012 | Serie de casos | EE. UU. | 24 | 47 | 71 | 1,4:1 | 6,1 | Cabeza y cuello | 23 | 0% | 8 | 0 | 15 | 0% |
| Broer | 2013 | Serie de casos | EE. UU. | 12 | 22 | 64 | 3:1 | 3,9 | Todas | 22 | 18,2% | 8 | 25% | 14 | 14% |
| Egger | 2013 | Serie de casos | EE. UU. | 11 | 47 | 57 | 2,1:1 | 2,6 | Todas | 47 | 17% | ||||
| Han | 2013 | Serie de casos | EE. UU. | 18 | 205 | 66 | 2,2:1 | 3,7 | Todas | 205 | 13,7% | 61 | 24,6% | 67 | 9% |
| Conic | 2018 | Serie de Casos | EE. UU. | 17 | 58 | 3,4 | Todas | 35 | 14,3% | 24 | 12,5% | 11 | 18,2 | ||
| Laeijendecker | 2020 | Serie de casos | Holanda | 15 | 239 | 67,2 | 1:1 | 4 | Todas | 62 | 9,7% | 36 | 16,7% | 26 | 0% |
La distinción entre las variantes histológicas de melanoma desmoplásico parece útil para establecer el riesgo de afectación del GC y la propia indicación de la BSGC. Así, el riesgo de afectación del GC es mayor en la variante mixta (8,5-25%) que en el melanoma desmoplásico puro (0-18,2%)7,39,41,52,54–56,58,60. En la revisión de Dunne et al. se evidenció una afectación del GC en el 13.8% de los MD mixtos y del 5,4% de los puros59. Solo un estudio ha señalado un riesgo mayor de afectación del GC en la variante pura que en la variante mixta41.
En definitiva, la indicación de la BSGC en el MD es más clara en la variante mixta y controvertida en los MD puros. Sin embargo, deben valorarse otros factores como la edad del paciente, sus comorbilidades y la localización del tumor primario. En este sentido, tanto la localización del tumor primario en cabeza y cuello como la edad avanzada que suelen presentar los pacientes con MD, son dos factores que clásicamente se asocian a una menor afectación del GC61.
Pocos estudios señalan la tasa de afectación de los ganglios no centinela (GNC) en una disección ganglionar completa tras una BSGC positiva en el MD. Dos estudios con más de 200 pacientes cada uno han obtenido afectación de los GNC en MD en porcentajes del 16,7% y 23,5%37,58, datos similares a los que se obtienen en MND62. En este sentido, con las limitaciones de la evidencia actual, parece sensato aplicar el mismo algoritmo de manejo del paciente con GC positivo que se utiliza en el melanoma convencional63.
RadioterapiaTeniendo en cuenta las altas tasas de recurrencia local descritas en los MD37,64, la adyuvancia con radioterapia (RDT) se ha planteado como una opción terapéutica interesante. A diferencia del melanoma convencional, que es relativamente resistente a la radioterapia, en el MD hay varios estudios que demuestran que su uso como tratamiento adyuvante puede ser eficaz en el control local de la enfermedad3,34,65.
Hay varios trabajos que exponen el potencial beneficio de la RDT adyuvante cuando el MD presenta factores de riesgo asociados (invasión perineural, desmoplasia extensa, márgenes positivos o enfermedad recurrente)38,66,67. Dos estudios más recientes afianzan esta asociación entre la RDT adyuvante y la mejoría del control local en los MD. Por un lado, Guadagnolo et al.68 evaluaron 130 pacientes con MD que habían sido tratados exclusivamente con cirugía o con cirugía más radioterapia adyuvante. Los autores encontraron que el 24% de los pacientes que se sometieron únicamente a tratamiento quirúrgico y sólo el 7% de los pacientes que se sometieron a cirugía más RDT adyuvante desarrollaron una recurrencia local, demostrando una correlación significativa con un mejor control local en el análisis multivariable. Por otro lado, Strom et al.69 también encontraron que el uso de la RDT adyuvante mejoraba significativamente el control local en el análisis multivariable. Los pacientes con márgenes de resección positivos tuvieron particularmente una mayor reducción de la tasa de recurrencia local, 54% sin el uso de RDT adyuvante frente al 14% con cirugía más RDT adyuvante. Además, estos autores describen factores pronósticos para seleccionar los MD con márgenes negativos que se beneficiarían de la RDT adyuvante: tumores localizados en cabeza y cuello, Breslow > 4 mm, y nivel V de Clark. También Oliver et al.70, en un estudio retrospectivo más reciente, evaluaron a 100 pacientes con MD tratados únicamente con cirugía, cirugía más RDT adyuvante o RDT radical en recurrencias post-cirugía. En este estudio evalúan el valor de la RDT como tratamiento radical en recurrencias, así como el de la adyuvancia post-intervención, encontrando un control local del 100% de los casos tanto en los 10 pacientes tratados con RDT adyuvante como en los siete pacientes tratados con RDT radical.
Sin embargo, la evidencia actual se basa en estudios retrospectivos y se precisan estudios prospectivos randomizados para afianzar estas conclusiones. Actualmente hay en marcha un ensayo clínico (NCT00975520)71 que compara el tratamiento exclusivamente quirúrgico frente a cirugía más radioterapia adyuvante en pacientes con MD extirpados con márgenes amplios negativos.
Tratamiento sistémicoLa inmunoterapia mediante fármacos anti-PD1 ha demostrado su eficacia en el tratamiento del MD metastásico. En un reciente estudio multicéntrico retrospectivo donde se analizaron 60 casos de MD metastásico tratados con fármacos anti-PD1 se evidenció una respuesta objetiva en el 70% de ellos, con un 32% de respuestas completas con un seguimiento medio de 22 meses72. Esta respuesta, incluso superior a la observada en el MND, podría explicarse por la alta carga de mutaciones inducidas por la radiación ultravioleta que presenta el MD. Se estima que la inmunoterapia podría ser más eficaz en neoplasias como el MD que presentan una alta carga mutacional73. Estos prometedores resultados deben ser confirmados en ensayos clínicos prospectivos. En la actualidad existe un ensayo en fase II (NCT02775851)74 en periodo de reclutamiento sobre la eficacia de pembrolizumab en el MD. La ausencia de mutaciones de BRAF en la mayoría de los melanomas desmoplásicos hace que los inhibidores de BRAF no sean un tratamiento útil en estos pacientes.
ConclusionesEl MD es una variante poco frecuente de melanoma con una conducta biológica distinta que requiere estrategias diagnósticas y terapéuticas diferentes al del melanoma convencional. Su diagnóstico representa un reto tanto para el clínico como para el patólogo. La clasificación histológica del MD en los subtipos puro y mixto parece ofrecer información importante sobre el comportamiento del tumor, que debe tenerse en cuenta para su tratamiento. El MD puro es aquel donde por lo menos el 90% del componente infiltrante es desmoplásico mientras que en el MD mixto, el componente desmoplásico representa menos del 90% del tumor infiltrante, y se acompañaba de un componente de melanoma no desmoplásico.
La cirugía con márgenes amplios es esencial para prevenir futuras recaídas que condicionan una peor supervivencia. El estado del ganglio centinela parece tener valor pronóstico en el MD y debe valorarse su indicación en el subtipo mixto. Más discutible parece ser su indicación en MD puro. La RDT adyuvante sobre el lecho tumoral puede ser útil en algunos casos con factores de riesgo asociados. En caso de desarrollo de metástasis la evidencia actual sugiere unas buenas tasas de respuesta con los inhibidores de puntos de control inmunológico.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Profesor Carlos Ferrándiz por la revisión crítica realizada de esta versión del manuscrito.