La aprobación de un gran número de nuevos fármacos en los últimos años y los cambios en el paradigma de tratamiento de la psoriasis hacen recomendable un nuevo documento de recomendaciones del GPS para el tratamiento de la psoriasis moderada-grave.
MetodologíaPara la elaboración del consenso se siguió la metodología de grupos nominales, con ayuda de una scoping review. Tras designar a un coordinador, se seleccionó un grupo de integrantes del GPS. El coordinador definió los objetivos y puntos clave del documento y, con ayuda de un documentalista, se realizó una scoping review incluyendo datos de Medline, Embase y Cochrane Library (hasta enero del 2021). Se seleccionaron revisiones sistemáticas, metaanálisis y ensayos clínicos no incluidos en las mismas, así como estudios de calidad en vida real. Se revisaron otras guías de práctica clínica y documentos de consenso nacionales e internacionales sobre el manejo de la psoriasis moderada-grave. El coordinador generó una serie de recomendaciones preliminares que fueron evaluadas y modificadas en una reunión de grupo nominal. Tras varios procesos de revisión, que incluyeron la revisión externa por parte de los miembros del GPS, se redactó el documento definitivo.
ResultadosEn el documento se incluyen principios generales sobre el tratamiento de los pacientes con psoriasis moderada-grave, la definición de objetivos terapéuticos y los criterios de indicación y selección de tratamiento tanto en primera como en sucesivas líneas terapéuticas de fármacos biológicos. Se abordan asimismo cuestiones prácticas como el fracaso terapéutico o el mantenimiento de la respuesta.
A new, updated AEDV Psoriasis Group consensus document on the treatment of moderate to severe psoriasis was needed owing to the approval, in recent years, of a large number of new drugs and changes in the treatment paradigm.
MethodologyThe consensus document was developed using the nominal group technique and a scoping review. First, a designated coordinator selected a group of Psoriasis Group members for the panel. The coordinator defined the objectives and key points for the document and, with the help of a documentalist, conducted a scoping review of articles in Medline, Embase, and the Cochrane Library up to January 2021. The review included systematic reviews and meta-analyses as well as clinical trials not included in those studies and high-quality real-world studies. National and international clinical practice guidelines and consensus documents on the management of moderate to severe psoriasis were also reviewed. Based on these reviews, the coordinator drew up a set of proposed recommendations, which were then discussed and modified in a nominal group meeting. After several review processes, including external review by other GPs members, the final document was drafted.
ResultsThe present guidelines include general principles for the treatment of patients with moderate to severe psoriasis and also define treatment goals and criteria for the indication of biologic therapy and the selection of initial and subsequent therapies. Practical issues, such as treatment failure and maintenance of response, are also addressed.
El Grupo de Psoriasis (GPS) de la Academia Española de Dermatología y Venereología (AEDV) inició en 2009 un proyecto para elaborar y actualizar recomendaciones basadas en la evidencia, pero incorporando también propuestas desde la práctica clínica para el tratamiento de la psoriasis con terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación1-3. El objetivo de estas recomendaciones es proporcionar a los dermatólogos una herramienta de consulta y apoyo en la toma de decisiones terapéuticas, que facilite que los pacientes con psoriasis moderada-grave reciban el mejor tratamiento disponible en cada momento. Al mismo tiempo, pretende recoger y homogeneizar propuestas —generadas e implementadas en la práctica clínica por dermatólogos expertos en psoriasis y miembros del propio GPS— que faciliten el manejo de los pacientes y mejoren sus perspectivas de respuesta clínica, conveniencia y seguridad terapéuticas. Para ello, las recomendaciones abarcan aspectos como la evaluación de la gravedad de la psoriasis y sus implicaciones prácticas, la indicación de estas terapias (1.ª línea y sucesivas), el establecimiento de objetivos terapéuticos y la respuesta al tratamiento.
Estas recomendaciones también representan el posicionamiento de la Dermatología española a través del GPS y, por ende, un instrumento útil como para los farmacéuticos hospitalarios, las asociaciones de pacientes, los gerentes de hospitales y las autoridades sanitarias.
Esta actualización incorpora algunas modificaciones con respecto a propuestas previas1-3 y nuevas consideraciones en relación con los avances en las terapias biológicas, así como los nuevos estándares internacionales derivados de la experiencia acumulada.
JustificaciónActualmente el arsenal terapéutico para la psoriasis moderada-grave es muy extenso: fototerapia (psoraleno+ultravioleta A [PUVA] y ultravioleta B de banda estrecha, fármacos sistémicos convencionales (ciclosporina, metotrexato, acitretina, fumaratos), moléculas sintéticas de nueva generación (apremilast y próximamente deucravacitinib) y terapias biológicas incluyendo algunos biosimilares (adalimumab, etanercept, infliximab, certolizumab, ustekinumab, secukinumab, ixekizumab, brodalumab, tildrakizumab, guselkumab, risankizumab y próximamente bimekizumab). Estos tratamientos se pueden utilizar en monoterapia o combinados con tratamientos tópicos u otros fármacos sistémicos convencionales.
El desarrollo del tratamiento para la psoriasis ha modificado las expectativas de eficacia y seguridad a corto-medio plazo, así como del mantenimiento de la respuesta terapéutica. La mayoría de las guías y las recomendaciones de grupos de expertos plantean objetivos terapéuticos cada vez más exigentes, en línea con lo demostrado en los ensayos clínicos aleatorizados y sus extensiones a largo plazo, refrendados por estudios en vida real.
El alto impacto económico de las nuevas terapias biológicas ha favorecido la inclusión de actores no clínicos, incluyendo gestores y pagadores, como elementos de peso en la toma de decisiones. La introducción de los biosimilares supone la oportunidad de ampliar el acceso a fármacos e incrementar la eficiencia de las terapias biológicas4,5. Sin embargo, la incorporación de los biosimilares a la primera línea de tratamiento ha condicionado con frecuencia el uso del criterio de coste absoluto como parámetro fundamental de priorización, lo que puede introducir importantes diferencias entre áreas de gestión sanitaria y problemas de equidad6. El informe de posicionamiento terapéutico en psoriasis para fármacos innovadores como guselkumab, risankizumab o tildrakizumab incluye condiciones de reembolso y la obligación de paso previo por fármacos anti-TNF-α que no se corresponden con la evidencia científica disponible y ni siquiera son coherentes con las conclusiones del propio texto. El GPS ha expresado la necesidad de una mayor independencia, transparencia, consistencia y documentación farmacoeconómica (coste incremental por respondedor, modelaje con horizonte temporal) en la elaboración de documentos empleados por los pagadores que permita una toma de decisiones que incorpore realmente la eficiencia como parámetro objetivo y medible de forma similar a lo que ocurre en otros países de nuestro entorno7.
La aprobación de un gran número de nuevos fármacos biológicos, incluyendo los biosimilares y las moléculas sintéticas de nueva generación, y los cambios en el paradigma de tratamiento de la psoriasis hacen recomendable un nuevo documento de recomendaciones del GPS para el tratamiento de la psoriasis moderada-grave.
MetodologíaDiseño del estudio. Este documento de consenso ha sido promovido por el GPS de la AEDV. Para la elaboración del consenso se siguió la metodología de grupos nominales, con ayuda de una scoping review. El proyecto se efectuó en plena conformidad con los principios establecidos en la Declaración de Helsinki, referente a la investigación médica en seres humanos, en su última versión, y de acuerdo con la normativa aplicable sobre buena práctica clínica.
Selección de participantes y desarrollo del documento. En primer lugar, se designó al coordinador y se seleccionó a un grupo de integrantes del GPS con base en su experiencia y conocimiento en psoriasis. Tras ello, el coordinador, con ayuda metodológica, definió los objetivos, el alcance, los usuarios y los apartados del documento. Finalmente, teniendo en cuenta el volumen de publicaciones sobre la eficacia y la seguridad de las terapias biológicas, incluyendo los biosimilares y las moléculas sintéticas de nueva generación en la psoriasis moderada-grave, se decidió realizar una scoping review. Para ello se contó con la ayuda de una de una experta documentalista que diseñó diferentes estrategias de búsqueda que incluyeron términos MeSH y términos en texto libres para las principales bases de datos bibliográficas (Medline, Embase y la Cochrane Library) hasta enero del 2021. Se seleccionaron revisiones sistemáticas de la literatura y metaanálisis, así como ensayos clínicos aleatorizados (ECA) no incluidos en las mismas y estudios de calidad en la vida real. Igualmente se revisaron otras guías de práctica clínica y documentos de consenso nacionales e internacionales sobre el manejo de la psoriasis moderada-grave.
Con esta información el coordinador generó una serie de recomendaciones preliminares y texto de los distintos apartados que fueron evaluadas, discutidas y modificadas en una reunión de grupo nominal. Tras varios procesos de revisión, que incluyeron la revisión externa por parte de los miembros del GPS, se redactó el documento definitivo.
ResultadosEvaluación de la gravedad de la psoriasisPara definir la gravedad de la psoriasis en la práctica clínica existen diversos índices validados y empleados de forma universal. Entre ellos destacan el porcentaje de superficie corporal afectada (BSA), el índice de área y gravedad de psoriasis (PASI) o la evaluación global del médico y del paciente (PGA y PtGA)8. En documentos previos, el GPS ha considerado la determinación del PASI absoluto como criterio más útil para evaluar, en cualquier momento del curso de la enfermedad, si el paciente se encuentra dentro de los parámetros de respuesta terapéutica1,2.
El índice de calidad de vida en dermatología (DLQI) es el más utilizado para evaluar la calidad de vida relacionada con la salud en dermatología y en psoriasis. Aunque es fácil de usar y sensible al cambio, este índice está limitado por su estructura unidimensional y equivalencia intercultural variable9.
La psoriasis supone también un importante impacto en el itinerario vital del paciente. Este concepto es reconocido como discapacidad acumulada en el transcurso vital o Cumulative Life Course Impairment (CLCI)10. La evaluación clínica del paciente y la toma de decisiones debe incorporar no solo el impacto actual, sino potencialmente futuro de la enfermedad en cada paciente, integrando la evaluación de variables sociodemográficas (p. ej., la edad o el sexo) y clínicas, como la gravedad de la enfermedad o las comorbilidades, que han sido identificadas en una reciente revisión sistemática como factores de riesgo del CLCI11.
La localización de las lesiones, la sintomatología asociada, el impacto en la calidad de vida o la resistencia a los tratamientos son otros aspectos que consideraremos en este documento para la toma de decisiones sobre el tratamiento de la psoriasis moderada-grave3.
Clasificación de psoriasis moderada-grave y criterios de tratamiento sistémicoLos criterios de clasificación del GPS de psoriasis moderada-grave se definieron en 2009 para ratificarse en 2016 (tabla 1)1-3 y representaron un salto cualitativo al incluir, más allá de parámetros objetivos aceptados por la mayor parte de las sociedades científicas (aunque arbitrarios, como la regla de los 10), manifestaciones clínicas que por sus características, extensión, localización o asociación a manifestaciones articulares representaban en sí mismas criterios de gravedad. Sin embargo, probablemente el criterio más innovador fue el de incorporar la necesidad de tratamiento sistémico o fototerapia como criterio de psoriasis moderada-grave y, por lo tanto, como elemento en la toma de decisiones. Esta propuesta se aproxima a la realizada desde otras sociedades científicas12-15.
Criterios de psoriasis moderada-grave GPS 2009 y 2016 (cualquiera de las siguientes)
| # | Criterios de gravedad moderada-grave |
|---|---|
| 1 | PASI >10 o BSA> 10 o DLQI> 10 |
| 2 | Psoriasis que precisa tratamiento sistémico en algún momento de la evolución (incluyendo tratamiento sistémico convencional, biológicos o fototerapia) |
| 3 | Psoriasis eritrodérmicaa |
| 4 | Psoriasis pustular generalizadaa |
| 5 | Psoriasis pustular localizada si esta se asocia a limitaciones funcionales o psicológicasa |
| 6 | Psoriasis que afecta a áreas expuestas (p. ej., la cara), palmas, plantas, genitales, cuero cabelludo, uñas y placas recalcitrantes cuando hay impacto funcional o psicológico para el paciente |
| 7 | Psoriasis que se asocia a artritis psoriásica |
BSA: body surface area; DLQI: Dermatology Life Quality Index; GPS: grupo de trabajo de psoriasis de la AEDV; PASI: Psoriasis Area and Severity Index.
El objetivo de las clasificaciones sobre la gravedad de la psoriasis es el de facilitar el manejo y la mejor evolución del paciente en cada situación. En este contexto, el GPS propone considerar candidatos para tratamiento sistémico (y, por lo tanto, también a terapias biológicas) a:
- 1.
Pacientes que cumplen al menos 1 de los siguientes criterios: BSA 10% o PASI> 10 o DLQI> 10.
- 2.
Psoriasis que afecta a áreas expuestas (región facial y dorso de manos) palmas, plantas, genitales, cuero cabelludo, uñas y placas recalcitrantes cuando hay impacto funcional o psicológico para el paciente.
- 3.
Psoriasis que no puede controlarse con tratamiento tópico o fototerapia.
Esta perspectiva incorpora el fracaso de la terapia tópica implementada de forma adecuada como un criterio comparable a la extensión o la localización en la conveniencia de iniciar tratamiento sistémico. La elección de un tratamiento sistémico u otro se basará en las consideraciones generales previamente comentadas en este documento y en las indicaciones de las fichas técnicas y criterios de aprobación de tratamiento sistémico por parte de las agencias reguladoras para todos los tratamientos disponibles. Esta propuesta es coincidente con la consensuada por organizaciones internacionales como el International Psoriasis Council12.
Principios generales sobre el manejo del paciente con psoriasis moderada-graveTodas las terapias biológicas, incluyendo biosimilares y moléculas sintéticas de nueva generación que han demostrado eficacia y seguridad, y que han sido aprobadas por la European Medicines Agency (EMA), se pueden prescribir en la práctica diaria y deben estar a disposición de los dermatólogos en función de las indicaciones de su ficha técnica, sin retrasos o limitaciones que puedan originar inequidades entre comunidades autónomas u hospitales. Estos tratamientos deben ser prescritos por dermatólogos con experiencia en su manejo, capaces de evaluar e incorporar las distintas variables para la mejor toma de decisiones y la optimización de los resultados clínicos en términos de eficacia y seguridad.
En la selección/priorización de este grupo de fármacos, deben tenerse en cuenta distintos factores:
- –
Relacionados con el fármaco: evidencia disponible (eficacia a corto y largo plazo, mantenimiento de la respuesta, eficacia comparativa directa e indirecta de metaanálisis entre fármacos, seguridad, eficiencia), vía de administración, velocidad de instauración del efecto, conveniencia.
- –
Relacionados con el paciente y la psoriasis: tipo de afectación, curso, gravedad, extensión e impacto de la psoriasis en calidad de vida y síntomas, tratamientos previos y la adherencia a estos, edad, sexo, peso y presencia de comorbilidades con especial atención a la artritis psoriásica.
- –
Relacionados con el sistema sanitario y su organización: resultados de los estudios de coste-eficacia. El GPS recomienda que para la priorización por criterios de eficiencia se evalúen parámetros como number needed to treat (NNT), siempre tomando como referencia los objetivos de respuesta aceptados (p. ej., respuesta PASI 90 o PASI 100 o PASI absoluto<3). La priorización por precio de adquisición puede ser considerada como arbitraria si no se acompaña de la evaluación y demostración de criterios de eficiencia.
La decisión final sobre qué fármaco prescribir debe quedar en manos del criterio clínico del dermatólogo, que después de valorar los criterios referidos y aplicarlos al paciente individual tomará una decisión final justificada.
Objetivo terapéutico del paciente con psoriasis moderada-graveLa evaluación clínica de los pacientes con psoriasis es fundamental en la toma de decisiones terapéuticas; para el establecimiento del objetivo terapéutico (que orientará la selección de una terapia concreta en el paciente individual) y para monitorizar la respuesta terapéutica. Dentro de la evaluación clínica, la valoración de la actividad de la psoriasis es fundamental. A pesar de sus limitaciones, el PASI es el estándar aceptado de medida de actividad de la enfermedad y debería ser evaluado en cada visita. Las medidas de mejoría relativa (p. ej., PASI 90) son apropiadas para evaluar la respuesta terapéutica en los ECA y para efectuar comparaciones directas o indirectas. Sin embargo, el GPS considera que la evaluación del PASI absoluto es más útil que el PASI relativo como medida de actividad para el establecimiento del objetivo terapéutico y la respuesta al tratamiento en la práctica clínica, ya que resulta independiente del PASI basal. Igualmente, el DLQI, el BSA y el PGA pueden utilizarse además del PASI para la toma de decisiones terapéuticas. El BSA siempre debe calcularse si se evalúa el PGA. En la evaluación del impacto en la calidad de vida, puede incluirse una escala analógica visual para valorar el prurito y la satisfacción del paciente con el tratamiento16. En la evaluación de localizaciones especiales (genital, cuero cabelludo y región palmoplantar), se recomienda utilizar el PGA y en el caso de la psoriasis ungueal el Nail Psoriasis Severity Index (NAPSI), ya que el PASI no es representativo.
Desde la publicación por el GPS de diversos documentos en 2009/2013/20161–3 han surgido nuevos fármacos y evidencia de calidad17-22, que permiten elevar las expectativas de los objetivos terapéuticos en la psoriasis moderada-grave. Distintos estudios han puesto de manifiesto (especialmente con los fármacos de reciente introducción) que un porcentaje relativamente alto de pacientes con psoriasis moderada-grave alcanza el aclaramiento completo. A las 16 semanas, y dependiendo del fármaco, se han descrito respuestas PASI 100 del 13,7-57,2%23-85.
Teniendo en cuenta la heterogeneidad clínica de psoriasis y la variabilidad en la respuesta a los tratamientos, el GPS considera que en el manejo actual de los pacientes con psoriasis moderada-grave se pueden establecer objetivos terapéuticos óptimos o ideales y objetivos clínicamente adecuados para un paciente individual (tabla 2).
Recomendaciones 2021 sobre el establecimiento del objetivo terapéutico en la psoriasis moderada-grave
| # | Recomendaciones |
|---|---|
| 1 | El objetivo terapéutico debe:IndividualizarseAdaptarse a las características de la enfermedadAdaptarse a las características del pacienteEstablecerse independientemente del tipo de fármaco |
| 2 | Al establecer el objetivo terapéutico es recomendable diferenciar entre:Objetivo óptimoObjetivo clínicamente adecuado |
| 3 | Entre los objetivos óptimos deben incluirse:Alcanzar una respuesta PASI 100, el PASI absoluto 0 o el aclaramiento completoAusencia de manifestaciones clínicas asociadas a la psoriasisAusencia de impacto de la psoriasis en las esferas psicológica, emocional, social y laboral del paciente |
| 4 | Entre los objetivos clínicamente adecuados deben incluirse:Alcanzar una respuesta PASI 90Alcanzar un PASI absoluto ≤ 3BSA <3% y PGA 0-1En localizaciones especiales PGA ≤1Minimizar el impacto en calidad de vidaAlcanzar la actividad mínima de la enfermedadUn DLQI de 0/1 no debe considerarse como objetivo terapéutico cuando se evalúa independientemente de la respuesta clínica |
| 5 | En pacientes concretos o situaciones determinadas (fracasos previos, comorbilidades asociadas) pueden considerarse clínicamente adecuados otros objetivos terapéuticos (respuesta PASI 75, PASI ≤ 5) |
BSA: body surface area; DLQI: Dermatology Life Quality Index; PASI: Psoriasis Area and Severity Index; PhGA: Physician Global Assessment.
En cuanto a las variables para establecer los objetivos terapéuticos óptimos y clínicamente adecuados, el GPS recomienda el empleo del PASI, preferiblemente en su valor absoluto, aunque resulta también aceptable la respuesta PASI relativa al valor basal. A pesar de las limitaciones del PASI8,86-95 se ha tenido en cuenta su amplia difusión, la correlación entre el PASI absoluto <2-3 y la respuesta PASI 90 o entre PASI 90 y DLQI 0/1, y las recomendaciones de recientes posicionamientos internacionales96-108.
Otro cambio en relación con los documentos anteriores del GPS1-3 se encuentra específicamente en los objetivos óptimos. Por primera vez, y teniendo en cuenta la nueva evidencia disponible23-85, se han incluido entre los objetivos óptimos el aclaramiento completo, definido como PASI absoluto 0 o respuesta PASI 100, reconociendo que actualmente son objetivos alcanzables al menos para un grupo de pacientes. Lo mismo ha sucedido con los objetivos clínicamente adecuados. A partir de la evidencia disponible23-85, se ha incrementado el límite superior de estos objetivos, incluyéndose ahora la respuesta PASI 90 y el PASI absoluto ≤ 2-3 (en el documento anterior se establecía en la respuesta PASI 75 y PASI absoluto ≤ 51). Sin embargo, el GPS reconoce que, a pesar de todo esto, hay escenarios en la práctica clínica —en particular aquellos pacientes en los que, por distintos motivos, han fracasado a varias terapias biológicas previas— en que se pueden aceptar objetivos de tratamiento menos exigentes y en los que puede ser todavía adecuado como objetivo terapéutico una respuesta PASI 75 o PASI absoluto ≤ 5.
Por otro lado, debe ponderarse —e integrarse en la toma de decisiones— el impacto en la seguridad, la calidad de vida y la eficiencia que puede suponer el intentar alcanzar el PASI 100/PASI absoluto 0 en todos los pacientes.
Como alternativa a lo anteriormente expuesto, en cuanto a la evaluación de la actividad de la psoriasis, se puede considerar el concepto de actividad mínima de la enfermedad (EMA), que el GPS ha definido como la ausencia de artritis activa, sin lesiones en localizaciones especiales y al menos 3 de los siguientes109,110:
- –
Picor ≤ 1/10.
- –
Descamación ≤ 2/10.
- –
Enrojecimiento ≤ 2/10.
- –
Visibilidad ≤ 2/10.
- –
BSA ≤ 2.
- –
DLQI ≤ 2.
Infliximab, etanercept y ustekinumab están indicados para aquellos pacientes con contraindicación o intolerancia a otros tratamientos sistémicos como metotrexato o PUVA. El resto de las terapias biológicas aprobadas en psoriasis tienen indicación según ficha técnica en primera línea de tratamiento para pacientes con psoriasis candidatos a tratamiento sistémico (tabla 3).
Indicaciones de los fármacos biológicos en distintas subpoblaciones
| Fármaco | Indicación en la ficha técnica (EMA) | |||
|---|---|---|---|---|
| Psoriasis adultos | Psoriasis pediátrica | Artritis psoriásica | Embarazadas | |
| Infliximab | Adultos que no han respondido, o que tienen contraindicación, o que son intolerantes a otro tratamiento sistémico, entre ellos ciclosporina, MTX o PUVA | – | Adultos con artritis psoriásica activa y respuesta inadecuada o intolerantes a FAME | Aprobado certolizumab pegol |
| Etanercept | Psoriasis en placas crónica grave en niños ≥ 6 años y adolescentes con respuesta inadecuada o intolerantes a otras terapias sistémicas o fototerapias | |||
| Ustekinumab | Psoriasis en placas de moderada a grave en adolescentes ≥ 12 años, con respuesta inadecuada, o intolerantes a otras terapias sistémicas o fototerapias | |||
| Apremilast | – | |||
| Adalimumab | Adultos candidatos a tratamiento sistémico | Psoriasis crónica en placas grave niños ≥ 4 años y adolescentes con respuesta inadecuada o que no sean candidatos apropiados para tratamiento tópico y fototerapias | ||
| Certolizumab pegol | – | |||
| Ixekizumab | – | |||
| Psoriasis en placas de moderada a grave en niños desde 6 años y con un peso corporal de al menos 25kg y en adolescentes que son candidatos a tratamientos sistémicos | ||||
| Secukinumab | Psoriasis en placas de moderada a grave en niños y adolescentes> 6 años candidatos a tratamientos sistémicos | |||
| Brodalumab | – | – | ||
| Guselkumab | – | – | ||
| Risankizumab | – | – | ||
| Tildrakizumab | – | – | ||
EMA: European Medicines Agency; FAME: fármacos modificadores de la enfermedad; kg: kilogramo; MTX: metotrexato.
En el sistema sanitario público español, guselkumab, risankizumab y tildrakizumab presentan como restricción a su reembolso el paso previo por un fármaco anti-TNF-α. Esta restricción (incluida en las consideraciones finales del grupo de coordinación del posicionamiento terapéutico es arbitraria y representa una limitación no fundamentada en el propio IPT, que propone emplear criterios de eficiencia.
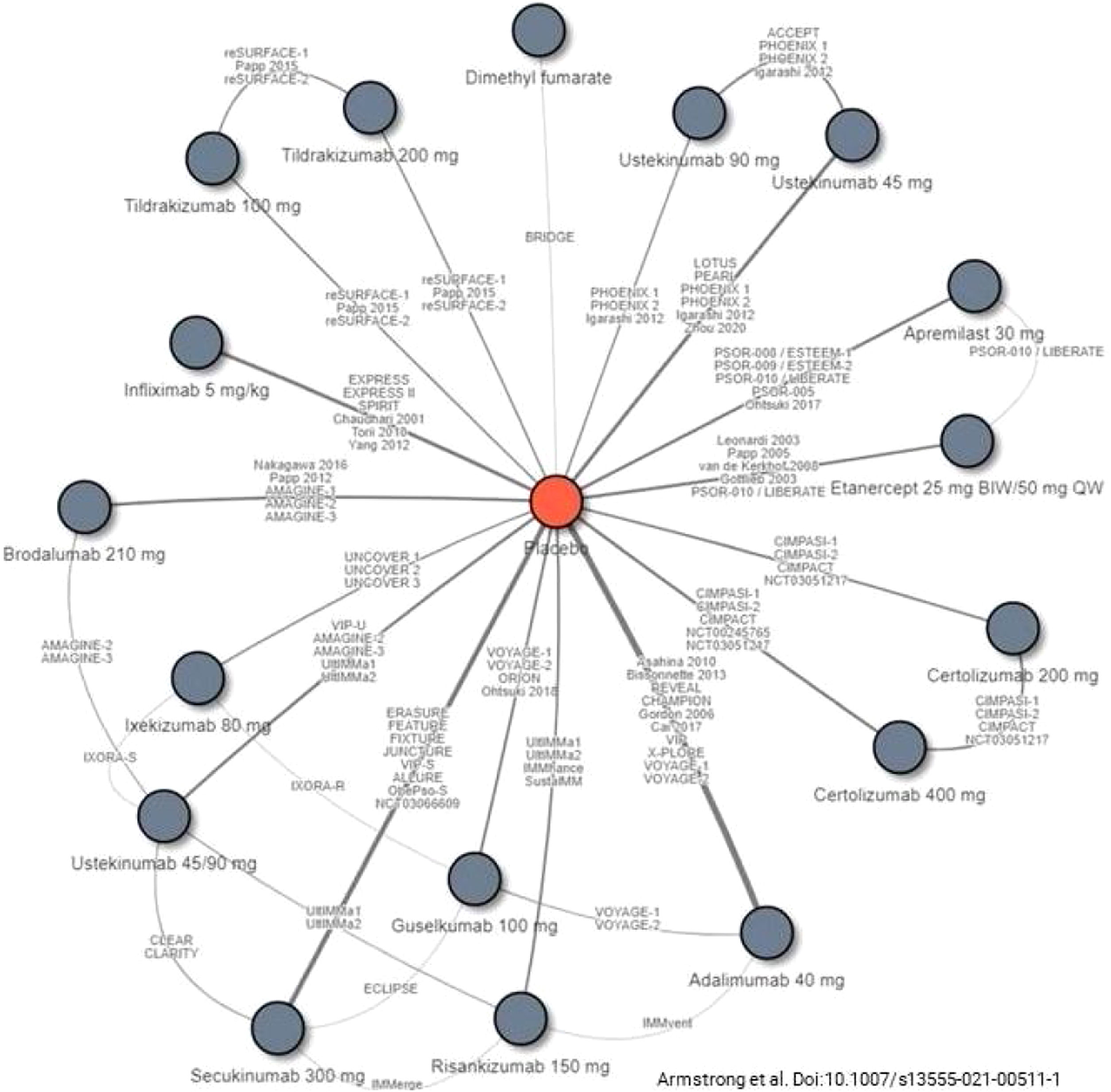
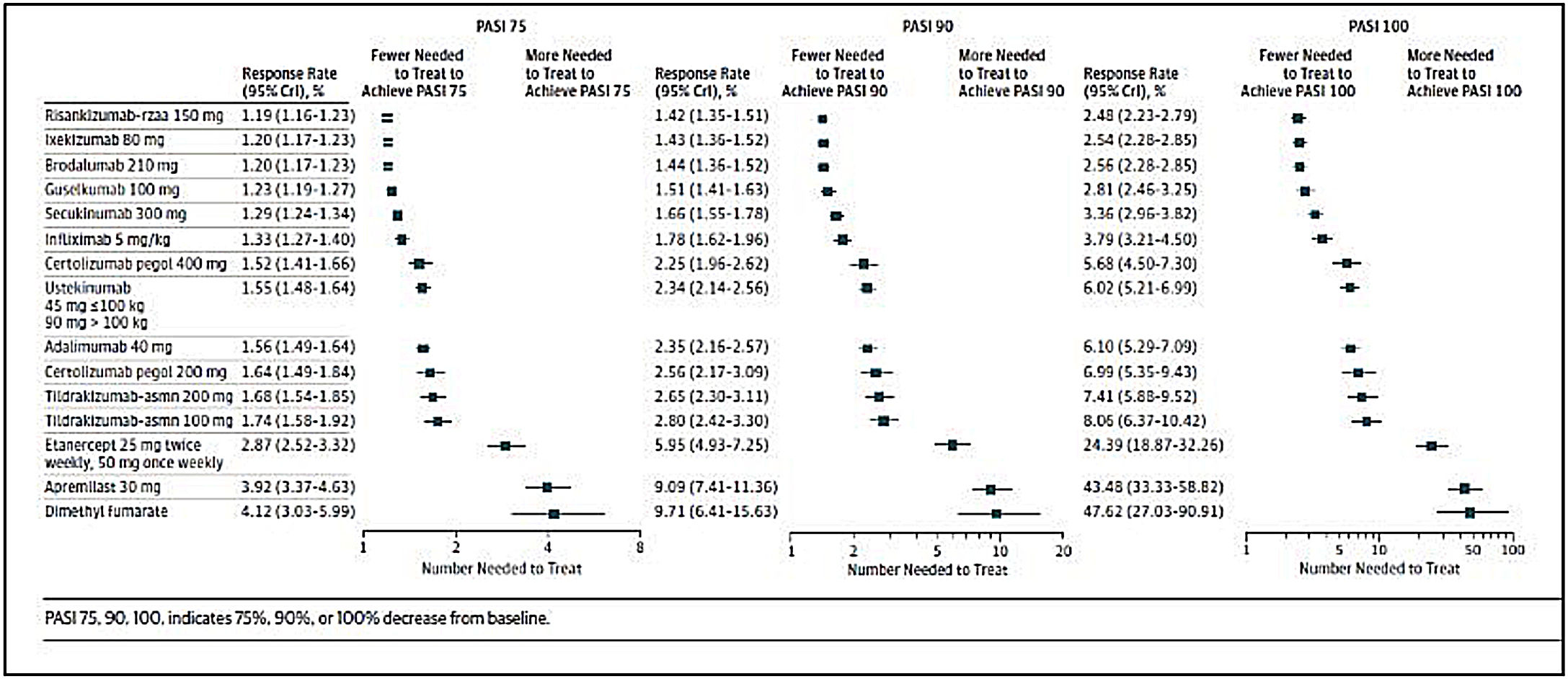
La selección de la 1.ª línea de tratamiento biológico incluyendo biosimilares y moléculas sintéticas de nueva generación depende de los factores previamente mencionados (principios generales). El GPS recomienda la evaluación de revisiones y de metaanálisis en red específicos17,19,21,111-114 (figs. 1 y 2), para la toma de decisiones en la elección de una terapia específica en función de los objetivos terapéuticos recomendados. Igualmente recomienda que se tengan en cuenta las consideraciones siguientes:
- –
En general, los inhibidores de la interleucina (IL)-17 y su receptor, y los inhibidores de la IL-23 (antip19), teniendo en cuenta su eficacia en comparación directa e indirecta con otros fármacos, y su perfil de seguridad, son los grupos que presentan, en su conjunto, un perfil con mejores perspectivas en relación con la consecución de los objetivos terapéuticos planteados en este documento.
- –
Otros grupos terapéuticos como los anti-TNF-α, inhibidores de la IL-12/23 (anti-p40), pueden considerarse como las terapias más indicadas para la 1.ª línea de tratamiento en algunos pacientes o escenarios clínicos.
- –
Teniendo en cuenta criterios de eficiencia, los biosimilares de cualquier clase terapéutica pueden considerarse como las terapias más indicadas para la 1.ª línea de tratamiento (en ausencia de contraindicaciones o consideraciones de seguridad en pacientes individuales), siempre y cuando se acompañen de estudios o valoraciones que demuestren esta eficiencia.
- –
El impacto del tratamiento en la artritis psoriásica debe tenerse en cuenta en la toma de decisiones terapéuticas.
- –
Las comorbilidades del paciente, tales como la presencia de enfermedad inflamatoria intestinal, hígado graso, enfermedad cardiovascular o enfermedad desmielinizante, pueden influir o condicionar en algunos casos la elección del tratamiento por cuestiones relacionadas con la seguridad.
Estudios incluidos en un metaanálisis en red reciente de las terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación aprobados en la actualidad para el tratamiento de la psoriasis moderada-grave.
Tomado de Armstrong et al.114.
Número adicional de pacientes a tratar, comparado con placebo, para alcanzar una respuesta PASI 75, PASI 90 o PASI 100, estimado en un metaanálisis en red reciente de las terapias biológicas incluyendo moléculas sintéticas de nueva generación actualmente aprobadas para el tratamiento de la psoriasis moderada-grave.
Tomado de Armstrong et al.113.
En la selección del tratamiento deberá incorporarse igualmente el perfil de seguridad de las terapias biológicas (véase la sección gestión del riesgo, más adelante)17,19,21,111,112. Pero, desde un punto de vista de la seguridad, para aquellos fármacos que se han incorporado en los últimos años todavía no se dispone de información suficiente a largo plazo.
Monoterapia vs. terapia combinadaEl GPS recomienda el uso de terapia biológica en monoterapia. Sin embargo, las combinaciones de estas terapias con fármacos sistémicos convencionales, fototerapia o tratamientos tópicos se podrán considerar en función de las características del paciente y de la psoriasis (preferiblemente de forma intermitente o transitoria). No existe evidencia consistente que demuestre que la combinación sea claramente más eficaz que la monoterapia115,116. Además, la combinación puede aumentar el riesgo de toxicidad115. Aunque la combinación de metotrexato con algunos fármacos biológicos podría disminuir o minimizar el riesgo e impacto de su inmunogenicidad, solo hay evidencia para el tratamiento con infliximab o adalimumab115,117.
Presencia de comorbilidadEn los últimos años se han descrito efectos potenciales de terapias o grupos terapéuticos sobre diversas comorbilidades relacionadas con la inflamación de bajo grado. Aunque hay evidencia de que algunos fármacos mejoran parámetros de riesgo cardiovascular118-120, en el momento actual no existe evidencia suficiente que permita priorizar un fármaco u otro atendiendo a esta consideración121. La aportación de nueva evidencia puede cambiar esta consideración.
La artritis psoriásica debe tenerse en cuenta para la toma de decisiones terapéuticas.
Concepto de fracaso terapéuticoEn relación con el documento del GPS de 20161, se propone eliminar el concepto de rebote ya que en la práctica diaria no influye en las decisiones terapéuticas.
Con ello, el GPS en esta actualización 2021 define fracaso terapéutico cuando se cumple alguna de las siguientes condiciones:
- –
No se ha conseguido el objetivo terapéutico propuesto para el paciente a las 16-24 semanas de tratamiento (fase de inducción): fracaso terapéutico primario.
- –
Se pierde el objetivo terapéutico propuesto para el paciente durante la fase de mantenimiento: fracaso terapéutico secundario.
- –
El paciente alcanza el objetivo terapéutico, pero a costa de toxicidad relevante que obliga a una suspensión del tratamiento: fallo de seguridad.
El GPS también quiere destacar la relevancia de evaluar la adherencia del paciente al tratamiento antes de determinar la presencia de fracaso terapéutico122.
Indicación y selección de terapia para la 2.ª y sucesivas líneas de tratamientoAnte un paciente con psoriasis moderada-grave y fracaso a terapias biológicas, incluyendo biosimilares y moléculas sintéticas de nueva generación, el GPS recomienda una de las siguientes opciones:
- –
Cambio de terapia (switch) a otra terapia biológica incluyendo biosimilares o moléculas sintéticas de nueva generación.
- –
En casos determinados se pueden valorar:
- 1.
Combinaciones con otros tratamientos sistémicos convencionales o tratamientos tópicos, preferiblemente de forma intermitente y temporal.
- 2.
Incremento de dosis/acortamiento de intervalo (en aquellos fármacos en los que están permitidos). Sin embargo, en estos casos deben tenerse en cuenta las consideraciones de la ficha técnica, de seguridad y de eficiencia.
La selección de la 2.ª línea y sucesivas de tratamiento con terapias biológicas incluyendo biosimilares y moléculas sintéticas de nueva generación depende de todos los factores comentados en los principios generales, teniendo en cuenta además que:
- –
La evidencia (eficacia y seguridad) en este punto es limitada (especialmente a mayor número de líneas de tratamiento).
- –
Ante un fracaso terapéutico primario debido a pérdida de eficacia (no se alcanza el objetivo terapéutico en ningún momento) o secundario (se pierde el objetivo terapéutico alcanzado previamente), se pueden emplear fármacos con el mismo mecanismo de acción o con un mecanismo de acción alternativo.
- –
En el caso de fracaso primario se recomienda priorizar un cambio de mecanismo de acción/clase terapéutica.
- –
En caso de fracaso terapéutico por acontecimiento adverso de clase relevante, se valorará un cambio de mecanismo de acción/clase terapéutica.
- –
Se desconoce el efecto que tienen los fracasos terapéuticos previos en el éxito de una nueva línea de tratamiento en particular.
- –
En casos determinados —pacientes con determinadas comorbilidades o fracasos previos a varias pautas de terapia biológica—, se aconseja flexibilidad en los objetivos terapéuticos. En este contexto, los criterios de respuesta adecuada deberán individualizarse en pacientes con varios fracasos terapéuticos.
En la tabla 4 se resume la evidencia disponible sobre los principales resultados tras la sustitución del fármaco.
Resumen de la evidencia disponible sobre respuestas PASI 75, PASI 90 y PASI 100 tras sustitución de un fármaco biológico
| Fármaco | Diseño del estudio | Biológico previo | Semanas | PASI 75 (%) | PASI 90 (%) | PASI 100 (%) |
|---|---|---|---|---|---|---|
| Anti-TNF-α | ||||||
| Etanercept | Registro (n=23)124 | Infliximab o adalimumab | 1624 | 1424 | – | – |
| Prospectivo, abierto (n=27)125 | Infliximab o efalizumab | 24 | 65,2 | – | – | |
| Adalimumab | Prospectivo, abierto (n=85)126 | Etanercept | 1224 | 40a31b52a63b | – | – |
| Registro (n=30)127 | Etanercept | 1224 | 2736 | – | – | |
| Registro (n=43)124 | Etanercept o infliximab | 1624 | 3858 | – | – | |
| Retrospectivo128 | Cualquier anti-TNF-α (n=52)Ustekinumab (n=53) | 12241224 | 56,982,743,471,4 | 3451,930,255,1 | 24,544,222,640,8 | |
| Cohorte, prospectivo (n=29)129 | Secukinumab | 52 | 75,9 | 15,4 | 3,85 | |
| Infliximab | Registro (n=39)124 | Etanercept o adalimumab | 1624 | 2740 | – | – |
| Prospectivo, abierto (n=215)130 | Etanercept | 10 | 52 | – | – | |
| Prospectivo, abierto (n=38)131 | Etanercept | 101824 | 719474 | – | – | |
| Inhibidor IL-23 | ||||||
| Guselkumab | Voyage 1 (ECA)132 | Adalimumab | 100 | – | 81,1 | 51,6 |
| Voyage 2 (ECA)132 | Adalimumab | 100 | – | 81,4 | 51,4 | |
| ECLIPSE (ECA)133 | Anti-TNF-αInhibidor IL-12/23, IL-23Inhibidor IL-17 (excluido secukinumab) | 484848 | – | 76,873,385,5 | 57,355,659,4 | |
| Risankizumab | LIMMitless (extensión)134 | Ustekinumab | 84 | – | 82,6 | 44,8 |
| Ultima-1,2 (ECA)135 | Anti-TNF-αInhibidor IL-17 | 5252 | – | 81,378,4 | –– | |
| IMMvent (ECA)136 | Adalimumab | 44 | – | 6 | – | |
| Inhibidor IL-17/IL-17i | ||||||
| Secukinumab | ECLIPSE (ECA)133 | Anti-TNF-αInhibidor IL-12/23, IL-23Inhibidor IL-17 (excluido secukinumab) | 484848 | – | – | 42,440,952,2 |
| Ixekizumab | Retrospectivo (n=31)137 | Secukinumab | 12 | 71 | ||
| Retrospectivo (n=69)138 | Secukinumab | 1224 | 81,180 | 72,468 | 40,538 | |
| Retrospectivo (n=17)139 | Secukinumab | 12 | 88,2 | – | – | |
| Retrospectivo (n=18)140 | Secukinumab | 12 | 50 | – | – | |
| Brodalumab | AMAGINE-2,3 (ECA)43 | Ustekinumab | 52 | 91%, 87% | – | 46%, 40% |
| Prospectivo, abierto (n=39)141 | Secukinumab o ixekizumab | 16 | 67 | 44 | 28 | |
| Retrospectivo (n=23)142 | Secukinumab o ixekizumab | 12 | 47,8 | – | – | |
| Retrospectivo143 | Secukinumab (n=7)Ixekizumab (n=3) | 12 | 67 | – | – | |
| Inhibidor IL-12/23 | ||||||
| Ustekinumab | Ultima-1,2 (ECA)135 | Anti-TNF-αInhibidor IL-17 | 5252 | – | – | – |
| ACCEPT (ECA)144 | Etanercept | 12 | – | 23,4 | – | |
| Retrospectivo (n=21)145 | Secukinumab | 48 | 69,2 | 50 | – | |
| Cohorte prospectiva (n=21)129 | Secukinumab | 52 | 85,7 | 19,1 | 4,8 |
ECA: ensayo clínico aleatorizado; IL: interleucina; PASI: Psoriasis Area and Severity Index; sem: semana; TNF: factor de necrosis tumoral.
Modificado de Tsai y Tsai123.
La evidencia disponible sobre las terceras líneas de tratamiento es actualmente muy escasa, de calidad baja-moderada y proviene de algunos subanálisis de ECA y de estudios observacionales45,146-150.
Aunque las acciones y los criterios para la selección de una terapia son los mismos que los descritos para la 1.ª y 2.ª línea, el GPS considera que cada vez que se produzca un fracaso terapéutico hay que revalorar los objetivos terapéuticos y en la 3.ª línea (y sucesivas) resulta más difícil alcanzar resultados óptimos o adecuados. Por ello, los objetivos terapéuticos podrán individualizarse en pacientes con varios fracasos terapéuticos en función de las características de los mismos.
Mantenimiento de la respuestaEn cuanto al mantenimiento de la respuesta el GPS considera lo siguiente:
- –
Los pacientes que alcanzan una respuesta óptima/clínicamente adecuada, se consideran respondedores y mantendrán el tratamiento.
- –
En la práctica diaria, si se cumplen los objetivos terapéuticos establecidos (óptimos o clínicamente aceptables) de una forma mantenida (6 meses-1 año) en el paciente con psoriasis moderada-grave, se puede valorar un cambio en la estrategia de tratamiento que incluye la reducción de dosis o el alargamiento del intervalo entre dosis.
- –
Las pautas de minoración (espaciamiento de intervalos, disminución dosis) se realizarán de forma progresiva monitorizando el mantenimiento del objetivo terapéutico. No existe evidencia firme de la mejor estrategia que permita optimizar los resultados de la minoración. Sin embargo, en la práctica clínica generalmente se procede a un aumento prudente de los intervalos de administración —30 al 50%— con pautas fáciles de recordar —p. ej., de 5-6 semanas en fármacos administrados cada 4 semanas o 10-16 semanas en aquellos administrados cada 8 o 12 semanas. Cada cambio en los intervalos de administración debe acompañarse de un seguimiento de 1 o 2 visitas que permitan monitorizar la evolución clínica de forma previa a llevar a cabo cambios adicionales.
- –
Aquellos pacientes en los que el objetivo terapéutico deje de cumplirse durante la minoración del tratamiento volverán a la pauta anterior en la que sí se implementaba.
- –
El mantenimiento de la respuesta requiere terapia continua en la mayoría de los pacientes. Sin embargo, si el paciente con la minoración sigue manteniendo el objetivo terapéutico, se puede valorar la suspensión del tratamiento. En este sentido, el GPS quiere señalar que no existe una evidencia clara del porcentaje de pacientes que van a desarrollar una recaída o exacerbación ni de la respuesta que se conseguiría con la reintroducción del tratamiento. Hay publicados algunos datos que permiten indicar que algunos pacientes podrían no alcanzar el nivel de respuesta logrado antes de la discontinuación del tratamiento82,151-154.
- –
En aquellos pacientes que pierden el objetivo terapéutico tras la suspensión del fármaco, se valorará la reintroducción del tratamiento previo.
La evolución dinámica del propio concepto de la psoriasis y del escenario terapéutico en esta dermatosis condiciona una adaptación flexible y continuada de la clasificación de la enfermedad y de las recomendaciones prácticas para los dermatólogos implicados en su manejo. En estos últimos años, la integración del impacto de la enfermedad en la calidad de vida ha permitido relativizar los criterios de clasificación de años pasados y buscar definiciones más prácticas y adaptables a la mayor parte de los pacientes. La evolución de las perspectivas en eficacia y seguridad de forma paralela a los conocimientos patogénicos también justifica el incremento de la exigencia en los resultados clínicos, en sintonía con las expectativas aportadas por los nuevos grupos terapéuticos. La llegada de los biosimilares supone una oportunidad para hacer llegar la terapia biológica a un número mayor de pacientes con psoriasis moderada grave, sin que exista duda de que este grupo terapéutico representa, en el momento actual y en su conjunto, un salto cualitativo con respecto a la terapia convencional clásica. Las implicaciones financieras y la propia llegada de los biosimilares implican, sin embargo, algunos riesgos en la aplicación de los criterios clínicos y en la equidad que deberían ser minimizados en aras de la evaluación de la eficiencia. Finalmente, la consideración de la psoriasis como una enfermedad sistémica y la importancia de las comorbilidades se integran también en la toma de decisiones y en el propio concepto de respuesta clínica.
FinanciaciónEste es un documento independiente del GPS. No ha recibido financiación específica para el mismo.
Conflicto de interesesJosé Manuel Carrascosa ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o steering comitee para Abbvie, Novartis, Janssen, Lilly, Sandoz, Amgen, Almirall, BMS, Boehringer ingelheim, Biogen, UCB.
Laura Salgado-Boquete ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Celgene, Leo Pharma, Novartis, Janssen, Lilly, Sandoz, Amgen, Almirall, UCB, Pfizer y MSD.
Lluis Puig ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Almirall, Amgen, Baxalta, Biogen, Boehringer Ingelheim, Celgene, Gebro, Janssen, JS BIOCAD, Leo-Pharma, Lilly, Merck-Serono, MSD, Mylan, Novartis, Pfizer, Regeneron, Roche, Sandoz, Samsung-Bioepis, Sanofi y UCB.
Elena del Alcázar ha participado como IP/SI y/o recibido honorarios como ponente para Abbvie, Almirall, Amgen, Celgene, Janssen, Leo-Pharma, Lilly, Novartis, Sanofi y UCB.
Isabel Belinchón ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Almirall, Amgen, BMS, Clegene, Janssen, Lilly, Leo-Pharma, Novartis, UCB.
Pablo de la Cueva ha participado como investigador y/o asesor y/o ponente con los siguientes laboratorios farmacéuticos: Abbvie, Almirall, Amgen, Astellas, Biogen, BMS, Boehringer, Celgene, Gebro, Janssen, LEO Pharma, Lilly, MSD, Novartis, Pfizer, Sandoz, Sanofi y UCB.
David Moreno ha sido investigador principal y coinvestigador en ensayos clínicos promovidos por las compañías Lilly, Novartis, Amgen, Almirall, Boehringer y Leo-Pharma.
Juan José Andrés Lencina ha participado como IP/SI y/o recibido honorarios como ponente y/o miembro de comité de expertos o asesor científico para Abbvie, Leo Pharma, Novartis, Janssen y UCB.
Los autores quieren agradecer a los miembros del GPS por sus contribuciones al documento, M. Teresa Abalde Pintos, Ignacio Alonso García, María Luisa Alonso Pacheco, Alsina Gibert Mercé, Gloria Aparicio Español, Mariano Ara Martín, Susana Armesto Alonso, Antoni Azón Masoliver, Ferrán Ballescá López, Ofelia Baniandres Rodríguez, Didac Barco Nebreda, Alvaro Barranquero Fernández, Ana Batalla Cebey, Isabel Bielsa Marsol, Xavier Bordas Orpinell, Leopoldo Borrego Hernando, Rafael Botella Estrada, Jesús María Careaga Alzaga, Rafael Carmena Ramón, Gregorio Carretero Hernández, Ana María Carrizosa Esquivel, Jose Manuel Casanova Seuma, Alberto Conde Taboada, Marisol Contreras Stelys, Pablo Coto Segura, Esteban Daudén Tello, Carlos de la Torre Fraga, Rubén del Río Gil, Aleisandre Docampo Simón, Noemí Eiris Salvado, Juan Escalas Taberner, Esther Eusebio Murillo, Jose Manuel Fernandez Armenteros, Emilia Fernandez López, M. Luisa Fernández Díaz, Almudena Fernández Orland, Carlos Ferrándiz Foraster, Marta Ferrán Farrés, Lara Ferrándiz Pulido, Eduardo Fonseca Capdevila, Manuel Galán Gutiérrez, Francisco Javier Garcia Latasa de Araníbar, Pilar Garcia Muret, Vicente Garcia-Patos Briones, Marta García Bustínduy, Ignacio García Doval, Rosa García Felipe, Alicia L. González Quesada, Beatriz González Sixto, Alfonso González Morán, Teresa Gárate Ayastui, Francisco José Gómez García, Jose Manuel Hernanz Hermosa, M. Isabel Hernández García, Pedro Herranz Pinto, Enrique Herrera Ceballos, Marta Herrera Sánchez, Rafael Jesús Jiménez Puya, Enrique Jorquera Barquero, Rosario de Fátima Lafuente Urrez, Salvador V. Laguarda Porter, Mónica Larrea Garcia, M. del Mar Llamas Velasco, Anna López Ferrer, Jesús Luelmo Aguilar, Pablo Lázaro Ochaita, Jose Luis López Estebaranz, María Marcellán Fernández, Amparo Marquina Vila, Eugenio Marrón Moya Servando, Trinidad Martin González, Antonio Martorell Calatayud, Francisco Javier Mataix Díaz, Almudena Mateu Puchades, Carolina Medina Gil, M. Victoria Mendiola Fernández, Miren Josune Michelena Eceiza, Jordi Mollet Sánchez, José Carlos Moreno Giménez, Carlos Muñoz Santos, Antoni Nadal Nadal, Belén Navajas Pinedo, Jaime Notario Rosa, Francisco Peral Rubio, Narciso Perez Oliva, Celia Posada García, Josep A. Pujol Montcusi, Conrado Pujol Marco, Silvia Pérez Barrio, Amparo Pérez Ferriols, Beatriz Pérez Suárez, Trinidad Repiso Montero, Miquel Ribera Pibernat, Raquel Rivera Díaz, Vicente Rocamora Durán, Jesús Rodero Garrido, Sabela Rodríguez Blanco, M. del Carmen Rodríguez Cerdeira, Lourdes Rodríguez Fernández-Freire, Manuel Ángel Rodríguez Prieto, Jorge Romani de Gabriel, Alberto Romero Maté, Mónica Roncero Riesco, Cristina Rubio Flores, José Carlos Ruiz Carrascosa, Diana Patricia Ruiz Genao, Ricardo Ruiz Villaverde, Montserrat Salleras Redonnet, Jorge Santos-Juanes Jiménez, María José Seoane Pose, Patricia Serrano Grau, Estrella Simal Gil, Caridad Soria Martínez, José Luis Sánchez Carazo, Manuel Sánchez Regaña, M. Dolores Sánchez-Aguilar Rojas, Rosa Taberner Ferrer, Lucía Tomás Aragonés, Francisco Valverde Blanco, Ricardo Valverde Garrido, Francisco Vanaclocha Sebastián, Manel Velasco Pastor, Diana Velázquez Tarjuelo, Asunción Vicente Villa, David Vidal Sarró, Jaime Vilar Alejo, Eva Vilarrasa Rull, Marta Vilavella Riu, Rosario Vives Nadal, Hugo Alberto Vázquez Veiga, Juan Ignacio Yanguas Bayona, Ander Zulaica Garate.
- Home
- All contents
- Publish your article
- About the journal
- Metrics