La señalización del interferón tipo I (IFN-I) interviene en la patogenia de enfermedades autoinmunes como el lupus eritematoso sistémico (LES) y cutáneo (LEC). El anifrolumab, un anticuerpo monoclonal dirigido contra la subunidad 1 del receptor del IFN-I (IFNAR1), ha sido recientemente aprobado por la FDA y la EMA para el tratamiento del LES. En 2ensayos clínicos de fase III ha demostrado ser eficaz en el tratamiento del LEC en pacientes con LES. Han sido publicados varios casos aislados y pequeñas series de casos de LEC con buena respuesta al anifrolumab.
Se realizó un estudio observacional retrospectivo en 4hospitales de la Comunidad Valenciana. Se incluyó a pacientes con LEC tratados con anifrolumab intravenoso (300mg/4 semanas) durante un mínimo de 16 semanas. Los objetivos incluyeron determinar el porcentaje de respuestas parciales (reducción ≥ 50% en el RCLASI-A), el porcentaje de respuestas completas (RCLASI-A 0) y la reducción media del RCLASI-A a las 16 semanas, así como la mediana del tiempo hasta alcanzar una respuesta parcial.
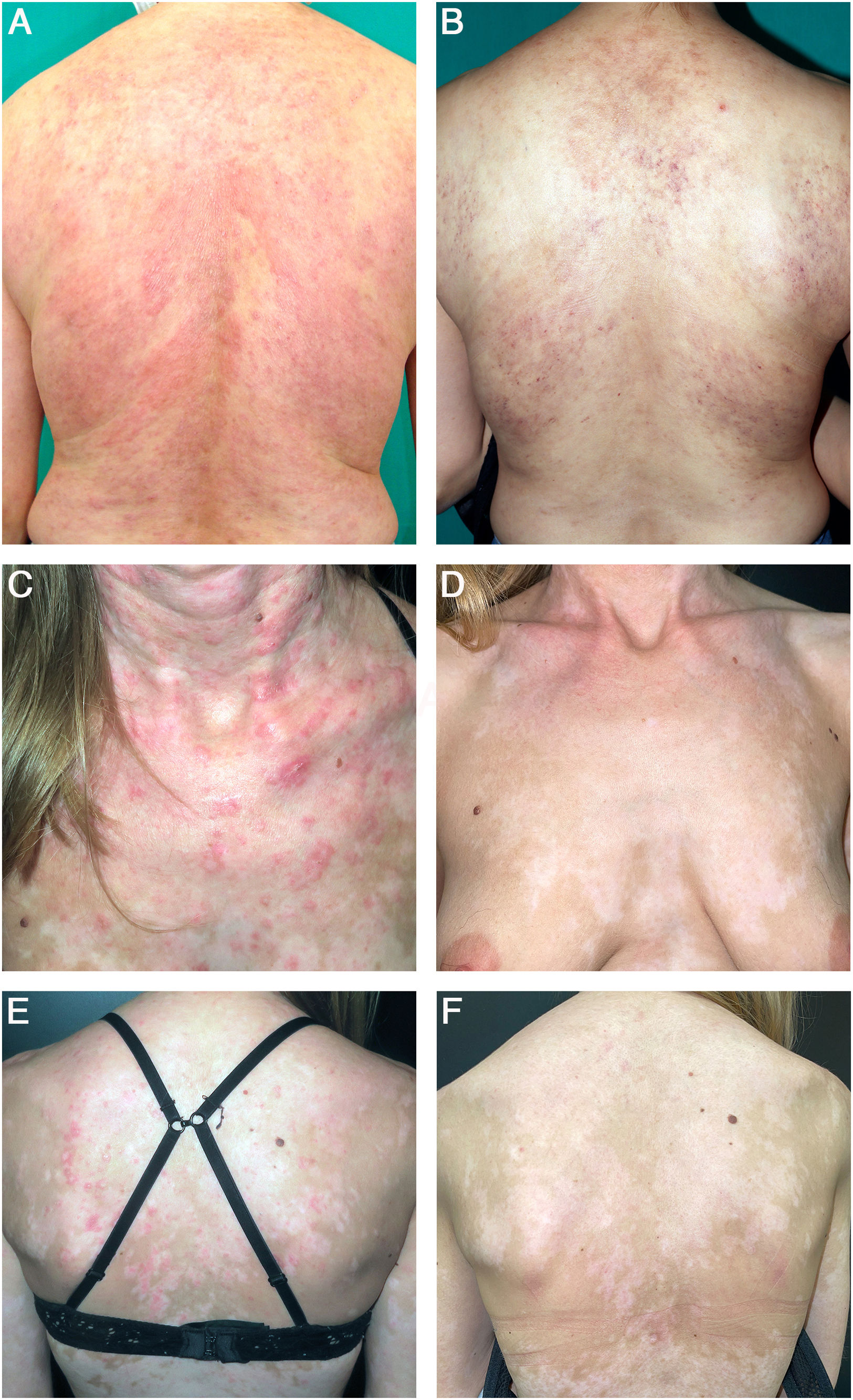
Se incluyeron un total de 9pacientes (tabla 1), todas mujeres. Compartían formas de LEC refractarias, con una mediana de 6tratamientos sistémicos previos (rango: 1-7). Todas las participantes cumplían criterios de clasificación EULAR/ACR 2019 de LES. La afectación mucocutánea más frecuente fue el LEC subagudo (LECS) (n=9), seguido de perniosis lúpica (n=3), úlceras orales (n=2) y alopecia no cicatricial (n=3). A las 16 semanas de tratamiento, todas las pacientes alcanzaron una respuesta parcial, 8 de ellas (88,89%) con una respuesta completa (fig. 1). La reducción media del RCLASI-A a las 16 semanas fue de 26,44 puntos. La mediana de tiempo hasta alcanzar una respuesta parcial fue de 4semanas (rango: 4-2). La mediana del tiempo de seguimiento fue de 20 semanas (rango: 16-48). La reducción media del RCLASI-A en la última visita fue de 26,78 puntos. Se documentaron efectos adversos en 3pacientes (33,33%): infección respiratoria de vías altas (n=1), astenia (n=1) y febrícula con reacción urticarial asintomática (n=1), todos de intensidad leve.
Características basales de los pacientes (n=9)
| Edad en años, mediana (rango) | 39 (28-48) |
| Fototipo; n (%)- I-III- IV-VI | 8 (88,89)1 (11,11) |
| Tratamientos sistémicos previos n (%)- Hidroxicloroquina- Mepacrina- Metotrexato- Micofenolato- Belimumab- Otrosa | 9 (100)5 (55,56)7 (77,78)5 (55,56)5 (55,56)5 (55,56) |
| RCLASI-A basal mediana (rango) | 22 (18-43) |
| Tratamientos sistémicos concomitantes n (%)- Corticoides orales- Hidroxicloroquina- Metotrexato- Micofenolato- Ninguno | 6 (66,67)3 (33,33)2 (22,22)3 (33,33)2 (22,22) |
LES: lupus eritematoso sistémico; RCLASI-A: escala de actividad del Revised Cutaneous Lupus Erythematosus Disease Area and Severity Index.
A) Paciente con lesiones de LECS en la espalda. B) A las 16 semanas del inicio del anifrolumab, la paciente no presentaba lesiones activas, únicamente poiquilodermia residual. C-D) Paciente con lesiones de LECS en cuello, tórax y espalda. E-F) Después de 16 semanas de tratamiento con anifrolumab, la paciente mantenía una respuesta completa con hipopigmentación postinflamatoria.
La actualización de 2023 de las recomendaciones de la European League Against Rheumatism (EULAR) para el manejo del LES posicionan al anifrolumab como tratamiento de segunda línea en la enfermedad cutánea activa, al nivel de metotrexato, micofenolato y belimumab, aunque con un mayor nivel de evidencia1. El análisis de los datos combinados de los ensayos TULIP-1 y TULIP-2 mostró superioridad del anifrolumab frente a placebo en el porcentaje de pacientes que logran una reducción ≥ 50% en el CLASI-A a las 12 semanas (46 vs. 24,9%; p = 0,001)2. No obstante, la respuesta cutánea fue un objetivo clave secundario y no se aportó información acerca de las características de la afectación mucocutánea. En los últimos 2años se han publicado múltiples casos y pequeñas series de casos que destacan la efectividad del anifrolumab a lo largo de gran parte del espectro de manifestaciones del LEC.
La mayoría de la evidencia disponible sobre el uso del anifrolumab en LEC se concentra en el tratamiento del LECS y lupus eritematoso discoide, en los que el anifrolumab ha demostrado inducir una respuesta rápida, generalmente observable en los primeros 2ciclos de tratamiento3-5. En nuestro estudio, todas las pacientes alcanzaron una respuesta parcial y, con excepción de una paciente, todas lograron una respuesta completa. Además, se destaca la rapidez del anifrolumab, ya que solo se necesitó una mediana de una perfusión para alcanzar la respuesta parcial. Tres pacientes de nuestra serie presentaron lesiones de LECS asociadas a lesiones de perniosis lúpica, hallazgo frecuente dada la asociación de ambas entidades con la presencia de anticuerpos anti-Ro, que respondieron de forma satisfactoria con anifrolumab. Varios estudios han resaltado la utilidad del anifrolumab para el tratamiento de las lesiones mucosas, tanto de lupus eritematoso discoide de mucosas6 como de úlceras7,8. En nuestro estudio, las 2pacientes con úlceras orales mostraron una rápida respuesta al tratamiento con anifrolumab. No hemos encontrado artículos que hagan referencia al manejo de la alopecia no cicatricial con anifrolumab, aunque nuestra experiencia al respecto es buena.
Los efectos adversos más frecuentes del anifrolumab en los ensayos clínicos fueron las infecciones respiratorias (48%), el herpes zóster (6,1%) y las reacciones relacionadas con la perfusión (9,4%)9. En nuestro estudio, el anifrolumab fue un fármaco seguro y bien tolerado. Observamos efectos adversos en 3 pacientes (33,33%), todos ellos de intensidad leve y que no requirieron la suspensión del tratamiento, sin ningún caso de herpes zóster.
En resumen, los hallazgos de nuestro estudio respaldan el uso del anifrolumab como una opción terapéutica rápida y efectiva para las diferentes manifestaciones del LEC, con un perfil de seguridad favorable y bien tolerado. Consideramos que el anifrolumab debe ser contemplado como tratamiento de segunda o tercera línea para el LEC.
FinanciaciónLa investigación se llevó a cabo sin el apoyo de ninguna fuente de financiamiento externa.
Confirmación de originalidadLos autores confirman que el trabajo presentado en este manuscrito es original y no ha sido publicado en otro lugar, ni total ni parcialmente. El contenido de este manuscrito no ha sido enviado para su publicación a ninguna otra revista.
Consentimiento del pacienteSe obtuvo consentimiento informado por escrito de los pacientes incluidos en este estudio para la publicación de sus detalles clínicos, imágenes y cualquier información identificable. Los formularios de consentimiento están en posesión del autor correspondiente y están disponibles para su revisión por parte del equipo editorial.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses que pudieran haber influido el contenido de este manuscrito.
Los autores desean agradecer a los doctores Carlos Abril Pérez, Miguel Ángel Navarro Mira e Iris González Villanueva su inestimable dedicación y colaboración en la elaboración de este artículo.