La pandemia de COVID-19ha podido afectar negativamente el diagnóstico precoz del cáncer de piel.
ObjetivoComparar las características epidemiológicas, clínicas e histopatológicas en los pacientes intervenidos de carcinoma de células escamosas (CCE) cutáneo antes de la pandemia y después del inicio de la pandemia.
Material y métodosSe diseñó un estudio transversal que incluía 2 series de pacientes: 1) pacientes intervenidos de CCE el año posterior a la declaración del confinamiento general en España (15 de marzo de 2020), y 2) pacientes intervenidos de CCE el año previo. Se recogieron variables epidemiológicas, clínicas e histopatológicas, así como el estadio tumoral y el grado de riesgo.
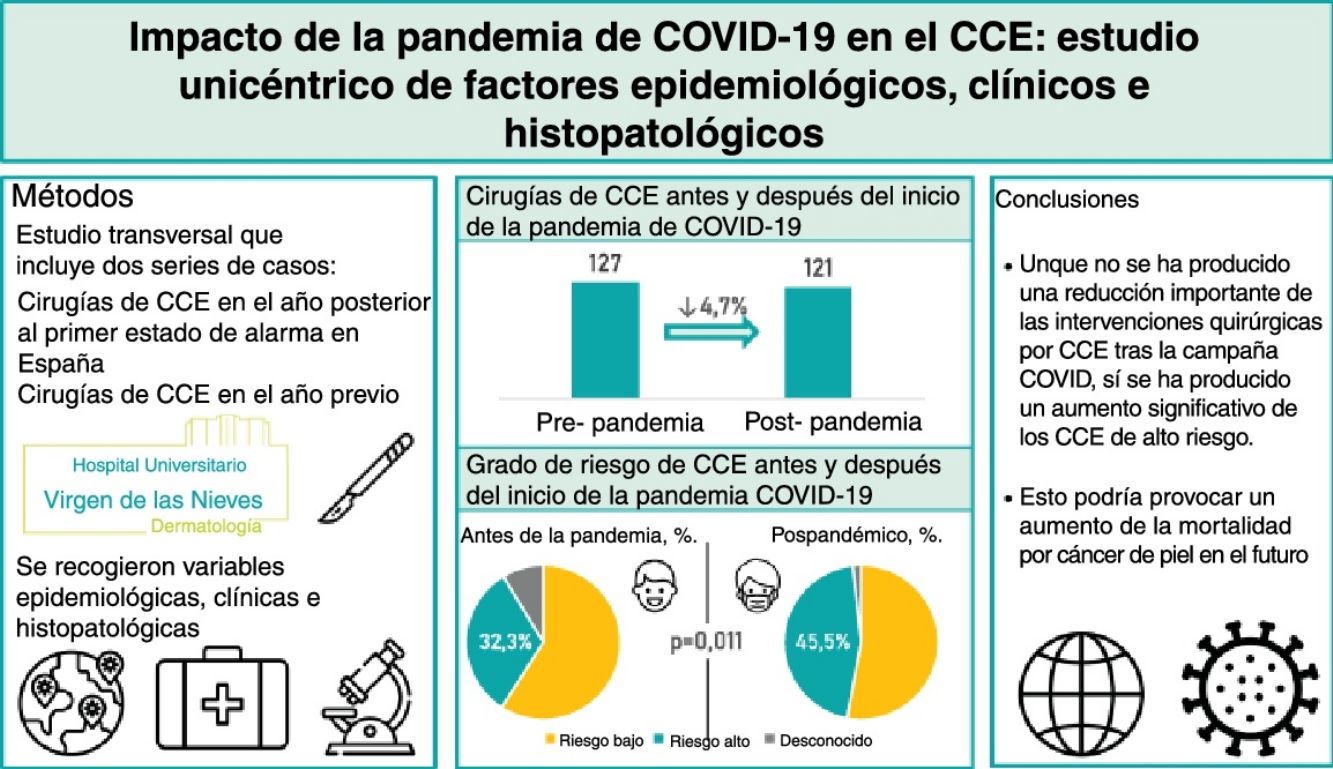
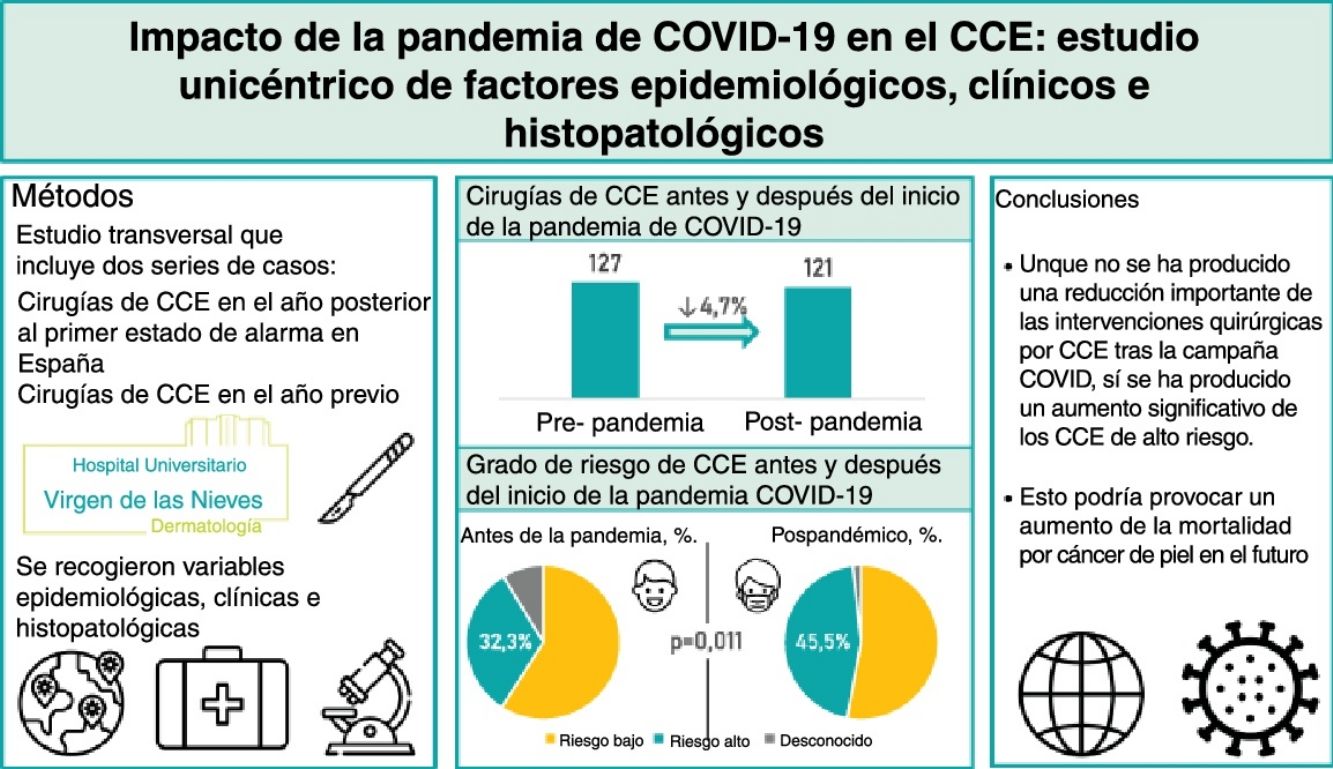
ResultadosSe incluyeron 248 pacientes (127 intervenidos antes de la pandemia y 121 intervenidos después de la pandemia). Tras el inicio de la pandemia, el porcentaje de CCE de alto riesgo aumentó significativamente de 32,3 a 45,5% (p=0,011). No obstante, no se encontraron diferencias significativas en el grosor tumoral, la invasión perineural o la presencia de metástasis.
ConclusionesAunque no se produjo una reducción significativa en el número de CCE intervenidos después de la pandemia, ha habido un incremento significativo en los CCE de alto riesgo. Todo ello puede conllevar un incremento en la mortalidad por cáncer de piel en el futuro.
The COVID-19 pandemic may have adversely affected the early diagnosis of skin cancer.
ObjectiveTo compare epidemiological, clinical and histopathological characteristics in patients undergoing cutaneous squamous cell carcinoma (SCC) surgery before and after the beginning of the pandemic.
Material & methodsWe conducted a cross-sectional study including two case series: (1) patients operated on for SCC in the year after the first state of alarm in Spain (15 March 2020), and (2) patients with SCC operated on in the previous year. Epidemiological, clinical and histopathological variables, tumour stage and risk grade were collected.
Results248 patients were included (127 undergoing surgery before the pandemic and 121 after the pandemic). After the beginning of the pandemic, the percentage of high-risk SCC significantly increased from 35.3% to 46.2% (p=0.011). However, no significant differences were found in thickness, perineural invasion or metastases.
ConclusionsAlthough there has not been a significant reduction in the number of SCC operated on after the pandemic, there has been a significant increase in high-risk SCC. All this could lead to an increase in skin cancer mortality in the future.
Una de las principales actividades asistenciales en la práctica de la dermatología es el diagnóstico y el tratamiento de los tumores malignos, como es el carcinoma de células escamosas (CCE), cuya incidencia ha ido en aumento.1 Existen determinados factores que están relacionados con el pronóstico del CCE y cuya presencia lo define como CCE de alto riesgo. Entre ellos figuran factores clínicos como el tamaño (>2cm), la localización (labio, oreja, sien), la recurrencia, los síntomas neurológicos y la inmunosupresión. Los factores histológicos de alto riesgo abarcan el grosor (>6mm), la invasión más allá de la grasa subcutánea, la escasa diferenciación celular, la invasión perineural (>0,1mm de fibras nerviosas), la invasión linfovascular y los tipos histológicos de alto riesgo (adenoescamoso, acantolítico, desmoplásico, de células fusiformes).2 Los retrasos en la cirugía del CCE, superiores a 18 meses, se asocian a tumores más gruesos e invasivos.3
En diciembre de 2019, el síndrome respiratorio agudo severo coronavirus tipo 2 (SARS-CoV-2) apareció en Wuhan (China), provocando más de 762 millones de casos y más de 6,9 millones de muertes en todo el mundo.4 La pandemia del SARS-CoV-19ha obligado a cambiar el estilo de vida de los pacientes mediante confinamientos y cuarentenas en los países más afectados.5,6 En dermatología, la teleconsulta se ha generalizado en los peores momentos de la pandemia, permitiendo mantener la atención no presencial.7,8 Si bien es una herramienta muy útil para la detección precoz del cáncer de piel, no permite realizar una exploración completa del paciente, por lo que existe el riesgo de un infradiagnóstico.9–11 Los efectos reales de la pandemia de COVID-19 sobre el diagnóstico precoz del cáncer de piel siguen sin estar claros. Este estudio pretende comparar los aspectos epidemiológicos, clínicos e histopatológicos de los pacientes intervenidos de CCE un año antes de la declaración del confinamiento en España con los intervenidos en el mismo periodo tras el confinamiento.
Pacientes y métodosDiseño del estudioSe realizó un estudio observacional, unicéntrico y transversal.
Población de estudioNuestra población de estudio comprendió aquellos pacientes intervenidos quirúrgicamente por CCE en el servicio de dermatología del Hospital Universitario Virgen de las Nieves entre el 15 de marzo de 2020 y el 15 de marzo de 2021. Estos pacientes fueron comparados con aquellos que fueron tratados quirúrgicamente por CCE durante el mismo periodo entre 2019 y 2020.
Los criterios de inclusión fueron: pacientes mayores de 18 años diagnosticados de CCE mediante estudio histológico en los periodos de estudio establecidos, estadificación completa mediante valoración clínica y/o pruebas de imagen según el sistema de estadificación AJCC 2018.12 Los pacientes que no cumplían estos criterios fueron excluidos del estudio.
Fuente de datosLa recogida de datos se basó en las historias clínicas de cada paciente y en los informes anatomopatológicos de las biopsias tumorales.
VariablesSe recogieron datos sobre la edad, el sexo, el estado de inmunosupresión, la localización de la lesión, el momento del diagnóstico (inicio prepandémico, inicio pospandémico), las características histopatológicas del CCE (el grosor tumoral, la invasión tumoral, la ulceración, el tipo histológico, el grado de diferenciación celular, la invasión linfovascular y la invasión perineural), la presencia de metástasis a distancia, el estadiaje TNM, el estadiaje tumoral según el sistema de estadiaje AJCC 201812 y el grado de riesgo del CCE. En cuanto al grado de riesgo, se consideraron CCE de alto riesgo aquellos en los que estaba presente una de las característica de riesgo elevado.2 Los factores clínicos de alto riesgo incluyen un tamaño tumoral superior a 2cm, la localización en el labio inferior, en la oreja o la sien, un tumor recurrente, una tasa de crecimiento del diámetro superior a 4mm al mes,13 la presencia de síntomas neurológicos (dolor y parestesia, prurito o parálisis motora) y la inmunosupresión (trasplante, neoplasia hematológica, terapia inmunosupresora crónica, VIH positivo). Los factores de alto riesgo relacionados con la histología tumoral son el grosor tumoral superior a 6mm, la invasión tumoral más allá de la grasa subcutánea, el escaso grado de diferenciación celular, la invasión perineural (fibras nerviosas de más de 0,1mm de diámetro), la invasión linfovascular y las variantes histológicas de alto riesgo (adenoescamosas, acantolíticas, desmoplásicas y fusocelulares).
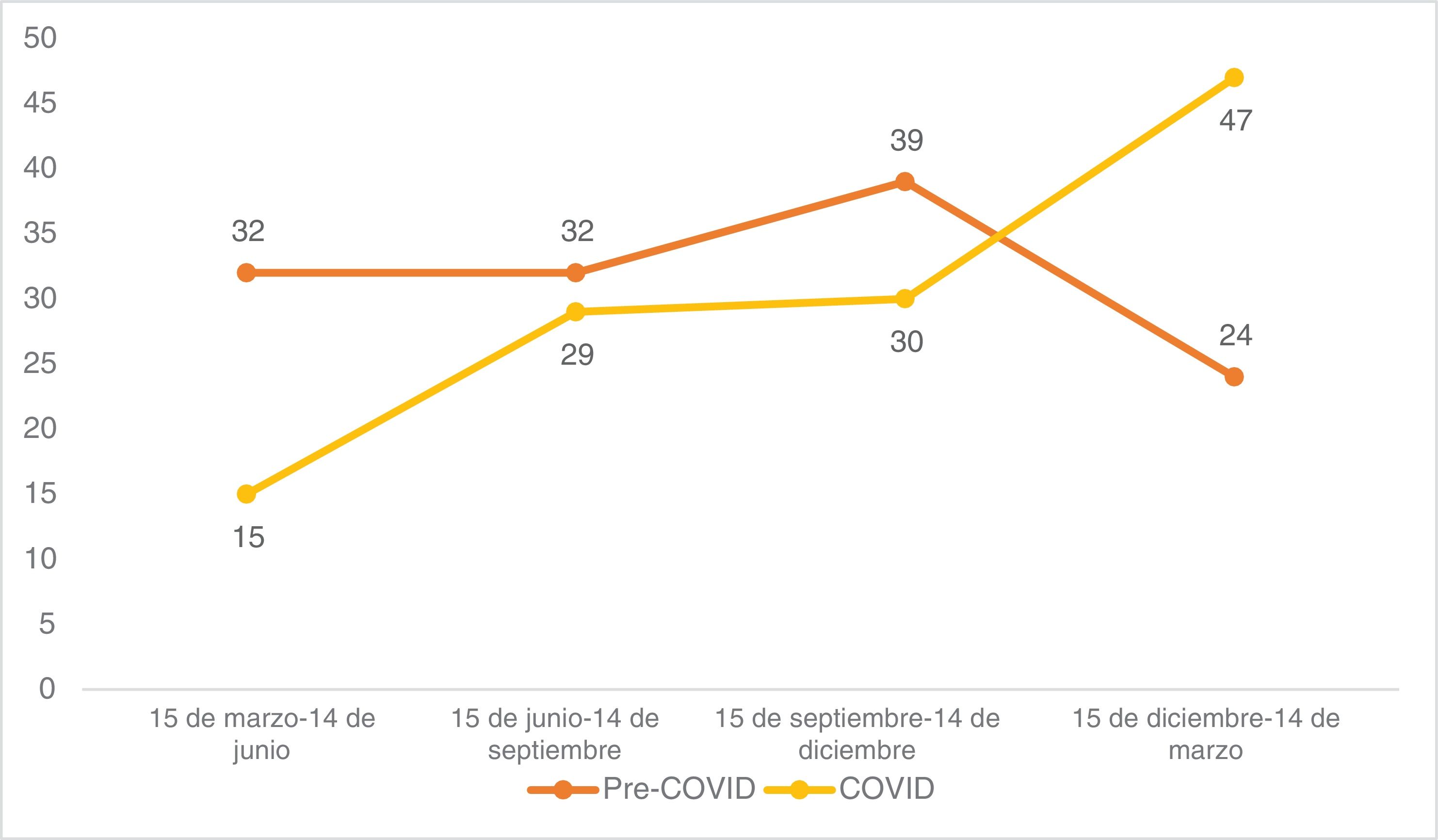
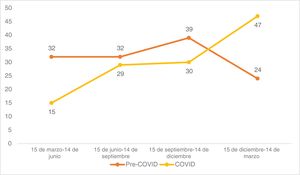
El número de tumores operados y el porcentaje de tumores de alto riesgo se estratificaron trimestralmente para determinar su distribución en los periodos de estudio. Cada periodo de estudio se dividió en cuatro: 15 de marzo -14 de junio, de 15 de junio -14 de septiembre, de 15 de septiembre -14 de diciembre y de 15 de diciembre -14 de marzo.
La actividad en la consulta y el quirófano de nuestro departamento no se interrumpió durante la pandemia.
Análisis estadísticoSe realizó un análisis descriptivo de los datos. Se obtuvieron medias y desviaciones típicas para las variables cuantitativas y porcentajes para las variables cuantitativas, con el fin de mostrar las características de la muestra recogida. Para la comparación de variables cuantitativas se utilizaron tablas de contingencia y, cuando fue necesario, la prueba de chi-cuadrado o la prueba exacta de Fisher. Las diferencias con un valor p<0,05 se aceptaron como estadísticamente significativas. Para el análisis estadístico se utilizó el programa informático IBM SPSS versión 28.
Aspectos éticosEste estudio se realizó recogiendo datos de informes médicos y anatomopatológicos, sin intervenciones que pudieran suponer algún riesgo para los pacientes. Este estudio fue aprobado por el Comité de Ética del Hospital Universitario Virgen de las Nieves (código de protocolo 1267-N-22).
ResultadosSe estudiaron 248 pacientes: 127 prepandémicos y 121 postpandémicos, una disminución del 4,7% (tabla 1). La edad media pasó de 79,3 a 76,5 años después de la pandemia (p=0,046). Los varones aumentaron del 55,9% al 68,6% entre los pospandémicos (p=0,04). Los pacientes inmunodeprimidos fueron el 12,6% dentro de los prepandémicos y del 18,2% entre los postpandémicos.
Factores epidemiológicos, características clínicas e histopatológicas, estadiaje y estado de riesgo de los pacientes intervenidos de CCE antes y después de la pandemia
| Pre-pandemia, N (%) | Pandemia, N (%) | p | |
|---|---|---|---|
| Edada | 79,3 (10,6) | 76,5 (10,8) | 0,046 |
| Sexo | 0,04 | ||
| Masculino | 71 (55,9) | 83 (68,6) | |
| Femenino | 56 (44,1) | 38 (31,4) | |
| Inmunosupresión | 0,22 | ||
| Si | 16 (12,6) | 22 (18,2) | |
| No | 111 (87,4) | 99 (81,8) | |
| Localización | 0,09 | ||
| Cara | 51 (40,2) | 39 (32,2) | |
| Sien | 8 (6,3) | 8 (6,6) | |
| Cuero cabelludo | 22 (17,3) | 19 (15,7) | |
| Oreja | 14 (11,0) | 12 (9,9) | |
| Labio inferior | 3 (2,4) | 6 (5,0) | |
| Tronco | 8 (6,3) | 9 (7,4) | |
| Miembro superior | 7 (5,5) | 21 (17,4) | |
| Miembro Inferior | 14 (11,0) | 7 (5,8) | |
| Espesor tumorala | |||
| Total | 3,01 (3,16) | 3,27 (3,18) | 0,49 |
| Invasivob | 4,05 (3,02) | 4,27 (2,99) | 0,61 |
| Invasión tumoral | 0,34 | ||
| In situ | 30 (25,6) | 27 (22,3) | |
| Invasivo | 87 (74,4) | 92 (76,0) | |
| Desconocidoc | 0 (0,0) | 2 (1,7) | |
| Ulceración | 0,37 | ||
| Si | 38 (29,9) | 30 (24,8) | |
| No | 89 (70,1) | 91 (75,2) | |
| Tipo histológico de riesgo | 0,43 | ||
| Si | 3 (2,4) | 5 (4,1) | |
| No | 124 (97,6) | 116 (95,9) | |
| Diferenciaciónc | 0,48 | ||
| Bien | 31 (32,0) | 30 (31,6) | |
| Moderadamente | 43 (44,3) | 49 (51,6) | |
| Pobre | 18 (18,5) | 15 (15,8) | |
| Desconocido | 5 (5,2) | 1 (1,0) | |
| InvasiónLinfovascular | 0,13 | ||
| Si | 0 (0,0) | 1 (0,8) | |
| No | 116 (91,3) | 116 (95,9) | |
| Desconocido | 11 (8,7) | 4 (3,3) | |
| InvasiónPerineural | 0,95 | ||
| Si | 4 (3,1) | 4 (3,3) | |
| No | 110 (86,6) | 114 (94,2) | |
| Desconocido | 13 (10,2) | 3 (2,5) | |
| Metástasis a distancia | 0,31 | ||
| Si | 0 (0,0) | 1 (0,8) | |
| No | 117 (92,1) | 118 (97,5) | |
| Desconocido | 10 (7,9) | 2 (1,7) | |
| T | |||
| IS | 30 (23,6) | 27 (22,3) | 0,68 |
| 1 | 55 (43,3) | 53 (43,8) | 0,66 |
| 2 | 14 (12,0) | 9 (7,4) | 0,25 |
| 3 | 18 (14,2) | 29 (24,0) | 0,08 |
| 4 | 0 (0,0) | 1 (0,8) | 0,32 |
| Desconocido | 10 (7,9) | 2 (1,7) | |
| N | 0,32 | ||
| 0 | 117 (92,1) | 118 (97,5) | |
| + | 0 (0,0) | 1 (0,8) | |
| Desconocido | 10 (7,9) | 2 (1,7) | |
| M | 0,32 | ||
| 0 | 117 (92,1) | 118 (97,5) | |
| 1 | 0 (0,0) | 1 (0,8) | |
| Desconocido | 10 (7,9) | 2 (1,7) | |
| Estadio | |||
| In situ | 30 (23,6) | 27 (22,3) | 0,68 |
| I | 56 (44,1) | 54 (44,6) | 0,70 |
| II | 13 (10,2) | 8 (6,6) | 0,24 |
| III | 18 (14,2) | 29 (24,0) | 0,08 |
| IV | 0 (0,0) | 1 (0,8) | 0,32 |
| Desconocido | 10 (7,9) | 2 (1,7) | |
| CEC de alto-riesgo | 0,011 | ||
| Si | 41 (32,3) | 55 (45,4) | |
| No | 75 (59,1) | 64 (52,9) | |
| Desconocido | 11 (8,7) | 2 (1,7) | |
| Total | 127 (100) | 121 (100) | |
La cara y el cuero cabelludo fueron las localizaciones más frecuentes, y la extremidad superior aumentó después de la pandemia. El grosor medio fue de 3,01mm antes de la pandemia y de 3,27mm después (p=0,49). Excluyendo el CCE in situ, que fue de 4,05mm prepandémico y 4,27mm postpandémico (p=0,61). Los CCE invasivos se evidenciaron en un 74,4% de los pacientes prepandémicos y en un 76,0% de los postpandémicos (p=0,34). No se observaron diferencias en cuanto a la ulceración, el tipo histológico, la diferenciación celular, la invasión perineural o la invasión linfovascular. No se hallaron diferencias significativas en las metástasis a distancia.
En cuanto a la estadificación tumoral, los T1 fueron el 43,3% de los pacientes prepandémico y el 43,8% en los postpandémico. El T2 y el T3 fueron del 12,0% y del 14,2% prepandémicos, pasando a 7,4% y 24,0% entre los postpandémicos, respectivamente. Se observó un tumor T4 postpandémico. Sólo se encontró un CCE N+postpandémico. El estadio I representó el 44,1% de los pacientes prepandémico y el 44,6% de los postpandémico. Los estadios II y III conformaron el 10,2% y el 14,2% prepandémicos y del 6,6% y el 24,0% de los postpandémicos, respectivamente. Se identificó un CCE en estadio IV pospandémico.
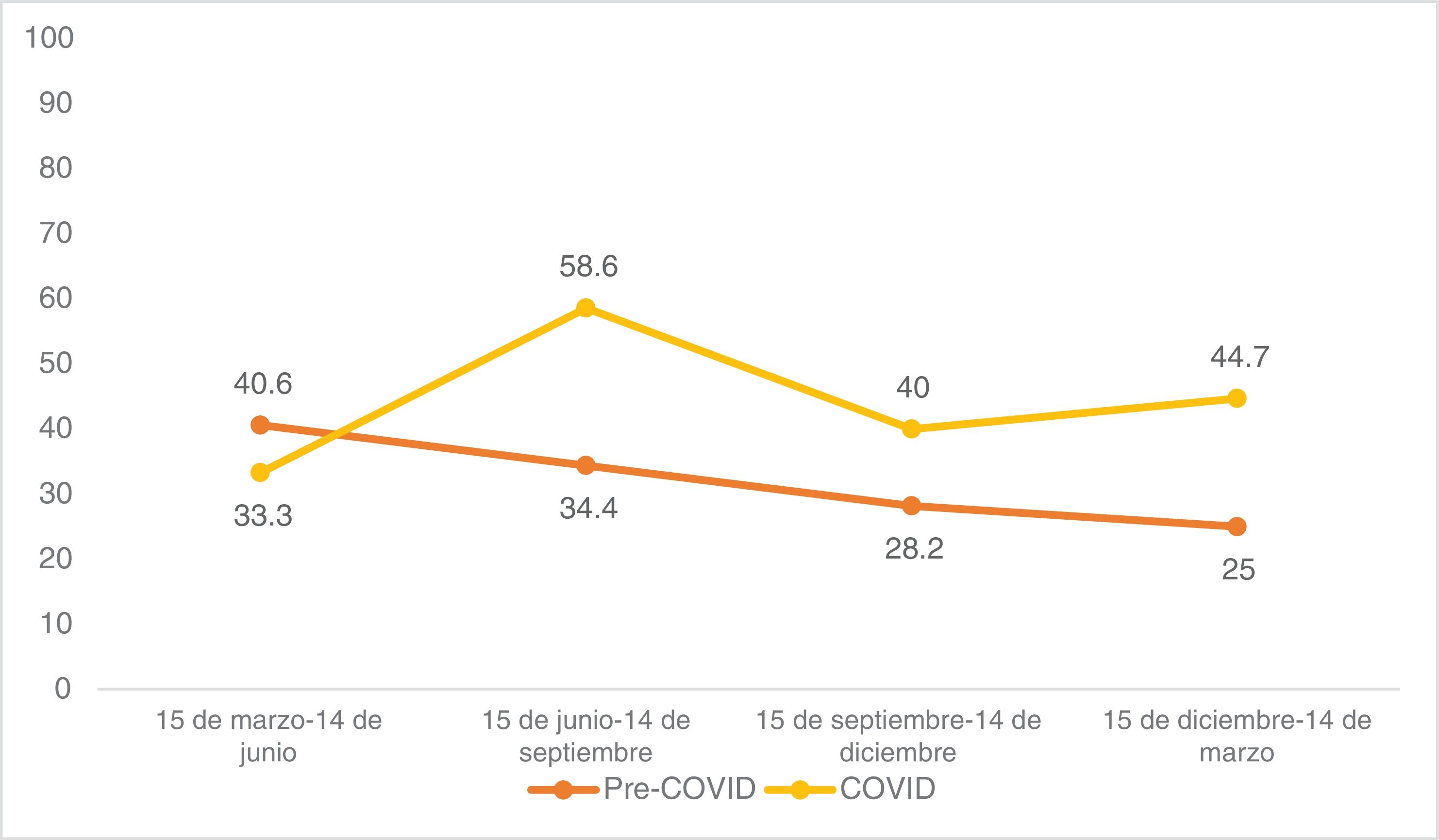
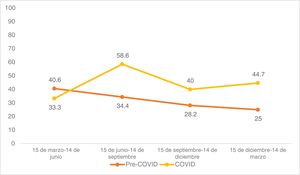
En cuanto al riesgo, los CCE de alto riesgo aumentaron del 32,3% prepandémico al 45,4% postpandémico (p=0,011). Observando la distribución trimestral de las cirugías antes de la pandemia de COVID-19: 32 cirugías de CCE se realizaron entre el 15 de marzo y el 14 de junio, 32 entre el 15 de junio y el 14 de septiembre, 39 entre el 15 de septiembre y el 14 de diciembre, y 24 entre el 15 de diciembre y el 14 de marzo (fig. 1). El porcentaje de CCE de alto riesgo durante estos periodos fue del 40,6%, 34,4%, 28,2% y 25,0%, respectivamente (fig. 2). Tras la declaración del confinamiento general en España, se produjeron 15 cirugías de CCE entre el 15 de marzo y el 14 de junio, 29 entre el 15 de junio y el 14 de septiembre, 30 entre el 15 de septiembre y el 14 de diciembre y 47 entre el 15 de diciembre y el 14 de marzo. Los porcentajes de tumores de alto riesgo fueron 33,3%, 58,6%, 40,0% y 44,7%, respectivamente.
DiscusiónDurante el confinamiento, las visitas médicas y la actividad quirúrgica se redujeron al mínimo. Además, el miedo a la infección hizo que la población general retrasara o incluso evitara la búsqueda de atención médica.14 Así, la pandemia de SARS-CoV-2ha tenido un impacto significativo tanto en el diagnóstico de nuevos tumores como en su pronóstico.15–17 En nuestra muestra, encontramos una reducción del 4,7% en el número de CCE intervenidos tras la declaración de confinamiento. La mayoría de los estudios realizados hasta el momento se han centrado en los primeros meses tras la declaración de confinamiento y muestran una reducción sustancial en el número de CCE intervenidos.14,18 Sin embargo, nuestro estudio incluye pacientes tratados hasta un año después de la declaración de confinamiento en España. Además, a diferencia de otros centros, la actividad en consulta y en el quirófano de nuestro servicio no se interrumpió en ningún momento, promoviéndose la teleconsulta.
Según un estudio reciente, durante los meses de confinamiento se produjo un descenso significativo de los tumores queratinocíticos diagnosticados en comparación con años anteriores. Sin embargo, tras el fin del confinamiento se produjo un aumento en el diagnóstico de tumores queratinocíticos.19 Otro estudio realizado en Italia informa que durante los meses de mayo a noviembre de 2020 se realizaron más cirugías de cáncer de piel que durante el mismo periodo del 2019.20 En nuestro caso, al desglosar los datos trimestralmente, las cirugías de CCE disminuyeron de 32 a 15 en el primer trimestre. El periodo de confinamiento general en España tuvo lugar entre el 15 de marzo y el 21 de junio de 2020. La mayor parte de este periodo se recogió en el primer trimestre del periodo del estudio COVID. Posteriormente, las cifras aumentaron, con cirugías postpandémicas entre el 15 de diciembre y el 14 de marzo que casi se duplicaron en comparación con el mismo periodo prepandémico. Por este motivo, creemos que en nuestra muestra no se observaron diferencias importantes en el número de cirugías de CCE antes del confinamiento en comparación con las realizadas después.
En un estudio realizado en nuestro centro, sí observamos diferencias en la reducción de cirugías de melanoma tras la pandemia.21 El hecho de no encontrar grandes diferencias en las cirugías de CCE podría deberse a que se trata de tumores visualmente más agresivos. Los CCE se asocian a mayores episodios de sangrado y ulceración y suelen aparecer en zonas expuestas, mientras que los melanomas suelen ser lesiones planas que tienden a pasar desapercibidas durante más tiempo22,23.
Asimismo, en nuestro estudio encontramos un mayor porcentaje de CCE de alto riesgo tras la pandemia. Varios estudios coinciden con este hallazgo, aunque, como se ha mencionado anteriormente, se centran en los primeros meses de la pandemia. En un estudio multicéntrico realizado en España y centrado en los meses de confinamiento, los autores observaron que durante este tiempo se operó el mismo número de CCE grandes (>4cm) que en los 3 meses previos al confinamiento.14 Sin embargo, estos CCE grandes representaron una mayor proporción de los tumores tratados tras el confinamiento, ya que se redujo el número de intervenciones en tumores menores de 4cm. Esto puede deberse a las recomendaciones formuladas por diferentes organizaciones durante los meses en que los hospitales estaban más saturados. En ellas se recomendaba priorizar los tumores más avanzados frente a las lesiones de menor riesgo para las que se podía retrasar la intervención.17,24,25
En nuestro estudio, en el que incluimos a los pacientes intervenidos más allá de los primeros meses tras el confinamiento, encontramos un mayor porcentaje de tumores de alto riesgo tras la pandemia, especialmente en los periodos que siguieron al confinamiento general. La estratificación trimestral en nuestra muestra post-COVID sugiere un retraso en el diagnóstico. Los pacientes que no acudieron a consulta en los meses iniciales de la pandemia sí lo hicieron en los meses posteriores, como ya se ha mencionado. De esta forma, es posible que el retraso en el tratamiento de las lesiones de bajo riesgo haya propiciado la aparición de alguna característica que transforme a éstas en tumores de alto riesgo.26,27 Explicaciones alternativas para el aumento de tumores de alto riesgo, como la implicación del propio virus o de los agentes utilizados en el tratamiento y profilaxis de la infección por COVID-19, no existen en la actualidad evidencias suficientes que apoyen un impacto significativo de estos factores en el aumento de tumores de alto riesgo.
Además, no hemos encontrado diferencias significativas en aquellas variables que determinan el grado de riesgo del CCE. Esto puede deberse fundamentalmente a una falta de potencia estadística, y hace necesaria la realización de más estudios como el nuestro para conocer los efectos reales de la pandemia sobre el CCE.
En el citado estudio realizado en nuestro centro, se encontraron diferencias significativas en cuanto al grosor o estadio tumoral de los melanomas.21 El hecho de que en los pacientes con CCE no se encontraran diferencias tan claras en las variables de riesgo puede deberse a una menor tasa media de crecimiento de los CCE en comparación con los melanomas.13
Con todos estos datos, cabe esperar un peor pronóstico para los pacientes con CCE diagnosticados tras los confinamientos generales provocados por la pandemia.
El principal punto fuerte de nuestro estudio es que hemos descrito los efectos de la pandemia sobre el CCE hasta un año después de la declaración del confinamiento general. No obstante, somos conscientes de que el estudio está sujeto a varias limitaciones. En primer lugar, al tratarse de un estudio unicéntrico, la muestra está limitada y esto podría dificultar la significación estadística en algunas de las variables estudiadas. Por otro lado, al tratarse de un estudio retrospectivo, es posible que exista información no recogida sobre los pacientes atendidos durante ambos periodos. Además, dado que se trata de un estudio transversal, es difícil establecer asociaciones causales. Aun así, es un buen punto de partida para futuros estudios prospectivos con tiempos de seguimiento más largos.
ConclusionesNo observamos diferencias significativas en el número de cirugías de CCE tras el confinamiento en comparación con el mismo periodo antes del confinamiento. Sin embargo, sí encontramos un aumento significativo en el número de CCE de alto riesgo tras la pandemia. El retraso en el diagnóstico y en el tratamiento de los CCE durante el confinamiento puede haber provocado un aumento posterior del número de lesiones de alto riesgo. Sin embargo, se necesitan más estudios para comprender los verdaderos efectos de la pandemia sobre el cáncer de piel.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo forma parte del proyecto de doctorado de Pablo Díaz-Calvillo.