La terminología usada para describir los diferentes hallazgos en la microscopía confocal de reflectancia (MCR), tanto en lesiones melanocíticas, como en no melanocíticas se ha consensuado en inglés. En el presente trabajo, se proponen los términos en español que mejor interpretan estos conceptos ya descritos para la MCR, mediante el consenso de expertos de distintas nacionalidades de habla hispana y utilizando el método DELPHI para el acuerdo final. Se obtuvieron 52 términos en total, de los cuales 28 fueron para lesiones melanocíticas y 24 para lesiones no melanocíticas. El uso de la nomenclatura propuesta permitirá una homogeneización y mejor entendimiento de las estructuras; una descripción más estandarizada en los registros clínicos y una mejor interpretación de estos informes por otros dermatólogos.
The terminology used to describe reflectance confocal microscopy (RCM) findings in both melanocytic and nonmelanocytic lesions has been standardized in English. We convened a panel of Spanish-speaking RCM experts and used the Delphi method to seek consensus on which Spanish terms best describe RCM findings in this setting. The experts agreed on 52 terms: 28 for melanocytic lesions and 24 for nonmelanocytic lesions. The resulting terminology will facilitate homogenization, leading to a better understanding of structures, more standardized descriptions in clinical registries, and easier interpretation of clinical reports exchanged between dermatologists.
La microscopia confocal de reflectancia (MCR) es una técnica diagnóstica no invasiva que permite visualizar in vivo la superficie cutáneo-mucosa en tiempo real con resolución celular y precisión cuasi-histológica, hasta una profundidad de 200-250μm1-3. Sus beneficios en el diagnóstico de lesiones melanocíticas4-13 y no melanocíticas14-35 ha sido demostrado en múltiples publicaciones, metaanálisis y revisiones sistemáticas36-40. Hasta ahora la terminología usada para describir los diferentes hallazgos a la MCR en piel normal, así como en lesiones melanocíticas41,42 y no melanocíticas43 se ha consensuado en inglés. Esto trae como consecuencia una dificultad en la descripción en registros clínicos, la interpretación de estos informes por otros dermatólogos y la realización de estudios que involucren la MCR en español. Hasta donde sabemos, a la fecha no existe un consenso oficial de expertos respecto a los términos de MCR.
ObjetivoEl presente trabajo tiene por objetivo obtener un consenso sobre la nomenclatura en español de la terminología más utilizada en lesiones melanocíticas y no melanocíticas en la MCR.
MétodosSe realizó una revisión bibliográfica en MEDLINE (Pubmed) de la terminología en inglés más frecuentemente utilizada en la MCR, en artículos, revisiones sistemáticas42,43 y del artículo de consenso de terminología en inglés41. Se emplearon en la búsqueda los términos: reflectance confocal microscopy; RCM; terminology; glossary; melanoma, melanocytic lesions, nonmelanocytic lesions; basal cell carcinoma; squamous cell carcinoma; actinic keratosis; seborrheic keratosis; solar lentigo; lichen planus-like keratosis. Se identificaron los términos de las estructuras más frecuentemente reportadas a la MCR del melanoma, nevus atípico, carcinoma basocelular (CBC), carcinoma espinocelular (CEC), queratosis actínicas, queratosis seborreicas, lentigo solar y queratosis liquenoides. Aquellas estructuras o términos que se consideraron equivalentes se simplificaron y otras se describieron como sinónimos. Las lesiones se clasificaron en 2grandes grupos: melanocíticas y no melanocíticas. Las lesiones no melanocíticas se clasificaron en 3grupos: el primer grupo solo con carcinoma basocelular; el segundo grupo, carcinoma espinocelular y queratosis actínica, y el tercer grupo, lentigo solar, queratosis seborreica y queratosis liquenoide.
Se realizó un consenso con la metodología e-Delphi en el que se valoró el acuerdo entre 14 expertos en microscopia confocal de reflectancia en lengua española (España, Chile, Argentina, Colombia y México). Se realizó la invitación a participar del estudio por email y quienes aceptaron participar se les envió un enlace para acceder a la encuesta. Para este fin se utilizó la plataforma Google Forms (https://docs.google.com/forms/u/0/). En la primera vuelta Delphi se incluyeron las alternativas muy de acuerdo, de acuerdo y en desacuerdo. En aquellos términos donde se alcanzó un acuerdo superior al 80% para la alternativa muy de acuerdo se consideraron como óptimos no requiriendo una nueva ronda de Delphi. En aquellos términos donde el acuerdo fue inferior al 80% para la alternativa muy de acuerdo se requirió una segunda vuelta. Los expertos que no estaban completamente de acuerdo con un término seleccionado en español podían proponer un término alternativo para la siguiente ronda. En la segunda vuelta se incluyeron las alternativas de acuerdo y en desacuerdo. En aquellos términos donde se alcanzó un acuerdo superior al 80% para la alternativa de acuerdo se consideraron como óptimos no requiriendo una nueva ronda de Delphi. En esta ronda solo en el término en inglés «nests of basaloid cells» los participantes tuvieron que votar entre los términos en español: «nidos basaloides» o «nidos hiporrefractiles», decidiéndose el ganador por mayoría simple. No fue necesario realizar una tercera ronda.
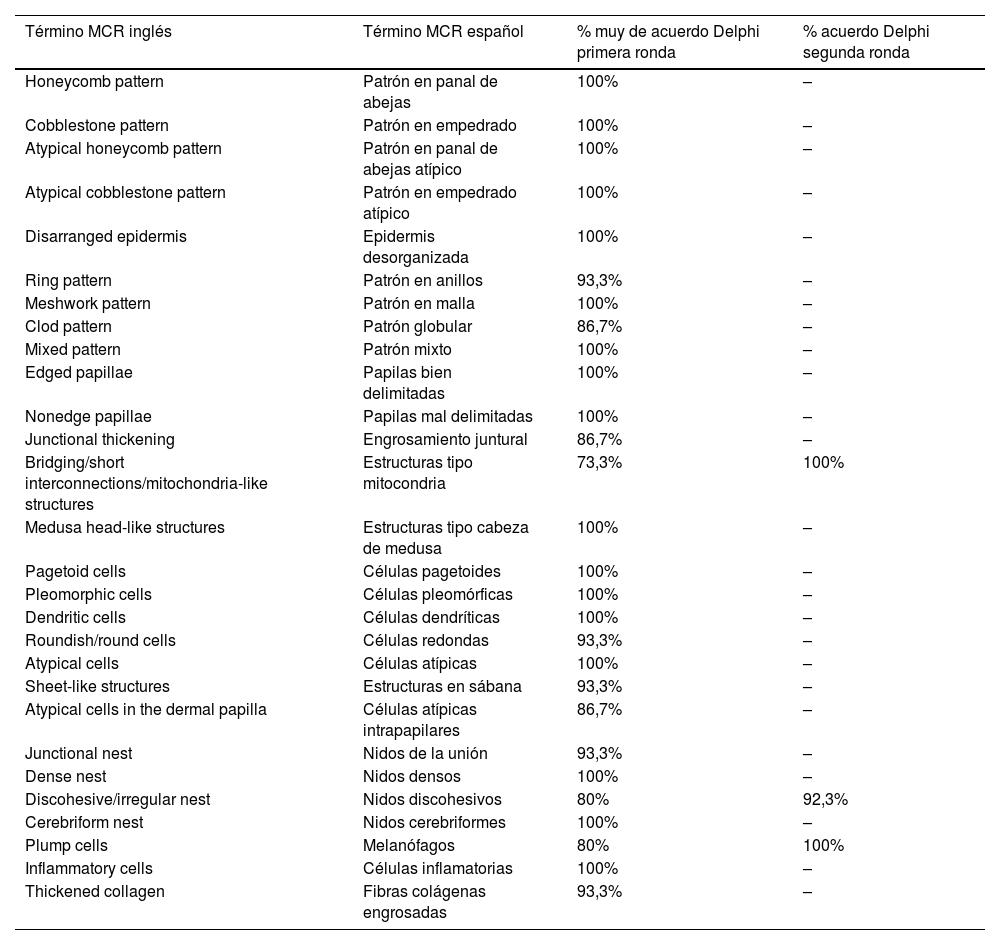
ResultadosDe los 14 expertos invitados a participar por email, todos (N=14) respondieron la primera vuelta Delphi en la que se incluyeron un total de 52 términos en inglés y su propuesta en español. De estos, 28 términos fueron para lesiones melanocíticas y 24 términos para lesiones no melanocíticas. Los 24 términos para lesiones no melanocíticas corresponden a 9 términos para carcinoma basocelular, 9 para carcinoma espinocelular y queratosis actínica y 6 para lentigo solar, queratosis seborreica y queratosis liquenoide. En la primera vuelta Delphi se alcanzó un acuerdo superior al 80% para la alternativa muy de acuerdo en 25 de 28 términos de las lesiones melanocíticas (tabla 1), entre ellos: patrón en panal de abejas, patrón en empedrado, epidermis desorganizada (fig. 1A); células pagetoides, células dendríticas, células pleomórficas, células redondas (fig. 1B y C); papilas mal delimitadas (fig. 2A), engrosamiento juntural (fig. 2B),células atípicas (fig. 2C y D), y en 19 de 24 términos de las lesiones no melanocíticas; en 7 de 9 para carcinoma basocelular (tabla 2), entre ellos: polarización, hendidura, empalizada periférica (fig. 3B); en 8 de 9 para carcinoma espinocelular y queratosis actínica (tabla 3), entre ellos: desorden arquitectural, patrón en panal de abejas atípico (fig. 3A), y en 4 de 6 para lentigo solar, queratosis seborreica, y queratosis liquenoide, entre ellos: quistes de millium, invaginaciones epidérmicas repletas de queratina y proyecciones bulbosas (tabla 4).
Nomenclatura términos MCR para lesiones melanocíticas
| Término MCR inglés | Término MCR español | % muy de acuerdo Delphi primera ronda | % acuerdo Delphi segunda ronda |
|---|---|---|---|
| Honeycomb pattern | Patrón en panal de abejas | 100% | – |
| Cobblestone pattern | Patrón en empedrado | 100% | – |
| Atypical honeycomb pattern | Patrón en panal de abejas atípico | 100% | – |
| Atypical cobblestone pattern | Patrón en empedrado atípico | 100% | – |
| Disarranged epidermis | Epidermis desorganizada | 100% | – |
| Ring pattern | Patrón en anillos | 93,3% | – |
| Meshwork pattern | Patrón en malla | 100% | – |
| Clod pattern | Patrón globular | 86,7% | – |
| Mixed pattern | Patrón mixto | 100% | – |
| Edged papillae | Papilas bien delimitadas | 100% | – |
| Nonedge papillae | Papilas mal delimitadas | 100% | – |
| Junctional thickening | Engrosamiento juntural | 86,7% | – |
| Bridging/short interconnections/mitochondria-like structures | Estructuras tipo mitocondria | 73,3% | 100% |
| Medusa head-like structures | Estructuras tipo cabeza de medusa | 100% | – |
| Pagetoid cells | Células pagetoides | 100% | – |
| Pleomorphic cells | Células pleomórficas | 100% | – |
| Dendritic cells | Células dendríticas | 100% | – |
| Roundish/round cells | Células redondas | 93,3% | – |
| Atypical cells | Células atípicas | 100% | – |
| Sheet-like structures | Estructuras en sábana | 93,3% | – |
| Atypical cells in the dermal papilla | Células atípicas intrapapilares | 86,7% | – |
| Junctional nest | Nidos de la unión | 93,3% | – |
| Dense nest | Nidos densos | 100% | – |
| Discohesive/irregular nest | Nidos discohesivos | 80% | 92,3% |
| Cerebriform nest | Nidos cerebriformes | 100% | – |
| Plump cells | Melanófagos | 80% | 100% |
| Inflammatory cells | Células inflamatorias | 100% | – |
| Thickened collagen | Fibras colágenas engrosadas | 93,3% | – |
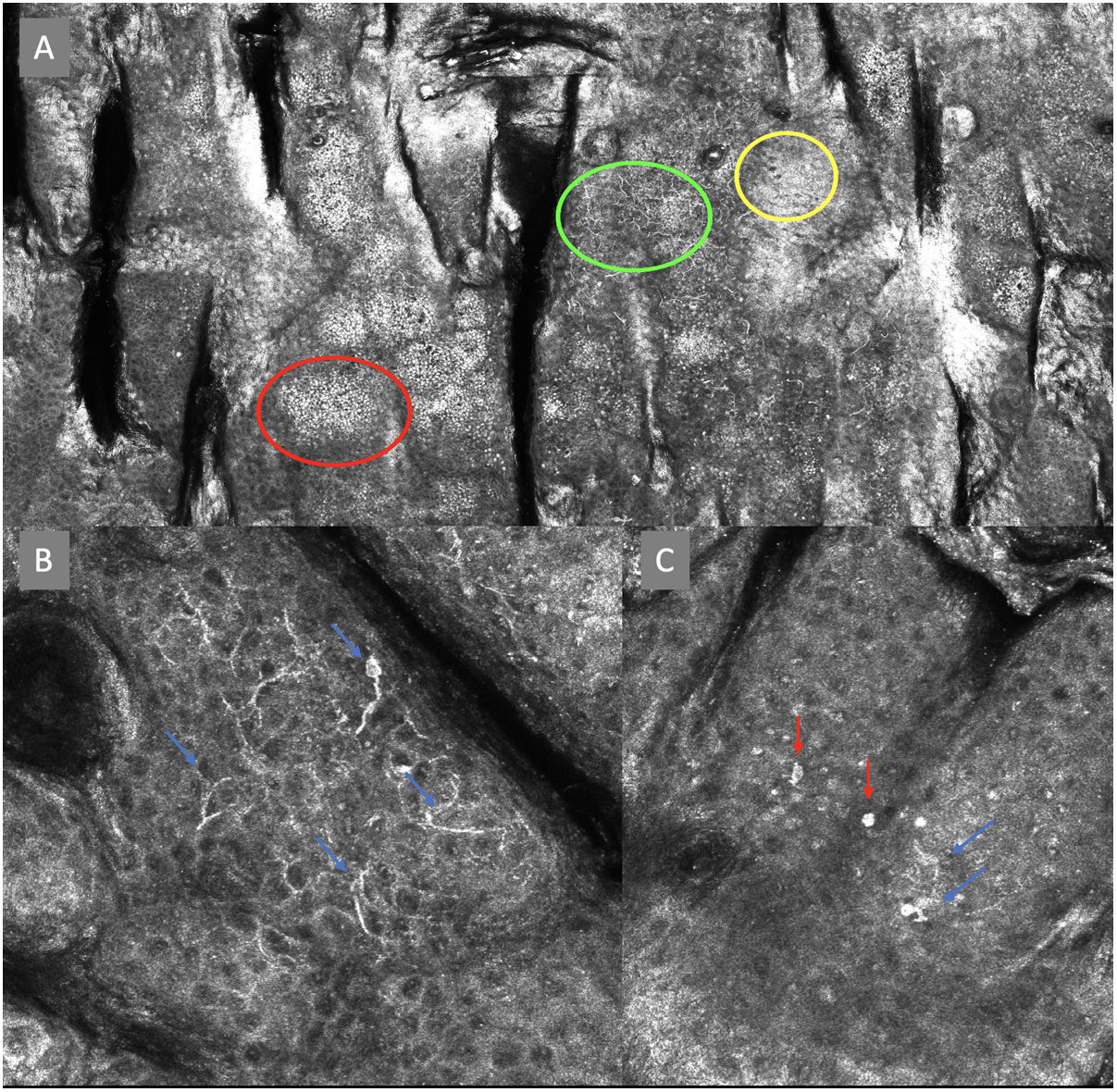
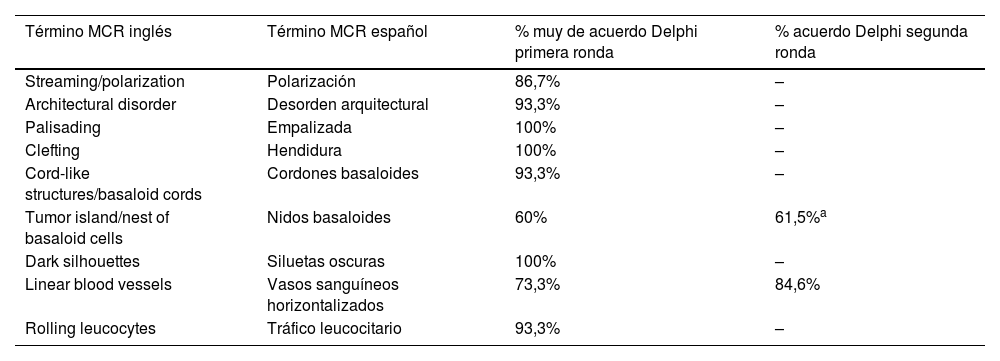
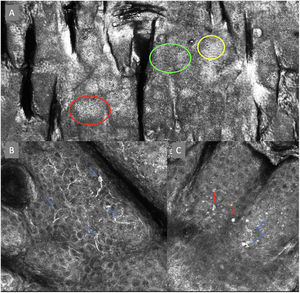
Imágenes de microscopia confocal en estratos epidérmicos altos. Superior (A). Se observa patrón en empedrado (círculo rojo), patrón en panal de abejas (círculo amarillo) y epidermis desorganizada con presencia de células dendríticas (círculo verde). Imágenes inferiores. Detalle de células en crecimiento pagetoide. A la izquierda (B) se observan células dendríticas (flecha azul). A la derecha (C) se observan células pleomórficas, redondas (flecha roja) y dendríticas (flecha azul).
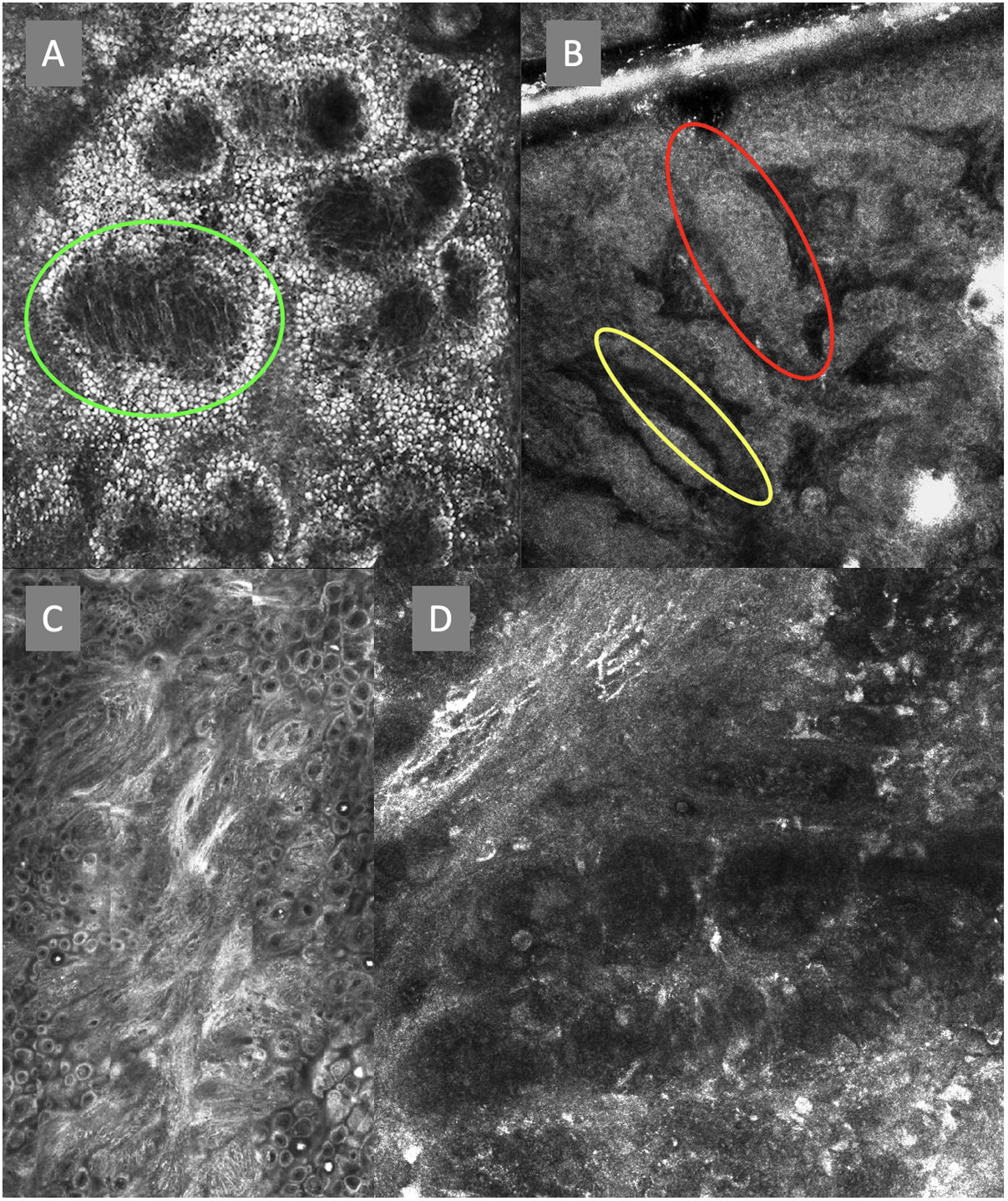
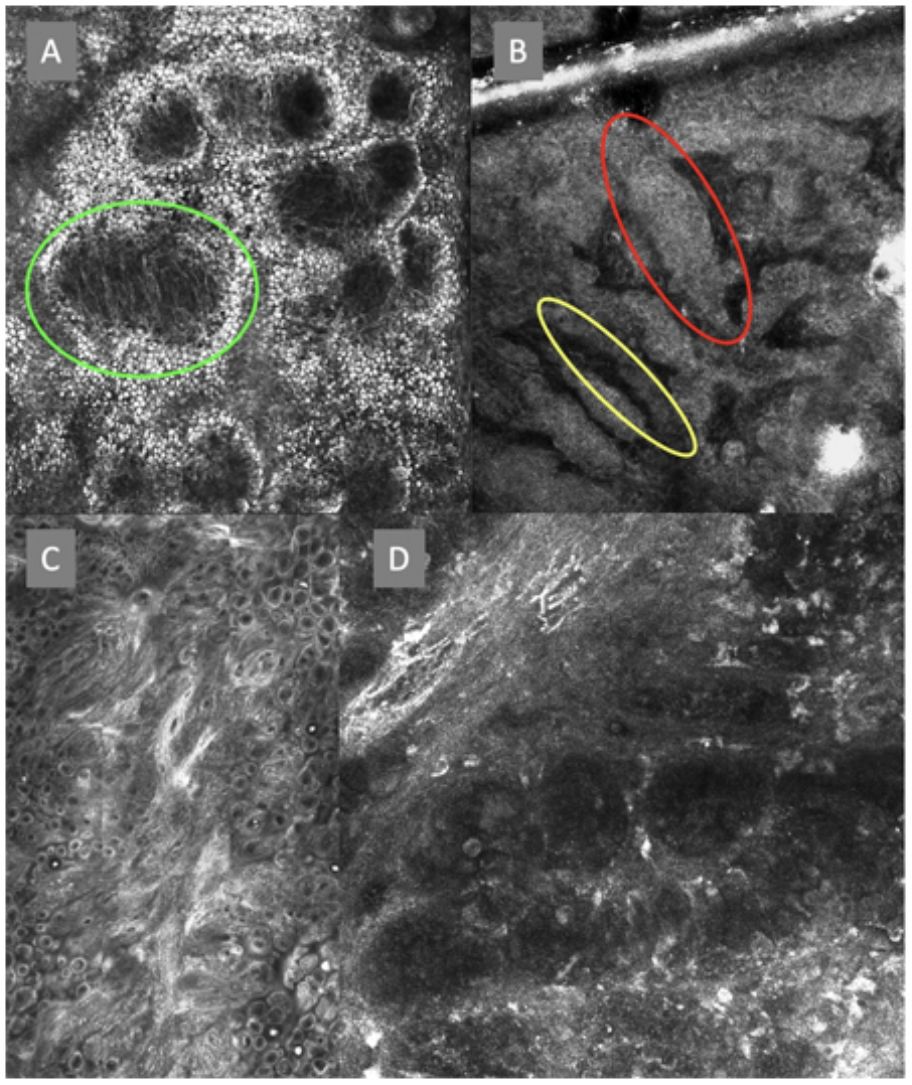
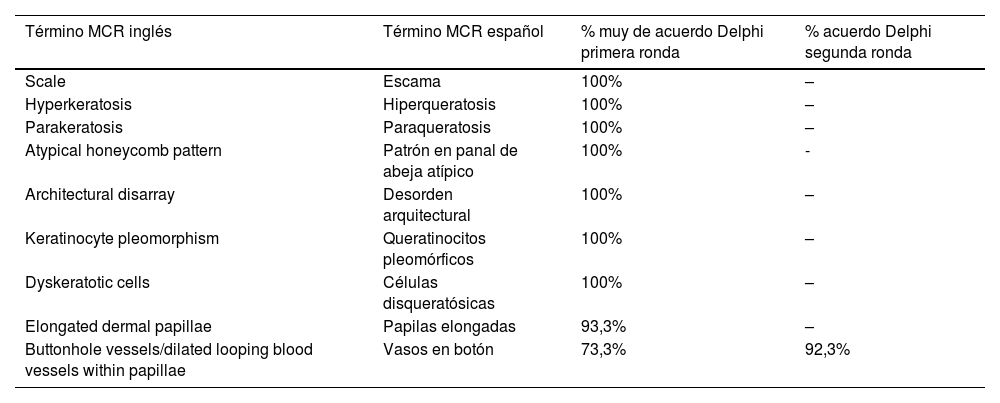
Imágenes de microscopia confocal de la unión dermoepidérmica. Izquierda superior (A). Se observa un patrón en anillos y empedrado, con papilas mal definidas y células dendríticas que protruyen en la papila y llegan a configurar la estructura tipo mitocondria (círculo verde). Derecha superior (B) se observan engrosamientos junturales (rojo) y papilas elongadas (amarillo). Izquierda inferior (C) se observa pérdida de la arquitectura normal de la unión dermoepidérmica. Derecha inferior (D), a mayor aumento, se observan papilas mal delimitadas, con células atípicas (dendríticas y redondas).
Nomenclatura términos MCR para carcinoma basocelular
| Término MCR inglés | Término MCR español | % muy de acuerdo Delphi primera ronda | % acuerdo Delphi segunda ronda |
|---|---|---|---|
| Streaming/polarization | Polarización | 86,7% | – |
| Architectural disorder | Desorden arquitectural | 93,3% | – |
| Palisading | Empalizada | 100% | – |
| Clefting | Hendidura | 100% | – |
| Cord-like structures/basaloid cords | Cordones basaloides | 93,3% | – |
| Tumor island/nest of basaloid cells | Nidos basaloides | 60% | 61,5%a |
| Dark silhouettes | Siluetas oscuras | 100% | – |
| Linear blood vessels | Vasos sanguíneos horizontalizados | 73,3% | 84,6% |
| Rolling leucocytes | Tráfico leucocitario | 93,3% | – |
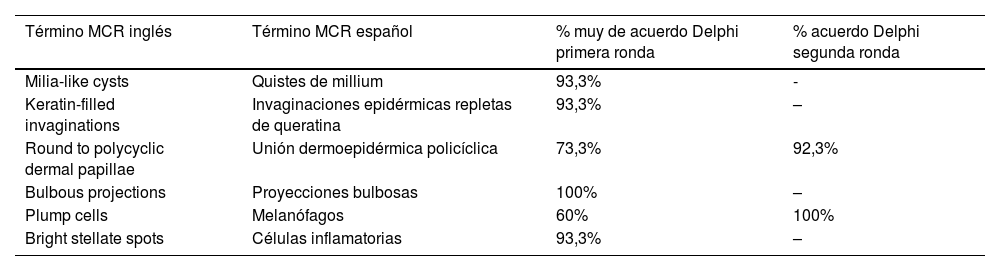
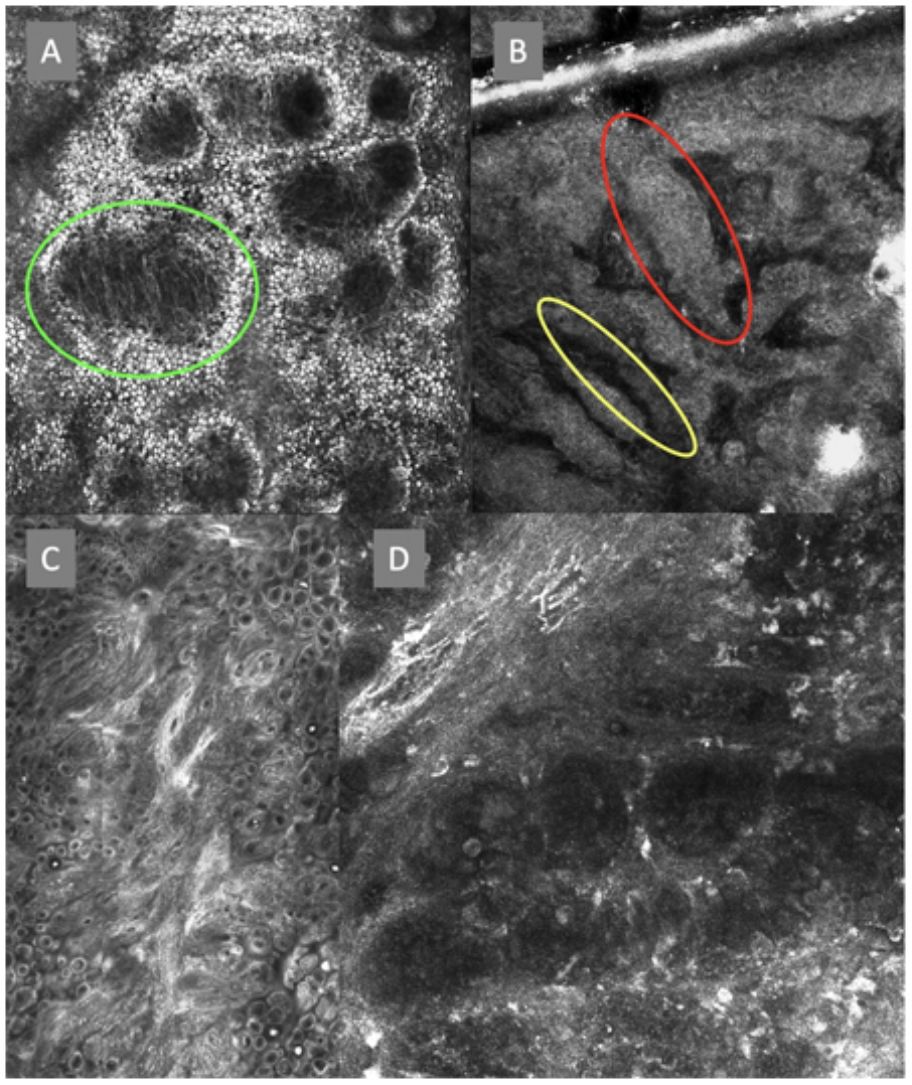
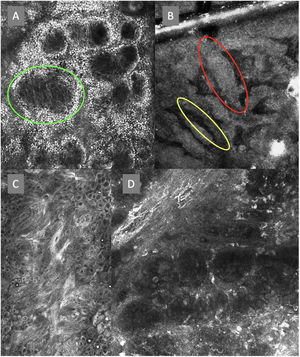
A la izquierda (A) observamos un desorden arquitectural epidérmico con presencia de vasos en botón, uno de ellos indicado en círculo rojo, así como un patrón en panal de abejas atípico (círculo amarillo), imagen característica de enfermedad de Bowen. A la derecha (B) se observa polarización de núcleos (círculo azul), vasos horizontalizados (flechas verdes), nidos basaloides (círculo verde), hendidura (flecha roja) y empalizada periférica (flecha amarilla) hallazgos característicos en un carcinoma basocelular.
Nomenclatura términos MCR para Carcinoma Espinocelular y Queratosis actínica
| Término MCR inglés | Término MCR español | % muy de acuerdo Delphi primera ronda | % acuerdo Delphi segunda ronda |
|---|---|---|---|
| Scale | Escama | 100% | – |
| Hyperkeratosis | Hiperqueratosis | 100% | – |
| Parakeratosis | Paraqueratosis | 100% | – |
| Atypical honeycomb pattern | Patrón en panal de abeja atípico | 100% | - |
| Architectural disarray | Desorden arquitectural | 100% | – |
| Keratinocyte pleomorphism | Queratinocitos pleomórficos | 100% | – |
| Dyskeratotic cells | Células disqueratósicas | 100% | – |
| Elongated dermal papillae | Papilas elongadas | 93,3% | – |
| Buttonhole vessels/dilated looping blood vessels within papillae | Vasos en botón | 73,3% | 92,3% |
Nomenclatura términos MCR para Lentigo Solar, Queratosis Seborreica y Queratosis Liquenoide
| Término MCR inglés | Término MCR español | % muy de acuerdo Delphi primera ronda | % acuerdo Delphi segunda ronda |
|---|---|---|---|
| Milia-like cysts | Quistes de millium | 93,3% | - |
| Keratin-filled invaginations | Invaginaciones epidérmicas repletas de queratina | 93,3% | – |
| Round to polycyclic dermal papillae | Unión dermoepidérmica policíclica | 73,3% | 92,3% |
| Bulbous projections | Proyecciones bulbosas | 100% | – |
| Plump cells | Melanófagos | 60% | 100% |
| Bright stellate spots | Células inflamatorias | 93,3% | – |
La segunda vuelta fue enviada por email y fue respondida por 13 de los 14 expertos. Se revaluaron en esta ronda 8 términos en total, 3 términos correspondientes a lesiones melanocíticas y 5 términos a lesiones no melanocíticas y se alcanzó un acuerdo superior al 80% en 7 de ellos; 3 para lesiones melanocíticas (tabla 1), que corresponden a estructuras tipo mitocondria (fig. 2A), nidos discohesivos y melanófagos, y 4 para lesiones no melanocíticas que se desglosan en, 1 para carcinoma basocelular que corresponde a vasos sanguíneos horizontalizados (tabla 2) (fig. 3B); 1 para carcinoma espinocelular y queratosis actínica que corresponde a vasos en botón (tabla 3) (fig. 3A), y 2 para lentigo solar, queratosis seborreica y queratosis liquenoide, que corresponden a unión dermoepidérmica policíclica y melanófagos (tabla 4). El término nests of basaloid cells se seleccionó por mayoría simple resultando elegido el término en español nidos basaloides con el 61,5% (fig. 3B).
DiscusiónEl evidente dominio y priorización de la lengua inglesa en publicaciones científicas, atlas y libros de texto conlleva el uso de terminología anglosajona que no siempre se traduce de forma homogénea ni menos intuitiva al español. Esto determina una considerable variación en el uso y traducción (muchas veces autogestionada o basada en cada centro médico) de los términos, muchos de los cuales ya tienen variaciones en inglés. A ello se suma que cada vez es mayor el número de dermatólogos de habla hispana que se forman en centros de Europa o Estados Unidos en técnicas diagnósticas no invasivas como la MCR. Si bien la MCR no es utilizada en forma masiva, su uso se ha ido extendiendo de forma global, y existen varios centros en España44, algunos en México, Colombia, Argentina y Chile que cuentan actualmente con esta tecnología diagnóstica. En este sentido, se hace imperativo tener un lenguaje común para los términos en español que actualmente están descritos en inglés ya sea para crear futuras publicaciones, redactar informes médicos, para explicarle a nuestros pacientes los hallazgos en este examen y para que la comunidad de dermatólogos de habla hispana, aunque no usen esta tecnología, puedan comprender estos informes. Si bien existen algunos trabajos que han logrado un consenso de la terminología de MCR in vivo en inglés41, creemos que era el momento de realizar un glosario en español de consenso entre expertos. Finalmente, en Actas Dermatosifilográficas coexisten 2versiones del mismo artículo científico, en inglés y en español (p. ej., El papel de la microscopia confocal en el diagnóstico del melanoacantoma)45,46, por lo que es muy necesario tener un consenso de terminología en español con su correspondiente correlación en lengua inglesa. En el presente trabajo, se proponen los términos que mejor interpretan los conceptos consensuados en inglés para la nomenclatura en lesiones melanocíticas y no melanocíticas descritas para la MCR, mediante el consenso de expertos de distintas nacionalidades de habla hispana y utilizando el método DELPHI para el acuerdo final.
LimitacionesRelativo bajo número de participantes limitados a centros académicos que disponen de la técnica. Se usó como base los términos en inglés ya existentes lo que da poca cabida a variaciones.
ConclusionesEl uso de la nomenclatura propuesta para MCR en español permitirá una homogeneización y mejor entendimiento de las estructuras y su correlación con la histopatología, tanto de las lesiones melanocíticas, como de las no melanocíticas. Esto permitirá una descripción más estandarizada en los registros clínicos, una mejor interpretación de estos informes por otros dermatólogos, una adecuada caracterización de las estructuras tanto para la docencia como para la realización de estudios que involucren la MCR en español.