La artritis psoriásica (APs) es una forma común de artritis inflamatoria que aparece hasta en el 40% de los pacientes con psoriasis. Dado que la afectación cutánea suele preceder a la afectación articular, los dermatólogos desempeñan un papel fundamental en la detección precoz de la APs. El diagnóstico precoz es importante para reducir el riesgo de daños estructurales irreversibles, limitar el deterioro de la función física y mejorar la calidad de vida de los pacientes. El presente documento ha sido elaborado por un grupo de especialistas (nueve dermatólogos y un reumatólogo) con el objetivo de proporcionar recomendaciones sencillas que ayuden a los dermatólogos en el cribado de la APs en pacientes con psoriasis. Los expertos elaboraron el presente documento ofreciendo unas recomendaciones consensuadas basadas en una revisión descriptiva de la evidencia científica disponible y en la experiencia adquirida en la práctica clínica diaria.
Psoriatic arthritis is a common type of inflammatory arthritis found in up to 40% of patients with psoriasis. Because skin involvement usually precedes joint involvement, dermatologists play a key role in early detection. Early diagnosis is important for reducing the risk of irreversible structural damage, attenuating the deterioration of physical function, and improving patients’ quality of life. This consensus statement was drafted by a group of 9 dermatologists and 1 rheumatologist to provide simple recommendations to help dermatologists screen for psoriatic arthritis in patients with psoriasis. The experts offer consensus-based guidelines that draw on a review of available scientific evidence and on experience acquired in routine clinical practice.
La artritis psoriásica (APs) es una enfermedad inflamatoria crónica que padece entre el 0,05 y el 0,25% de la población general, y entre el 6 y el 41% de los pacientes con psoriasis1. Se caracteriza por una alta heterogeneidad clínica y un curso variable2. A nivel articular, el proceso inflamatorio afecta a la membrana sinovial y a las inserciones periósticas de los tendones y ligamentos, provocando erosiones y entesiofitos, respectivamente3. La APs puede ser deformante y destructiva aproximadamente en el 40-60% de los pacientes, con el consiguiente deterioro funcional, disminución de la calidad de vida, complicaciones psicosociales y mayor riesgo de muerte con respecto a la población general4,5. Las manifestaciones de la APs son muy variables y pueden afectar a cualquier articulación, y el paciente puede presentar una afectación articular periférica, axial o mixta6. El dolor inflamatorio, uno de los síntomas distintivos de esta afectación, se caracteriza por mejorar con la actividad y empeorar con el reposo, y suele ir acompañado de calor, hinchazón, rigidez matutina y dificultad de movimiento7,8. Además de la afectación articular, la entesitis, la dactilitis y la afectación ungueal son también características de la APs9.
Esta amplia variedad de signos y síntomas hace que el diagnóstico clínico y el tratamiento de la enfermedad puedan resultar complejos, siendo necesario además realizar un diagnóstico diferencial con otras patologías articulares (tabla 1).
Cuadro para el diagnóstico diferencial de la APs. Características clave de las principales artropatías10-13
| APs | Artrosis | Gota | Condrocalcinosis | Artritis infecciosa | Fibromialgia | |
|---|---|---|---|---|---|---|
| Género, edad | Hombre/mujerMediana | Hombre/mujerMediana/avanzada | HombreMediana/joven | Hombre/mujerAvanzada | Hombre/mujerCualquier edad | MujerMediana |
| Presentación | Gradual | Gradual | Repentina | Repentina | Repentina | Gradual |
| Afectación articular | PeriféricaAsimétricaOligo/poliarticular | Periférica/axialAsimétricaMono/oligoarticular | PeriféricaAsimétricaMono/oligoarticular | VariableRodilla > 50% casosCarpos, cadera | VariableMonoarticularAfectación de rodilla frecuente | Numerosas áreas localizadas |
| Tipo de dolor y duración | InflamatorioLarga duraciónCon episodios de mayor intensidad o empeoramiento | MecánicoLarga duraciónCon episodios de mayor intensidad o empeoramiento | Inflamatorio48-72 h (1-2 semanas si no se trata) | InflamatorioVariable (días-semanas) | InflamatorioDuración hasta tratamiento con agentes antimicrobianos | GeneralizadoContinuo con exacerbaciones periódicas y fluctuantes |
| Afectación axial | ComúnPuede ser silente | Común | No | Rara | Rara (espondilodiscitis) | Dolor axial frecuente |
| Entesitis | Común | No | No | No | No | No |
| Dactilitis | Común | No | Rara | Rara | Rara | No |
| Onicopatía psoriásica | Común | No | No | No | No | No |
Otras entidades que pueden entrar en el diagnóstico diferencial, como la artritis reumatoide, el lupus eritematoso sistémico o la sarcoidosis, reúnen unas características y unos criterios de clasificación muy claros.
El diagnóstico precoz de la APs es fundamental para realizar una intervención temprana en el paciente, modificar el curso natural de la enfermedad y evitar así posibles daños estructurales irreversibles desencadenados por el proceso inflamatorio14,15.
Diversos estudios han demostrado que el deterioro articular en pacientes con APs aparece durante los primeros años una vez iniciada la enfermedad16–18. Un estudio retrospectivo comprobó que un retraso de apenas 6meses en el diagnóstico se asociaba a peores resultados radiográficos y funcionales a largo plazo19.
Hasta el 84% de los pacientes con APs presenta manifestaciones cutáneas antes de la primera manifestación clínica evidente a nivel articular20, lo que explica por qué a menudo los dermatólogos son los primeros especialistas en enfrentarse al reto de establecer un diagnóstico precoz de la APs. Aunque los dermatólogos están ampliamente familiarizados con las lesiones cutáneas de la psoriasis, pueden tener menos experiencia con las manifestaciones musculoesqueléticas de la APs21 y la mayoría no realizan un cribado de APs en la práctica clínica habitual, lo que implica un potencial retraso diagnóstico. La prevalencia estimada de APs no diagnosticada entre los pacientes con psoriasis que están recibiendo tratamiento en consultas dermatológicas oscila entre el 15 y el 40%20,22,23. Para garantizar unos buenos resultados clínicos a largo plazo es esencial que los dermatólogos lleven a cabo un cribado sistemático de la APs en los pacientes con psoriasis, por lo que deben obtener una formación y una práctica adecuadas que les permitan hacer un diagnóstico de sospecha de APs y realizar una derivación precoz al reumatólogo, quien podrá confirmar el diagnóstico e iniciar el tratamiento antes de que se produzca un daño articular permanente24,25.
Otra necesidad no cubierta en el diagnóstico de la APs es la falta de herramientas de cribado adecuadas que puedan utilizar tanto los dermatólogos como los médicos de atención primaria. Aunque existen diversos instrumentos de cribado, su valor en la clínica diaria es limitado debido principalmente al tiempo que requieren, a su complejidad y a la elevada tasa de falsos positivos.
Las recomendaciones expuestas en el presente documento contemplan diversas cuestiones relacionadas con la detección precoz de la APs por parte del dermatólogo, reforzando y actualizando lo expuesto en trabajos previos8, y ofreciendo una revisión actualizada de los tratamientos disponibles para la psoriasis y su nivel de eficacia a nivel articular. En el documento se describen y analizan de manera sistemática, estructurada y concisa herramientas y procedimientos potencialmente útiles y viables para la detección precoz de la enfermedad por parte del dermatólogo, proporcionando una serie de recomendaciones y un algoritmo práctico y sencillo que pueden ser de utilidad para el control clínico de los pacientes con APs en las consultas de dermatología. Todo ello basado en una revisión actualizada de la evidencia científica, así como en el conocimiento práctico de un grupo de expertos.
ObjetivoEl principal objetivo del presente trabajo fue elaborar un documento que pueda servir como guía al dermatólogo para establecer un diagnóstico precoz de la APs en la práctica clínica habitual.
MétodosEste documento ha sido elaborado por un equipo de trabajo constituido por nueve dermatólogos y un reumatólogo, todos ellos con amplia experiencia en el campo de la psoriasis y la APs. El abordaje metodológico empleado en este proyecto se basó en los fundamentos del denominado «método formal» para alcanzar un consenso y elaborar recomendaciones: un panel de expertos evalúa la evidencia científica disponible en el contexto de la experiencia clínica real (opinión de expertos) en aras de elaborar un consenso en relación con un problema clínico determinado26,27.
Siguiendo los preceptos de este abordaje metodológico, el grupo de expertos revisó la bibliografía relevante y cumplimentó un cuestionario previamente diseñado para identificar cuestiones importantes no resueltas relativas al diagnóstico precoz de la APs y a las posibles herramientas diagnósticas. Posteriormente se llevó a cabo una reunión presencial para analizar y debatir los resultados del cuestionario, discutir los aspectos del manejo clínico relativo al diagnóstico precoz de los pacientes con sospecha de APs en las consultas de dermatología y consensuar discrepancias en base a la evidencia científica y la experiencia clínica aportada por los expertos. El análisis de los resultados del cuestionario y los puntos más relevantes de la discusión entre el grupo de expertos fueron la base para la elaboración del algoritmo de manejo y otras recomendaciones que se recogen en el presente documento.
El punto número 5 (Abordaje terapéutico) del apartado de Resultados contiene una tabla elaborada a partir de la evidencia científica disponible sobre los tratamientos para la psoriasis y el grado de eficacia demostrado en estudios clínicos para el tratamiento de cada una de las manifestaciones de la APs y la espondiloartritis axial. En la tabla se muestra el número de ensayos clínicos de fase3 realizados en población adulta y caucásica para valorar la eficacia de cada dominio específico, contabilizándose también los estudios head-to-head del promotor. La investigación bibliográfica incluye estudios publicados hasta el 4 de junio de 2020. La búsqueda se realizó en la página de registros de ensayos clínicos clinicaltrials.gov y en la base de datos PubMed. Todas las referencias de artículos y ensayos clínicos utilizadas para elaborar la tabla se pueden consultar en el material suplementario1.
ResultadosA continuación se describe la revisión crítica de la literatura y la opinión de los expertos para facilitar la detección precoz de la APs, considerando los siguientes aspectos:
- 1.
Herramientas de cribado.
- 2.
Anamnesis y exploración física.
- 3.
Pruebas complementarias.
- 4.
Atención conjunta: derivación a reumatología.
- 5.
Abordaje terapéutico.
a. Revisión bibliográfica
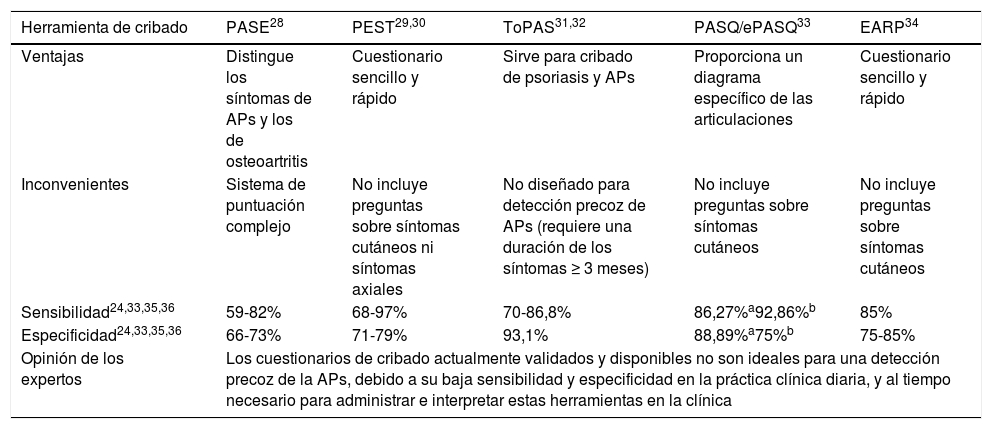
Ante la necesidad de un diagnóstico y tratamiento precoz de la APs se han desarrollado y validado diversas herramientas de cribado para este fin (tabla 2).
Características de las herramientas de cribado para la detección precoz de la APs
| Herramienta de cribado | PASE28 | PEST29,30 | ToPAS31,32 | PASQ/ePASQ33 | EARP34 |
|---|---|---|---|---|---|
| Ventajas | Distingue los síntomas de APs y los de osteoartritis | Cuestionario sencillo y rápido | Sirve para cribado de psoriasis y APs | Proporciona un diagrama específico de las articulaciones | Cuestionario sencillo y rápido |
| Inconvenientes | Sistema de puntuación complejo | No incluye preguntas sobre síntomas cutáneos ni síntomas axiales | No diseñado para detección precoz de APs (requiere una duración de los síntomas ≥ 3 meses) | No incluye preguntas sobre síntomas cutáneos | No incluye preguntas sobre síntomas cutáneos |
| Sensibilidad24,33,35,36 | 59-82% | 68-97% | 70-86,8% | 86,27%a92,86%b | 85% |
| Especificidad24,33,35,36 | 66-73% | 71-79% | 93,1% | 88,89%a75%b | 75-85% |
| Opinión de los expertos | Los cuestionarios de cribado actualmente validados y disponibles no son ideales para una detección precoz de la APs, debido a su baja sensibilidad y especificidad en la práctica clínica diaria, y al tiempo necesario para administrar e interpretar estas herramientas en la clínica | ||||
APs: artritis psoriásica; EARP: cuestionario de cribado Early Psoriatic Arthritis Screening; PASE: cuestionario Psoriatic arthritis screening and evaluation questionnaire; PASQ: cuestionario Psoriasis and Arthritis Screening; ToPAS: cuestionario de cribado Toronto Psoriatic Arthritis Screening.
Recientemente se han elaborado otros dos nuevos cuestionarios: Simple Psoriatic Arthritis Screening (SiPAS)37 y Psoriatic arthritis UnclutteRed screening Evaluation (PURE-4)38. El SiPAS es un cuestionario de 5ítems que el propio paciente puede completar de manera rápida y que tiene una especificidad y una sensibilidad comparables a otros cuestionarios existentes (un 79% de sensibilidad y un 87% de especificidad)37. El cuestionario PURE-4 se basa en los 4 dominios con mayor valor diagnóstico de APs en pacientes con psoriasis. Los resultados iniciales son prometedores (un 85,7% de sensibilidad y un 83,6% de especificidad)38 y ha sido recientemente validado al castellano39.
b. Recomendaciones del grupo de expertos
El grupo de expertos concluye que los cuestionarios de cribado actualmente validados no son ideales para la detección precoz de la APs, fundamentalmente debido al tiempo que se precisa para administrarlos e interpretar los resultados en la práctica clínica diaria. Sin embargo, entre los instrumentos previamente citados, la versión española del PURE-4, recientemente validada, puede ser prometedora dado su número reducido de preguntas, su buena sensibilidad diagnóstica y su viabilidad en la práctica clínica.
Anamnesis y exploración físicaa. Revisión bibliográfica
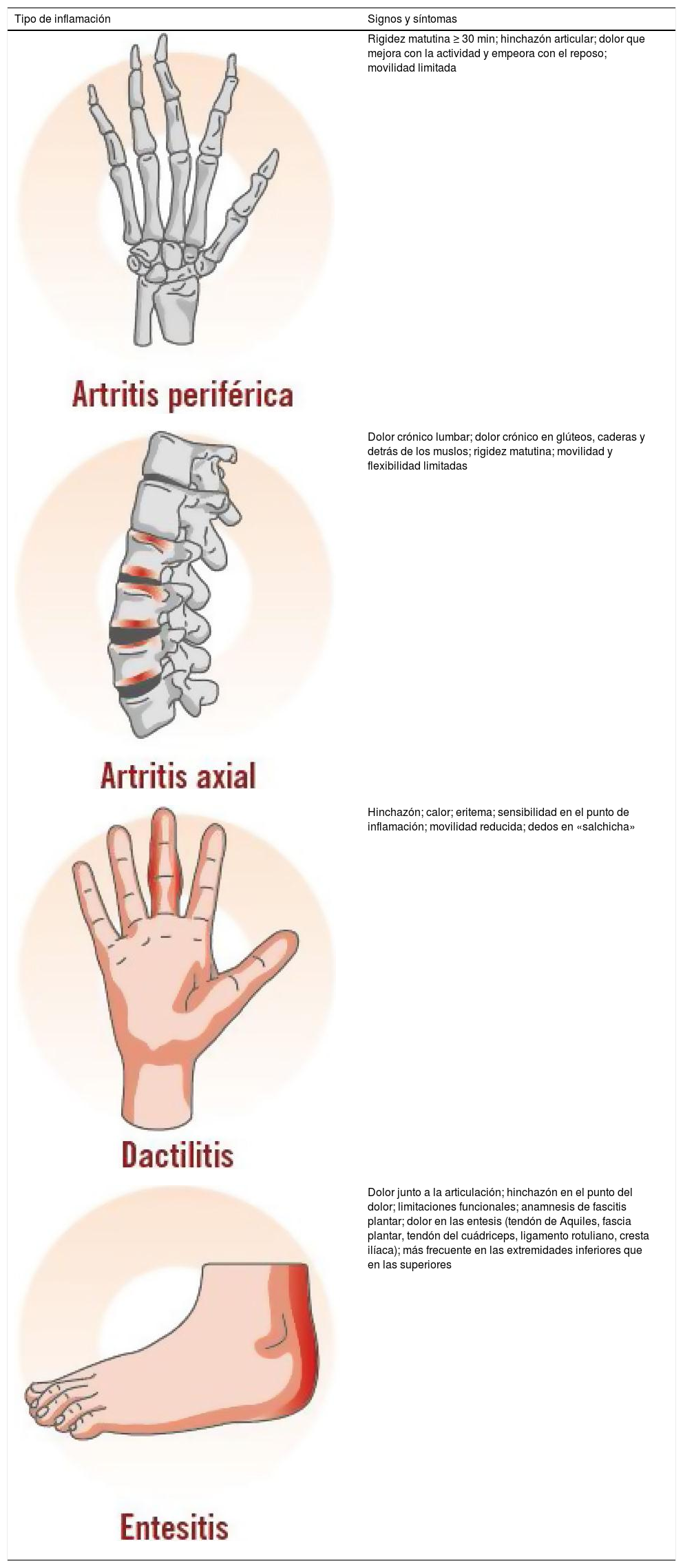
Aunque las manifestaciones clínicas de la APs son muy variables, las principales características clínicas son la artritis inflamatoria (periférica), la entesitis, la dactilitis y el dolor axial inflamatorio (tabla 3)7,40,41.
Características clínicas de la artritis inflamatoria, entesitis, dactilitis y espondilitis o dolor axial7
| Tipo de inflamación | Signos y síntomas |
|---|---|
| Rigidez matutina ≥ 30 min; hinchazón articular; dolor que mejora con la actividad y empeora con el reposo; movilidad limitada | |
| Dolor crónico lumbar; dolor crónico en glúteos, caderas y detrás de los muslos; rigidez matutina; movilidad y flexibilidad limitadas | |
| Hinchazón; calor; eritema; sensibilidad en el punto de inflamación; movilidad reducida; dedos en «salchicha» | |
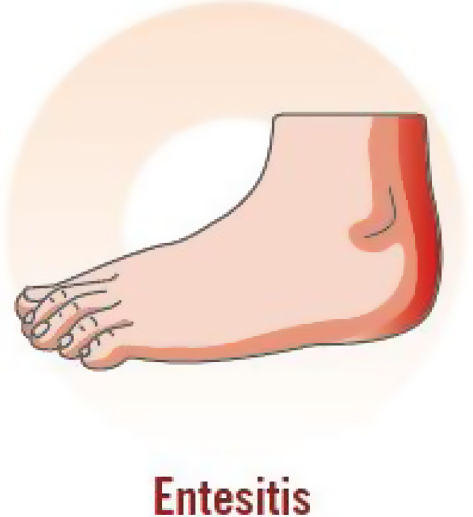
| Dolor junto a la articulación; hinchazón en el punto del dolor; limitaciones funcionales; anamnesis de fascitis plantar; dolor en las entesis (tendón de Aquiles, fascia plantar, tendón del cuádriceps, ligamento rotuliano, cresta ilíaca); más frecuente en las extremidades inferiores que en las superiores |
Otro signo frecuente de la APs es la psoriasis ungueal42. Algunos autores consideran que los pacientes con psoriasis ungueal tienen mayor probabilidad de padecer entesitis y afectación interfalángica distal43,44. Por consiguiente, los dermatólogos deben familiarizarse con estos signos, ya que pueden ser la única manifestación de la APs en los pacientes durante la fase precoz de la enfermedad.
Aproximadamente el 25% de los pacientes con APs presenta inflamación en el esqueleto axial, lo que provoca dolor, predominantemente en la región lumbar y en las articulaciones sacroilíacas (sacroilitis)45, y limitaciones en la movilidad.
b. Recomendaciones del grupo de expertos
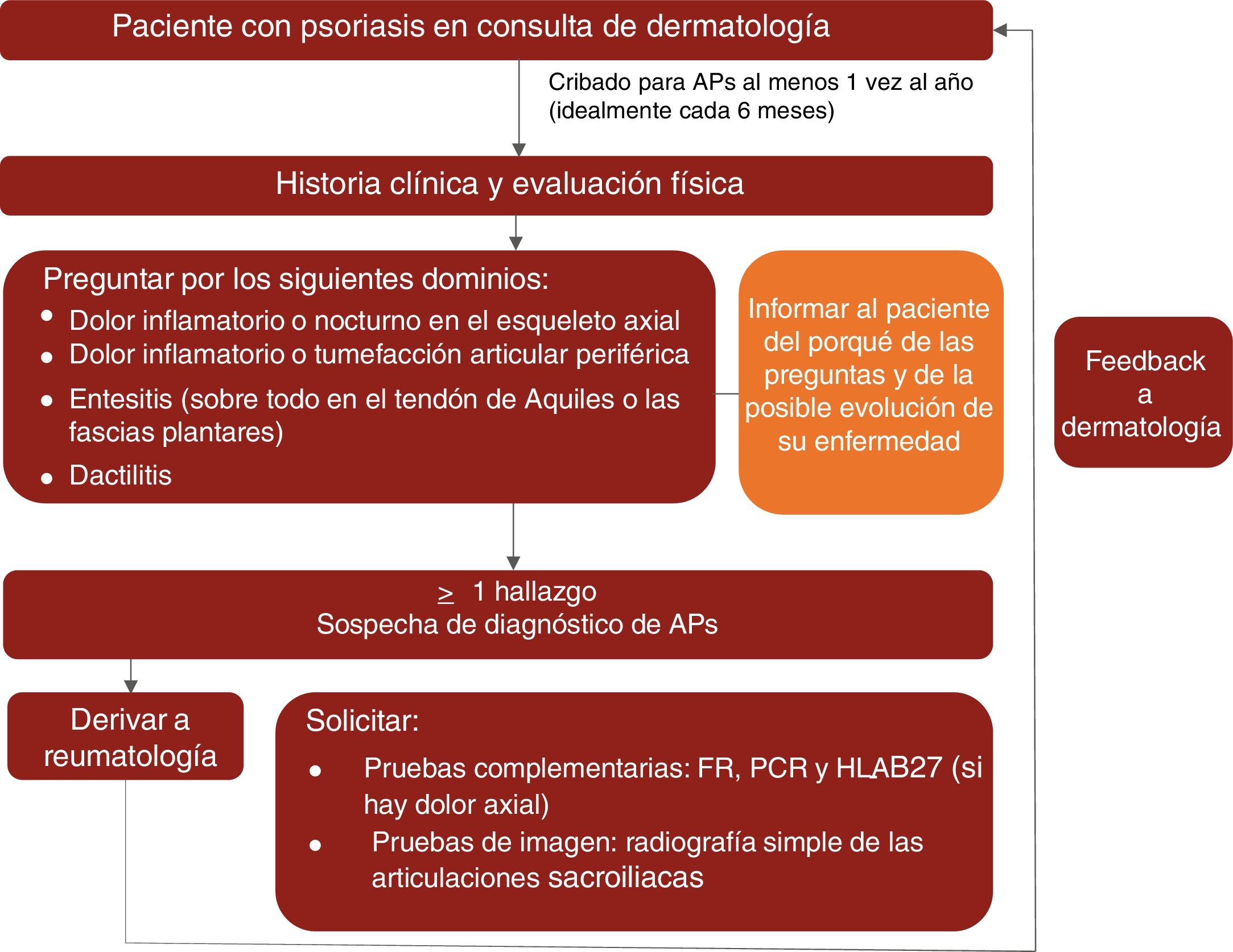
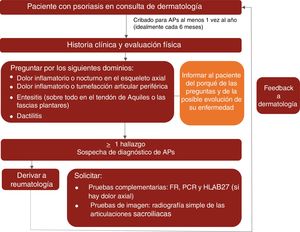
Basándose en la evidencia científica disponible y en su experiencia clínica, el grupo de expertos recomienda buscar activamente manifestaciones de APs en pacientes con psoriasis, al menos una vez al año e idealmente cada 6meses, mediante una anamnesis completa y valorando las manifestaciones clave (esqueleto axial, dactilitis, entesitis y artritis periférica) para comprobar la presencia de dolor inflamatorio14,15,19,46.
En la exploración física se ha de prestar especial atención a los dedos de las manos y de los pies (especialmente en las articulaciones interfalángicas distales) para comprobar una posible inflamación periférica, a las entesis —como la del tendón de Aquiles— para comprobar posibles entesitis, a los dedos (sobre todo de los pies) para comprobar posibles dactilitis, y a la columna vertebral para valorar la presencia de dolor axial inflamatorio.
El grupo de expertos también destaca la importancia de informar al paciente sobre las manifestaciones de la APs para incrementar la atención sobre su enfermedad y la posible evolución a una afectación articular. De esta manera, el propio paciente podrá identificar síntomas y signos asociados a la misma y consultará con su especialista específicamente por estos, lo que incrementará la probabilidad de realizar un diagnóstico precoz.
Pruebas complementariasPruebas de laboratorioa. Revisión bibliográfica
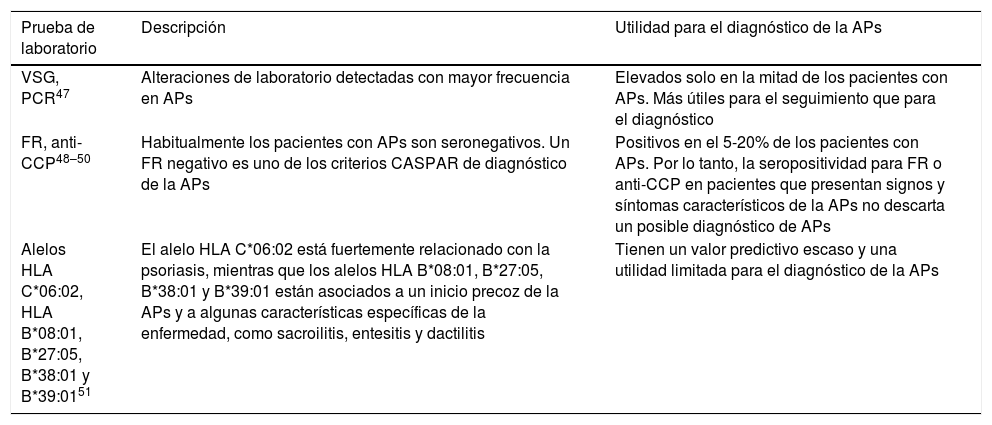
Dado que el diagnóstico de la APs es fundamentalmente clínico, a menudo es difícil distinguirla de otros cuadros con signos y síntomas similares. Por este motivo, la disponibilidad de biomarcadores específicos de la APs podría facilitar el diagnóstico definitivo. En la tabla 4 se describen diferentes pruebas de laboratorio y su utilidad para el diagnóstico de la APs.
Posibles biomarcadores para el diagnóstico de la APs
| Prueba de laboratorio | Descripción | Utilidad para el diagnóstico de la APs |
|---|---|---|
| VSG, PCR47 | Alteraciones de laboratorio detectadas con mayor frecuencia en APs | Elevados solo en la mitad de los pacientes con APs. Más útiles para el seguimiento que para el diagnóstico |
| FR, anti-CCP48–50 | Habitualmente los pacientes con APs son seronegativos. Un FR negativo es uno de los criterios CASPAR de diagnóstico de la APs | Positivos en el 5-20% de los pacientes con APs. Por lo tanto, la seropositividad para FR o anti-CCP en pacientes que presentan signos y síntomas característicos de la APs no descarta un posible diagnóstico de APs |
| Alelos HLA C*06:02, HLA B*08:01, B*27:05, B*38:01 y B*39:0151 | El alelo HLA C*06:02 está fuertemente relacionado con la psoriasis, mientras que los alelos HLA B*08:01, B*27:05, B*38:01 y B*39:01 están asociados a un inicio precoz de la APs y a algunas características específicas de la enfermedad, como sacroilitis, entesitis y dactilitis | Tienen un valor predictivo escaso y una utilidad limitada para el diagnóstico de la APs |
Anti-CCP: antipéptido citrulinado cíclico; APs: artritis psoriásica; FR: factor reumatoide; HLA: antígeno leucocitario humano; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
b. Recomendaciones del grupo de expertos
Los expertos concluyen que ninguno de los biomarcadores séricos actualmente disponibles aporta información suficiente para establecer un diagnóstico definitivo de APs. Sin embargo, en caso de que el dermatólogo solicite alguna prueba de laboratorio antes de la derivación al reumatólogo, los siguientes biomarcadores podrían contribuir a complementar los resultados de la exploración clínica y acelerar el diagnóstico: factor reumatoide (FR), proteínaC reactiva (PCR) y antígeno leucocitario humano B27 (HLA-B27) en pacientes con dolor axial. Si no es posible solicitar las tres pruebas, se recomienda hacer la determinación de PCR de alta sensibilidad como prueba complementaria de elección.
Diagnóstico por la imagena. Revisión bibliográfica
La radiografía convencional (rayosX), la ecografía y la resonancia magnética (RM) se han utilizado ampliamente para la evaluación de la APs.
La prueba de imagen más sencilla es la radiografía. La evidencia radiográfica de una osteoproliferación periarticular escasamente definida (excepto osteofitos) en manos o pies es un criterio de clasificación de APs52. La presencia de erosiones también es característica de las lesiones articulares inducidas por la APs. De todos modos, el papel principal de los rayosX es identificar manifestaciones específicas de la APs que solamente aparecen en una fase avanzada de la enfermedad.
En las últimas décadas ha aumentado sustancialmente el uso de la ecografía y de la RM para el diagnóstico precoz de la APs, y ambas técnicas proporcionan datos útiles para ayudar a dilucidar la patogenia de esta enfermedad y determinar el nivel de actividad de la misma53–55. Algunos estudios han sugerido que la RM podría discriminar entre APs, artritis reumatoide y osteoartritis, basándose en la presencia de entesitis e inflamación extracapsular56–58. La ecografía se utiliza para detectar lesiones precoces, principalmente sinovitis y entesitis. Diversos estudios han valorado el papel de la ecografía en pacientes con psoriasis sin signos articulares59,60. Sin embargo, actualmente el valor predictivo de la entesitis subclínica para el diagnóstico de la APs todavía es desconocido.
Basándose en la evidencia creciente del impacto positivo de los datos del diagnóstico por imagen sobre el tratamiento de las enfermedades reumáticas, la European League Against Rheumatism (EULAR) publicó las primeras recomendaciones sobre el uso de técnicas de imagen para el diagnóstico y el tratamiento de las espondiloartritis, incluyendo la APs61. Si se sospecha una APs periférica en un paciente con antecedentes personales o familiares de psoriasis, estas recomendaciones sugieren el uso de rayosX, ecografía o RM (aunque esta última deber considerarse una técnica de imagen secundaria, debido a su disponibilidad limitada y a su coste relativamente elevado). Para el diagnóstico de la APs axial el procedimiento de elección es el examen radiográfico de la pelvis para detectar la presencia de sacroilitis; sin embargo, puede requerirse la realización de una RM para distinguir una lesión ósea antigua de una lesión activa, en la que será evidente el edema óseo.
b. Recomendaciones del grupo de expertos
Los expertos no consideran aplicables las pruebas de imagen de modo rutinario en las consultas de dermatología. Sin embargo, permiten optimizar el proceso asistencial si se solicitan en paralelo a la derivación al reumatólogo. Por tanto, el grupo de expertos recomienda realizar una evaluación radiográfica de las articulaciones sacroilíacas (si hay dolor axial) y de las articulaciones más sintomáticas, especialmente de manos y pies. En presencia de sintomatología axial, el grupo de expertos también recomienda realizar una RM. La ecografía puede resultar útil, para los dermatólogos con experiencia en su interpretación, para identificar signos musculoesqueléticos de la APs.
Atención conjunta: derivación a reumatologíaa. Revisión bibliográfica
El valor de la atención conjunta ha ido adquiriendo cada vez más reconocimiento62–65. Se han propuesto y evaluado diferentes modelos de atención conjunta. Por ejemplo, el modelo en el que tanto el reumatólogo como el dermatólogo visitan al paciente el mismo día, o modelos virtuales en que ambos especialistas atienden a pacientes en la misma unidad pero en momentos distintos62,66. Dada la situación actual por la crisis de la COVID-19, los modelos de consulta teledermatológica están siendo ampliamente evaluados con el objetivo de reducir las consultas presenciales y el consecuente riesgo de infección67,68. En este sentido, aunque en España existen distintos modelos de teledermatología, su uso no está ampliamente expandido69, y es probable que la situación actual que ha surgido a raíz de la COVID-19 haga aumentar el uso de la teledermatología.
La aplicación de estos modelos ha mejorado la atención a los pacientes y los resultados de los tratamientos, principalmente gracias a diagnósticos más precoces y precisos. Los especialistas también refieren una mejor comunicación, una mayor colaboración y mayores oportunidades de investigación70–73. Sin embargo, la programación es un reto importante en este modelo de atención conjunta, porque las evaluaciones reumatológicas y dermatológicas requieren una elevada carga de tiempo, así como experiencia clínica.
Otro tema relevante es que, dada la amplia heterogeneidad en los criterios y prácticas de derivación, el Grupo de Investigación y Evaluación de la Psoriasis y la Artritis Psoriásica (GRAPPA) ha destacado la necesidad de elaborar criterios claros para establecer qué pacientes se deberían derivar a un reumatólogo para una evaluación más detallada74; no obstante, todavía no se han establecido dichos criterios.
b. Recomendaciones del grupo de expertos
El panel de expertos considera que los dermatólogos desempeñan un papel clave para establecer un diagnóstico precoz de la APs gracias a su papel durante el manejo de la psoriasis. Sin embargo, siempre que sea posible, es deseable una evaluación conjunta del paciente para confirmar el diagnóstico.
Independientemente de la posibilidad de realizar una consulta conjunta, los expertos recomiendan mantener una comunicación fluida y bidireccional que permita monitorizar el estado del paciente derivado, resolver cualquier incertidumbre diagnóstica y adoptar las decisiones terapéuticas oportunas.
En cuanto a la derivación, el grupo de expertos, de acuerdo con las recomendaciones elaboradas por Daudén et al.8 en 2012, considera que los pacientes con psoriasis y sospecha de APs deben ser derivados al reumatólogo cuando presenten, por lo menos, uno de los siguientes signos o síntomas:
- •
Dolor inflamatorio o nocturno del esqueleto axial.
- •
Dolor inflamatorio o inflamación articular periférica.
- •
Entesitis o signos clínicos que la sugieran (especialmente en el tendón de Aquiles y en la fascia plantar).
- •
Dactilitis o signos clínicos que la sugieran.
Como se ha mencionado antes, el grupo de expertos recomienda que los dermatólogos busquen activamente estas manifestaciones por lo menos una vez al año e idealmente cada 6meses.
Por último, la telemedicina podría desempeñar un papel clave en el abordaje conjunto del paciente con enfermedad psoriásica, necesidad que se ha hecho más evidente en la situación pandémica por COVID-19 que actualmente afronta el sistema sanitario67.
En la figura 1 se representa un algoritmo de control clínico de la APs propuesto para las consultas de dermatología.
a. Revisión bibliográfica
Aunque en casos de progresión rápida, enfermedad avanzada o poca familiaridad con el manejo de la APs se recomienda una derivación inmediata a reumatología, la realidad en el contexto asistencial implica que en ocasiones el dermatólogo deba tomar decisiones en cuanto al abordaje terapéutico de un paciente con psoriasis y signos sugestivos de APs75,76.
Actualmente no existen directrices concretas de tratamiento ni recomendaciones para pacientes con una APs precoz; por el contrario, la mayoría de las directrices (p. ej., GRAPPA, EULAR, ACR) se centran en el tratamiento de pacientes con una APs ya establecida, es decir, que cumplan los criterios CASPAR77–79.
Habitualmente, en los pacientes con manifestaciones clínicas leves y/o un cuadro no erosivo están indicados los antiinflamatorios no esteroideos y otras medidas conservadoras. Sin embargo, en pacientes con un cuadro moderado o grave cabe considerar un tratamiento con fármacos antirreumáticos modificadores de la enfermedad no biológicos (FAME convencionales) como primera línea de tratamiento. Otros fármacos que también pueden prescribirse son los biológicos (inhibidores del factor de necrosis tumoral alfa e inhibidores de la interleucina [IL]-17 e IL-12/23) o nuevas moléculas sintéticas orales (inhibidores de la fosfodiesterasa), cuyo desarrollo ha mejorado sustancialmente el tratamiento de los pacientes con APs76.
La evidencia científica actual sobre un tratamiento óptimo de la APs precoz es escasa. Sin embargo, un estudio exploratorio reciente demostró que el tratamiento precoz con secukinumab en los pacientes psoriásicos sin APs, pero con artralgia y alteraciones inflamatorias articulares, resolvía la inflamación y detenía la progresión de los cambios estructurales a las 24semanas del inicio del tratamiento. Estos datos sugieren que es posible una intervención terapéutica precoz con secukinumab, que va asociada a la mejora de las manifestaciones clínicas y de imagen de la APs precoz15. Otro estudio exploratorio demostró que la administración de ustekinumab en pacientes con psoriasis sin síntomas de APs reducía la entesitis subclínica a las 12semanas de tratamiento80.
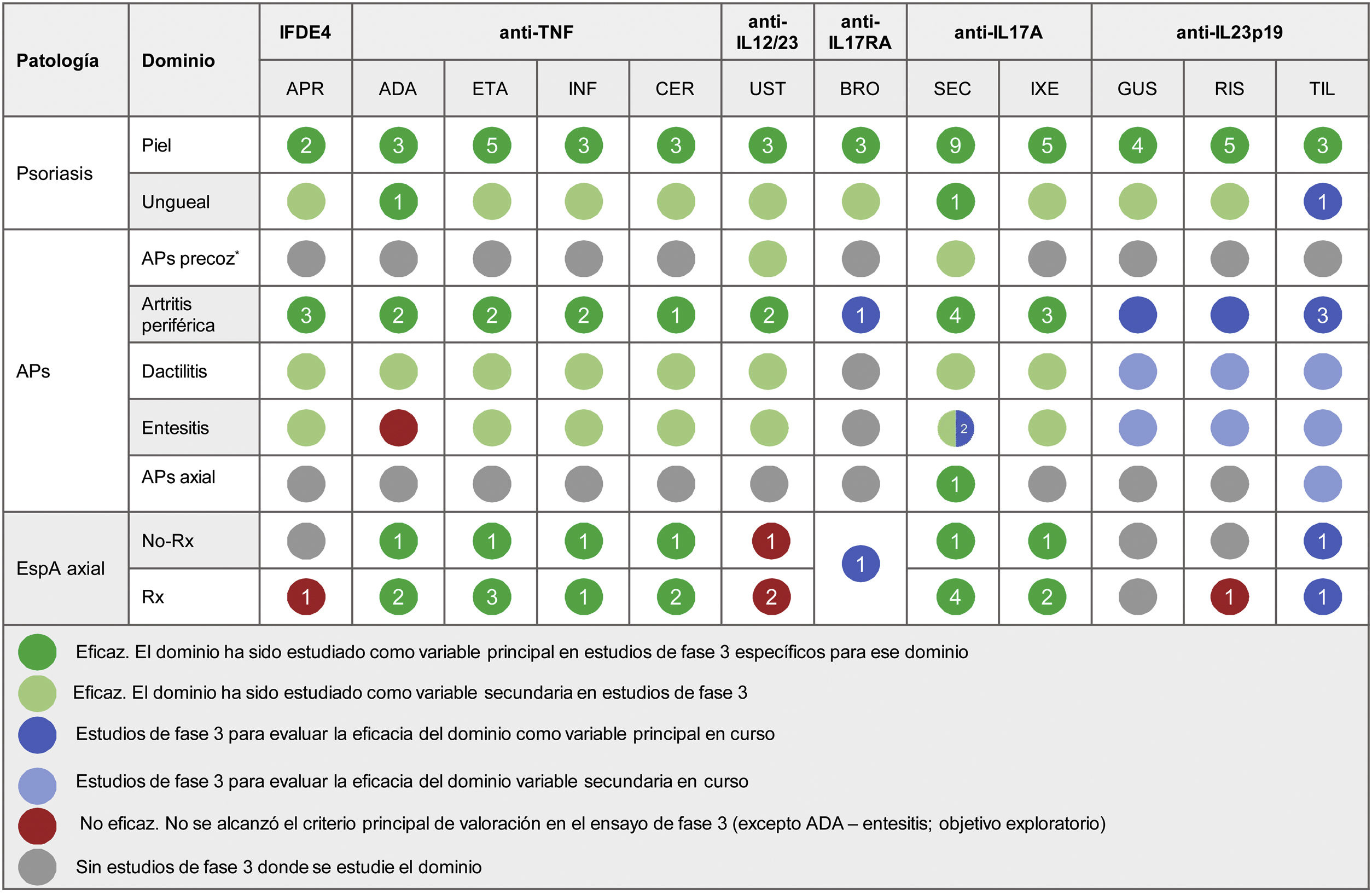
En la tabla 5 se resumen los tratamientos actualmente disponibles para la psoriasis y el grado de eficacia demostrado en estudios clínicos para el tratamiento de cada una de las manifestaciones de la APs y la espondiloartritis axial.
Resumen de la eficacia clínica de los fármacos sistémicos biológicos y moléculas pequeñas orales aprobados para el tratamiento de la psoriasis sobre los dominios de APs y espondiloartritis axial. La cifra dentro de cada círculo indica el número de ensayos clínicos específicos para evaluar ese dominio. Todas las referencias de artículos y ensayos clínicos utilizadas para elaborar la tabla se pueden consultar en el Anexo. Material adicional
ADA: adalimumab; APR: apremilast; APs: artritis psoriásica; BRO: brodalumab; CER: certolizumab; ETA: etanercept; GUS: guselkumab; IFDE4: inhibidor de la fosfodiesterasa 4; IL: interleucina; INF: infliximab; IXE: ixekizumab; No-Rx: no radiográfica; RIS: risankizumab; Rx: radiográfica; SEC: secukinumab; TIL: tildrakizumab; TNF-α: factor de necrosis tumoral alfa; UST: ustekinumab.
* El término «APs precoz» hace referencia a estudios exploratorios donde los pacientes no presentaban un diagnóstico definitivo de APs.
b. Recomendaciones del grupo de expertos
El grupo de expertos recomienda un abordaje terapéutico que contemple las diferentes manifestaciones clínicas de la APs. El tratamiento clínico concreto debe basarse en los resultados de eficacia y seguridad de los ensayos clínicos, así como en la experiencia en la práctica clínica.
ConclusionesEl diagnóstico precoz de la APs es fundamental, ya que un abordaje temprano en el manejo y en el tratamiento puede alterar positivamente el curso natural de la APs, evitando de este modo daños articulares irreversibles. La falta de herramientas de cribado adecuadas para este fin, sin embargo, constituye una necesidad no cubierta que ha sido la base y premisa de este trabajo. En él se han abordado y analizado cuestiones clave, así como las potenciales herramientas y procedimientos que el dermatólogo podría utilizar para la detección precoz de la enfermedad.
A continuación se exponen las conclusiones de cada uno de los apartados revisados (véase resumen en la tabla 6):
- •
Herramientas de cribado. Aunque los cuestionarios de cribado no son útiles para la detección precoz de la APs, el cuestionario de cribado recientemente validado al español PURE-4 puede ser una herramienta diagnóstica viable en la práctica clínica para la detección precoz de la enfermedad por parte del dermatólogo.
- •
Anamnesis y evaluación física. La periodicidad con la que debe realizarse una exploración física centrada en la APs debe ser de al menos una vez al año e idealmente cada 6meses. Los principales signos a los que hay que prestar especial atención son la artritis periférica inflamatoria, la entesitis (tendón de Aquiles y fascia plantar), la dactilitis y el dolor inflamatorio axial.
- •
Pruebas complementarias. El uso de biomarcadores y las pruebas de diagnóstico por imagen, en general, no fueron recomendados por los especialistas. Sin embargo, ante sospecha de APs, y en caso de solicitar estudios analíticos, los expertos consideran que podrían ser de utilidad, como pruebas complementarias a la exploración física, el FR, la PCR y el HLA-B27 (solo si existe dolor axial). Respecto a las pruebas de imagen, los autores recomiendan solicitar una radiografía de las articulaciones sacroilíacas (si hay dolor axial) y de las articulaciones más sintomáticas. En presencia de sintomatología axial, recomiendan solicitar una RM, y consideran que la ecografía puede resultar útil para los dermatólogos que tengan un manejo avanzado de la técnica a la hora de identificar signos musculoesqueléticos susceptibles de APs.
- •
Asistencia multidisciplinar y derivación a reumatología. El dermatólogo debe realizar la derivación si el paciente presenta dolor inflamatorio axial, periférico, entesitis o dactilitis. La comunicación entre los servicios de dermatología y reumatología es fundamental para conocer el estado de las derivaciones, esclarecer dudas en el diagnóstico y tomar decisiones terapéuticas conjuntas. Por último, la telemedicina podría desempeñar un papel clave en el abordaje conjunto del paciente con enfermedad psoriásica en el contexto de situación pandémica por COVID-19 que actualmente afronta el sistema sanitario.
- •
Abordaje terapéutico. Debe contemplar las diferentes manifestaciones clínicas de la APs y basarse en los resultados de eficacia y seguridad de los ensayos clínicos, así como en la experiencia en la práctica clínica.
Resumen de recomendaciones
| Herramientas diagnósticas | Recomendaciones de los expertos |
|---|---|
| Cuestionarios de cribado | No son ideales para la detección precoz de la APs y consumen tiempo. Sin embargo, el cuestionario PURE-4 parece prometedor |
| Anamnesis y exploración clínica | Anual, e idealmente cada 6 mesesComprobar:• Artritis periférica inflamatoria• Dactilitis• Entesitis (tendón de Aquiles y fascia plantar)• Dolor inflamatorio axial |
| Pruebas complementarias: análisis de laboratorio | No se recomiendan los biomarcadores como herramienta diagnóstica para detectar APsPruebas de laboratorio útiles:• PCR• HLA-B27 (si hay dolor axial inflamatorio)• FR (criterios CASPAR) |
| Diagnóstico por imagen | • Radiografías de las articulaciones más sintomáticas• Ecografía si el dermatólogo domina la técnica |
| Atención conjunta: derivación a reumatología | Comunicación bidireccional fluida entre dermatólogos y reumatólogosSe recomienda la derivación a reumatología si se sospecha una APs y existe:• Dolor inflamatorio o dolor nocturno en el esqueleto axial• Dolor inflamatorio periférico, hinchazón de articulaciones• Entesitis o signos clínicos que la sugieran (centrarse en el tendón de Aquiles y la fascia plantar)• Dactilitis o signos clínicos que la sugieran |
| Abordaje terapéutico | • Tener en cuenta las diferentes manifestaciones posibles de la APs• Selección basada en datos de eficacia y de seguridad de los ensayos clínicos, y en la práctica clínica diaria |
APs: artritis psoriásica; FR: factor reumatoide; HLA: antígeno leucocitario humano; PCR: proteína C reactiva.
Las reuniones, así como el soporte en la redacción y edición del manuscrito, fueron financiadas por Novartis Farmacéutica S.A.
Conflicto de interesesI. Belinchón: Ha colaborado como consultor y/o conferenciante y/o participado en ensayos clínicos patrocinados por empresas que fabrican fármacos utilizados para el tratamiento de la psoriasis, incluidas Janssen, Almirall, Eli Lilly and Company, AbbVie, Novartis Farmacéutica S.A., Celgene España S.L., Biogen Inc., Amgen, LEO Pharma, Pfizer-Wyeth, UCB y Merck Sharp & Dohme Española S.A.
L. Salgado-Boquete: AbbVie, Almirall, Celgene España S.L., Janssen, LEO Pharma, Eli Lilly and Company, Novartis, MSD, Pfizer y Reig Jofre.
A. López-Ferrer: Novartis Farmacéutica S.A., Janssen, MSD, Eli Lilly and Company, Pfizer, Celgene España S.L., Almirall, LEO Pharma, AbbVie y Amgen.
M. Ferran: Ha colaborado como conferenciante y/o asesor y o en ensayos clínicos para Janssen, Eli Lilly and Company, Novartis, Pfizer, MSD, AbbVie, Celgene y Almirall.
P. Coto-Segura: Ha colaborado como miembro del comité asesor, consultor, becas, apoyo a la investigación, participación en ensayos clínicos, honorarios por conferencias y apoyo a la investigación con las siguientes empresas farmacéuticas: AbbVie (Abbott), Janssen-Cilag, Novartis Farmacéutica S.A., Pfizer, MSD, UCB, Eli Lilly and Company y Celgene España S.L.
R. Rivera: Consultor, investigador y/o conferenciante para AbbVie, Almirall, Celgene España S.L., GlaxoSmithKline, Janssen-Cilag, Lilly, LEO Pharma, MSD, Novartis, Pfizer y UCB.
D. Vidal: Consultor, investigador y/o conferenciante para AbbVie, Celgene España S.L., Eli Lilly and Company, Janssen, Novartis Farmacéutica S.A., Laboratorios Gebro Pharma S.A., LEO Pharma y UCB.
L. Rodríguez: Ha colaborado como consultor y conferenciante para AbbVie, Janssen, MSD, Pfizer-Wyeth, Novartis Farmacéutica S.A., Celgene España S.L., Almirall, Eli Lilly and Company y LEO Pharma.
P. de la Cueva: Asesor y/o investigador y/o conferenciante para AbbVie, Almirall, Astellas Pharma, Biogen Inc., Boehringer Ingelheim, Celgene España S.L., Janssen, LEO Pharma, Eli Lilly and Company, Merck Sharp & Dohme Española S.A., Novartis Farmacéutica S.A., Pfizer y UCB.
R. Queiro: Consultor, investigador y/o conferenciante para AbbVie, MSD, Pfizer, Novartis Farmacéutica S.A., Lilly, Janssen, UCB y Celgene España S.L. Ha recibido fondos no restringidos para investigación de AbbVie, Novartis Farmacéutica S.A. y Janssen.
Los autores agradecen a Itsaso Cabezón Rodríguez (Ediciones Mayo, España) por su soporte en la redacción y edición del manuscrito.