La escabiosis es una de las enfermedades transmisibles más prevalentes en el mundo, actualmente en auge en nuestro entorno. Existen diferentes causas que explican la problemática de esta epidemia: una incorrecta aplicación o pauta del tratamiento; la disminución de la sensibilidad o la resistencia al tratamiento tópico y las carencias en el conocimiento del parásito y su transmisibilidad. Por este motivo es necesario un nuevo enfoque en el tratamiento de esta enfermedad que contemple los problemas y la evidencia actual. Si hay una persistencia de la clínica tras un correcto tratamiento es importante corroborar el fracaso terapéutico y estandarizar la actitud. Por último, ante un caso recalcitrante cabría plantear la posibilidad de priorizar el tratamiento oral, aumentar su dosis, realizar tratamientos combinados o plantear su uso fuera de ficha técnica en poblaciones especiales. La aparición de nuevos tratamientos, como el spinosad o, sobre todo, la moxidectina, aportan esperanza en el control de esta enfermedad.
Scabies, which is among the most prevalent diseases worldwide, is becoming more frequent in Spain. The problems of this epidemic can be explained by several factors: improper application or prescription of treatments, resistance or reduced sensitivity to topical treatments, and poor understanding of the parasite and contagion. We require a new evidence-based approach to therapy that takes these problems into consideration. If symptoms persist after proper treatment, it is important to identify the reason for failure and standardize our approach. In refractory cases, the prescriber should prioritize oral medication, indicate a higher dose, combine treatments, or evaluate the use of off-label treatments in certain populations. The availability of new medications —such as spinosad or, especially, moxidectin— offer hope for bringing this disease under control.
La escabiosis o sarna es una parasitosis producida por el Sarcoptes scabiei (S. scabiei) variedad hominis, un ácaro humano estricto con un ciclo de vida de aproximadamente 10-14 días1–3. El cuadro clínico se inicia cuando los ácaros adultos excavan un surco en la epidermis del huésped. La hembra fecundada deposita los huevos de los que emergerán las larvas que se desarrollarán en ácaros adultos4.
La clínica cutánea está producida tanto por los surcos que excavan los parásitos –lesiones específicas– como por la respuesta de hipersensibilidad generada por los ácaros y sus productos4. Tras la primera infestación, los pacientes normalmente se mantienen asintomáticos durante el periodo de incubación, que dura unas 4-6 semanas. En posteriores infestaciones, la clínica se manifiesta con una mayor premura2,3.
El parásito se transmite por el contacto directo prolongado piel con piel y, raramente, por el contacto con fómites, en los que puede sobrevivir hasta 8 días5.
Una enfermedad ancestral... que plantea un gran problema en la actualidadLas primeras referencias de esta enfermedad aparecen en el siglo IV a.C., o incluso, en el Antiguo Testamento. Su etiología fue descrita en el siglo XVII, convirtiéndose en una de las primeras enfermedades en las que se descubrió su causa6. En la actualidad, la escabiosis tiene una prevalencia e incidencia anual mundial estimada de 147 y 455 millones de casos respectivamente7.
A pesar de los avances en la parasitología durante los siglos XIX y XX, la investigación acerca de la escabiosis apenas avanzó en este periodo debido al escaso interés que provocó históricamente una enfermedad que afectaba predominantemente a las poblaciones menos favorecidas8.
En los últimos años parece observarse un aumento de casos en los países europeos9–11 agravado por la pandemia por SARS-CoV-2, en gran parte debido al confinamiento domiciliario y al retraso en el diagnóstico y el tratamiento10.
Con el objetivo de combatir esta epidemia, en 2012 nace la International Alliance for the Control of Scabies (IACS), que propone unos criterios para facilitar el diagnóstico de la escabiosis sin necesidad de grandes recursos (tabla 1). Posteriormente, la Organización Mundial de la Salud clasificó la escabiosis como una enfermedad tropical desatendida en 2017, y actualmente colabora con organismos como la IACS con el objetivo de desarrollar estrategias conjuntas para su control12. En 2020 la escabiosis se incluyó en la hoja de ruta de la Organización Mundial de la Salud para las enfermedades tropicales desatendidas 2021-203013.
Simplificación de los criterios diagnósticos propuestos por la International Alliance for the Control of Scabies (IACS)
| Criterios diagnósticos de la escabiosis | ||
| Diagnóstico de confirmación* | Observación directa del ácaro, huevos o escíbalos | |
| Diagnóstico clínico | Surcos acarinos | |
| Al menos uno de los siguientes | Nódulos escabióticos en genitales masculinos | |
| Lesiones típicas en regiones frecuentemente afectadas**, prurito y contacto con paciente diagnosticado de escabiosis | Otros diagnósticos son menos probables | |
| Diagnóstico de sospecha | Lesiones en regiones típicas y prurito o contacto con paciente diagnosticado de escabiosis | |
| Al menos uno de los siguientes | Lesiones o distribución atípica, pero prurito y contacto con paciente con sarna | |
No se puede realizar el diagnóstico de confirmación sin instrumentos diagnósticos (microscopio, dermatoscopio).
Lesiones eccematosas, pápulas eritematosas y en ocasiones nódulos afectando principalmente manos, axilas, ingles, nalgas y miembros inferiores. En niños es típica la presencia de vesículas y pústulas sobre todo palmo-plantares.
Se muestran los criterios diagnósticos propuestos por la IACS de forma simplificada.
Fuente: Engelman et al.12.
En los últimos años se describe un número creciente de fracasos al tratamiento cuyas causas no están del todo establecidas.
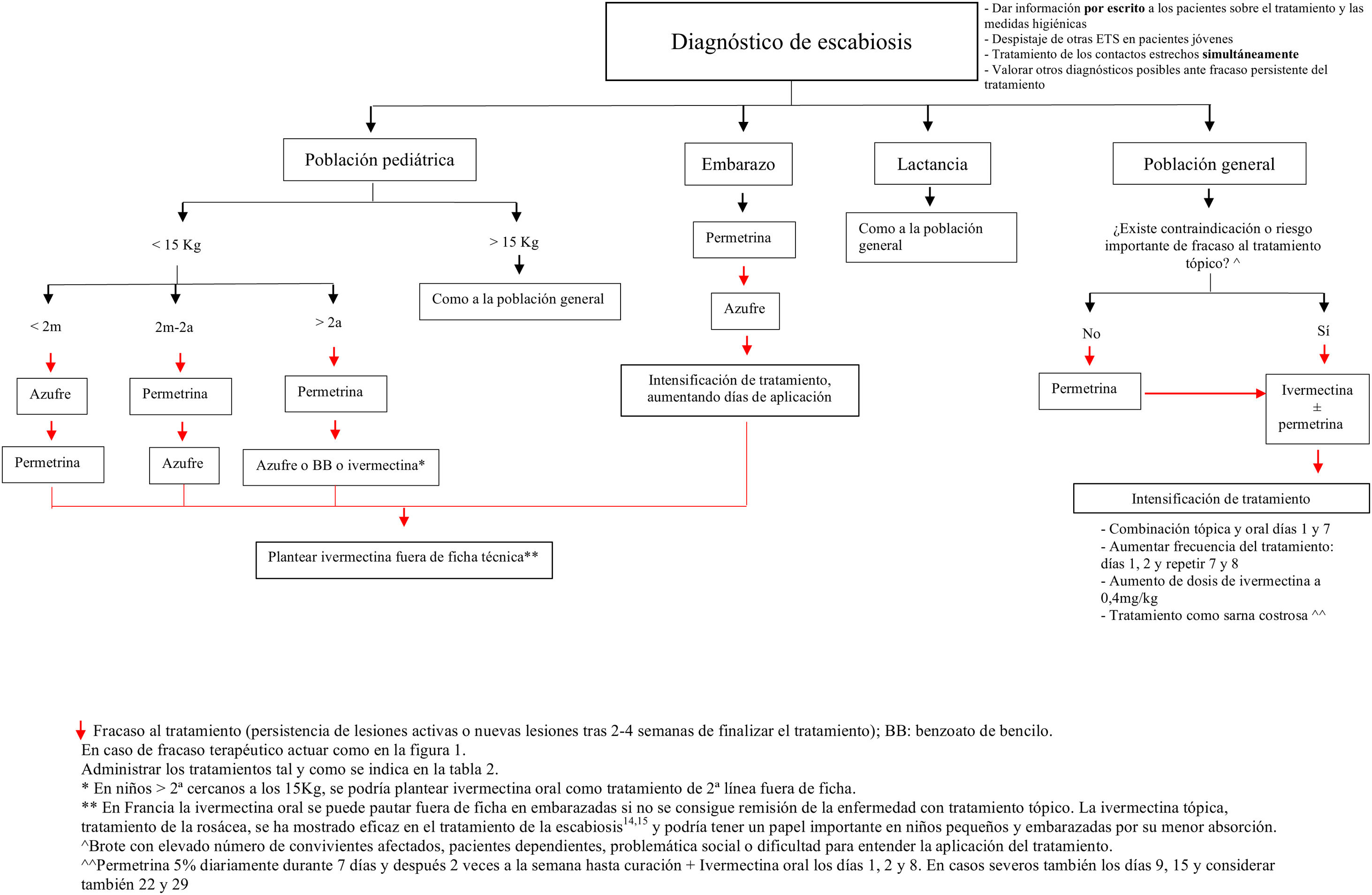
Propuesta terapéutica en la actualidadAnte un caso o un brote de escabiosis, el objetivo principal es el de erradicar el parásito del paciente y abortar la transmisión de la enfermedad. Por este motivo, tanto el paciente como sus contactos estrechos (convivientes o personas que han tenido contacto prolongado con el paciente, ya sea piel con piel o mediante fómites) en el último mes deben ser tratados simultáneamente –independientemente de que tengan sintomatología o no– y mantener un aislamiento hasta finalizar la primera tanda del tratamiento escogido11.
Se debe realizar siempre una adecuada descontaminación ambiental integrada con el tratamiento farmacológico. Se ha descrito que todos los ácaros adultos y huevos de S. scabei mueren al ser expuestos a temperaturas de al menos 50°C durante 10 minutos, o después de ser aislados en bolsas de plástico durante 3-8 días, dependiendo de las condiciones ambientales5. Sin embargo, es probable que el impacto del tratamiento de los fómites se haya magnificado y realmente tenga un papel menor del que se cree en la transmisión de la escabiosis clásica. Las medidas higiénicas sí que son fundamentales en los pacientes con sarna costrosa, donde la infestación está ocasionada por miles de ácaros2.
Elección del tratamiento (tabla 2)En nuestro medio, los tratamientos más frecuentemente utilizados son la permetrina tópica al 5% y la ivermectina oral a dosis de 0,2mg/kg. Junto al benzoato de bencilo, constituyen los tratamientos de elección propuestos en la «European guideline for the management of scabies»3. En un metanálisis realizado en 2018 no se encontraron diferencias significativas entre las tasas de curación con permetrina tópica (74%) y la ivermectina oral (68%) tras dos semanas de tratamiento14. La combinación de ivermectina oral y permetrina tópica se ha propuesto como el tratamiento que tiene una mayor probabilidad de alcanzar la curación a las 3-6 semanas en un metanálisis en red15.
Tratamientos disponibles y financiados por el Sistema Nacional de Salud (SNS) para el tratamiento de la escabiosis clásica en España
| Fármaco | Presentación | Pauta posológica general | Embarazo | Lactancia | Pediatría |
|---|---|---|---|---|---|
| Tratamientos tópicos | |||||
| Permetrina | Comercializado en crema al 5% | Aplicar durante mínimo 12h los días 1 y 7 desde el cuello a la planta de los pies | Apto | Apto | Apto para > 2 meses de edad. Probablemente seguro en < 2 meses.Aplicar también en la cabeza en < 2 años |
| Benzoato de bencilo | Mediante FM en emulsión O/W al 10-25%. | Aplicar durante 24h los días 1, 2 y 7 desde el cuello a la planta de los pies al 25% | No contraindicado, pero utilizar solo si es necesarioUna única aplicación durante 12h al 10% | Apto | Preferible no utilizar en < 2 años, pero en caso de utilizarlo, reducir exposición a 12 h y realizar una única aplicaciónMantener solo 6h en < 6m y realizar una única aplicaciónHasta los 12 años al 10% |
| Azufre | Mediante FM en vaselina/pomada/crema fría al 5-10% | Aplicar durante 24 h los días 1, 2 y 3 desde el cuello hasta las plantas de los pies | Apto | Apto | Apto en todas las edades. En lactantes aplicar también en la cabeza |
| Tratamientos orales | |||||
| Ivermectina oral | Comercializado en comprimidos de 3mg | 0,2mg/Kg el día 1 y repetir el día 7 Actualmente se recomienda administrar tras 2h de ayuno y no ingerir alimentos hasta 30 minutos después | No indicado en España. En Francia es tratamiento de segunda línea. Valorar su uso fuera de ficha en casos recalcitrantes | AptoPlantear la extracción de leche materna previa si la paciente muestra rechazo al tratamiento | Apto en > 15 Kg. Probablemente también seguro en < 15 Kg, pero sin indicación en ficha técnica. Valorar su uso fuera de ficha en casos resistentes a tratamiento tópicoEn < 15Kg administrar el tratamiento triturando un comprimido -o medio comprimido en función del peso-, o mediante formulación en suspensión oral |
FM: fórmula magistral; O/W: oil-in-water; Kg: kilogramos; h: horas; m: meses; mg: miligramos.
No se indican el malatión y el crotamitón al no ser considerado tratamientos de primera línea, no estar financiados y disponer de menor evidencia y experiencia en nuestro entorno.
Fuente: Salavastru et al. 3, Barrabeig et al.11, Morgado-Carrasco et al.16 y Medecins sans frontieres36.
No obstante, en la mayoría de las guías de práctica clínica se recomienda todavía la permetrina al 5% como el tratamiento de primera línea. A ello contribuye su fácil disponibilidad, su efecto ovicida y su perfil de seguridad9,16,17.
La ivermectina oral, a pesar de no estar aprobada de forma específica, se utiliza como una alternativa en el tratamiento de la escabiosis en todo el mundo, con un buen perfil de tolerancia y de seguridad14,15.
La ivermectina carece de actividad ovicida. Por ello, siempre hay que administrar una segunda dosis en el periodo ventana, que se encuentra entre la eclosión de los huevos –días 2-4 del ciclo– y el depósito de nuevos huevos por la hembra adulta fertilizada –días 7-15–. Aunque el día exacto de la segunda dosis tiene que establecerse aún, parece lógico administrarlo en este periodo.
Aunque en general no se recomienda en embarazadas y en niños con peso inferior a 15 kg, existen estudios que plantean su seguridad en este último colectivo18. De hecho, se está llevando a cabo un ensayo clínico (EC) para evaluar la seguridad y eficacia de la ivermectina en niños que tienen entre 5-15kg a una dosis de hasta 0,8mg/kg [NCT04332068]19. De este modo, la evidencia actual de seguridad de este fármaco utilizado fuera de guía en niños pequeños probablemente favorezca la aparición de cambios en esta indicación.
Para las mujeres embarazadas, las contraindicaciones se basan en los estudios realizados en animales donde las dosis utilizadas de ivermectina son mucho mayores que las utilizadas en seres humanos. Cabe destacar que en Francia se prescribe como un tratamiento de segunda línea en estas pacientes y algunos de los mayores expertos en escabiosis y organizaciones dedicadas a evaluar la seguridad de fármacos en gestantes apoyan dicho tratamiento en caso de necesidad20. En las mujeres en periodo de lactancia se considera un fármaco seguro20.
Fracaso en el tratamiento de la escabiosisEn los últimos años se ha detectado un aumento del fracaso del tratamiento de la escabiosis. Una de las posibles explicaciones sería la falta de respuesta o una resistencia a la permetrina tópica. En una serie de casos recogida durante la pandemia por SARS-CoV-2 se describió una tasa de fracaso al tratamiento con permetrina del 73%. Sin embargo, todos los pacientes respondieron al tratamiento con ivermectina oral21, datos similares a los observados en otros estudios22.
En un EC realizado en Austria la aplicación de dos dosis de permetrina con una semana de separación demostró una eficacia del 31%, sin mejores resultados tras intensificar el tratamiento23. En la misma línea, solo 1 de cada 3 pacientes respondió a la permetrina tras una mediana de 15 aplicaciones en un trabajo retrospectivo24. Estos datos motivaron un nuevo estudio prospectivo en el que únicamente el 26% respondió a uno o dos ciclos de permetrina tópica al 5%25. En todas estas publicaciones los autores se plantean la necesidad de revisar las guías actuales y contemplar la posibilidad de resistencias a la permetrina tópica.
Posibles causas de fracaso en el tratamientoExisten varios motivos que podrían explicar el incremento en el fracaso del tratamiento de la escabiosis:
- 1.
Aplicación o pautas incorrectas y reinfestación.
En un estudio se describió que los principales predictores de fracaso terapéutico fueron el uso de una única dosis de ivermectina oral o la administración de un único tratamiento, ya sea oral o tópico en comparación con la administración de ambos, no realizar medidas higiénicas ambientales y la existencia de convivientes afectados. Además, los autores mostraron cómo la combinación de una dosis de tratamiento tópico y dos dosis de tratamiento oral tiene una mayor proporción de curación (86%) a los 3 meses26.
Una parte del fracaso del tratamiento tópico podría ser, además, atribuible a una mala aplicación. En un estudio con crema fluorescente se observó cómo de 21 pacientes ninguno fue capaz de aplicar correctamente el tratamiento, a pesar de ser instruidos para ello27.
Por este motivo, cabe destacar la dificultad que existe para aplicar correctamente el tratamiento tópico en todos los miembros de las familias numerosas y, más aún, cuando existe una cierta desestructuración familiar con varios núcleos involucrados.
Por último, resaltar la heterogeneidad –y a menudo inconsistencia– de los abordajes diagnósticos y terapéuticos de la escabiosis entre los propios profesionales sanitarios10,12.
- 2.
Disminución de sensibilidad al tratamiento tópico
La resistencia a los tratamientos de la escabiosis es un tema controvertido y del que no existen datos concluyentes. Se han descrito mecanismos de resistencia a la permetrina en S. scabei diferentes a la variedad hominis9. En estudios in vitro, a partir de ácaros obtenidos de pacientes que habían realizado múltiples tandas de permetrina, se detectaron parásitos viables tras 18-22h de exposición constante a este fármaco28. Por el contrario, en otros trabajos se demostró la sensibilidad a las distintas dosis de permetrina en ácaros de pacientes aparentemente resistentes al tratamiento29. Por tanto, aunque algunos autores abogan por considerar probable que existan resistencias a permetrina23–25, no existe una clara evidencia al respecto.
En cuanto a la ivermectina, se han descrito casos de resistencia en el parásito tras aplicaciones repetidas y prolongadas7.
- 3.
Transmisión entre animales y humanos
Las variedades de S. scabiei han sido divididas taxonómicamente en función de su hospedador, aunque fueran indistinguibles en su morfología. Sin embargo, actualmente esto se cuestiona, ya que se ha observado infectividad cruzada en más de 50 especies30.
Estudios filogenéticos describen cómo los ácaros de S. scabei que afectan a humanos se distribuyen dentro de tres clados genéticamente diferenciados (A, B y C), y cómo el clado C contiene no solo S. scabiei provenientes de humanos, sino también de otras 12 especies. También describen transferencia genética entre los ácaros de humanos y animales. Con esto concluyen que deberíamos abandonar la clasificación taxonómica actual y proponen que la escabiosis debiera ser considerada una zoonosis, ya que los ácaros provenientes de los animales podrían infectar a humanos, aunque los casos descritos sean en su mayoría transitorios y más leves31. Estos datos, a falta de estudios adicionales, sugieren examinar clínicamente la mascota de los casos con una sarna resistente y descartar que se trate de sarna zoonótica.
- 4.
Prurito residual: un falso fracaso terapéutico
Por último, cabe destacar que muchos pacientes consultan de nuevo a los pocos días de terminar el tratamiento por una persistencia del prurito. Por este motivo, es importante recordar que el prurito, al igual que la persistencia de algunas lesiones reactivas, pueden durar hasta 4-6 semanas después de haber finalizado el tratamiento, aunque se haya erradicado la infestación3.
En definitiva, el fracaso terapéutico detectado en la práctica clínica puede tener ser multifactorial: por errores en la aplicación, por una resistencia a los tratamientos, por la existencia de vías de transmisión mal identificadas e incluso porque realmente se trate de falsos fracasos asociados a una clínica residual.
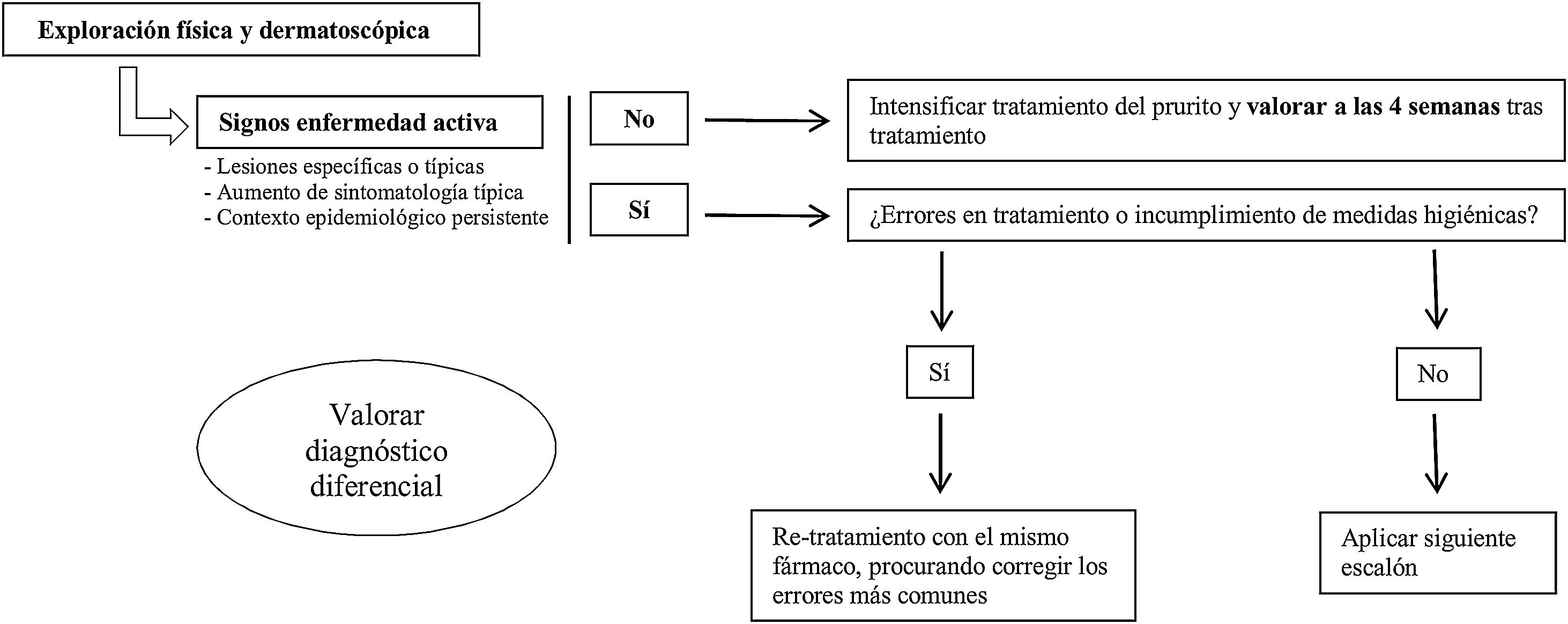
¿Qué hacemos ante un fracaso terapéutico? (fig. 1)Ante una nueva consulta en un paciente diagnosticado de escabiosis y tratado correctamente, lo primero es realizar una minuciosa exploración física, para la que es útil incluir el examen con dermatoscopia, si disponemos de ella, buscando signos activos de enfermedad. No se conoce el tiempo de persistencia de los surcos ni de los parásitos visibles en pacientes efectivamente tratados. Sin embargo, teniendo en cuenta que el recambio epitelial es de aproximadamente un mes de duración32 y el parásito se establece en los estratos más superficiales de la epidermis, si tras 4 semanas del tratamiento estos continúan, deberíamos considerar la infección activa.
En el caso de que estos no existan, intensificaremos el tratamiento del prurito y reevaluaremos al paciente a las 4 semanas. Si existen lesiones activas, se recomienda buscar dónde se ha podido producir el error en el tratamiento para corregirlo (fig. 2). Cuando la enfermedad siga activa a pesar de no encontrar ningún error, utilizaremos el segundo escalón terapéutico disponible según las características del paciente. Sin embargo, si persisten signos de actividad a pesar de utilizar varios escalones terapéuticos, actualmente, no existen guías globalmente aceptadas de cómo proceder.
Checklist del tratamiento de la escabiosis. Rellenar los círculos cuando se complete el paso.
Listado de comprobación adaptado de la propuesta de la Societat Catalana de Dermatologia i Venerologia disponible en: http://webs.academia.cat/societats/dermato/docs/SCD_Informacion_medica_listado_de_comprobacion_V10_castellano.pdf junto con la información presente en5,26,30,31,37.
En la actualidad el tratamiento de la escabiosis es muy heterogéneo entre los diferentes profesionales y guías. Por ello es necesario plantear un abordaje que contemple los problemas y la evidencia actual.
En caso de un número grande de convivientes afectados, de pacientes con importantes lesiones eccematosas o erosivas en la piel, o si consideramos improbable que vaya a haber una correcta aplicación del tratamiento tópico –pacientes dependientes, problemática social o dificultad para entender la aplicación del tratamiento–, la ivermectina oral sería el tratamiento de elección, como ya plantean algunos autores9.
Por otro lado, cabría considerar la posibilidad de aplicar concomitantemente la permetrina cuando se utiliza ivermectina, en al menos una dosis, ya que la primera sí posee actividad ovicida, y mantenerla un mínimo de 12h. No obstante, encontramos objetores de esta propuesta, con la teoría de que podría aumentar las resistencias a la ivermectina y la premisa de que no se ha demostrado fehacientemente que la combinación sea más eficaz9. Sin embargo, en la actualidad sí existen trabajos en los que se propone esta combinación como el tratamiento más eficaz15,26.
Otra opción es aumentar la dosis de ivermectina. Esto se fundamenta, por un lado, en que las dosis actuales están basadas en decisiones razonadas pero arbitrarias, sin que existan estudios de rango de dosis y, por otro, en los buenos resultados obtenidos tras aumentar la dosis en otras infecciones parasitarias como la pediculosis8. Actualmente existe un ensayo clínico en marcha comparando la eficacia de ivermectina oral a doble dosis (0,4mg/kg) con el tratamiento convencional (0,2mg/kg) en los pacientes con una escabiosis grave (NCT02841215)33.
En los casos recalcitrantes, en los que hemos agotado todas las alternativas terapéuticas, podrían plantearse tratamientos fuera de ficha técnica, pero que se muestran seguros en estudios o ya se proponen en algunas guías.
Expectativas de futuroRecientemente la Food and Drug Administration (FDA) ha aprobado el spinosad al 0,9%, un insecticida utilizado para la pediculosis capitis, para el tratamiento de la escabiosis en pacientes mayores de 4 años. Dicho fármaco ha demostrado unas tasas de curación completa en pacientes con una escabiosis confirmada del 78,1% y del 85% de curación microscópica y/o dermatoscópica a los 28 días de una única aplicación, con una baja tasa de efectos adversos, ninguno de ellos grave34.
La moxidectina, una molécula de la misma familia que la ivermectina, está aprobada por la FDA para el tratamiento de la oncocercosis y es una de las mayores esperanzas en el tratamiento de la escabiosis. Esta molécula presenta algunas características ventajosas como una semivida media de 23 días (que cubre todo el ciclo vital del S. scabiei) y una mayor concentración en la piel respecto a la ivermectina. En estudios realizados en modelos porcinos, se ha demostrado más eficaz que aquella en una sola dosis de 0,3mg/kg8. Actualmente existe un EC en marcha para establecer la eficacia y la dosis adecuada de moxidectina para el tratamiento oral de la escabiosis (NCT03905265)35.
ConclusionesLa escabiosis es una enfermedad ancestral que en la actualidad continúa planteando importantes problemas epidemiológicos. En nuestro entorno su incidencia y prevalencia están en aumento, sobre todo desde los inicios de la pandemia por SARS-CoV-2. Entre las principales causas de este problema se encuentra el fracaso terapéutico, cada vez más documentado por los profesionales sanitarios y de origen multifactorial. Por este motivo, el desarrollo de pautas de tratamiento efectivas, un abordaje común y basado en la evidencia actual por parte de los diferentes profesionales y un mejor conocimiento del parásito y su transmisibilidad es fundamental para alcanzar una gran asignatura pendiente: el control de la escabiosis.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la doctora Raquel Ugena García por sus inestimables consejos en la preparación del manuscrito.