El tumor pilar proliferante es una neoplasia cutánea rara, que se deriva de la vaina de la raíz externa de los folículos pilosos con un amplio espectro en su presentación dado a que puede variar desde la benignidad hasta la malignidad con alta probabilidad de recurrencia posterior a su escisión. En este artículo describimos la experiencia del Hospital de San José en Bogotá, Colombia en el manejo de 3 tumores pilares proliferantes, con una presentación clínica y un comportamiento patológico distinto.
A proliferating pilar tumor is a rare skin neoplasm that arises from the outer root sheath of a hair follicle. Presentation varies widely, as the tumor can be benign or malignant and has a high probability of recurring after excision.
We report our experience managing 3 proliferating pilar tumors with different clinical presentations and pathology findings at Hospital de San José, Bogota, Colombia.
El tumor pilar proliferante (TPP) es una neoplasia cutánea rara, que se deriva de la vaina de la raíz externa de los folículos pilosos. Se presenta predominantemente en mujeres mayores de 40 años. El 90% de los casos ocurren en el cuero cabelludo y se ha descrito un amplio espectro en su presentación que puede variar desde la benignidad hasta la malignidad con recurrencias posterior a su escisión y metástasis. A pesar de que la resección quirúrgica es el tratamiento de elección, la cirugía micrográfica de Mohs (CMM) ha surgido como herramienta útil y novedosa para la escisión de estas neoplasias.
A continuación, exponemos nuestra experiencia en el tratamiento de tres casos de TPP en el Hospital de San José en Bogotá, Colombia y realizamos una revisión de la literatura sobre esta rara neoplasia, los distintos abordajes terapéuticos disponibles y sus altas tasas de recidiva.
Casos clínicos, métodos y resultadosCaso 1Una mujer de 59 años consultó por la aparición de una lesión móvil y asintomática en el cuero cabelludo de 6 años de evolución. Sin antecedentes de importancia. Al examen físico presentaba un nódulo eritematoso indurado de 18×15mm de diámetro localizado en la región parietal izquierda. Con el diagnóstico presuntivo de un quiste infundibular, se tomó biopsia de piel. El estudio de histopatología documentó una lesión dérmica en el cuero cabelludo, bien circunscrita y parcialmente quística, constituida por una pared formada por un cordón de células pavimentosas, atípicas y anastomosadas, y la presencia de queratina lamelar en la luz. Los hallazgos histopatológicos fueron congruentes con un TPP. La lesión se trató mediante una resección local amplia con márgenes laterales de 2cm y en profundidad hasta el plano muscular con una histología libre de tumor. Después de 12 meses de seguimiento la paciente no había presentado recidiva tumoral.
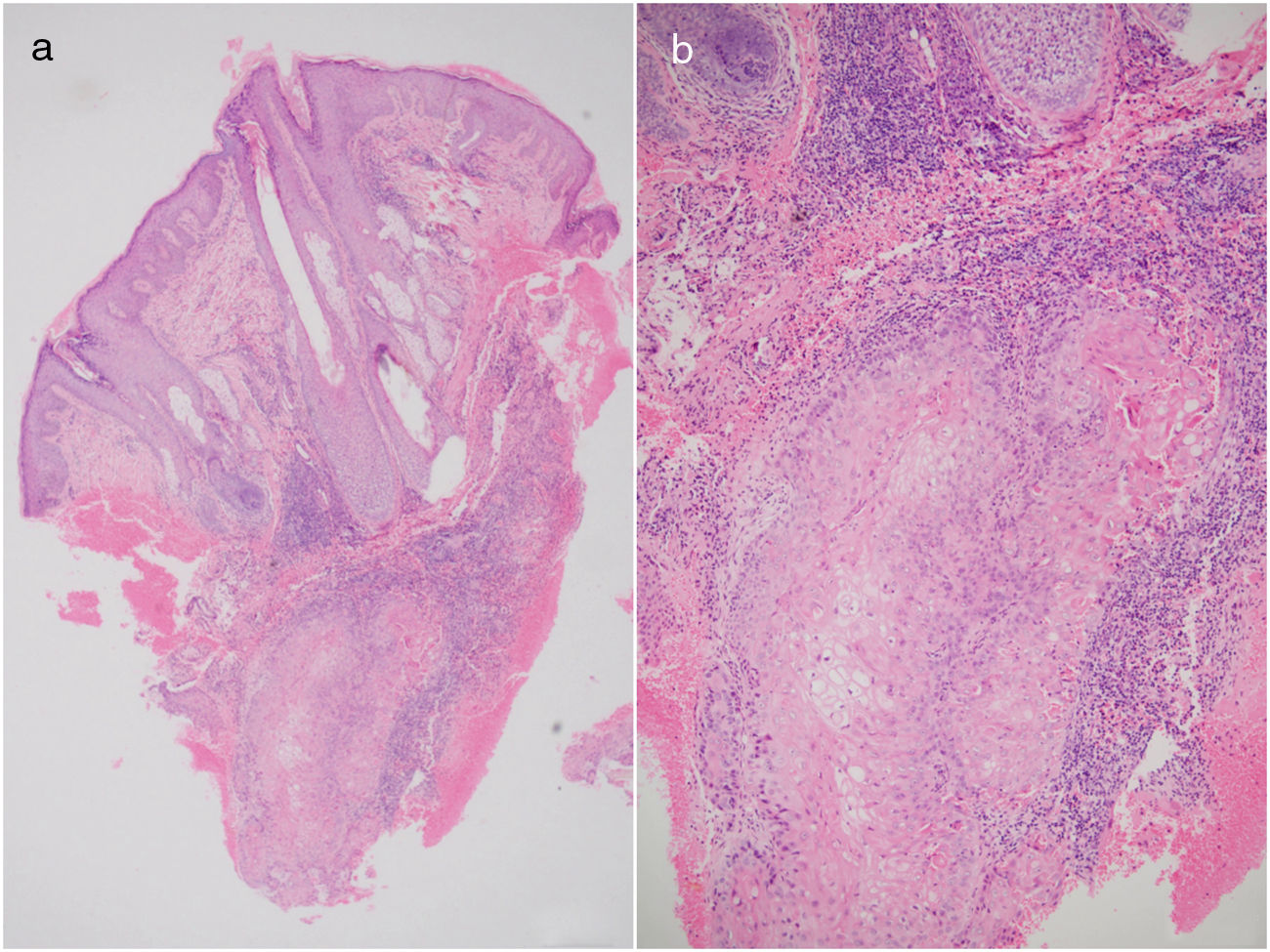
Caso 2Una mujer de 29 años fue atendida para la evaluación de una lesión dolorosa, de crecimiento progresivo en el cuero cabelludo de 4 años de evolución. Sin antecedentes patológicos. Previamente había consultado otra institución donde tomaron biopsia de piel que reportaba proliferación de queratinocitos con atipia moderada, queratinización triquilemal, disqueratosis y ocasionales mitosis. Con estos hallazgos se plantearon varios diagnósticos diferenciales como carcinoma espinocelular infiltrante vs. tumor pilar proliferante. Al ingreso a nuestro hospital se identificó en el examen físico la presencia de un nódulo exofítico de aspecto tumoral, semiblando y doloroso a la palpación localizado en la región parietal izquierda. Por no tener una claridad diagnóstica se decidió realizar una nueva biopsia de piel, la cual mostró en la dermis un denso infiltrado linfocitario y neutrofílico, asociado a una hemorragia de predominio perianexial, además en la dermis profunda se identificaron unos nidos de queratinocitos escamosos, con un ligero pleomorfismo y ocasionales mitosis además de la presencia de globos de queratina (figs. 1A y B). Se realizaron estudios complementarios de inmunohistoquímica los cuales mostraron una positividad para CKAE1, AE3y EMA y un positivo focal en la periferia para CK8/CK18 (CAM 5.2). La CK7, actina de músculo liso (AML), CD34, BER EP4, S100 y P53 fueron negativos. El índice de proliferación celular Ki 67 fue del 20%. Los hallazgos morfológicos e inmunofenotípicos fueron compatibles con TPP. Se extirpó mediante CMM obteniendo márgenes libres después del segundo tiempo. La paciente no presentó recidiva tumoral tras 17 meses de seguimiento.
Caso 3Un hombre de 71 años consultó por la reaparición de una lesión asintomática en el cuero cabelludo de 3 años de evolución, previamente resecada con el diagnóstico de quiste infundibular 5 años atrás. Al examen físico se identificó un nódulo fijo a planos profundos de 50 x 30mm de diámetro localizado en la región occipital izquierda. Por considerarse como un posible quiste infundibular recidivante se programó para resección. Durante la cirugía se evidenció una masa irregular adherida a planos profundos con un difícil control hemostático. El estudio histopatológico reveló la presencia, en la piel y el tejido celular subcutáneo, de un tumor formado por múltiples nódulos con proliferaciones exo- y endofíticas de células epiteliales escamosas con queratinización abrupta y otras áreas de queratinización triquilemal además de amplios islotes de queratina compacta e invasión estromal con zonas de crecimiento. No se evidenció invasión linfovascular ni perineural. Congruente con la clínica e histopatología se diagnosticó de TPP y se trató mediante CMM, logrando márgenes libres al segundo tiempo. Después de 10 meses de seguimiento no presentó recidiva tumoral.
DiscusiónEl TPP es una neoplasia cutánea rara, derivada de la vaina de la raíz externa de los folículos pilosos1. Su formación tumoral aparentemente surge después de un trauma, infección, inflamación o irritación de un quiste tricolémico preexistente.
EL TPP tiene una predilección por el sexo femenino entre 40 y 80 años, dado por el 80% con un pico de incidencia en la sexta década, el 90% de los casos ocurren en el cuero cabelludo1.
El tamaño varía desde 2-15cm con dimensiones máximas reportadas de 24cm2. Se presenta como un nódulo o pápula exofítica, frecuentemente ulcerada en su superficie, a menudo aparece en áreas expuestas al sol con crecimiento del cabello, sin embargo, también se puede presentar en áreas como la frente, el cuello, la región mamaria y la vulva3.
Histológicamente existe una marcada queratinización amorfa del epitelio que recubre la pared del quiste, con la ausencia de la capa granular4.
Ye et al., estudiaron 76 casos y clasificaron los TPP en 3 grupos, según su histopatología, detallados en la tabla 1.
Clasificación histopatológica de TPP
| Grupo 1 | Grupo 2 | Grupo 3 | |
|---|---|---|---|
| Hallazgos histológicos | Queratinización tricolemal y una modesta atipia nuclear, con un tejido adyacente que muestra infiltración de células mononucleares, plasmáticas y gigantes, ausencia de mitosis patológicas, de necrosis e invasión de nervios o vasos | Atipia citológica moderada, con focos de necrosis unicelular, afectación de la dermis profunda y queratinización abrupta | Marcada atipia nuclear con formas mitóticas patológicas y un estroma desmoplásico |
| Descripción | Benignos | Localmente agresivos | Malignos |
| Tasa de recurrencia | 0% | 15% | 50% |
Conforme a lo descrito en la literatura, el primer caso clínico descrito se corresponde a un TPP del grupo 1, mientras que los otros dos casos cumplen características histopatológicas de los TPP del grupo 2. Es importante resaltar que ningún paciente presentó recidiva y tampoco requirieron procedimientos adicionales.
El diagnóstico se realiza principalmente por la histopatología, sin embargo, la inmunohistoquímica ayuda al diagnóstico diferencial, debido a que los tumores del grupo 1 expresan fuertemente CK10 e involucrina, por su parte, los TPP malignos expresan antígenos de proliferación nuclear y CK16 con una pérdida de expresión de CD346.
A pesar de que las pruebas de imagen no son frecuentemente utilizadas para el diagnóstico, se puede realizar una resonancia nuclear magnética donde se observa al TPP como una masa sólida o como un tumor quístico. Cuando el tumor es sólido, generalmente se encuentra asociado a malignidad7.
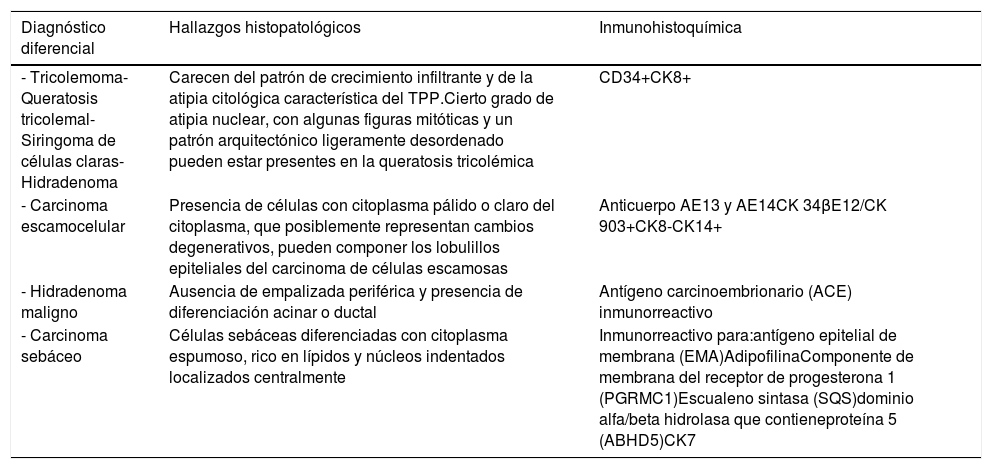
En la tabla 2 se resumen los hallazgos que pueden ser referencia para realizar un adecuado diagnóstico diferencial histopatológico. Sin embargo, clínicamente resulta pertinente diferenciarlos de nódulos que se puedan ulcerar en el cuero cabelludo como el carcinoma basocelular, los cilindromas, el dermatofibrosarcoma protuberans, el carcinoma de células de Merkel y las metástasis cutáneas.
Diagnósticos diferenciales histopatológicos
| Diagnóstico diferencial | Hallazgos histopatológicos | Inmunohistoquímica |
|---|---|---|
| - Tricolemoma- Queratosis tricolemal- Siringoma de células claras- Hidradenoma | Carecen del patrón de crecimiento infiltrante y de la atipia citológica característica del TPP.Cierto grado de atipia nuclear, con algunas figuras mitóticas y un patrón arquitectónico ligeramente desordenado pueden estar presentes en la queratosis tricolémica | CD34+CK8+ |
| - Carcinoma escamocelular | Presencia de células con citoplasma pálido o claro del citoplasma, que posiblemente representan cambios degenerativos, pueden componer los lobulillos epiteliales del carcinoma de células escamosas | Anticuerpo AE13 y AE14CK 34βE12/CK 903+CK8-CK14+ |
| - Hidradenoma maligno | Ausencia de empalizada periférica y presencia de diferenciación acinar o ductal | Antígeno carcinoembrionario (ACE) inmunorreactivo |
| - Carcinoma sebáceo | Células sebáceas diferenciadas con citoplasma espumoso, rico en lípidos y núcleos indentados localizados centralmente | Inmunorreactivo para:antígeno epitelial de membrana (EMA)AdipofilinaComponente de membrana del receptor de progesterona 1 (PGRMC1)Escualeno sintasa (SQS)dominio alfa/beta hidrolasa que contieneproteína 5 (ABHD5)CK7 |
La escisión quirúrgica es el tratamiento de elección con márgenes laterales de al menos 1cm para aquellos TPP de bajo grado de malignidad. La CMM puede considerarse como una técnica adicional para el tratamiento de dichos tumores. Aunque no existe una comparación con evidencia científica en la literatura, la CMM ayuda en el ahorro de tejidos por medio del control de márgenes11.
Para los TPP malignos, es necesario realizar una disección ganglionar en caso de metástasis. Se ha descrito la radioterapia adyuvante con buenos resultados incluso como monoterapia, alternativa que toma importancia en pacientes de edad avanzada o con tumores en áreas cosméticas o funcionalmente relevantes y la radioterapia paliativa en la enfermedad metastásica12. Existe la posibilidad de realizar quimioterapia sistémica con cisplatino y 5 fluorouracilo, debido a que el régimen quimioterapéutico (cisplatino- adriamicina vindesina) previamente utilizado para estadios avanzados de CEC, ha dado resultados limitados13.
Jo et al. describieron un caso exitoso de terapia inmunomoduladora tópica realizada con imiquimod al 5% durante 8 semanas sin recurrencia posterior a 16 meses de seguimiento como opción alternativa a la cirugía14.
Se han comunicado tasas de recurrencia de metástasis local del 3,7% a 6,6% y regional a ganglios linfáticos del 1,2% al 2,6% en un tiempo variable entre 6 meses a más de 10 años6. Sau et al. mostraron una recidiva del 1,7% posterior a 87 meses de seguimiento, además, en un paciente se encontró metástasis a nivel regional sin metástasis a distancia, ni recurrencia durante 7 años de seguimiento posterior a la extirpación quirúrgica15.
La tasa de metástasis para TPP del grupo 3 es del 25%6,15 por esto toma relevancia realizar estudios complementarios una vez el diagnóstico se ha establecido, la tomografía craneal con contraste es la modalidad de elección con el fin de evaluar afectación ósea local y erosión, por su parte la tomografía computarizada de cuello es utilizada para evaluar metástasis regionales y ganglionares en base de cráneo y cuello y finalmente la resonancia magnética es conveniente para valorar infiltración en tejidos blandos o afectación de senos durales cuando la localización es en cuero cabelludo11.
La escasa literatura encontrada sobre la biopsia selectiva de ganglio centinela en los TPP no es contundente. En concordancia con su pobre difusión, solo se ha publicado un caso de TPP maligno recurrente al cual se le realizó la biopsia selectiva de ganglio centinela siendo esta negativa16. Dado que no existen estudios adecuados que permitan comparar el desenlace de este procedimiento no lo podemos recomendar como parte del estudio rutinario de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los residentes de Dermatología del Hospital de San José, Bogotá, Colombia.