La urticaria crónica es una entidad relativamente frecuente en la práctica clínica habitual, cuyo diagnóstico se establece de forma clínica. Sin embargo, existen ocasiones en las que está indicada la realización de una biopsia cutánea para confirmar el diagnóstico y diferenciarla de otras patologías que pueden cursar con erupciones urticariformes. En este trabajo revisamos los hallazgos histopatológicos que podemos encontrar tanto en la urticaria crónica como en las patologías que plantean un diagnóstico diferencial. Con base en ello, proponemos un algoritmo que recoge las indicaciones para realizar una biopsia cutánea y la orientación del diagnóstico en función de los hallazgos histopatológicos que encontremos en la misma.
Chronic urticaria is a relatively common condition in dermatology and is usually diagnosed on clinical grounds. Skin biopsy, however, may be indicated in certain cases to confirm diagnosis and rule out other conditions that can cause hive-like rashes. We review histopathologic findings seen in both chronic urticaria and other entities in the differential diagnosis. We then propose an algorithm of indications for skin biopsy in patients with hive-like rashes and suggest possible diagnoses based on the histopathologic findings.
La urticaria es una entidad que se define por la aparición de habones pruriginosos, que se resuelven en menos de 24 horas. Se clasifica en aguda o crónica, siendo crónica aquella de más de seis semanas de duración. La prevalencia de la urticaria crónica (UC) se calcula en torno a un 0,5-4%1,2.
Aunque el diagnóstico es habitualmente clínico, existe una discordancia entre los propios dermatólogos. Un ejemplo de ello es la comunicación presentada en el Fórum Global de Urticaria por Ijaz et al. celebrado en Berlín en 2016 (resultados no publicados). De doscientos pacientes remitidos con un diagnóstico de UC a un hospital de tercer nivel, un alto porcentaje terminaba con otro diagnóstico definitivo (eccema, vasculitis urticarial, síndrome autoinflamatorio, etc.). Por tanto, existen ocasiones en las que puede estar indicado realizar pruebas de laboratorio, biopsia cutánea o ambas. Los hallazgos histológicos descritos clásicamente en la urticaria son el edema en la dermis, la vasodilatación y la presencia de un infiltrado dérmico perivascular de predominio mononuclear y con un número variable de eosinófilos y neutrófilos3-5. Este patrón histológico es muy frecuente cuando biopsiamos lesiones urticariformes. Es la presencia o ausencia de otros hallazgos histológicos lo que nos ayuda para establecer un diagnóstico correcto.
Indicaciones de biopsia. ¿Cuándo realizar una biopsia cutánea?Cuando nos encontramos ante un paciente con lesiones urticariformes de más de seis semanas de duración, lo más probable es que se trate de una urticaria crónica. Sin embargo, existen datos clínicos y analíticos que nos deben «alertar» sobre la posibilidad de que se trate de otras patologías. Los datos clínicos de alarma son: la ausencia de prurito, la existencia de sintomatología general, una duración mayor de 48 horas de las lesiones individuales y la presencia de halo violáceo o hiperpigmentación residual. En la analítica sanguínea nos fijaremos sobre todo en: la velocidad de sedimentación globular (VSG), la proteína C reactiva (PCR), el proteinograma y los factores del complemento. La ausencia de respuesta al tratamiento supuestamente correcto es también motivo de alerta. En todas estas situaciones deberíamos plantearnos la realización de una biopsia cutánea (tabla 1).
Indicaciones de biopsia cutánea en pacientes con lesiones urticariformes
| Lesiones no pruriginosas |
| Lesiones individuales no claramente evanescentes (duran más de 24-48 h) |
| Hiperpigmentación o halo violáceo residual |
| Dolor o sensación de quemazón más que prurito |
| Presencia de síntomas sistémicos de forma recurrente: fiebre, poliartralgias, etcétera. |
| Alteraciones analíticas recurrentes: elevación de PCR, VSG, leucocitosis, hipocomplementemia, ANA positivo, alteración proteinograma… |
| Ausencia de respuesta a antihistamínicos no sedantes a dosis alta (x4) |
ANA: anticuerpos antinucleares; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
El diagnóstico diferencial suele incluir las reacciones medicamentosas, el penfigoide ampolloso (en su fase prodrómica urticarial) y la dermatitis urticarial. Aunque menos frecuentes, es necesario descartar la dermatosis neutrofílica urticarial (DNU), los síndromes autoinflamatorios y la vasculitis urticarial.
En la tabla 2 se recogen las características clínicas a tener en cuenta en el diagnóstico diferencial de la urticaria crónica.
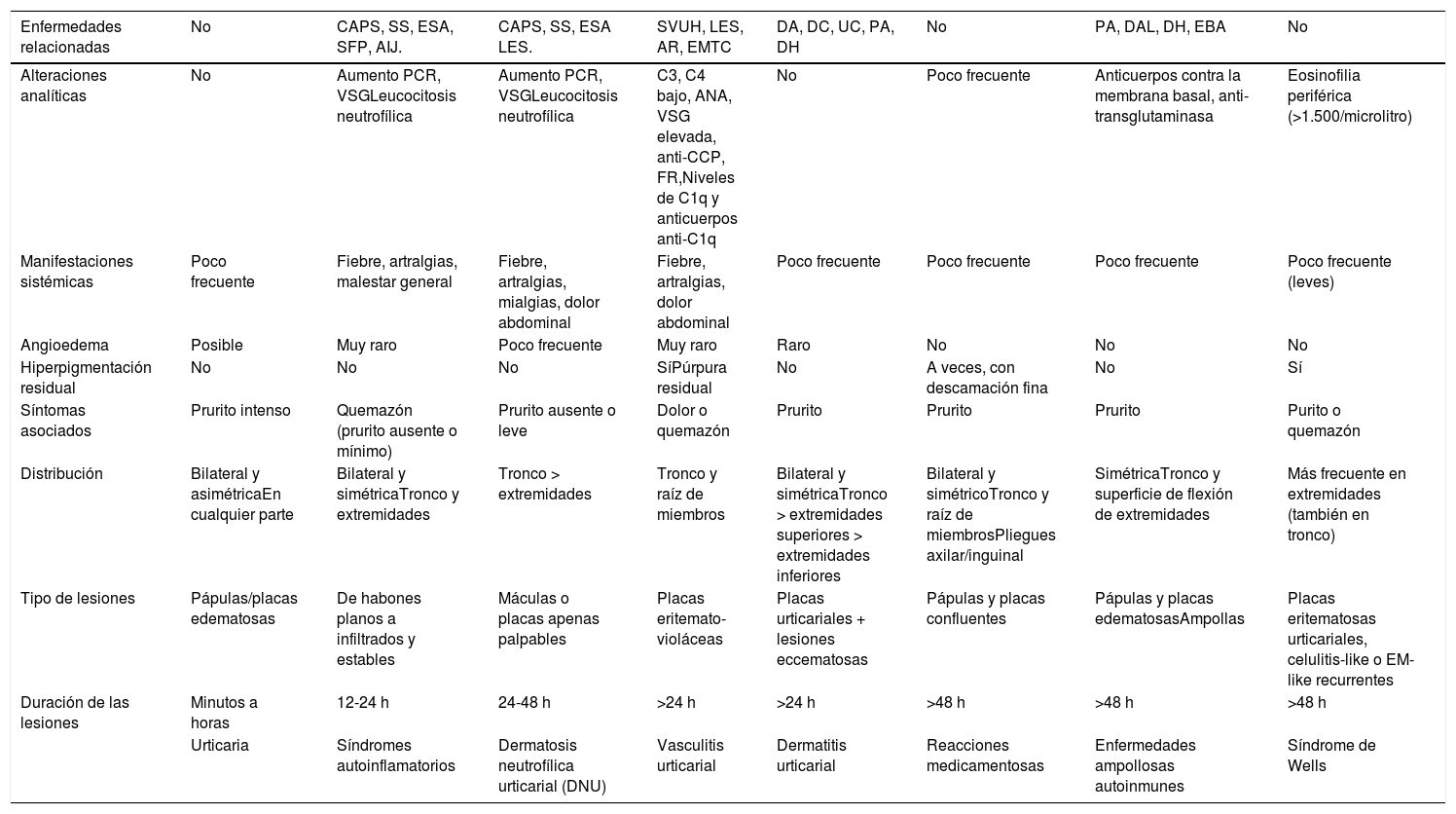
Diagnóstico diferencial de la urticaria crónica
| Enfermedades relacionadas | No | CAPS, SS, ESA, SFP, AIJ. | CAPS, SS, ESA LES. | SVUH, LES, AR, EMTC | DA, DC, UC, PA, DH | No | PA, DAL, DH, EBA | No |
|---|---|---|---|---|---|---|---|---|
| Alteraciones analíticas | No | Aumento PCR, VSGLeucocitosis neutrofílica | Aumento PCR, VSGLeucocitosis neutrofílica | C3, C4 bajo, ANA, VSG elevada, anti-CCP, FR,Niveles de C1q y anticuerpos anti-C1q | No | Poco frecuente | Anticuerpos contra la membrana basal, anti-transglutaminasa | Eosinofilia periférica (>1.500/microlitro) |
| Manifestaciones sistémicas | Poco frecuente | Fiebre, artralgias, malestar general | Fiebre, artralgias, mialgias, dolor abdominal | Fiebre, artralgias, dolor abdominal | Poco frecuente | Poco frecuente | Poco frecuente | Poco frecuente (leves) |
| Angioedema | Posible | Muy raro | Poco frecuente | Muy raro | Raro | No | No | No |
| Hiperpigmentación residual | No | No | No | SíPúrpura residual | No | A veces, con descamación fina | No | Sí |
| Síntomas asociados | Prurito intenso | Quemazón (prurito ausente o mínimo) | Prurito ausente o leve | Dolor o quemazón | Prurito | Prurito | Prurito | Purito o quemazón |
| Distribución | Bilateral y asimétricaEn cualquier parte | Bilateral y simétricaTronco y extremidades | Tronco > extremidades | Tronco y raíz de miembros | Bilateral y simétricaTronco > extremidades superiores > extremidades inferiores | Bilateral y simétricoTronco y raíz de miembrosPliegues axilar/inguinal | SimétricaTronco y superficie de flexión de extremidades | Más frecuente en extremidades (también en tronco) |
| Tipo de lesiones | Pápulas/placas edematosas | De habones planos a infiltrados y estables | Máculas o placas apenas palpables | Placas eritemato- violáceas | Placas urticariales + lesiones eccematosas | Pápulas y placas confluentes | Pápulas y placas edematosasAmpollas | Placas eritematosas urticariales, celulitis-like o EM-like recurrentes |
| Duración de las lesiones | Minutos a horas | 12-24 h | 24-48 h | >24 h | >24 h | >48 h | >48 h | >48 h |
| Urticaria | Síndromes autoinflamatorios | Dermatosis neutrofílica urticarial (DNU) | Vasculitis urticarial | Dermatitis urticarial | Reacciones medicamentosas | Enfermedades ampollosas autoinmunes | Síndrome de Wells |
AIJ: artritis idiopática juvenil; ANA: anticuerpos antinucleares; Anti-C1q: anticuerpos anti C1q; Anti-CCP: anticuerpo antipéptido cíclico citrulinado; AR: artritis reumatoide; C1q: componente del complemento 1q; C3: factor del complemento 3; C4: factor del complemento 4; CAPS: síndromes periódicos asociados con criopirina; DA: dermatitis atópica; DAL: dermatosis IgA lineal; DC: dermatitis de contacto; DH: dermatitis herpetiforme; EBA: epidermólisis bullosa adquirida; EM-like: eritema multiforme-like; EMTC: enfermedad mixta del tejido conectivo; ESA: enfermedad de Still del adulto; FR: factor reumatoideo; LES: lupus eritematoso sistémico; PA: penfigoide ampolloso; PCR: proteína C reactiva; SFP: síndromes de fiebre periódica; SS: síndrome de Schnitzler; SVUH: síndrome de vasculitis urticarial hipocomplementémica; UC: urticaria crónica; VSG: velocidad de sedimentación globular.
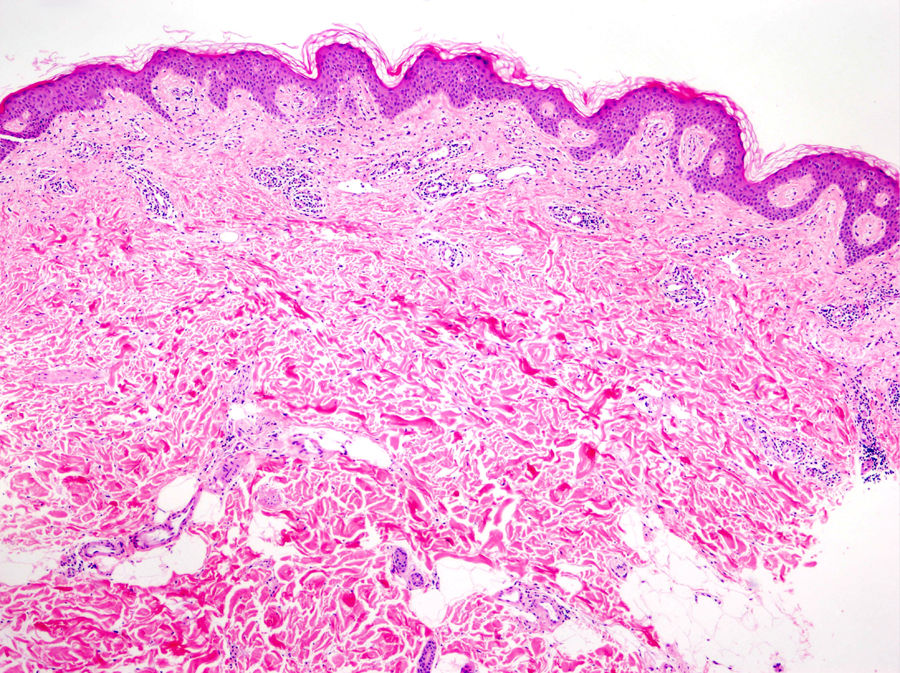
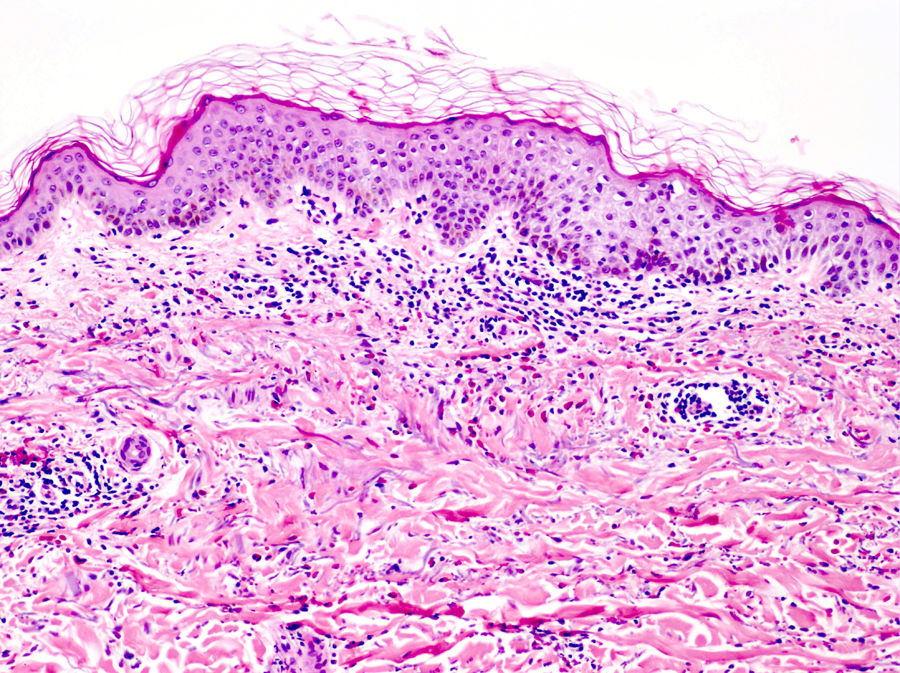
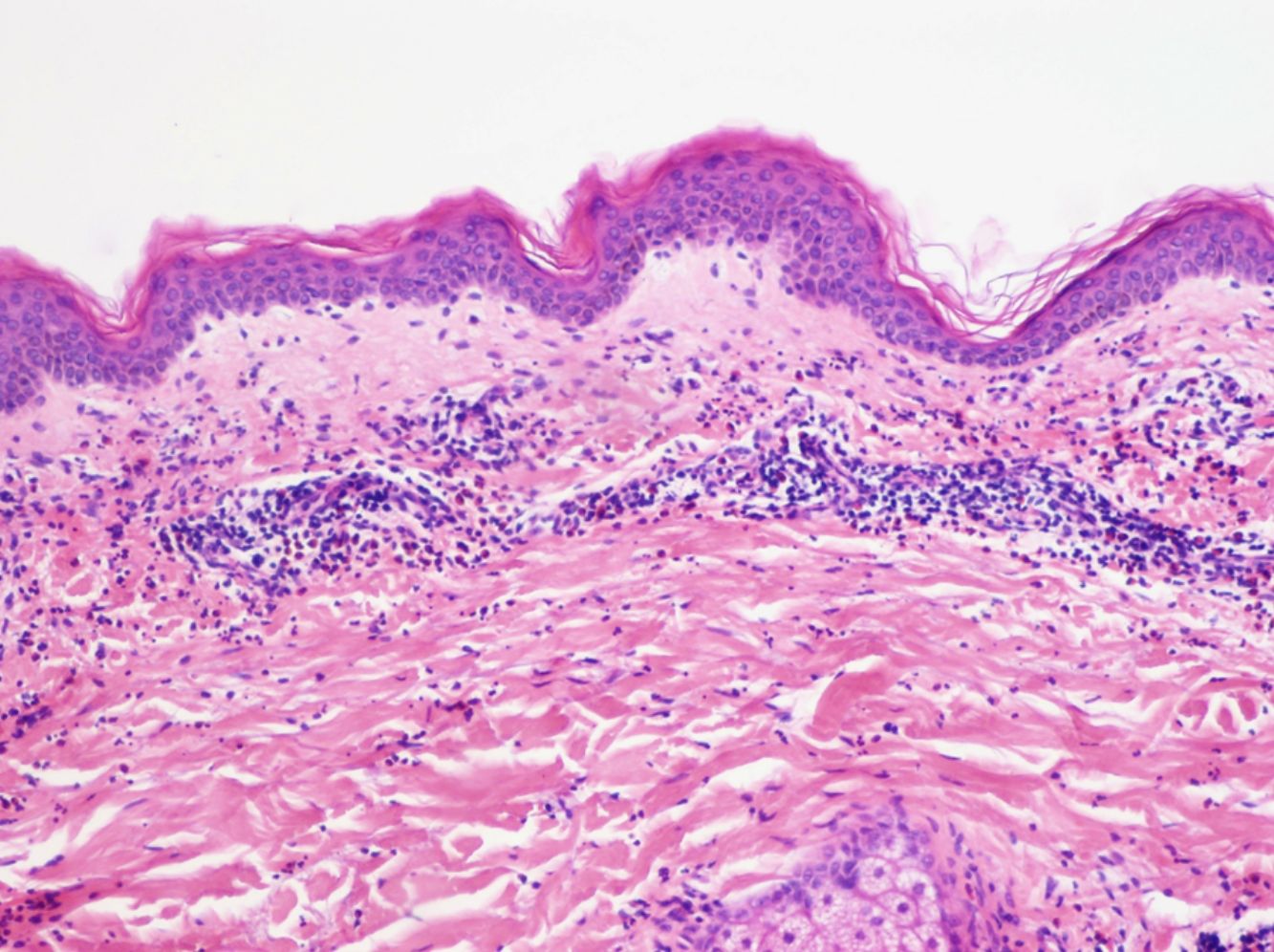
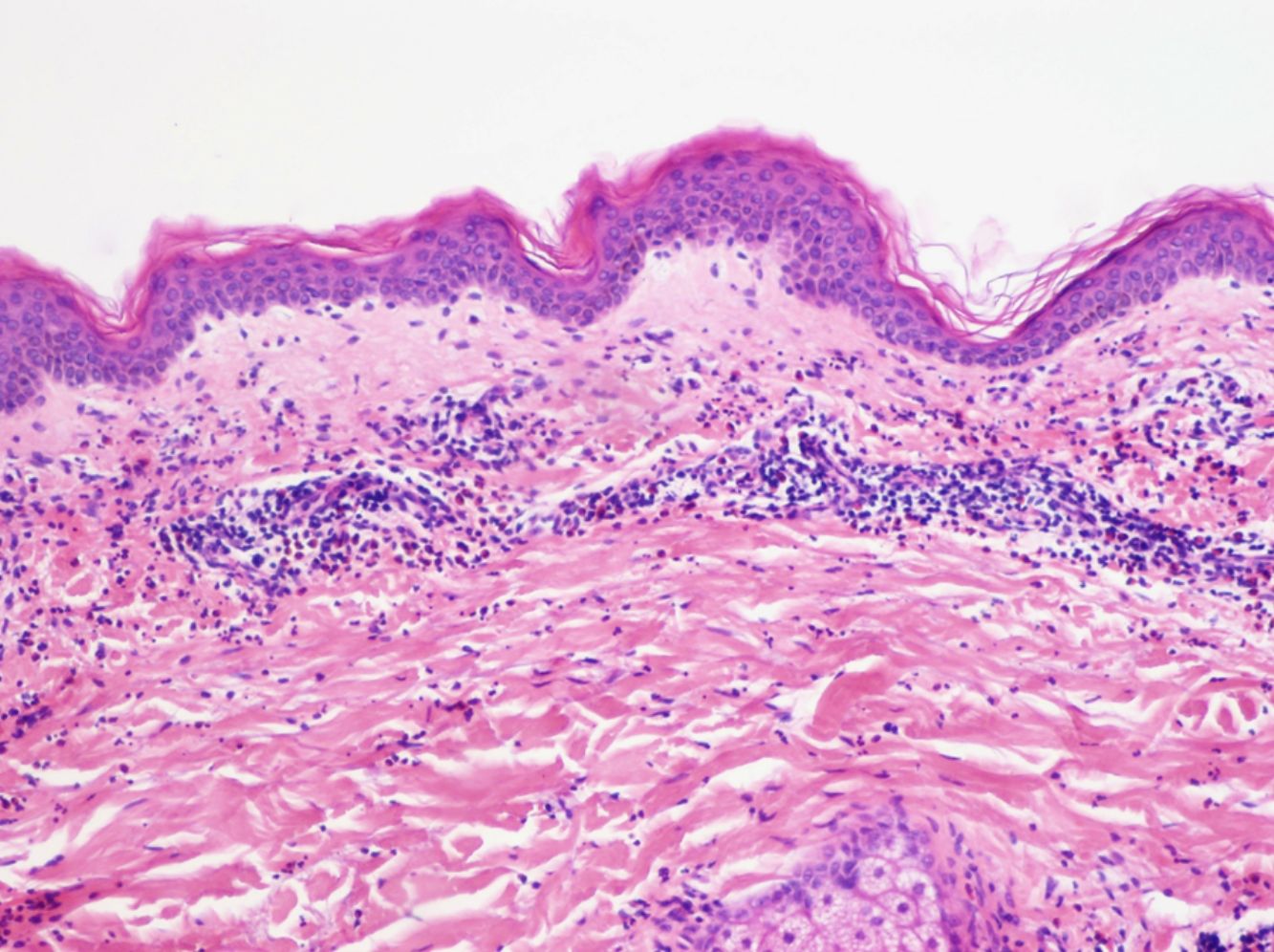
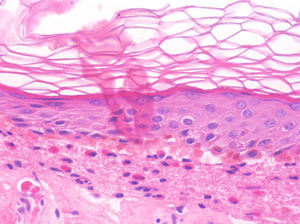
La histología de la urticaria crónica (UC) se caracteriza por un edema leve en la dermis papilar con un infiltrado perivascular superficial compuesto por linfocitos, eosinófilos y neutrófilos (fig. 1)6. En ocasiones el infiltrado puede ser también intersticial y profundo, ampliando la descripción clásica, como han demostrado Barzilai et al.7.
Se ha intentado establecer la existencia de distintos patrones histológicos según la célula predominante en el infiltrado inflamatorio y correlacionarlos con patrones clínicos de urticaria. Sin embargo, la presencia de un infiltrado predominantemente linfocítico o neutrofílico («urticaria neutrofílica») no ha demostrado tener implicaciones en la presentación clínica7.
Barzilai et al.7 analizaron 58 biopsias de pacientes con urticaria. Los linfocitos fueron la célula predominante en el 26% de las biopsias, los neutrófilos en el 21% y los eosinófilos en un 4%. En el resto de casos (41%), el infiltrado era mixto. En este estudio se relacionó la presencia de un infiltrado predominantemente neutrofílico con una variante de urticaria más difícil de tratar.
Marques et al.8 clasificaron el infiltrado de 41 pacientes con urticaria crónica en predominantemente eosinofílico (46,3%), neutrofílico (24%) o mixto (27%). Estos autores encontraron una asociación entre el predominio de eosinófilos y una puntuación mayor en las escalas de severidad, sin afectar a la respuesta al tratamiento.
Algunos estudios han demostrado que los mastocitos están aumentados3,9. Sin embargo, Smith et al.10 y más recientemente Fujisawa et al.11 encontraron un número normal de mastocitos pero con una actividad aumentada.
La extravasación de hematíes es un hallazgo que podemos encontrar hasta en un 50% de pacientes7, y que puede manifestarse clínicamente con un tono purpúrico y confundirnos con una vasculitis urticarial.
La inmunofluorescencia directa en la UC es habitualmente negativa. Se ha encontrado de forma ocasional depósito de factor del complemento 3 (C3) o de fibrinógeno en los vasos de la dermis superficial, sin hallazgos clínicos ni de laboratorio compatibles con vasculitis7.
Claves diagnósticasUna vez realizada la biopsia, nos fijaremos en los siguientes aspectos para orientar nuestro diagnóstico: la naturaleza del infiltrado inflamatorio, el patrón de reacción tisular y la inmunofluorescencia directa (IFD). Creemos que la realización de una biopsia cutánea para IFD es altamente recomendable, pues nos ayuda en el diagnóstico de muchas de las entidades encuadradas en el diagnóstico diferencial de la UC.
Naturaleza del infiltrado inflamatorioCuando observamos una presencia marcada de neutrófilos en la dermis debemos descartar que se trate de una dermatosis neutrofílica urticarial. Como claves diagnósticas destacan: la presencia de polvo nuclear (leucocitoclasia) sin vasculitis, el epiteliotropismo neutrofílico y la distribución de los neutrófilos en fila india en el intersticio dérmico.
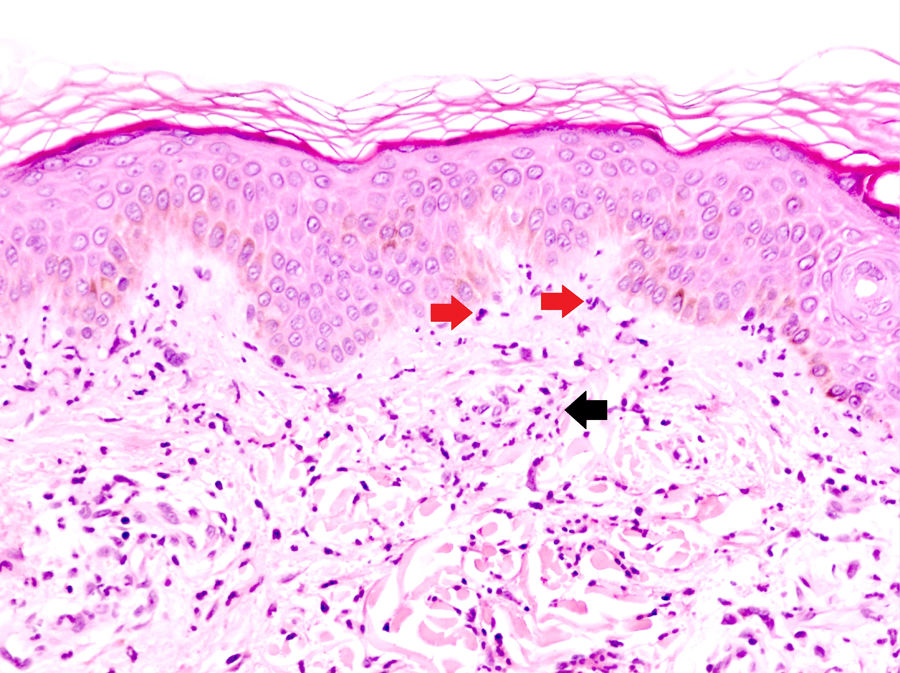
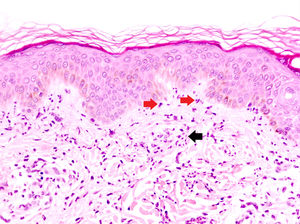
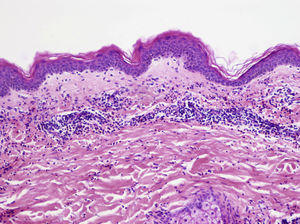
La DNU es una entidad descrita por Kieffer et al. en 200812 que se caracteriza por una erupción urticarial, clínicamente, y una dermatosis neutrofílica, histopatológicamente. Esta entidad no debe ser confundida con el término histológico de urticaria neutrofílica acuñado por Peters y Winkelmann en 1985 para referirse a una urticaria con un infiltrado de predominio neutrofílico13. Broekaert et al. en 2016 definieron el epiteliotropismo neutrofílico para diferenciar histológicamente ambas entidades, lo que es muy relevante dado que la primera se ha demostrado asociada con enfermedades sistémicas12, no así la urticaria neutrofílica14. El epiteliotropismo neutrofílico se define por la presencia de neutrófilos intraepidérmicos, pero sobre todo dentro del epitelio de las glándulas sudoríparas ecrinas, los folículos pilosos y las glándulas sebáceas. También es muy frecuente encontrarlos en la dermis perianexial y agrupados a lo largo de la unión dermoepidérmica (fig. 2). Sin embargo, la localización en la unión dermoepidérmica es menos específica, pudiendo aparecer también en la urticaria neutrofílica, reacción a fármacos neutrofílica y lupus eritematoso con expresión de neutrófilos.
Dermatosis neutrofílica urticarial (HE×40). Se observa un infiltrado intersticial, perivascular superficial, y en la unión dermoepidérmica en el que predominan los neutrófilos (flechas rojas). También se observa leucocitoclasia (flecha negra). No se objetivan trombos ni necrosis o edema de la pared vascular. Los hallazgos fueron compatibles con una dermatosis neutrofílica urticarial, y finalmente la paciente fue diagnosticada de síndrome de Sjögren.
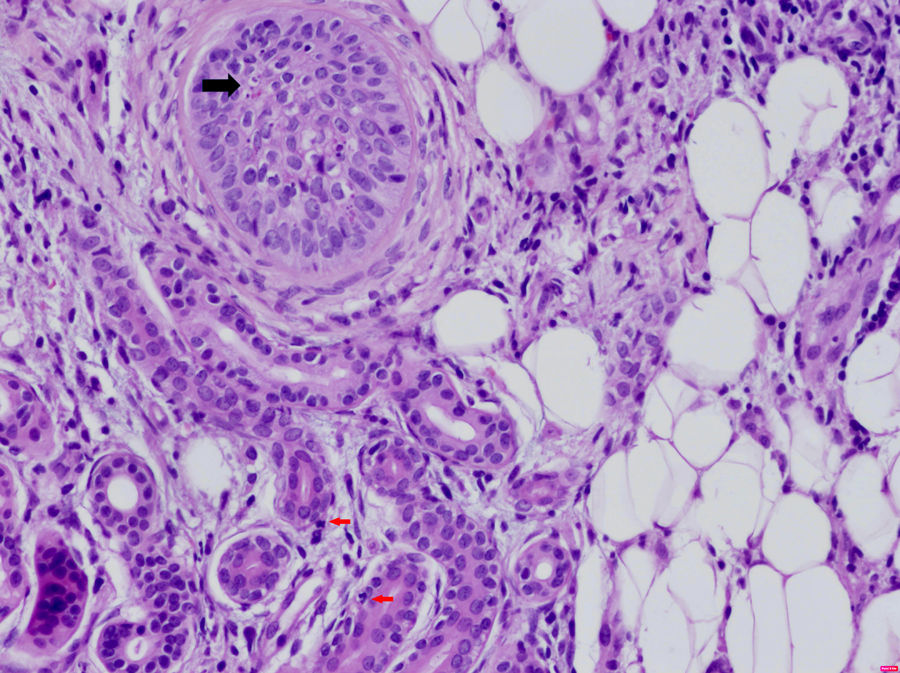
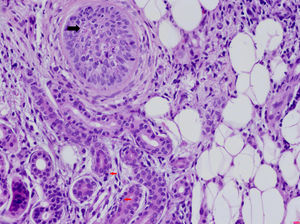
Entre las enfermedades sistémicas asociadas con la DNU se encuentran los síndromes autoinflamatorios hereditarios, el síndrome de Schnitzler, la enfermedad de Still del adulto, la artritis idiopática juvenil y el lupus eritematoso (LES). La frecuente asociación de la DNU con enfermedades autoinflamatorias lleva a especular sobre si realmente se trata de un signo de disfunción del sistema inmunitario innato. En la histología de los síndromes autoinflamatorios es típica la presencia de un infiltrado intersticial y perivascular denso, rico en neutrófilos (fig. 3).
Dermatosis neutrofílica urticarial (HE×40). Se observa la presencia de un infiltrado linfohistiocitario perianexial con presencia de neutrófilos en las glándulas sudoríparas ecrinas (flechas rojas) y en el epitelio del folículo piloso (flecha negra), así como polvo nuclear. El paciente fue diagnosticado de fiebre mediterránea familiar.
En la DNU no hay, por definición, vasculitis. Se puede ver extravasación de hematíes o leucocitoclasia en infiltrados neutrofílicos densos, pero nunca encontraremos necrosis fibrinoide. También se puede observar la presencia de linfocitos, eosinófilos, o ambos. La epidermis suele estar intacta y hay ausencia de edema en la dermis superficial15. Puede haber un incremento de mucina en dermis en aquellos casos de DNU asociada con LES.
Cuando observamos un infiltrado con eosinófilos deberíamos plantear el diagnóstico diferencial con un penfigoide ampolloso16, una reacción medicamentosa17, una dermatitis urticarial18, o menos frecuentemente, con un síndrome de Wells19. Como claves diagnósticas histológicas buscaremos la existencia de espongiosis eosinofílica, la presencia de eosinófilos en la unión dermoepidérmica y las figuras en llama.
El síndrome de Wells se presenta inicialmente como una dermatitis intersticial superficial y profunda con un infiltrado mixto de eosinófilos y linfocitos que se puede acompañar de edema subepidérmico. Si realizamos una biopsia más tardíamente (entre la primera y tercera semanas) es posible encontrar las figuras en llama, características, pero no patognomónicas de esta enfermedad19.
Patrón de reacción tisularLa presencia de otros patrones histológicos acompañando a la dermatitis perivascular superficial característica de la urticaria puede darnos la clave para establecer un diagnóstico. Los patrones histológicos que buscaremos son: dermatitis de interfase, patrón espongiótico y patrón vasculopático.
Dermatitis de interfaseUn hallazgo histológico que podemos encontrar en varias entidades que nos plantean diagnóstico diferencial con la urticaria, pero que no aparece en esta última, es la dermatitis de interfase, que se caracteriza por el daño vacuolar basal y los queratinocitos apoptóticos en la epidermis. Las entidades que pueden simular una urticaria y presentar este patrón son las reacciones medicamentosas y el lupus cutáneo.
En las reacciones medicamentosas es típica la presencia de dermatitis de interfase en grado variable17 junto con un infiltrado mononuclear perivascular superficial con algunos eosinófilos. La dermatitis de interfase se caracteriza por la acumulación de linfocitos en la unión dermoepidérmica, junto con una degeneración hidrópica de los queratinocitos de la capa basal. Es posible la presencia de exocitosis.
El espectro histopatológico de las reacciones medicamentosas es muy amplio, existiendo de forma habitual varios patrones histológicos superpuestos20.
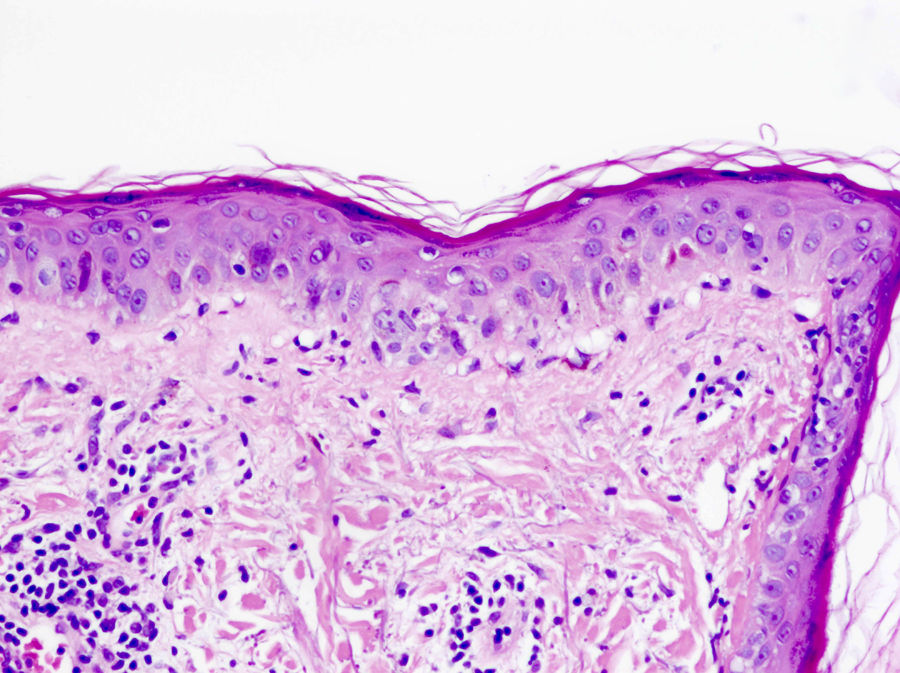
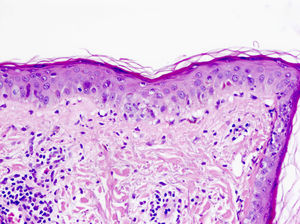
En el lupus cutáneo subagudo encontramos una dermatitis de interfase vacuolar junto a un infiltrado linfocítico perivascular superficial y profundo (fig. 4)21,22. La distribución perianexial de dicho infiltrado también es característica. De forma tardía puede aparecer un engrosamiento de la membrana basal23. El aumento de mucina entre las fibras de colágeno nos ayuda en el diagnóstico de lupus tumidus, variante de lupus cutáneo en la que suele estar ausente la degeneración vacuolar de la capa basal de la epidermis24.
Dermatitis de interfase (HE×40). Se observa presencia de atrofia epidérmica junto a una dermatitis de interfase vacuolar con queratinocitos necróticos, junto a un infiltrado perivascular superficial de predominio linfocitario. Esta biopsia corresponde a una paciente con lupus cutáneo.
En la UC no se observa espongiosis, salvo que exista una dermatitis de contacto asociada por la aplicación de productos tópicos. La característica principal del patrón espongiótico es el edema intercelular intraepidérmico (espongiosis). Este patrón se puede observar en la dermatitis urticarial (DU), el penfigoide ampolloso (PA) y también en las reacciones medicamentosas.
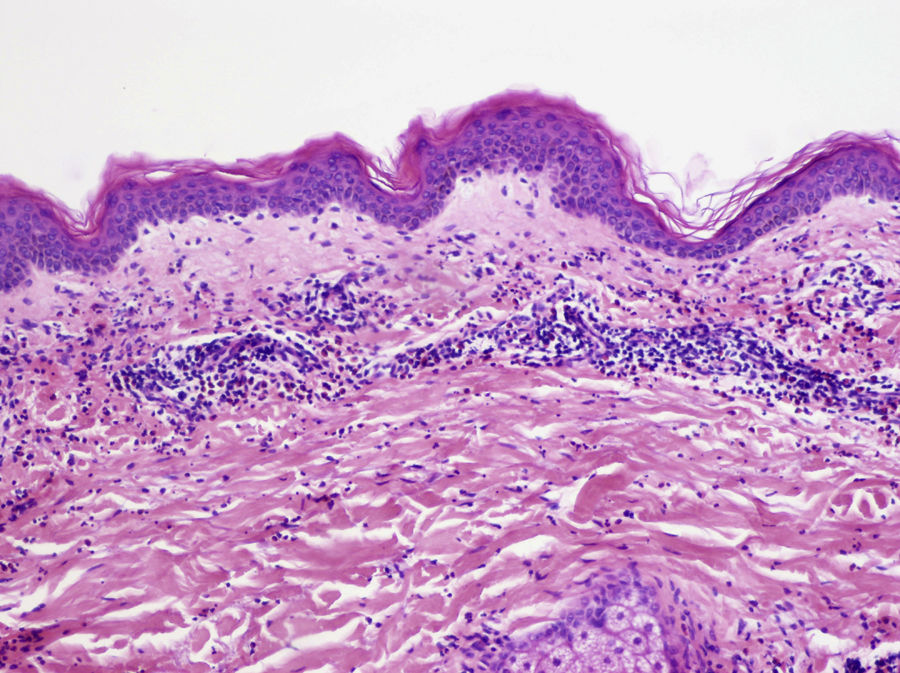
La DU es un término inicialmente histopatológico definido en 2006 por Kossard et al.25 y que fue adoptado posteriormente como una entidad clínica para describir a pacientes con lesiones urticariales de más de 24 horas de duración, que asocian lesiones eccematosas. De los pacientes que se presentan con un cuadro clínico compatible con DU, entre el 53,8 y 75% presentan hallazgos histopatológicos consistentes con DU18,25. Por el contrario, solo un 33,8% de los pacientes con criterios histopatológicos de DU tienen un diagnóstico clínico previo de DU25. Entre los pacientes que presentan clínica inicialmente compatible, muchos terminan con un diagnóstico definitivo de dermatitis (16-26,4%), urticaria (8,1-10%), reacciones medicamentosas (6-23,6%), dermatitis atópica (3%), dermatitis de contacto (3%), penfigoide ampolloso o dermatitis herpetiforme (4-31,8%), o de vasculitis urticarial (16,2%)18,25. Parece que la DU representa un patrón de reacción que puede verse en varias condiciones dermatológicas, y sería necesaria una evaluación diagnóstica para establecer una correlación clínicopatológica. Si biopsiamos una lesión urticariforme de un paciente con DU, encontraremos espongiosis en la epidermis sin alteración del estrato córneo y un infiltrado linfocítico con un número variable de eosinófilos en la dermis papilar (fig. 5)18,25. También puede haber edema subepidérmico como ocurre en la urticaria.
El patrón espongiótico puede aparecer también en las reacciones medicamentosas (de forma menos característica que la dermatitis de interfase) y en el PA. En ambas entidades es característico además que haya eosinófilos.
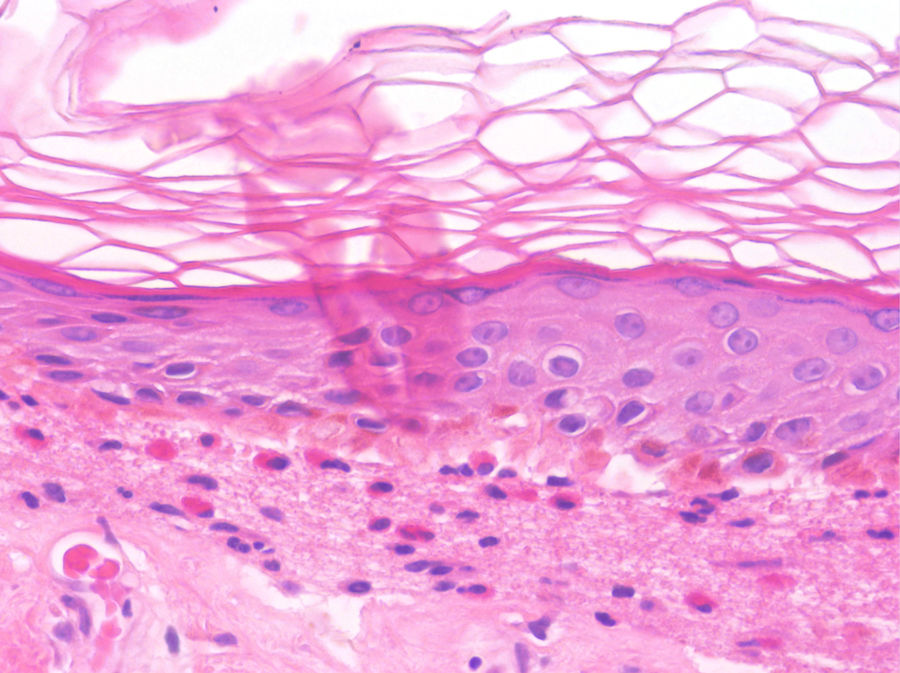
Los hallazgos histológicos del PA no son patognomónicos pero son altamente sugestivos. En fases precoces preampollosas (fase urticarial), es característico observar hendiduras subepidérmicas, espongiosis eosinofílica y/o un infiltrado eosinofílico en la dermis superficial revistiendo la unión dermo-epidérmica (fig. 6)26. Las enfermedades ampollosas subepidérmicas pueden cursar con una fase prodrómica urticarial que precede a las ampollas típicas por días o semanas; en casos en los que la fase urticarial dure más tiempo, no debemos incluirlo en nuestro diagnóstico diferencial27.
Penfigoide ampolloso en fase urticarial (HE×100). En la epidermis podemos evidenciar la presencia de espongiosis, junto a un infiltrado con abundantes eosinófilos dispuestos en la dermis superficial y en la unión dermoepidérmica. Se observa el inicio de la formación de una vesícula subepidérmica, hallazgos concordantes con el diagnóstico de penfigoide ampolloso.
La vasculitis urticarial (VU) es uno de los principales diagnósticos que nos debemos plantear ante un paciente con una erupción urticariforme.
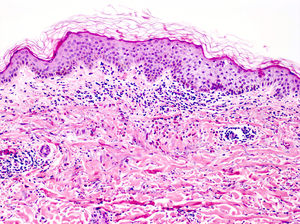
Se ha descrito clásicamente como una vasculitis leucocitoclástica con células endoteliales tumefactas, edema en la dermis, extravasación de hematíes y necrosis fibrinoide de la pared de los vasos28,29, con un infiltrado dérmico variable de neutrófilos, eosinófilos o ambos (fig. 7)30. En la UC podemos encontrar, de forma ocasional, tanto extravasación de hematíes como leucocitoclasia7, y esta última también es habitual en la DNU15. Sin embargo, de acuerdo con la descripción clásica de VU, la ausencia de necrosis fibrinoide nos descarta que nos encontremos ante una VU en ambos casos.
Vasculitis urticarial (HE×10). Se observa una epidermis sin alteraciones, con inflamación perivascular superficial de predominio linfohistiocitario, junto a aislados eosinófilos y neutrófilos perivasculares. Además, destaca la presencia de edema y daño de la pared vascular de los pequeños vasos en la dermis superficial. Estos hallazgos se acompañan de extravasación de hematíes, de la presencia de leucocitoclasia intersticial así como de edema en la dermis superficial. En este caso no se observa necrosis fibrinoide. Precisó una correlación clinicohistológica para establecer el diagnóstico definitivo.
Por otra parte, Lee et al.31 han demostrado la existencia de pacientes que cumplen criterios clínicos de VU pero que histopatológicamente presentan un infiltrado de predominio linfocitario perivascular y en el interior de los vasos de la dermis. Este grupo de pacientes muestra datos indirectos de daño vascular como son la extravasación de hematíes y la tumefacción de las células endoteliales, pero con ausencia de extravasación de fibrina y de polvo nuclear. En la actualidad, no existe un consenso sobre si es necesaria la presencia de depósito de fibrina para establecer el diagnóstico de una vasculitis linfocitaria. Tampoco está ampliamente aceptada la vasculitis linfocitaria como mecanismo etiopatogénico32.
Inmunofluorescencia directa (IFD)La inmunofluorescencia en la UC suele ser negativa. Sin embargo, podemos encontrar hallazgos patológicos en las enfermedades ampollosas subepidérmicas, en el lupus cutáneo y en la VU por lo que consideramos que debería realizarse, si existe disponibilidad, a todos los pacientes con urticaria crónica en los que se decide practicar una biopsia cutánea.
En la IFD del PA, se observan depósitos lineales de inmunoglobulina G (IgG) y C3 en la membrana basal, aunque puede haber también depósitos de inmunoglobulinas M o A, pero siempre de menor intensidad. Típicamente los depósitos de C3 son más intensos que los de IgG. En un pequeño porcentaje de pacientes con PA se observan depósitos exclusivamente de C3, sin presencia de IgG. Los depósitos de IgG adoptan un patrón en «N serrada»16,26
En la VU, la IFD puede demostrar la presencia de inmunoglobulinas, complemento y fibrinógeno en la membrana basal, perivascular o ambas30, sobre todo en el contexto de enfermedades sistémicas como el LES y la enfermedad mixta del tejido conectivo33.
En el lupus cutáneo, se detecta en la unión dermoepidérmica de la piel lesional el depósito granular o fibrilar de inmunoglobulinas IgG, IgM y en ocasiones de IgA, así como depósitos del factor de complemento C323. Algunos autores emplean el término de «banda lúpica» para referirse a estos hallazgos34.
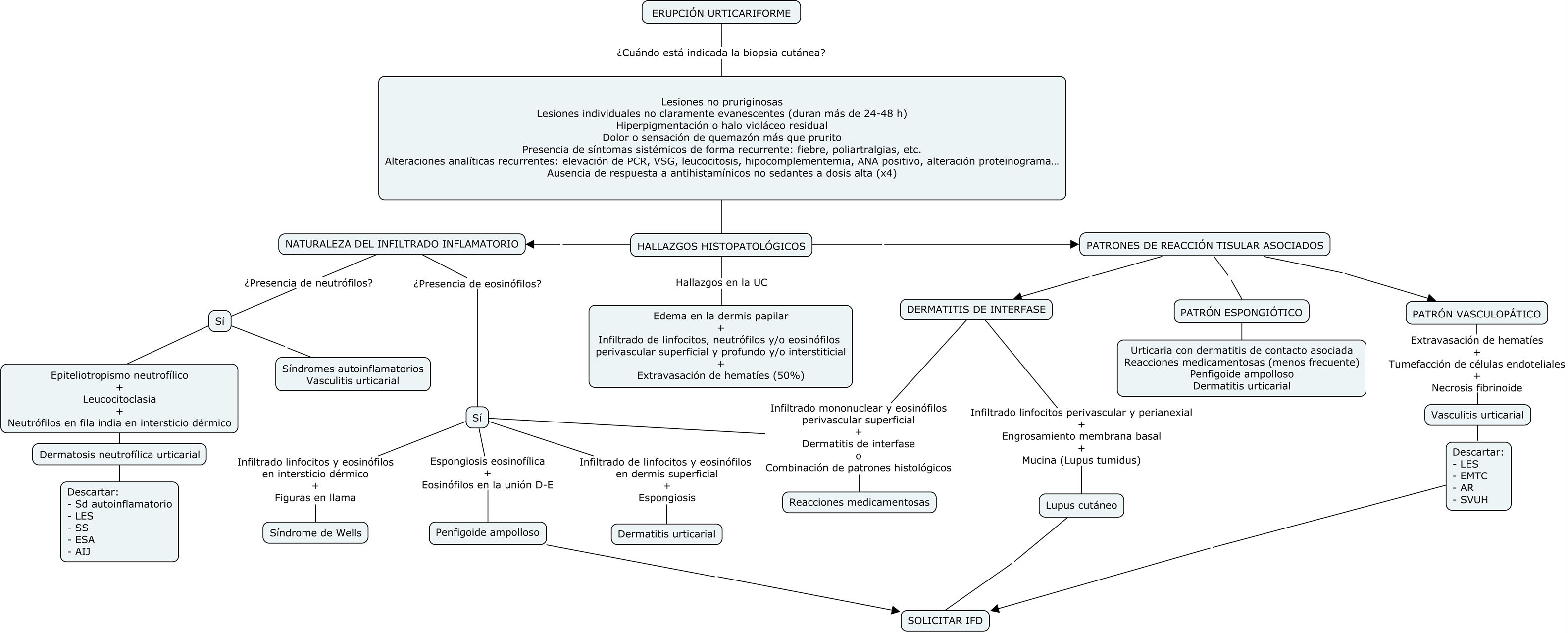
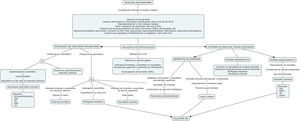
Proponemos un algoritmo para orientar el diagnóstico histopatológico en la figura 8.
Algoritmo de diagnóstico histológico de erupciones que simulan una urticaria crónica.
AIJ: artritis idiopática juvenil; AR: artritis reumatoide; EMTC: enfermedad mixta del tejido conectivo; ESA: enfermedad de Still del adulto; IFD: inmunofluorescencia directa; LES: lupus eritematoso sistémico; PCR: proteína C reactiva; SVUH: síndrome de vasculitis urticarial hipocomplementémica; UCE: urticaria crónica espontánea; VSG: velocidad de sedimentación globular.
La urticaria crónica es una entidad de diagnóstico fundamentalmente clínico, pero en ocasiones la clínica no es suficiente para establecer un diagnóstico definitivo. La biopsia cutánea es necesaria en aquellos pacientes con datos clínicos de alarma o alteraciones analíticas recurrentes, permitiéndonos distinguir entre la urticaria crónica y otros cuadros urticariformes.
La naturaleza del infiltrado inflamatorio y el patrón de reacción tisular encontrado en la biopsia, así como la inmunofluorescencia directa, interpretadas en el contexto clínico del paciente, son clave para establecer el diagnóstico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.