El melanoma en receptores de un trasplante de órgano sólido (RTOS) puede aparecer en 3 situaciones clínicas, objeto de esta revisión: pacientes con historia de melanoma previa al trasplante, pacientes que desarrollan el melanoma posteriormente al trasplante y pacientes con melanoma procedente del donante. Los factores más relevantes a considerar en pacientes con antecedentes de melanoma candidatos a un trasplante son el estadio del tumor, la presencia o no de enfermedad residual y el periodo entre el diagnóstico y el trasplante. Los RTOS tienen mayor riesgo de padecer un melanoma que la población inmunocompetente. La mortalidad por melanoma es también mayor, especialmente en aquellos con estadios avanzados, que suponen un verdadero reto terapéutico. Finalmente, la historia clínica y la exploración física del donante son las herramientas más útiles para evitar la transmisión de un melanoma al receptor, situación con pronóstico infausto.
In this review, we analyze the 3 clinical scenarios related to the development of melanoma in solid organ transplant recipients: melanoma in patients with a history of the tumor prior to a transplant, de novo melanoma following a transplant, and melanoma of donor origin. The main factors to consider in organ-transplant candidates with a history of melanoma are tumor stage, presence or absence of residual disease, and time from diagnosis to transplantation. Solid organ transplant recipients have a greater risk of melanoma than immunocompetent individuals. Mortality is also higher in this population, especially in patients with advanced melanoma, as treatment is especially challenging. Clinical history and physical examination provide the most useful information for preventing donor-to-recipient transmission of melanoma. Donor-derived melanoma has a very poor prognosis.
Cada año se realizan aproximadamente 120.000 trasplantes de órganos sólidos (TOS) en el mundo1. La supervivencia de los receptores de un trasplante de órgano sólido (RTOS) ha aumentado progresivamente gracias a los avances en las técnicas quirúrgicas y a las mejores pautas de inmunosupresión2. La inmunosupresión crónica aumenta el riesgo de desarrollar neoplasias, correspondiendo el 40-50% de estas al cáncer cutáneo no melanoma (CCNM)3. El melanoma en la población inmunocompetente (IC) justifica hasta el 80% de las muertes por cáncer cutáneo4,5. El diagnóstico temprano reduce significativamente su mortalidad6. Por tratarse de un tumor muy inmunogénico, sería esperable que en el contexto de la inmunosupresión de los RTOS aumente su incidencia y agresividad7,8. El melanoma supone el 6,2% de las neoplasias en los RTOS en adultos y el 15% en niños9. El objetivo del presente trabajo es revisar los diferentes escenarios clínicos en los que los RTOS pueden padecer un melanoma, sus características clínicas y epidemiológicas, abordaje terapéutico y pronóstico.
Estrategia de búsqueda y selección de artículosSe empleó la base de datos PUBMED para buscar artículos con diferentes combinaciones de los siguientes términos MeSH en el título o en el resumen: «melanoma», «organ transplantation», «transplantation», «nivolumab», «pembrolizumab», «ipilimumab», «dabrafenib», «vemurafenib», «photocarcinogenesis» y «voriconazole».
Finalmente se revisó manualmente la bibliografía de los trabajos seleccionados para completar la búsqueda.
Escenarios clínicosAl referirnos al melanoma en los RTOS nos encontramos con 3 posibles situaciones clínicas: pacientes con antecedentes de melanoma antes del trasplante, pacientes que lo desarrollan después del trasplante y pacientes con melanoma procedente del donante6. En nuestra experiencia, habría un cuarto escenario: los RTOS con un melanoma en el periodo pretrasplante que no es diagnosticado ni tratado hasta la visita dermatológica postrasplante.
Historia de melanoma previa al trasplanteEl antecedente de melanoma se ha considerado clásicamente una contraindicación para recibir un TOS, sentenciando a pacientes cuya supervivencia dependía de dicho trasplante10. Existe poca evidencia sobre si existe un riesgo incrementado de recurrencia o progresión en el periodo postrasplante de un melanoma previamente tratado en un paciente candidato a un TOS11. En una serie de 31 pacientes con historia de melanoma tratado que recibieron un TOS se observó un alarmante porcentaje de recurrencia del 19%12. Los autores recomendaron que entre el tratamiento del melanoma y la realización del trasplante pasasen al menos 5 años12. No obstante, no se especificaba el índice de Breslow de los melanomas incluidos, principal factor pronóstico13. Trabajos más recientes no han podido confirmar estos resultados10. Dapprich et al. publicaron una serie de 12 pacientes con antecedentes de melanoma tratado previo al trasplante (índice de Breslow medio de 0,35mm) que no mostraron recidiva ni mortalidad postrasplante debida al melanoma14. De manera análoga, el grupo europeo Skin Care in Organ Transplant Patients, Europe (SCOPE) tampoco encontró recidivas ni mortalidad postrasplante por melanoma entre sus 9 RTOS con antecedentes de melanoma4. Brewer et al. tampoco encontraron diferencias significativas en cuanto a recurrencia (tras un periodo de 10,5 años) ni metástasis en sus 59 pacientes RTOS con melanoma pretrasplante15. A pesar de ello, la información del índice de Breslow tan solo estaba disponible en 17 casos15. Conviene destacar que en estos trabajos probablemente hay un sesgo de selección, ya que es esperable que los pacientes que fueron sometidos a un TOS fueran aquellos que habían padecido un melanoma de mejor pronóstico (menor índice de Breslow) y aquellos que llevaban más tiempo libres de enfermedad. Otro estudio con 336 pacientes RTOS con historia previa de melanoma mostró que estos pacientes tenían, respecto a los RTOS sin melanoma previo, un mayor riesgo de mortalidad específica por melanoma (hazard ratio [HR]: 27; intervalo de confianza [IC] 95%: 11-64; p<0,0001), un mayor riesgo de mortalidad global y de nuevos melanomas postrasplante16. A pesar de estos alarmantes resultados, los propios autores explican que dado que la muerte por melanoma es, en términos absolutos, rara entre los RTOS, estas diferencias se traducían en una pequeña diferencia absoluta de mortalidad específica por melanoma del 1,2% a los 5 años. Los autores discuten que sus resultados probablemente no justifiquen un cambio en las estrategias de selección de pacientes, aunque sí un seguimiento dermatológico estrecho16. En base a estos estudios previos y a las curvas de supervivencia del melanoma según la American Joint Commission on Cancer (AJCC, 7.ª edición), el International Transplant Skin Cancer Collaborative Group (ITSCC) propuso las recomendaciones resumidas en la tabla 117. Los autores aceptan una supervivencia postrasplante del 60% a los 5 años y utilizan las curvas de supervivencia del melanoma de la 7.ª edición de la AJCC para proponer qué estadios serían candidatos a trasplante (Ia, Ib, IIa, IIb y IIIa). Por otro lado, consideran que el momento en el que la curva de supervivencia para cada estadio se aplana es el tiempo mínimo de espera entre el diagnóstico de melanoma y el trasplante17. El resultado de la biopsia selectiva del ganglio centinela (BSGC) será de especial ayuda a la hora de considerar estos pacientes para el TOS6.
Tiempo mínimo desde el tratamiento del melanoma hasta el TOS según el ITSCC
| Estadio según AJCC (7.ª edición) | Tiempo recomendado hasta TOS |
|---|---|
| Estadio 0 | No precisa demorar el TOS |
| Estadio Ia | 2 años |
| Estadio Ib | 5 años |
| Estadio IIa, IIb, IIIa | 5-10 años |
| Estadios IIc, IIIb, IV | No candidatos a TOSa |
AJCC: American Joint Commission on Cancer; ITSCC: International Transplant Skin Cancer Collaborative Group; TOS: trasplantes de órganos sólidos.
Considerar individualmente en supervivientes de más de 10-15 años.
Fuente: adaptado de Zwald et al.17.
Los RTOS tienen de 2 a 8 veces más riesgo de desarrollar un melanoma que la población IC18–24 (tabla 2). Probablemente, el mayor número de revisiones dermatológicas en esta población sensibiliza del problema a los profesionales implicados en la atención de los RTOS y permite diagnosticar mayor número de casos2. Este riesgo puede llegar a ser 17,2 veces mayor en población afroamericana25.
Estudios de la tasa de incidencia de melanoma en RTOS y en la población IC española
| Referencia | N.° de RTOS incluidos | Lugar de estudio | Tasa de incidencia (por 100.000 personas/año) |
|---|---|---|---|
| Garret et al.20 | 10.649 | EE. UU. | 75 |
| Brown et al.21 | 861 | Londres | 82 |
| Vajdic et al.22 | 8.152 | Australia | 134 |
| Referencia | Estudio | Lugar de estudio | Tasa de incidencia (por 100.000 personas/año) |
|---|---|---|---|
| Tejera-Vaquerizo et al.23 | Metaanálisis | España | 8,82 |
IC: inmunocompetente; RTOS: receptores de un trasplante de órgano sólido.
No obstante, a pesar de esta mayor incidencia de melanoma en pacientes RTOS respecto a la población IC, no debemos olvidar que el riesgo de padecer carcinoma escamoso y carcinoma basocelular está mucho más incrementado (50-250 y 10 veces, respectivamente)11.
Factores de riesgoEl melanoma es un tumor muy inmunogénico, con excelente respuesta a las nuevas inmunoterapias17. Como otros tumores, tiene mecanismos de evasión de la vigilancia inmunológica fisiológica para poder diseminarse11. Es de esperar que en el paciente inmunodeprimido aumente tanto su incidencia como su capacidad de diseminación15. Además del propio estado de inmunosupresión, es posible que otras características específicas de cada inmunosupresor estén implicadas en la mayor incidencia y en la progresión del melanoma8, como ocurre en el CCNM. Incluso se ha descrito buena respuesta y evolución del melanoma al retirar los inmunosupresores22. Los inhibidores de la calcineurina y la azatioprina aumentan el riesgo de cáncer cutáneo por disminución de la vigilancia inmunológica, aumento de la vascularización y capacidad invasiva tumoral, y por aumento del daño en el ADN (por ejemplo tras exposición a radiación UVB) o inhibición de su reparación26. También sabemos que la sustitución de estos inmunosupresores clásicos por un inhibidor de mTOR (imTOR), con propiedades antiproliferativas, es eficaz en la prevención secundaria del CCNM2,27,28. La evidencia que tenemos de los beneficios del cambio a una pauta inmunosupresora con un imTOR en el caso del melanoma es escasa. Procede de experiencias en animales y del estudio CONVERT, que mostró una menor incidencia de melanoma en la cohorte de receptores de riñón que recibieron sirolimus respecto a los que no, aunque dicha incidencia fue muy baja en ambos grupos29,30. Resulta llamativo que un metaanálisis que incluía datos de 5.876 pacientes de 21 ensayos clínicos aleatorizados reveló que el uso de sirolimus en RTOS se asociaba a un riesgo de muerte del 43% mayor (HR: 1,43; IC 95%: 1,21-1,71; p<0,001), principalmente por causas cardiovasculares o infecciosas, en aquellos tratados con altas dosis. Estos resultados de mortalidad junto a la elevada incidencia de efectos secundarios (muchos de los cuales aumentan el riesgo cardiovascular), limitan su uso como tratamiento inmunosupresor de primera línea28.
El estudio de Vajdic et al. en RTOS destacó que el riesgo de melanoma era mayor en el segundo año postrasplante, y disminuía de manera lineal posteriormente. La edad y el tratamiento inmunosupresor de inducción con anticuerpos monoclonales eran también factores de riesgo. Por el contrario, el sexo femenino, ser de raza no caucásica y el aumento del tiempo desde el trasplante eran factores protectores22.
Diversos trabajos han destacado un incremento del número de nevus en RTOS, potencialmente relacionado con la duración de la inmunosupresión. Un número elevado de nevus se asocia a mayor riesgo de melanoma6,31. En una serie sueca, el 63% de los melanomas en RTOS se asociaron histológicamente a la presencia de un nevus displásico32. En otras 2 series, tan solo el 33-36% de los melanomas en RTOS se desarrollaron sobre un nevus previo18,24.
Varias publicaciones sobre RTOS con melanoma han remarcado que son frecuentes los antecedentes de CCNM4,24.
El voriconazol se emplea en infecciones fúngicas invasivas en RTOS, especialmente en receptores de pulmón. Se considera un factor de riesgo independiente para desarrollar un cáncer cutáneo, especialmente un carcinoma escamoso. Además de ser fotosensibilizante, parece que potencia el daño del ADN celular al exponerse a la radiación UV y evita su reparación. Por todo ello, varios artículos han señalado también su posible papel en el desarrollo del melanoma. Se recomienda suspender su administración en RTOS que desarrollen un carcinoma escamoso o un melanoma3,33.
Evolución y pronóstico esperableEl estadio tumoral en el momento del diagnóstico es uno de los factores pronósticos más importantes, igual que en IC17,34. El índice de Breslow es el parámetro histopatológico con más importancia pronóstica17. El estudio multicéntrico del grupo SCOPE de 2008, en el que analizaron 95 RTOS con melanoma postrasplante y lo compararon con una cohorte de pacientes IC con melanoma, no encontró diferencias estadísticamente significativas en cuanto a mortalidad en los estadios T1 y T2. No obstante, la mortalidad de los RTOS con estadio T3 y T4 fue significativamente mayor que la de los IC con el mismo estadio con una HR de 11,49 (IC 95%: 3,59-36,82). Otro estudio concluyó que los RTOS tenían melanomas más avanzados en el momento del diagnóstico comparados con una población IC (estadios III-IV OR: 4,2; IC 95%: 1,6-10,8; p=0,003)32. Además, el riesgo de muerte específica por melanoma estaba aumentado en RTOS (HR ajustada de 3; IC 95%: 1,7-5,3; p<0,001). Finalmente, un estudio canadiense con 51 RTOS con melanoma en el periodo postrasplante puso de manifiesto que la mortalidad específica por melanoma era mayor en los RTOS respecto a una población IC de referencia, independientemente del estadio (HR ajustado: 1,93; IC 95%: 1,03-3,63; p=0,04)35. También se asociaba a una mortalidad por cualquier causa de 2 a 8 veces mayor (dependiendo del estadio) en los RTOS diagnosticados de melanoma. Si bien es cierto que una parte de este incremento de mortalidad pudiera deberse a cambios en el régimen inmunosupresor, los autores justifican que parecía que no contribuía de forma significativa35.
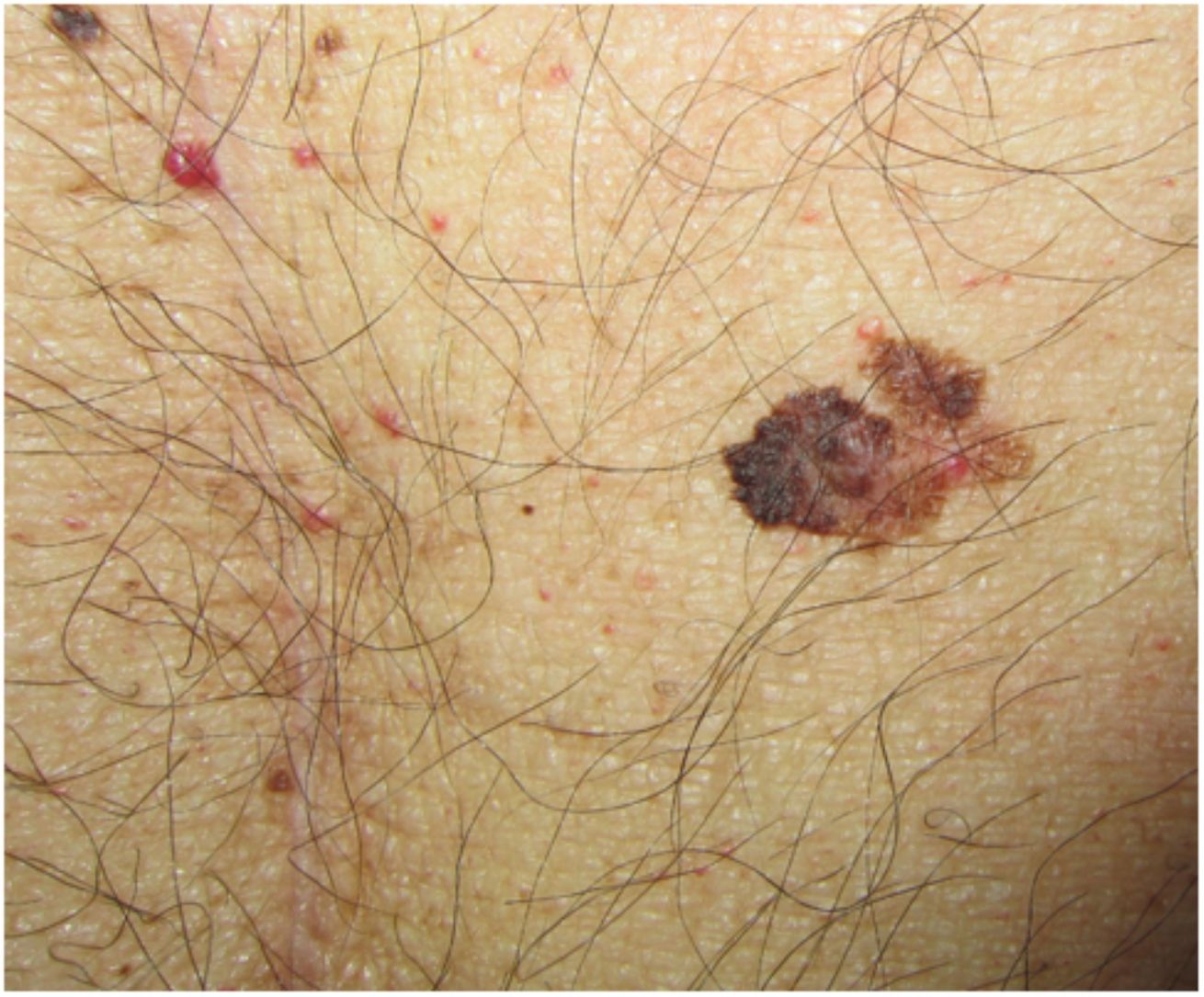
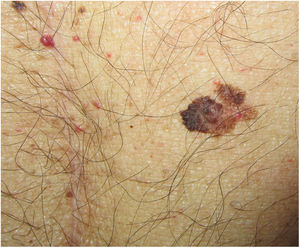
Características clínicas e histológicasSegún la serie más importante hasta el momento de RTOS con melanoma postrasplante, el melanoma en estos pacientes es clínica e histopatológicamente indistinguible de los que se desarrollan en IC4. La edad media en el momento del diagnóstico fue de 54 años (26-77) con predominio por el sexo masculino (66%), similar a lo observado en otras publicaciones35. El melanoma se desarrolló tras un intervalo medio de 8,7 años (0,1-24,9) tras el primer trasplante, tiempo algo inferior a la media de 12 años que describieron Brocard et al.36. El 95% de los pacientes tenían fototipo I-III y, a diferencia de lo que ocurre en la población general, no hubo diferencias en la localización anatómica del melanoma según el sexo. En la serie de Park et al., encontraron que los melanomas en RTOS se encontraban más frecuentemente localizados en la cabeza y en el cuello que los de los IC35. En otro trabajo, los melanomas de los RTOS se localizaban predominantemente en el tronco (51%) y en la cabeza y cuello (26%) en los varones, y en el tronco (50%) y en las extremidades (42%) en las mujeres, a diferencia de lo que ocurre en la población general de mujeres (donde es más frecuente en extremidades inferiores, 36%)32.
En la serie de Brocard et al., que incluía 20 casos de RTOS con melanoma, 2 (10%) tenían melanoma de mucosas36. En nuestra serie (no publicada) de 8 pacientes, 2 (25%) melanomas estaban en la mucosa oral. Son proporciones mayores a las de la población general, donde los melanomas en mucosas representan aproximadamente el 1-2% del total37. Los datos deben ser confirmados, pero podrían evidenciar una etiopatogenia diferencial de estos melanomas en RTOS.
Aunque todos los tipos histológicos de melanoma estaban representados en la serie de SCOPE, el melanoma de extensión superficial fue el más frecuente entre los invasivos, similar a lo que ocurre en la población general y a lo que se describe en otras series4,24,35. El índice de Breslow medio observado en los melanomas invasivos fue de 1,5 a 2mm4,32. En el trabajo de Krynitz et al., el 82% de los melanomas diagnosticados en RTOS tenían un nivel de Clark III-V, a diferencia del 66% de los melanomas en IC (OR: 2,2; IC 95%: 1,01-4,7)32. También destaca un menor infiltrado linfocítico tumoral en aquellos RTOS con melanomas que acabaron siendo letales, por lo que los autores sugieren que podría ser un dato con implicaciones pronósticas. Este menor infiltrado linfocítico tumoral probablemente refleja el estado de inmunosupresión iatrogénica subyacente32.
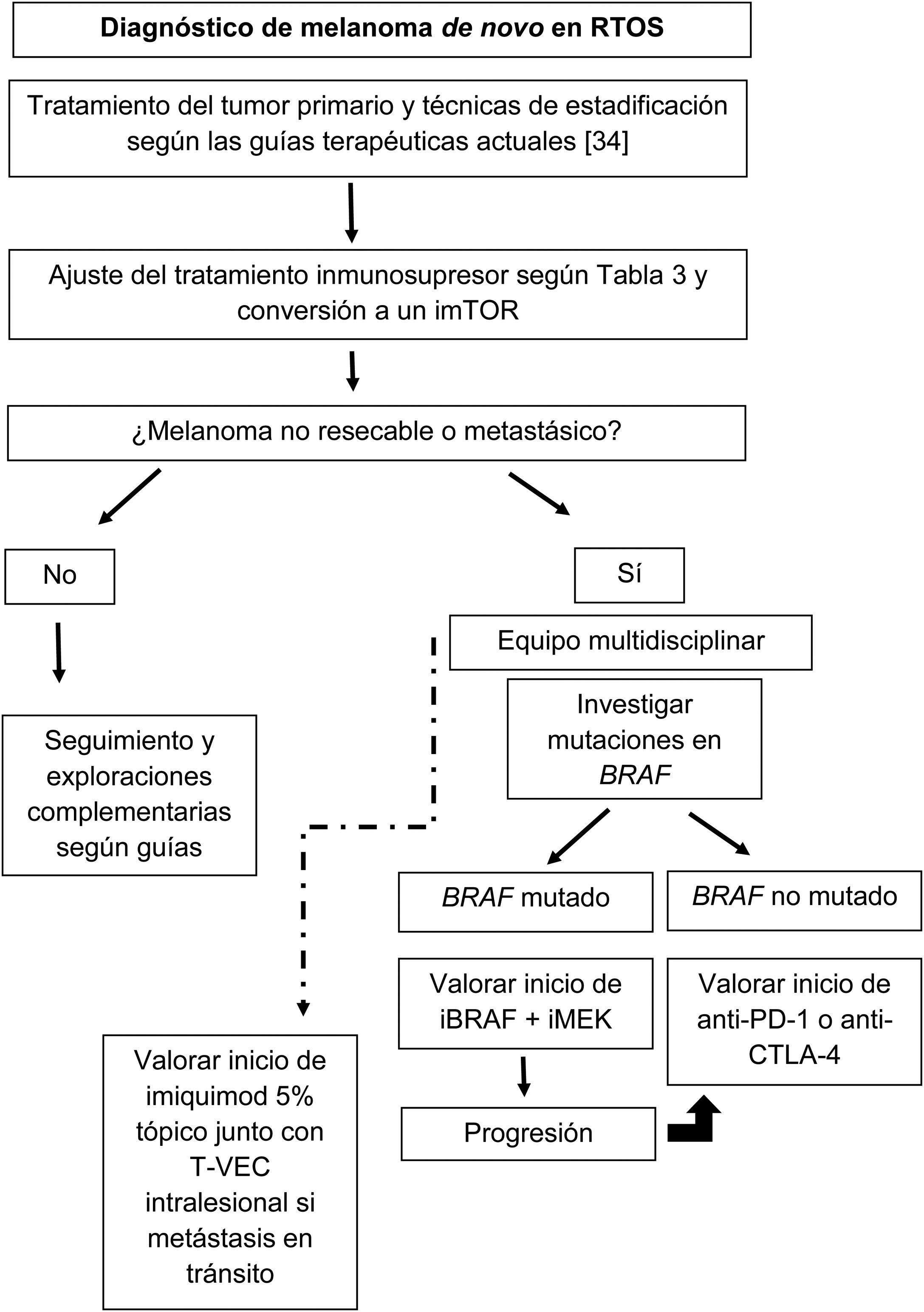
Manejo y tratamientoEl tratamiento inicial del melanoma en RTOS no debe diferir del de los IC. Tras la escisión simple, según el índice de Breslow, se procederá a la ampliación con el correspondiente margen y, si precisa, la BSGC. La correcta estadificación del tumor será esencial para su manejo; cuanto peor sea el pronóstico, más agresiva deberá ser nuestra intervención y, derivado de ello, probablemente, un mayor riesgo para la supervivencia del órgano trasplantado6,38.
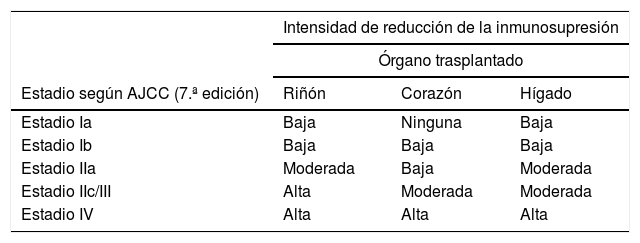
Tras el diagnóstico de melanoma en un RTOS, se debe revisar el tratamiento inmunosupresor, ya sea retirando algún fármaco, disminuyendo sus niveles en sangre o bien cambiándolo por otro con actividad antiproliferativa y antiangiogénica, con el objetivo de reducir el riesgo de diseminación. Se debe conseguir un equilibrio entre un nivel de inmunosupresión que no favorezca la diseminación tumoral y que, a la vez, evite el rechazo del órgano trasplantado. Los factores determinantes a tener en cuenta son el estadio del tumor y su pronóstico, el tipo de órgano trasplantado y la posibilidad de sustituir su funcionalidad artificialmente (en trasplantes renales se puede volver a diálisis) y el estado general del paciente. La tabla 3 reproduce las recomendaciones del ITSCC acerca de la intensidad de reducción de la inmunosupresión tras el diagnóstico de CCNM o melanoma6,39. A pesar de la escasa evidencia disponible en el caso del melanoma, parece razonable plantear pautas inmunosupresoras con un ImTOR cuando sea posible28.
Recomendaciones del ITSCC y del grupo SCOPE acerca de la intensidad de reducción de la inmunosupresión en RTOS con CCNM y melanoma
| Intensidad de reducción de la inmunosupresión | |||
|---|---|---|---|
| Órgano trasplantado | |||
| Estadio según AJCC (7.ª edición) | Riñón | Corazón | Hígado |
| Estadio Ia | Baja | Ninguna | Baja |
| Estadio Ib | Baja | Baja | Baja |
| Estadio IIa | Moderada | Baja | Moderada |
| Estadio IIc/III | Alta | Moderada | Moderada |
| Estadio IV | Alta | Alta | Alta |
AJCC: American Joint Commission on Cancer; CCNM: cáncer cutáneo no melanoma; ITSCC: International Transplant Skin Cancer Collaborative Group; RTOS: receptores de un trasplante de órgano sólido.
Fuente: adaptado de Zwald et al.6
La supervivencia de los pacientes con melanoma avanzado y, en especial, con melanoma metastásico es muy baja40. Las terapias dirigidas a dianas y de la inmunoterapia han supuesto una revolución, consiguiendo largas supervivencias en algunos pacientes con enfermedad diseminada41. No obstante, los RTOS han sido excluidos sistemáticamente de los ensayos clínicos con estos fármacos42, por lo que no disponemos de evidencia suficiente sobre su eficacia y seguridad en este contexto. Algunos trabajos ponen de manifiesto una respuesta aceptable al tratamiento combinado con inhibidores de BRAF y MEK en RTOS con melanoma avanzado BRAF mutado40,43. No obstante, varias investigaciones señalan que las lesiones de los RTOS tienen menos frecuentemente mutaciones en BRAF36,44. En la serie no publicada de nuestro grupo de RTOS tan solo el 29% tenían mutación en BRAF, frente al 54% descrito en los melanomas en la población general45. Es posible que el contexto de inmunosupresión y los propios tratamientos inmunosupresores puedan influir en una patogénesis diferencial en los melanomas de los RTOS44. Brocard et al., caracterizaron el estado mutacional de BRAF, C-KIT y NRAS en 20 melanomas desarrollados en RTOS36. La mutación en BRAF y NRAS la presentaron el 40 y el 23% de los melanomas, respectivamente. No encontraron mutaciones en c-kit. Como limitación, un número no despreciable de muestras fueron inadecuadas para el estudio molecular36. Por tanto, se requieren nuevos estudios para saber si las mutaciones presentes en los melanomas de RTOS son diferentes a las que se han descrito en IC, lo que ayudaría a identificar dianas terapéuticas potencialmente específicas.
Ante un RTOS con melanoma avanzado BRAF no mutado se debe considerar el tratamiento con inhibidores de checkpoint inmunológicos (ICI). Es preciso valorar minuciosamente los beneficios potenciales de estos tratamientos y el riesgo incrementado de rechazo del órgano trasplantado, siendo muy difícil encontrar el punto exacto para mantener este equilibrio46. La decisión debe tomarse en un comité multidisciplinar, incluyendo equipos de trasplante, oncólogos y dermatólogos17, sin olvidar la implicación del paciente, adecuadamente informado. La evidencia sobre el tratamiento con ICI en RTOS es escasa y procede de casos clínicos aislados o pequeñas series47–60. Recientemente Abdel-Wahab et al., publicaron la serie más extensa de RTOS que recibieron ICI, procedente de «The University of Texas MD Anderson Cancer Center»42. Los autores realizan, además, la primera revisión sistemática de la literatura42. En conjunto, analizan el desarrollo de un rechazo, la supervivencia y la respuesta tumoral de un total de 39 RTOS sometidos a inmunoterapia, de los que el 62% presentaban un melanoma metastásico. El 41% de los pacientes sufrieron rechazo tras una mediana de 21 días tras el inicio del ICI; un 81% de ellos perdieron finalmente el órgano trasplantado a pesar del tratamiento (aumento de la inmunosupresión y suspensión del ICI) (10 receptores de riñón y 3 de hígado). El porcentaje de rechazo con anti-CTLA-4 y anti-PD-1 fue similar, a diferencia de estudios previos que proponían que los anti-CTLA-4 podían ser más seguros56. De los 22 RTOS con melanoma metastásico incluidos en el análisis, el 64% tuvieron progresión tumoral y el 32% respuesta parcial o completa. Un trabajo reciente de Hurkmans et al., propone el uso de la detección de ADN libre procedente del donante en sangre como un método sensible a desarrollar para detectar de manera precoz el rechazo del órgano trasplantado en el contexto del uso de ICI61.
Se han utilizado con éxito algunas pautas inmunosupresoras para preservar el injerto en un receptor de riñón candidato a nivolumab por un adenocarcinoma de duodeno metastásico54 (tabla 4).
Pauta de inmunosupresión en trasplantados renales candidatos al uso de anti-PD-1
| Periodo en relación al inicio del anti-PD-1 | Tratamiento y dosis |
|---|---|
| Una semana antes | Prednisona: 40mg/día |
| Durante el tratamiento | Prednisona: 20mg/díaSirolimus (niveles objetivo): 4-6ng/ml |
| Una semana después | Prednisona: 20mg/día |
| >2 semanas y ≤6 meses | Prednisona: 10mg/díaSirolimus (niveles objetivo): 10-12ng/ml |
| >6 meses después del tratamiento | Prednisona: reducción progresiva hasta 5mg/díaSirolimus (niveles objetivo): 10-12ng/ml |
Fuente: adaptado de Barnett et al.54
Finalmente, Sunshine et al., trataron de manera satisfactoria a un paciente receptor de un riñón con melanoma y metástasis en tránsito con una combinación de imiquimod al 5% tópico junto con inyecciones de talimogene laherparepvec (T-VEC), sin ningún signo de rechazo62.
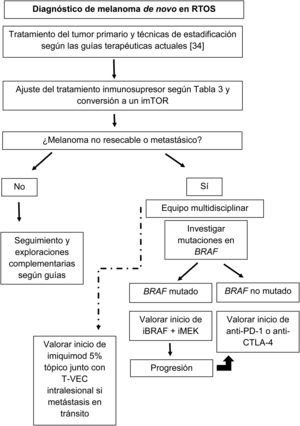
La figura 1 esquematiza nuestra propuesta de aproximación terapéutica a estos pacientes en base a la literatura revisada.
Controles dermatológicos en los receptores de un trasplante de órgano sólidoDado que el pronóstico de los RTOS con melanoma avanzado es significativamente peor que el de la población general y el riesgo de rechazo tras el uso de los ICI en estos pacientes es muy elevado, se requiere una vigilancia dermatológica estrecha para diagnosticarlos en estadios iniciales4. Estos pacientes deberían ser seguidos con una frecuencia determinada por su riesgo individual, con especial atención a aquellos con nevus displásicos y antecedentes personales o familiares de melanoma6,24. El seguimiento con dermatoscopia digital, incluyendo mapeos corporales y microscopía confocal son herramientas útiles para mejorar la ratio de exéresis entre lesiones benignas y malignas24. Los pacientes deben ser instruidos en el reconocimiento de lesiones sospechosas o recidivas de tumores en zonas de exéresis previas, en la necesidad de evitar la exposición solar recreativa y en la utilización continuada de fotoprotectores y otras medidas para minimizar la exposición solar17. Estas medidas de fotoprotección estrictas deberán ir acompañadas de una monitorización de los niveles de vitamina D, que deberá ser suplementada cuando haya deficiencia3,6. Por último, desde nuestro punto de vista sería ideal la exploración dermatológica pre-trasplante para evitar someter al paciente al trasplante con un melanoma. Sabemos que el periodo peritrasplante es el de mayor inmunosupresión, lo que podría aumentar el riesgo de progresión tumoral (fig. 2).
Melanoma procedente del donanteEventualmente el melanoma puede transmitirse al receptor a partir del órgano de un donante con antecedente de melanoma. Esto puede ocurrir como consecuencia de melanomas silentes en donantes que, en el contexto de inmunosupresión del receptor, puede diseminarse. También puede proceder de donantes, especialmente jóvenes, fallecidos por metástasis cerebrales de melanoma que fueron erróneamente diagnosticados como hemorragia cerebral o tumor cerebral primario. El riesgo estimado de que un donante tenga una neoplasia oculta es del 1,3%, siendo el riesgo de transmitirla al receptor del 0,2%6. El melanoma es el tumor procedente de donante con mayor riesgo de producir metástasis en el receptor. En la revisión se incluyeron 17 donantes con melanoma cuyos órganos fueron trasplantados a 44 receptores6. Treinta y cinco (80%) receptores desarrollaron melanoma tras 3-24 meses del trasplante. Treinta y tres pacientes (75%) fallecieron por el melanoma6,11. Esto supone excluir de la donación de órganos a cualquier donante con antecedente de melanoma. Además, se debe intentar examinar la superficie corporal total del donante en busca de lesiones sospechosas o cicatrices que sugieran el antecedente de un melanoma3,4.
En cuanto al tratamiento, la poca evidencia existente sugiere que se debe extirpar el órgano trasplantado junto a aquellas metástasis resecables y suspender la inmunosupresión. Este manejo tan solo es posible en el caso de receptores de riñón y no en receptores de órganos vitales, en los cuales el pronóstico es infausto, salvo que sea posible un nuevo trasplante4. Ante un RTOS que desarrolla un melanoma metastásico en el que dudamos si este pudiera proceder del donante, se pueden emplear técnicas de biología molecular como FISH, PCR o la secuenciación de repeticiones en tándem. Esta diferenciación tendrá importantes implicaciones pronósticas y terapéuticas. Además, en caso de proceder del donante, todos los receptores de otros órganos con la misma procedencia deberían ser sometidos a una intervención para extirpar el órgano trasplantado4.
ConclusionesA pesar de que la evidencia científica acerca del manejo de los RTOS con melanoma es escasa y basada en series de casos, sabemos que los pacientes diagnosticados en fases iniciales tienen un pronóstico similar a la población general. Por lo tanto, el papel del dermatólogo es esencial en el seguimiento postrasplante de estos pacientes, para diagnosticar melanomas finos. En los RTOS con melanoma avanzado queda mucho trabajo por hacer, ya que el pronóstico actualmente es peor que el de la población general. Dado que estos pacientes han sido excluidos de los ensayos clínicos con los ICI, las decisiones terapéuticas deben tomarse en comités multidisciplinares y contando siempre con el consentimiento informado del paciente, asumiendo un riesgo elevado de sufrir un rechazo agudo. Otro aspecto a investigar es el papel de la adyuvancia en los RTOS, que ha demostrado eficacia en términos de supervivencia en la población no inmunodeprimida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.