Dupilumab es una nueva terapia dirigida para la dermatitis atópica (DA) grave con una evidencia en la vida real aún limitada.
ObjetivoExplorar nuestra experiencia con dupilumab para la DA en práctica clínica en un centro terciario.
Material y métodoEstudio observacional retrospectivo y unicéntrico que incluye pacientes adultos y pediátricos con DA grave en tratamiento con dupilumab entre diciembre de 2017 y diciembre de 2021. La gravedad y la respuesta se evaluaron con las escalas Eczema Area and Severity Index (EASI), Pruritus Numerical Rating Scale y Sleep Disturbance Numerical Rating Scale.
ResultadosCincuenta y nueve pacientes recibieron dupilumab: 52, 48, 26 y 13 pacientes alcanzaron los 6, 12, 24 y 36 meses de tratamiento, respectivamente. La tasa de EASI-75 fue del 94,2; 95,8; 92,3 y 100% a los 6, 12, 24 y 36 meses, respectivamente. La tasa de EASI-90 fue del 63,5; 72,9; 84,6 y 92,3% a los 6, 12, 24 y 36 meses, respectivamente. La tasa de EASI <7 fue del 92,3; 91,7; 88,5 y 100% a los 6, 12, 24 y 36 meses, respectivamente. La Pruritus Numerical Rating Scale ≥4 fue del 86; 87,5; 92,3 y 100% a los 6, 12, 24 y 36 meses, respectivamente. La tasa de reducción Sleep Disturbance Numerical Rating Scale ≥4 fue del 82,7; 85,4; 100 y 100% a los 6, 12, 24 y 36 meses, respectivamente. Los eventos adversos fueron leves y ocurrieron en el 20,3% de los pacientes, todos adultos.
ConclusiónNuestros hallazgos apoyan el perfil favorable de eficacia y tolerabilidad de dupilumab en práctica clínica real. Dupilumab ofrece una respuesta rápida y mantenida, independientemente del uso de terapia combinada. Se requieren seguimientos más prolongados para evaluar su funcionamiento a largo plazo.
Dupilumab is a new targeted therapy for severe atopic dermatitis (AD) with limited real-world evidence.
ObjectiveExplore our experience with dupilumab for AD in clinical practice at a tertiary care center.
Material and methodUnicentric observational retrospective study including adult and pediatric patients with severe AD receiving dupilumab between December 2017 and December 2021. The Eczema Area and Severity Index (EASI) score, Pruritus Numerical Rating Scale (P-NRS) and Sleep disturbance Numerical Rating Scale (S-NRS) were recovered to assess severity and response.
ResultsFifty-nine patients received dupilumab: 52, 48, 26 and 13 patients reached 6, 12, 24 and 36 months of treatment, respectively. The EASI-75 response rates were 94.2%, 95.8%, 92.3% and 100% at months 6, 12, 24 and 36. The EASI-90 response rates were 63.5%, 72.9%, 84.6% and 92.3% at months 6, 12, 24 and 36. The EASI <7 response rates were 92.3%, 91.7%, 88.5% and 100% at months 6, 12, 24 and 36. The P-NRS ≥4 reduction rates were 86%, 87.5%, 92.3% and 100% at months 6, 12, 24 and 36. The S-NRS ≥4 reduction rates were 82.7%, 85.4%, 100% and 100% at months 6, 12, 24 and 36. Adverse events were mild and occurred in 20.3% of patients, all of them adults.
ConclusionOur findings support dupilumab's favorable efficacy and tolerability profile in clinical practice. Dupilumab offers a rapid and sustained response, regardless of combined therapy. Longer follow-ups are still required to adequately assess its performance.
La dermatitis atópica (DA) es un trastorno inflamatorio crónico de la piel frecuente entre la población adulta, con una prevalencia general entre el 2,2% y el 17,6% y con distintos grados de gravedad1. Las lesiones eccematosas, la xerosis y el prurito caracterizan esta enfermedad que suele comenzar durante la primera infancia, aunque puede aparecer de novo en adultos hasta en un 9-24,5% de los casos2. Esta afección puede afectar significativamente a la calidad de vida de los pacientes, sobre todo en los casos graves3. La fisiopatología de la DA implica una compleja interacción de factores humanos y ambientales y se centra, entre otros, en una vía T helper 2 (Th2) regulada y en el aumento de los niveles de interleucinas (IL)-4 y 134. Las directrices clínicas incluyen desde hace tiempo a los inmunosupresores sistémicos clásicos como opciones de tratamiento para la DA grave, tanto en niños como en adultos, sobre todo cuando los corticosteroides tópicos (CST) y los inhibidores tópicos de la calcineurina (ITC) son insuficientes. Los riesgos derivados de una amplia inmunosupresión y la necesidad de monitorización durante estos tratamientos han motivado la búsqueda de terapias dirigidas más seguras y eficaces5.
El dupilumab es un anticuerpo monoclonal que inhibe tanto la IL-4 como la IL-13 de manera simultánea mediante el antagonismo del receptor de la IL-4, que sirve de diana para ambas interleucinas implicadas en la vía Th26. Los ensayos clínicos que evalúan este fármaco con y sin terapia de fondo con corticosteroides tópicos han hallado resultados favorables en cuanto a su eficacia y seguridad para el tratamiento de la DA de moderada a grave6–8. Está aprobado por la Agencia Europea del Medicamento para su uso en la DA moderada-grave en pacientes de 6 meses o más, y ahora se incluye en las directrices europeas actuales como una opción para adultos y niños con DA grave5. Aunque el dupilumab parece ser una adición importante a nuestro arsenal terapéutico, los datos sobre su eficacia y seguridad en un entorno de la práctica clínica aún son limitados. Los estudios de práctica clínica publicados hasta este momento incluyen pacientes adultos que han sido seguidos durante periodos que oscilan en su mayoría entre las 4 y 16 semanas, con pocas series que alcanzan las 52 u 84 semanas de seguimiento9–14. Una serie multicéntrica informó recientemente sobre un seguimiento más prolongado de 156 semanas15.
En este trabajo, informamos sobre nuestra experiencia en la práctica clínica con el dupilumab para su uso en el tratamiento de la DA grave en adultos y niños en un centro de referencia terciario.
Materiales y métodoRealizamos un estudio retrospectivo observacional unicéntrico que incluyó a todos los pacientes con DA grave tratados con dupilumab en nuestro centro de referencia terciario entre diciembre del 2017 y diciembre del 2021. Este estudio fue aprobado por el comité de revisión institucional. Todos los pacientes incluidos cumplían los criterios diagnósticos de DA según la evaluación de los dermatólogos de nuestro centro16. Los datos de los pacientes se recuperaron de las historias clínicas electrónicas y al inicio del tratamiento. Los pacientes se clasificaron según el momento de inicio de la enfermedad (mayores o menores de 18 años) y el fenotipo clínico basal, distinguiendo entre fenotipo clásico (dermatitis predominantemente flexural o de cabeza y cuello), eritrodermia y lesiones exclusivamente pruriginosas. Se recuperaron los datos sobre los niveles séricos totales de inmunoglobulina E (IgE) antes del tratamiento. El valor máximo de los niveles de IgE determinado en nuestro laboratorio fue de 5000U/mL. También se clasificó a los pacientes en formas alérgicas y no alérgicas de DA según sus parámetros clínicos y niveles séricos totales de IgE17,18. Todos los pacientes eritrodérmicos fueron evaluados con análisis de sangre completos y biopsia cutánea para descartar micosis fungoide.
Al iniciar el dupilumab, los pacientes que ya recibían tratamiento sistémico mantuvieron o suspendieron este último en función de nuestra evaluación de su riesgo individual de empeoramiento. La duración de la terapia combinada se determinó en función del grado de control de su enfermedad. La terapia básica y las estrategias reactivas y proactivas tópicas con CST y ITC se mantuvieron según lo recomendado por las directrices europeas5. El régimen de tratamiento estándar con dupilumab fue de 600mg en la primera administración seguida de 300mg cada dos semanas para pacientes con un peso igual o superior a 40kg. Para los pacientes de menos de 40kg, el dupilumab se inició con una fase de inducción de 300mg en las semanas 0 y 2, seguida de 300mg mensuales. Excepcionalmente, en pacientes que respondían a la terapia pero cuya mejoría era parcial o no duraba hasta la siguiente dosis, se podía intensificar la terapia reduciendo el intervalo de dosificación a 300mg semanales.
Los parámetros clínicos que evaluaron la gravedad de la DA fueron la puntuación del Índice de Área y Gravedad del Eczema (EASI), la Escala de Calificación Numérica del Prurito (P-NRS) y la Escala de Calificación Numérica de los Trastornos del Sueño (S-NRS). La respuesta terapéutica se evaluó mediante las siguientes variables: Reducción de la puntuación EASI del 50% (EASI-50), 75% (EASI-75) y 90% (EASI-90), reducción significativa de la P-NRS y la S-NRS, definida como una reducción de 4 puntos, y consecución de un 0 o 1 en estas dos escalas (P-NRS 0/1 y S-NRS 0/1). La información sobre la respuesta terapéutica y los acontecimientos adversos se recuperó de las visitas de seguimiento en torno a las semanas 4, 12 y 24 y cada 6 meses a partir de entonces. En cuanto a los síntomas oculares, el término conjuntivitis se reservó para los pacientes que desarrollaron molestias oculares más cambios conjuntivales y que recibieron este diagnóstico tras una evaluación oftalmológica.
Los datos se procesaron con el programa «Statistical Package for the Social Sciences» versión 25 y la información se representó mediante figuras generadas con Microsoft Excel versión 16.35. Se realizó estadística descriptiva utilizando la media y el rango para expresar variables cuantitativas, y frecuencias absolutas y porcentajes para describir variables cualitativas. Se realizó un análisis estadístico para comparar la respuesta terapéutica entre los pacientes que iniciaban el dupilumab con y sin terapia combinada, fijando la significación en p<0,05. Las variables cualitativas se compararon mediante la prueba de la chi cuadrado y las variables cuantitativas se compararon mediante la prueba de la t de Student o la prueba de la U de Mann-Whitney para las variables que seguían una distribución normal o no normal, respectivamente.
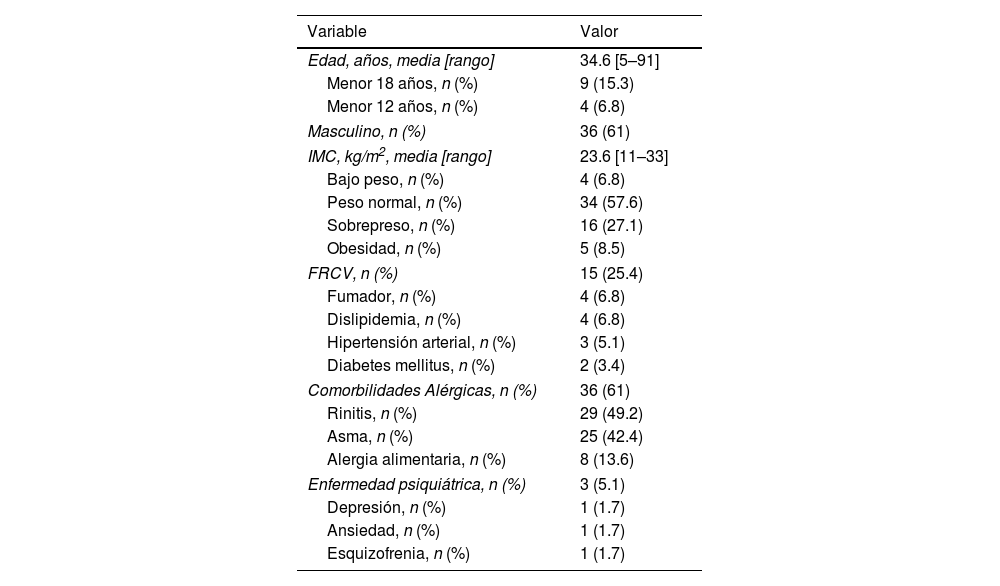
ResultadosUn total de 59 pacientes iniciaron tratamiento con dupilumab para la DA moderada-grave durante el periodo de estudio. Las características demográficas se muestran en la tabla 1. Se objetivaron cuatro pacientes (6,8%) menores de 12 años que recibían dupilumab fuera de indicación. Los datos sobre los antecedentes de DA de los pacientes se muestran en la tabla 2. De los 21 pacientes (35,6%) con enfermedad de inicio en la edad adulta, uno desarrolló DA durante la vejez. No hubo diferencias en las características basales entre los pacientes con inicio antes o después de los 18 años y entre las formas alérgica y no alérgica de la DA.
Características demográficas de los pacientes (n=59)
| Variable | Valor |
|---|---|
| Edad, años, media [rango] | 34.6 [5–91] |
| Menor 18 años, n (%) | 9 (15.3) |
| Menor 12 años, n (%) | 4 (6.8) |
| Masculino, n (%) | 36 (61) |
| IMC, kg/m2, media [rango] | 23.6 [11–33] |
| Bajo peso, n (%) | 4 (6.8) |
| Peso normal, n (%) | 34 (57.6) |
| Sobrepreso, n (%) | 16 (27.1) |
| Obesidad, n (%) | 5 (8.5) |
| FRCV, n (%) | 15 (25.4) |
| Fumador, n (%) | 4 (6.8) |
| Dislipidemia, n (%) | 4 (6.8) |
| Hipertensión arterial, n (%) | 3 (5.1) |
| Diabetes mellitus, n (%) | 2 (3.4) |
| Comorbilidades Alérgicas, n (%) | 36 (61) |
| Rinitis, n (%) | 29 (49.2) |
| Asma, n (%) | 25 (42.4) |
| Alergia alimentaria, n (%) | 8 (13.6) |
| Enfermedad psiquiátrica, n (%) | 3 (5.1) |
| Depresión, n (%) | 1 (1.7) |
| Ansiedad, n (%) | 1 (1.7) |
| Esquizofrenia, n (%) | 1 (1.7) |
IMC, índice de masa corporal; FRCV, factores de riesgo cardiovascular.
Características de los antecedentes de dermatitis atópica de los pacientes (n=59)
| Variable | Valor |
|---|---|
| Edad de inicio, años, media [rango] | 15.2 [1–88] |
| Menores de 18 años, n (%) | 38 (64.4) |
| Mayores de 18 años, n (%) | 21 (35.6) |
| Fenotipo clínico | |
| Clásico, n (%) | 49 (83.1) |
| Eritrodermia, n (%) | 7 (11.9) |
| Prurigo, n (%) | 3 (5.1) |
| Niveles basales de IgE, U/mL, media [rango] | 2703.6 [13–5000*] |
| Forma de la dermatitis atópica | |
| Alérgica | 53 (89.8) |
| No alérgica | 6 (10.2) |
| EASI basal, media [rango] | 29.6 [12–58] |
| P-NRS basal, media [rango] | 8.4 [4–10] |
| S-NRS basal, media [rango] | 7.1 [0–10] |
| Antecedentes de hospitalización, n (%) | 10 (16.9) |
| Terapia sistémica previa | |
| N° de terapias, media [rango] | 3.2 [1–8] |
| 1 o 2 terapias, n (%) | 26 (44.1) |
| 3 o más terapias, n (%) | 33 (55.9) |
| Corticosteroides, n (%) | 59 (100) |
| Ciclosporina A, n (%) | 49 (83.1) |
| Azatioprina, n (%) | 25 (42.4) |
| Metotrexate, n (%) | 19 (32.2) |
| Fototerapia, n (%) | 14 (23.7) |
| Micofenolato de mofetilo, n (%) | 3 (5.1) |
| Omalizumab, n (%) | 5 (8.5) |
| Inhibidor de IL-12/23, n (%) | 4 (6.8) |
| Inhibidor de IL-17C– ensayo clínico, n (%) | 3 (5.1) |
| Inhibidor de IL-13, n (%) | 3 (5.1) |
| Inhibidor de JAK, n (%) | 2 (3.4) |
| Terapia sistémica combinada, n (%) | 25 (42.4) |
| Ciclosporina A, n (%) | 13 (22) |
| Corticosteroides, n (%) | 9 (15.3) |
| Metotrexate, n (%) | 3 (5.1) |
| Azatioprina, n (%) | 1 (1.7) |
IgE, inmunoglobulina E; EASI, «Eczema Area and Severity Index»; P-NRS, escala de valoración numérica del prurito; S-NRS, escala de valoración numérica de los trastornos del sueño; IL, interleucina; JAK, Janus kinasa.
El dupilumab se inició en combinación con un fármaco sistémico clásico en 25 casos (42,4%). El fármaco concomitante se administró durante una duración media de 3 meses (rango 1-18) antes de continuar con dupilumab como monoterapia. Veinte pacientes (33,9%) recibieron el tratamiento combinado durante ≤3 meses, tres pacientes (5,1%) durante 3-6 meses y dos pacientes durante >6 meses (8 y 18 meses).
Los detalles sobre los fármacos concomitantes se muestran en la tabla 2. El dupilumab se administró siguiendo la pauta estándar en 57 casos (96,6%) y en los 2 restantes (3,4%) se intensificó a 300mg semanales; 1 por respuesta parcial y 1 por pérdida progresiva de mejoría tras una respuesta completa. El seguimiento medio fue de 23 meses (intervalo 3-48), con 52 pacientes (88,1%) que alcanzaron el punto temporal de 6 meses, 48 pacientes (81,4%) que alcanzaron el punto temporal de 12 meses y 26 pacientes (44,1%) que alcanzaron el punto temporal de 24 meses. Un total de 13 pacientes (22%) alcanzaron un seguimiento de 36 meses.
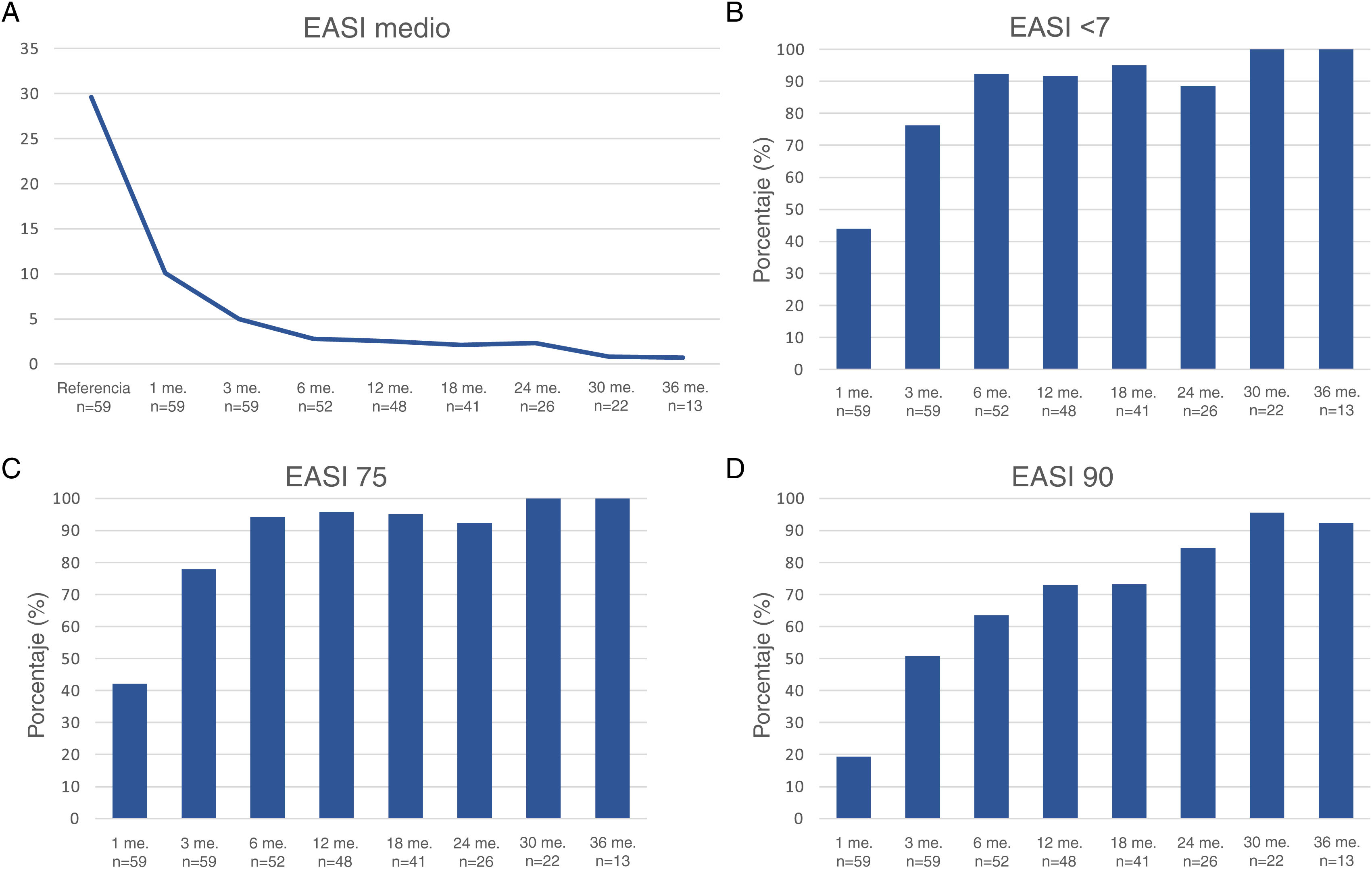
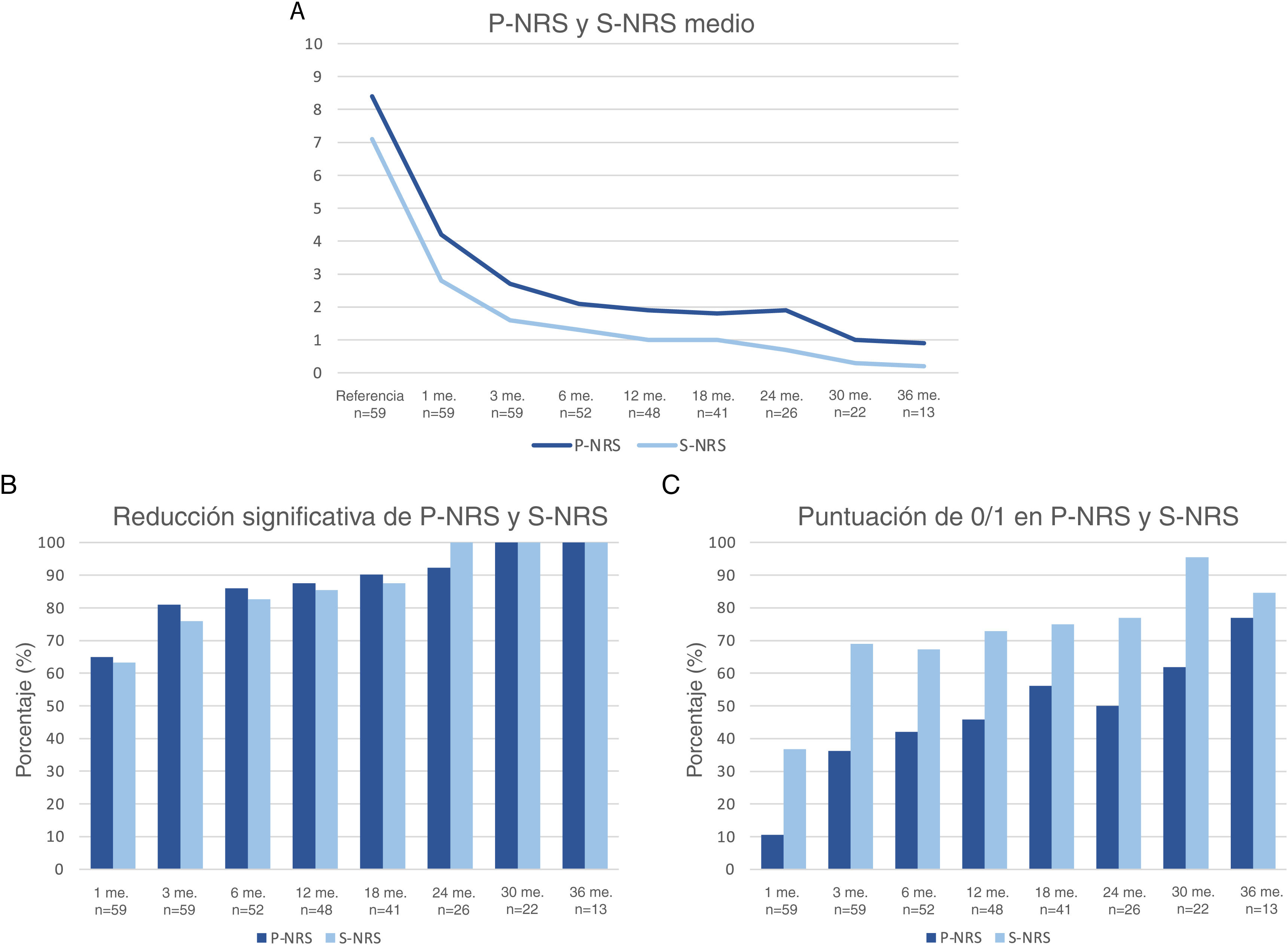
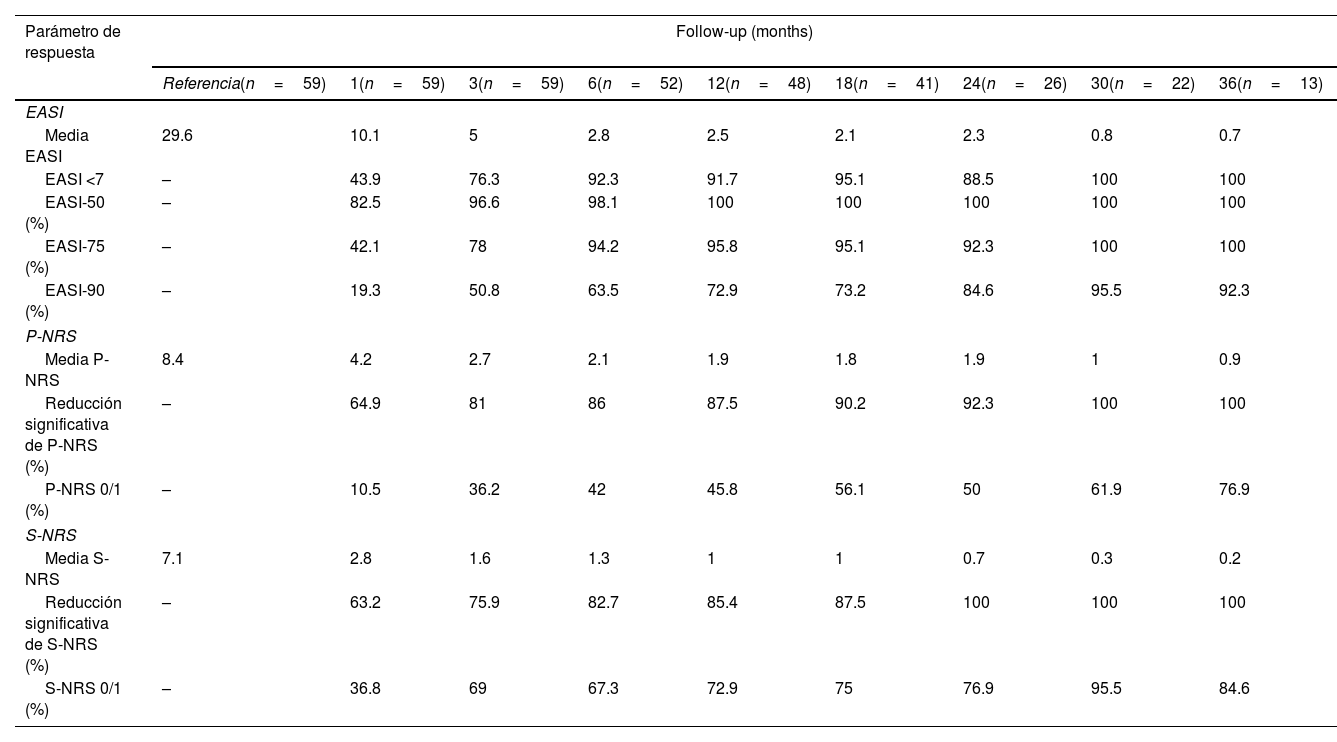
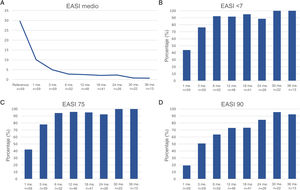
La respuesta terapéutica en términos de EASI medio, así como las tasas de respuesta EASI <7, EASI-75 y EASI-90 se ilustran en la fig. 1. La respuesta subjetiva en términos de P-NRS y S-NRS se ilustra en la fig. 2, incluidos los valores medios, las tasas de reducción significativa y las tasas de respuesta 0/1. Los valores exactos de la respuesta terapéutica en términos de EASI, P-NRS y S-NRS se muestran en la tabla 3.
Respuesta terapéutica al dupilumab en términos de los parámetros subjetivos Escala de Calificación Numérica del Prurito (P-NRS) y Escala de Calificación Numérica del Sueño (S-NRS) desde el inicio hasta el mes 36. (A) Evolución de las medias de P-NRS y S-NRS. (B) Tasas de reducción significativa de P-NRS y S-NRS. (C) Tasas de respuesta P-NRS 0/1 y S-NRS 0/1.
Respuesta terapéutica a dupilumab para la dermatitis atópica grave en términos de Índice de Área y Gravedad del Eczema (EASI), Escala de Calificación Numérica del Prurito (P-NRS) y Escala de Calificación Numérica del Sueño (S-NRS), desde el inicio hasta el mes 36
| Parámetro de respuesta | Follow-up (months) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Referencia(n=59) | 1(n=59) | 3(n=59) | 6(n=52) | 12(n=48) | 18(n=41) | 24(n=26) | 30(n=22) | 36(n=13) | |
| EASI | |||||||||
| Media EASI | 29.6 | 10.1 | 5 | 2.8 | 2.5 | 2.1 | 2.3 | 0.8 | 0.7 |
| EASI <7 | – | 43.9 | 76.3 | 92.3 | 91.7 | 95.1 | 88.5 | 100 | 100 |
| EASI-50 (%) | – | 82.5 | 96.6 | 98.1 | 100 | 100 | 100 | 100 | 100 |
| EASI-75 (%) | – | 42.1 | 78 | 94.2 | 95.8 | 95.1 | 92.3 | 100 | 100 |
| EASI-90 (%) | – | 19.3 | 50.8 | 63.5 | 72.9 | 73.2 | 84.6 | 95.5 | 92.3 |
| P-NRS | |||||||||
| Media P-NRS | 8.4 | 4.2 | 2.7 | 2.1 | 1.9 | 1.8 | 1.9 | 1 | 0.9 |
| Reducción significativa de P-NRS (%) | – | 64.9 | 81 | 86 | 87.5 | 90.2 | 92.3 | 100 | 100 |
| P-NRS 0/1 (%) | – | 10.5 | 36.2 | 42 | 45.8 | 56.1 | 50 | 61.9 | 76.9 |
| S-NRS | |||||||||
| Media S-NRS | 7.1 | 2.8 | 1.6 | 1.3 | 1 | 1 | 0.7 | 0.3 | 0.2 |
| Reducción significativa de S-NRS (%) | – | 63.2 | 75.9 | 82.7 | 85.4 | 87.5 | 100 | 100 | 100 |
| S-NRS 0/1 (%) | – | 36.8 | 69 | 67.3 | 72.9 | 75 | 76.9 | 95.5 | 84.6 |
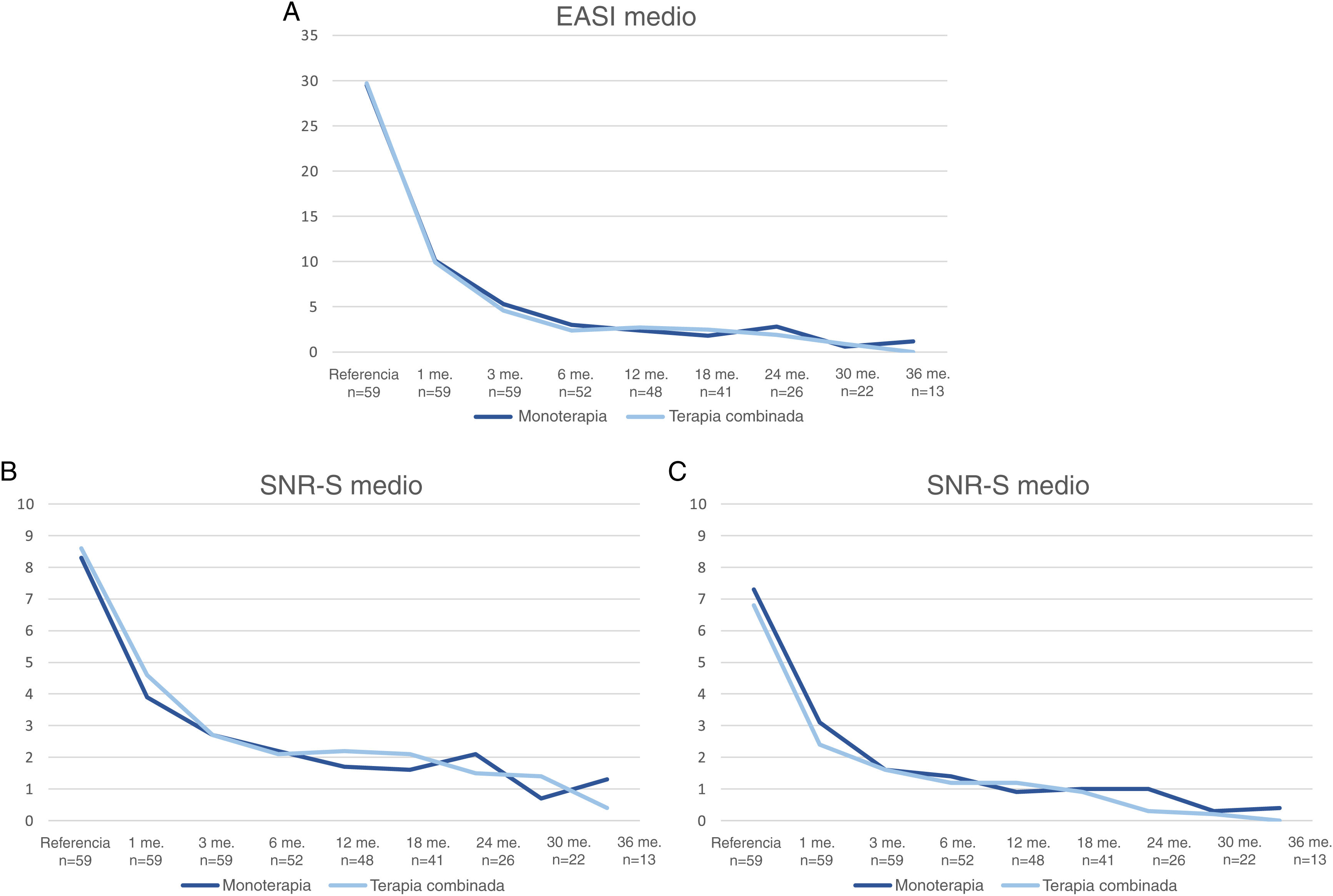
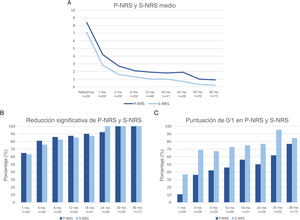
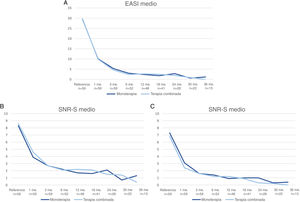
En la fig. 3 se muestra una comparación del cambio en los valores medios de EASI, P-NRS y S-NRS entre los pacientes que iniciaron dupilumab como monoterapia o en combinación con otro fármaco sistémico. El análisis estadístico no encontró diferencias significativas en los valores medios de EASI, P-NRS y S-NRS al inicio o en cualquiera de los puntos temporales. Otros análisis no hallaron diferencias estadísticamente significativas en las tasas de respuesta EASI <7, EASI-50, EASI-75 o EASI-90, reducción significativa de P-NRS y S-NRS, y consecución de P-NRS 0/1 y S-NRS 0/1, en ninguno de los puntos temporales. Tampoco se encontraron diferencias estadísticamente significativas en los parámetros de respuesta entre los pacientes con inicio menor o mayor de 18 años, entre los fenotipos clínicos y entre las formas alérgica y no alérgica de la DA.
Comparación entre los pacientes que iniciaron con dupilumab como monoterapia y en combinación con otro fármaco sistémico en cuanto a la media del Índice de Área y Gravedad del Eczema (EASI), la Escala de Calificación Numérica del Prurito (P-NRS) y la Escala de Calificación Numérica del Sueño (S-NRS), desde el inicio hasta el mes 36. (A) Evolución de la media del EASI. (B) Evolución de la P-NRS media. (C) Evolución de la S-NRS media.
En cuanto a la seguridad del fármaco, se identificaron acontecimientos adversos en 12 pacientes (20,3%). Ocho pacientes (13,6%) presentaron síntomas oculares; cuatro pacientes (6,8%) desarrollaron conjuntivitis y cuatro (6,8%) se quejaron de prurito ocular sin conjuntivitis. Cuatro de estos siete pacientes tenían antecedentes de rinoconjuntivitis alérgica. Los síntomas oculares se trataron con éxito con tratamientos tópicos y lágrimas artificiales. Se identificó un caso (1,7%) de cada uno de los siguientes acontecimientos adversos: psoriasis, eritema de cabeza y cuello, reacción en el lugar de inyección, infección por herpes simple, dispepsia, cefalea y astenia. Ninguno de los acontecimientos adversos fue grave y no motivaron la interrupción del dupilumab. Todos los acontecimientos adversos identificados se produjeron en los pacientes adultos.
Se tuvo que suspender el dupilumab en un total de siete pacientes (15,3%). Los motivos de interrupción fueron la gestación en dos pacientes (3,4%), la pérdida de respuesta en una paciente (1,7%) y la respuesta insuficiente en seis pacientes (10,2%), incluida una de las pacientes que recibía tratamiento intensificado. Seis de los siete pacientes que presentaron fracaso terapéutico habían recibido previamente sólo terapias sistémicas clásicas (corticosteroides y ciclosporina A). Un paciente no había respondido previamente al omalizumab y ninguno de ellos había recibido previamente inhibidores de JAK. El tratamiento se suspendió tras una duración media de 14,1 meses (rango 4-24). Ningún paciente tuvo que abandonar la terapia por problemas de tolerabilidad.
DiscusiónHasta la reciente introducción del dupilumab en nuestro arsenal terapéutico contra la DA, esta enfermedad ha necesitado durante mucho tiempo tratamientos específicos que ofrecieran altas tasas de eficacia y mejores perfiles de seguridad y tolerabilidad. El dupilumab parece satisfacer esta necesidad según los resultados comunicados en los ensayos clínicos6–8. Sin embargo, las condiciones de los ensayos clínicos suelen diferir de las del mundo real, lo que plantea la necesidad de evaluar su uso en la práctica clínica. Presentamos nuestra experiencia en práctica clínica con adultos y niños que reciben dupilumab para la DA grave. Las características demográficas y de la enfermedad de nuestra serie son similares a las de la mayor serie de práctica clínica publicada hasta la fecha19. Las puntuaciones medias del EASI fueron de 29,3 y 28, respectivamente, que también son comparables a las comunicadas en los ensayos clínicos6–8. Estos valores son indicativos de la gravedad de la DA de estos pacientes que, junto con la proporción de pacientes que no respondieron a terapias sistémicas previas, reflejan el perfil del paciente tratado con dupilumab en entornos de práctica clínica real12,19,20.
La evolución de las puntuaciones medias de EASI, P-NRS y S-NRS y las diferentes tasas de respuesta observadas en nuestra serie indican que, en general, los pacientes experimentaron una respuesta más rápida al dupilumab que la descrita en los ensayos clínicos8. Se observó una mejoría significativa desde el principio, con más del 80% de los pacientes que alcanzaron una reducción de EASI-50 ya después de 1 mes y más del 90% después de 3 meses. Las tasas de respuesta de EASI-75 y EASI-90, a pesar de ser resultados más exigentes, seguían reflejando la rapidez y la magnitud de esta mejoría; hasta un 75% y un 50% después de 3 meses, respectivamente. Estas tasas fueron similares, aunque ligeramente superiores, a los resultados agrupados para los puntos temporales de 1 y 3 meses comunicados en un metaanálisis reciente9. Esta rápida mejoría también se reflejó en las tasas de respuesta P-NRS y S-NRS como resultados subjetivos, especialmente en lo que respecta al prurito. Más del 60% y el 80% de los pacientes experimentaron una reducción significativa de la P-NRS tras sólo 1 y 3 meses de tratamiento, respectivamente.
Nuestros datos de seguimiento desde el mes 6 hasta el mes 36 indican que existe una respuesta sostenida al dupilumab tras la mejoría inicial, ya que la reducción del EASI-50 se mantuvo en todos los pacientes que continuaron el tratamiento durante 6 meses o más. Además, se observó una disminución gradual de las puntuaciones medias de EASI, P-NRS y S-NRS y un aumento progresivo de EASI-75, EASI-90 y de las tasas de reducción significativa de P-NRS y S-NRS a lo largo del tiempo. Esto se refleja en una mejora adicional con duraciones de tratamiento más prolongadas. La mayor serie con seguimiento prolongado que se informó sobre estos parámetros también describió tasas de respuesta muy favorables en términos de mejora del EASI-50 (97,2%), EASI-75 (73,3%), EASI-90 (37,5%) y P-NRS de ≥4 puntos (82,6%) después de 52 semanas12. Se encontraron tasas similares en otras grandes series de registros nacionales que alcanzaron 52 y 84 semanas de seguimiento13,14. Una serie multicéntrica con 156 semanas de seguimiento informó de tasas elevadas de respuesta en términos de reducción de la SCORAD (SCORing Atopic Dermatitis) y de la VAS (Visual Analogue Scale) del prurito (88,2% y 77,1%, respectivamente)15. Cabe destacar el efecto del dupilumab sobre el prurito, ya que las tasas de reducción significativa de la P-NRS en nuestra serie se sitúan sistemáticamente por encima del 85% desde el mes 6 hasta el mes 36. Además, observamos que casi el 50% de los pacientes que alcanzaron los 24 meses de tratamiento presentaban una puntuación P-NRS de 0/1, es decir, un estado de prurito nulo o mínimo. En opinión de los autores, esto es especialmente significativo dada la importancia del prurito en el curso de la DA y lo difícil que suele ser controlarlo. El fenotipo eritrodérmico de la DA es una forma interesante de esta enfermedad para la que aún hay pocas pruebas en cuanto a la respuesta a los tratamientos. Los siete pacientes eritrodérmicos de este estudio lograron una respuesta EASI-90 tras una media de 7 meses y siete pacientes alcanzaron puntuaciones P-NRS y S-NRS de 0/1 tras una media de 14 y 8 meses, respectivamente. Su respuesta favorable objetiva y subjetiva no difirió de la de los fenotipos clásico o prurigo.
La respuesta a lo largo del tiempo de los pacientes que iniciaron el dupilumab solo fue similar a la de los pacientes que recibieron terapia combinada, como se observa en los datos mostrados en la fig. 3. Dado que el fármaco sistémico concomitante sólo se administró durante los primeros 1-3 meses en la mayoría de los pacientes, resulta interesante que la disminución de la media del EASI, la P-NRS y la S-NRS fuera comparable durante este periodo. Dado que el análisis estadístico no encontró diferencias significativas en los parámetros medios ni en las tasas de respuesta estudiadas, parece que los pacientes pueden experimentar una rápida mejoría al iniciar dupilumab independientemente de que reciban o no un tratamiento combinado. Creemos que la decisión de iniciar dupilumab en combinación con otro fármaco sistémico no debe estar motivada por la necesidad de una respuesta más rápida, sino que debe depender únicamente del grado previo de control o estabilidad de la enfermedad.
El perfil de seguridad y tolerabilidad de dupilumab fue favorable, ya que nuestra tasa observada de acontecimientos adversos fue del 20,3% y no se identificaron acontecimientos adversos graves. Esto coincide con lo notificado en la serie más amplia hasta la fecha, en la que los datos de 534 pacientes también respaldan el buen perfil de seguridad del dupilumab. No obstante, la tasa de acontecimientos adversos varía significativamente, hasta el 71%, entre las distintas series reales de la literatura9,21. Cabe destacar que ninguno de los acontecimientos adversos se produjo entre los pacientes menores de 18 años o entre los usos no indicados por debajo de los 12 años, lo que respalda los hallazgos realizados hasta la fecha sobre su seguridad y tolerabilidad en niños22–24.
Se ha prestado especial atención a los efectos adversos oculares, en particular la conjuntivitis, dadas las tasas notificadas en los ensayos clínicos6–8. La incidencia de conjuntivitis en la práctica clínica oscila entre un 6% y un 70%, dependiendo del estudio9,25. Aunque generalmente son leves, las formas graves pueden llevar a la interrupción del dupilumab26,27. En nuestra experiencia, sólo cuatro pacientes (6,8%) desarrollaron conjuntivitis verdadera. Estos pacientes presentaron formas leves que se resolvieron con un tratamiento tópico. La variabilidad en la incidencia de conjuntivitis podría deberse, entre otros factores, a los diferentes criterios diagnósticos y a la participación de un oftalmólogo en el diagnóstico28,29. No obstante, su relación causal, más que temporal, está aún por establecer y los posibles mecanismos y predictores de su desarrollo no están claros19,30. Encontramos pocos acontecimientos adversos no oculares, todos ellos ya descritos en la literatura9,22.
En cuanto a la interrupción del dupilumab por fracaso terapéutico, cabe destacar que no pudimos asociar esta falta de respuesta al fracaso previo a otros biológicos o inhibidores de JAK. Esto quizá se deba a la disponibilidad del dupilumab antes de la introducción de estos últimos en nuestro arsenal terapéutico.
Nuestros hallazgos deben interpretarse teniendo en cuenta las limitaciones de este estudio, incluyendo su carácter observacional y retrospectivo, el seguimiento corto en un subconjunto de pacientes, el tamaño limitado de la muestra y la falta de pacientes control.
En conclusión, este trabajo apoya el perfil favorable de eficacia y seguridad del dupilumab para el tratamiento de la DA grave en la práctica clínica, tanto en adultos como en niños. El dupilumab ofrece una rápida mejoría de las lesiones clínicas y del prurito, con o sin tratamiento concomitante. Esta respuesta es sostenida y puede ir seguida de nuevas mejoras con el tiempo. Los acontecimientos adversos suelen ser leves, lo que hace del dupilumab una opción tolerable y conveniente para pacientes que, de otro modo, requerirían inmunosupresores amplios. Aún son necesarios seguimientos más prolongados para evaluar adecuadamente su rendimiento y desarrollar estrategias futuras en el tratamiento a largo plazo de la DA con dupilumab.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.