Los angiofibromas faciales son tumoraciones hamartomatosas íntimamente relacionadas con el complejo de la esclerosis tuberosa, y representan uno de los criterios mayores para el diagnóstico de la enfermedad. Su aparición desde edades tempranas en la región facial, así como su naturaleza fibrovascular, producen importantes repercusiones físicas y psicológicas en estos pacientes, lo que ha motivado la utilización de múltiples tratamientos para su eliminación o mejora. Sin embargo, no existen guías de tratamiento que permitan establecer un protocolo de actuación común en este tipo de pacientes.
El objetivo de este artículo es revisar los tratamientos utilizados hasta la fecha para los angiofibromas faciales en función de la evidencia científica demostrada e intentar aportar un protocolo terapéutico.
Facial angiofibromas are hamartomatous growths that are closely associated with tuberous sclerosis complex and, in fact, they constitute one of the main diagnostic criteria for that disease. These lesions composed of blood vessels and fibrous tissue appear on the face at an early age. Since they have important physical and psychological repercussions for patients, several treatment options have been used to remove them or improve their appearance. However, the lack of treatment guidelines prevents us from developing a common protocol for patients with this condition.
The present article aims to review the treatments for facial angiofibromas used to date and to propose a new evidence-based treatment protocol.
La esclerosis tuberosa (ET) es una genodermatosis de herencia autosómica dominante y expresividad variable que se caracteriza por la formación multisistémica de tumoraciones hamartomatosas1. Los genes supresores tumorales TSC1 y TSC2 codifican las proteínas hamartina y tuberina, las cuales forman un complejo que inhibe el mammalian target of rapamycin (mTOR), proteína fundamental en la regulación de la proliferación y diferenciación celular. El amplio espectro clínico de la ET se debe a la presencia de mutaciones en los genes TSC1 o TSC2, que al producir una disregulación del mTOR, dan lugar a una proliferación celular descontrolada y, por tanto, a la aparición de hamartomas en diferentes localizaciones como la piel, el cerebro, los riñones, los pulmones, el corazón y los ojos2.
Entre las manifestaciones cutáneas de la enfermedad destacan los angiofibromas faciales (AF), las máculas hipopigmentadas «en hoja de fresno», la placa de piel chagrín, los fibromas periungueales y el recientemente descrito hamartoma colágeno y foliculoquístico3.
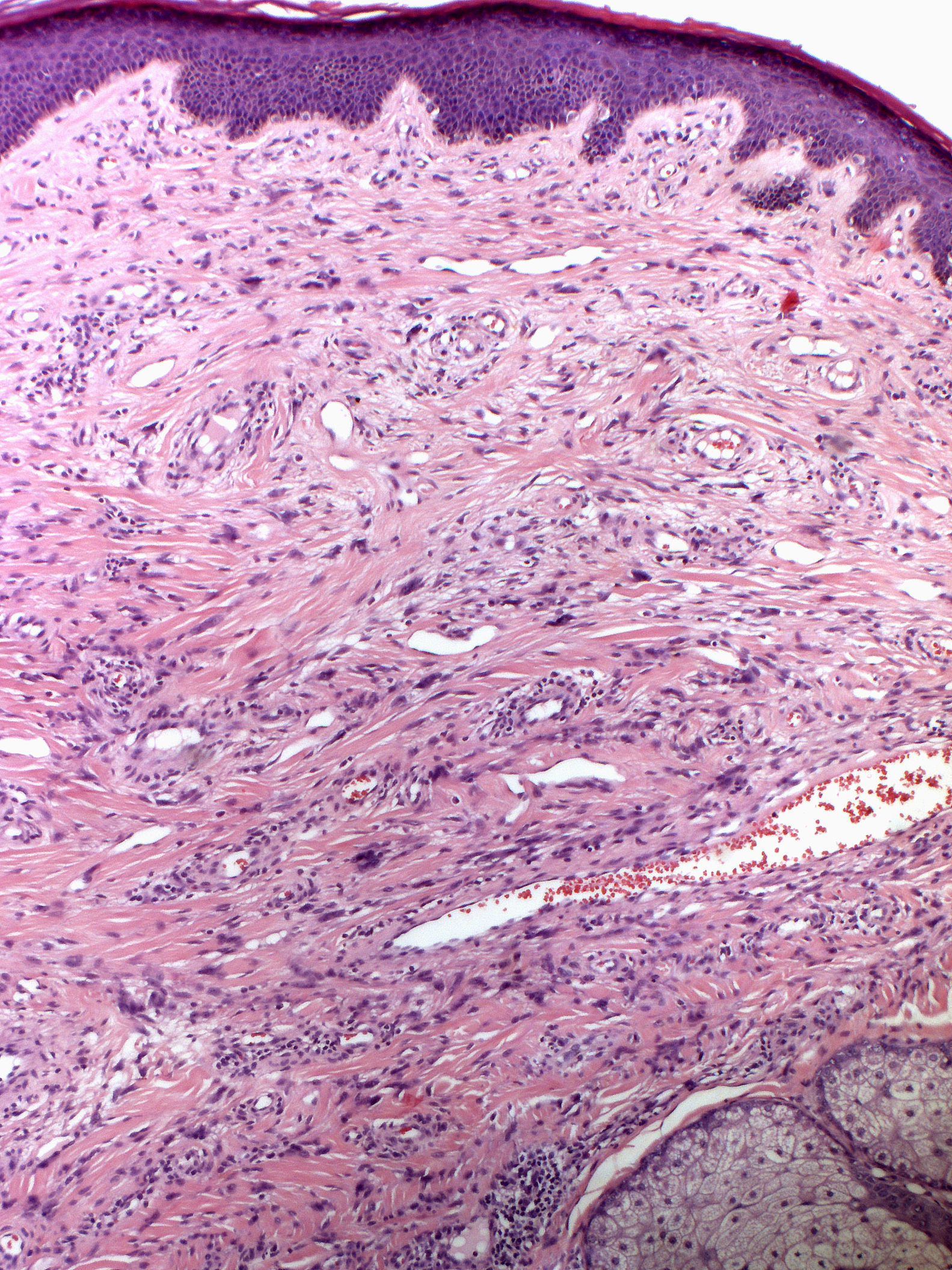
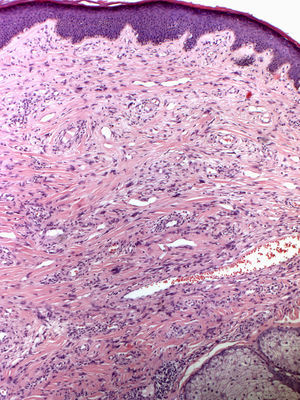
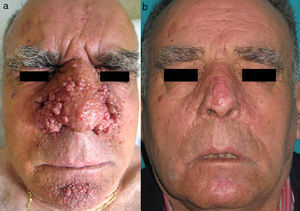
En 1880 Bourneville incluyó bajo el nombre de acné-rosácea a las lesiones faciales que presentaban los pacientes con ET, formando la característica tríada clínica junto al retraso mental y las convulsiones4. Posteriormente, Pringle5 acuñó el término de adenoma sebaceum para describir estas tumoraciones. Con el desarrollo de la histopatología esta denominación se abandonó por su carácter confuso, ya que no se trata de una proliferación adenomatosa de glándulas sebáceas, sino una proliferación dérmica de fibroblastos y fibras de colágeno acompañada de un aumento de vasos dilatados de superficie irregular6 (fig. 1). Estos hallazgos morfológicos han llevado a la sustitución de los antiguos y erróneos términos por el de AF.
Los AF son tumoraciones hamartomatosas que aparecen en forma de múltiples pápulas eritemato-rosadas de pequeño tamaño con tendencia a confluir formando placas. Suelen afectar de forma bilateral y simétrica la región centrofacial y, característicamente, los surcos nasolabiales. Se han descrito casos aislados de presentación de AF unilaterales, asociados o no a otras manifestaciones de ET, que podrían corresponder a formas segmentarias de ET7,8.
Aparecen hasta en el 80% de los pacientes y representan uno de los criterios mayores en el diagnóstico de la ET9. Su aparición se inicia entre los 2 y 5 años de edad y aumentan progresivamente en número y tamaño hasta estabilizarse tras la adolescencia.
Aunque los AF se relacionan estrechamente con la ET pueden aparecer formando parte de otras entidades como la neurofibromatosis tipo 210, el síndrome de Birt-Hogg-Dubé11 o la neoplasia endocrina múltiple tipo 112. Aunque es una condición excepcional, los AF múltiples bilaterales pueden presentarse sin relación con manifestaciones sistémicas13.
Las repercusiones tanto físicas (obstrucción nasal, sangrados tras traumatismos mínimos) como psicológicas (problemas emocionales y de autoimagen)14,15 que ocasionan los AF, han motivado la utilización de múltiples tratamientos para su eliminación y mejorar así la calidad de vida de estos pacientes.
Material y métodosSe realizó una búsqueda bibliográfica en las bases de datos MEDLINE, EMBASE, Medicina en Español (MEDES), Índice Médico Español (IME) y en la biblioteca Cochrane. Se revisaron los artículos, en inglés o español, publicados en el periodo comprendido entre 1992 y agosto de 2012, así como las referencias de los mismos. También se consultaron los ensayos clínicos en marcha en la página Web http://www.clinicaltrial.gov
ResultadosTan solo existe un estudio aleatorizado y controlado en el tratamiento de los AF asociados a ET. El resto de tratamientos disponibles hasta la fecha se fundamentan en los datos extraídos de series cortas o casos aislados. Además, todos los métodos de medición de la severidad y la respuesta al tratamiento son subjetivos, y tan solo uno ha mostrado datos de fiabilidad intra e interobservador16.
Tratamientos físicosDesde la descripción de la ET se han utilizado diversos tratamientos físicos para la corrección de los AF. Estas modalidades terapéuticas tienen la característica común de ser invasivos y, por tanto, dolorosos, por lo que requieren el uso de anestesia. Aunque pueden alcanzar buenos resultados, especialmente en pacientes con afectación severa, están sujetos a posibles complicaciones como cicatrices hipertróficas, trastornos de la pigmentación o infecciones posquirúrgicas. Además su éxito depende en gran medida de la pericia del dermatólogo y de su experiencia previa en el uso de la técnica.
RadiofrecuenciaLa ablación por radiofrecuencia ha sido utilizada en 2 pacientes adultos de fototipos altos con buenos resultados, aunque con desarrollo de hiperpigmentación postinflamatoria y reaparición de las lesiones17,18.
CrioterapiaEl uso de la crioterapia para el tratamiento de AF ha sido publicado de forma anecdótica en la literatura, con tan solo 3 casos aislados19,20. Este método presenta la ventaja de no requerir anestesia, ser barato y de fácil aplicación, pero requiere sesiones repetidas, la colaboración del paciente (que en muchos casos no es posible por las alteraciones psicológicas propias de la ET) y tiene unos resultados limitados.
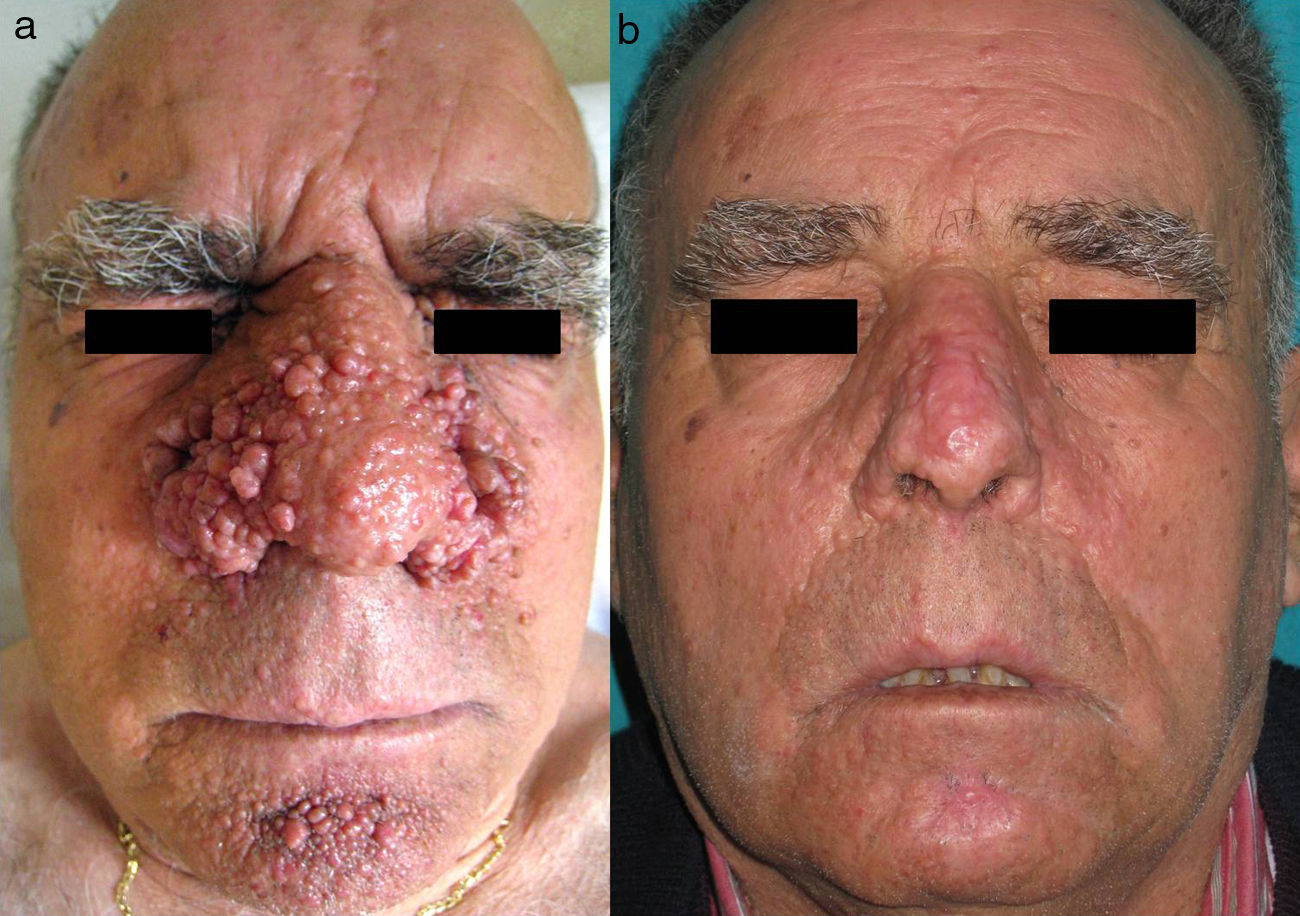
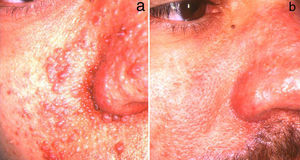
ElectrocoagulaciónLa electrocoagulación ha sido utilizada para el tratamiento de AF de gran tamaño con buena respuesta (fig. 2). No obstante, la obtención de buenos resultados depende en gran medida de la experiencia del dermatólogo, presentando un riesgo elevado de cicatrices y otras complicaciones posquirúrgicas. Por esta razón se han desarrollado técnicas más específicas que nos permiten controlar la potencia eléctrica de una forma más precisa. Capurro21 obtuvo buenos resultados a largo plazo en un paciente con AF mediante el uso de Timed-surgery, un dispositivo electroquirúrgico con el que se pueden establecer los parámetros de energía y tiempo de emisión.
DermoabrasiónLa dermoabrasión ha sido utilizada por varios autores con buenos resultados22–25. La técnica requiere de extirpación previa por afeitado de las lesiones de mayor tamaño y posterior dermoabrasión del resto bajo anestesia general. El riesgo de hiperpigmentaciones postinflamatorias, cicatrices y recurrencia a medio-largo plazo es muy elevado. Para intentar evitar estas complicaciones, así como para minimizar el tiempo de cicatrización, algunos autores han propuesto el uso de autoinjertos epidérmicos cultivados26 o dermis artificiales27. Hori et al.26 utilizaron injertos epidérmicos autólogos cultivados tras el afeitado y dermoabrasión de AF múltiples de gran tamaño en 5 pacientes adultos. Evidenciaron una rápida reepitelización sin mostrar complicaciones. No obstante, el proceso requiere anestesia general y estrecha colaboración del paciente para la supervivencia del injerto, por lo que varios pacientes tuvieron que ser sedados durante el postoperatorio. Las lesiones mostraron un recrecimiento tras 4-5 años de la realización de la técnica, con la necesidad de retratamiento en 2 de los pacientes.
Tratamientos con láserEl desarrollo del láser y su introducción en Dermatología ha permitido el abordaje de múltiples enfermedades con una mayor precisión, obteniendo excelentes resultados y disminuyendo los efectos adversos.
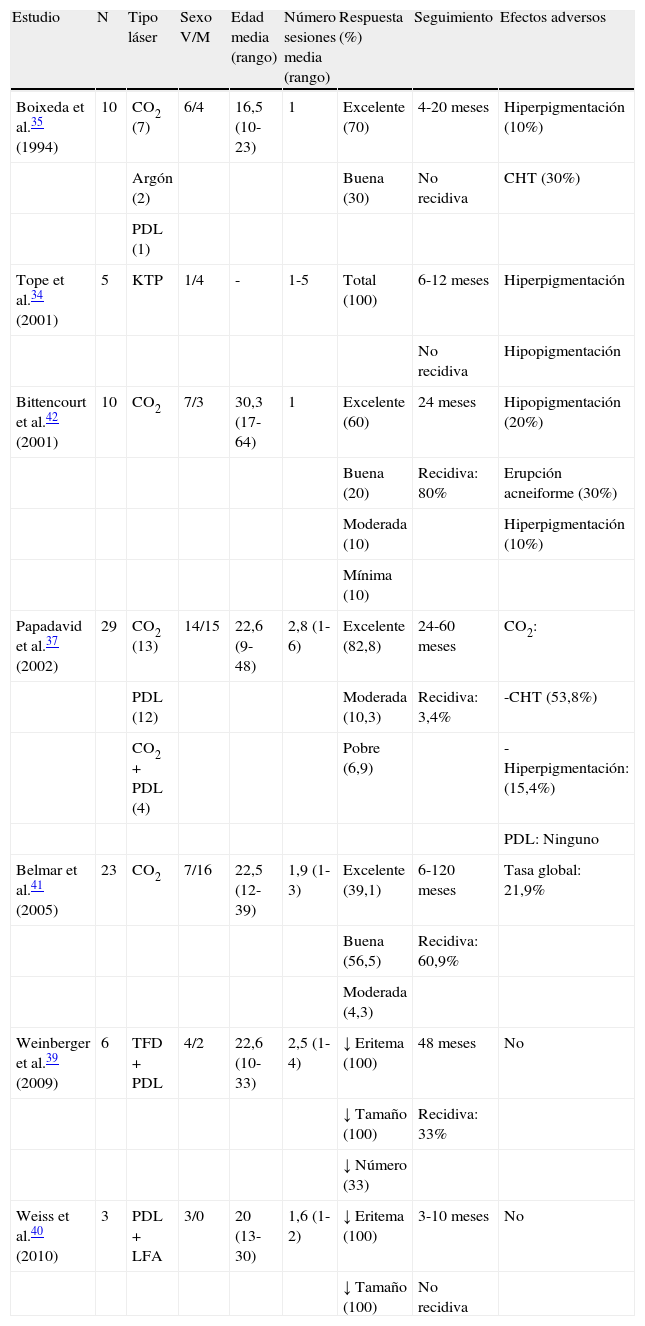
Para el tratamiento de los AF se han utilizado diferentes tipos de láser. Los primeros en emplearse fueron los láseres ablativos de argón28,29 y de CO230,31. Basados en la teoría de la fototermólisis selectiva, y con la aparición de nuevos equipos como el láser de vapor de cobre32, el láser de argón, potasio-titanil-fosfato (KTP)33,34 y, especialmente, el láser de colorante pulsado (PDL)35–38, numerosos autores han utilizado estos tipos de láser para el tratamiento de los AF. Posteriormente, el PDL se ha asociado a otras fuentes de luz como la terapia fotodinámica con ácido 5-aminolevulínico39 o los sistemas fraccionales40 con buenos resultados. En la tabla 1 se resumen todos los estudios publicados con más de 2 pacientes con AF tratados con diferentes modalidades de láser34,35,37,39–42.
Series de casos publicadas de pacientes con angiofibromas faciales tratados con láser
| Estudio | N | Tipo láser | Sexo V/M | Edad media (rango) | Número sesiones media (rango) | Respuesta (%) | Seguimiento | Efectos adversos |
| Boixeda et al.35 (1994) | 10 | CO2 (7) | 6/4 | 16,5 (10-23) | 1 | Excelente (70) | 4-20 meses | Hiperpigmentación (10%) |
| Argón (2) | Buena (30) | No recidiva | CHT (30%) | |||||
| PDL (1) | ||||||||
| Tope et al.34 (2001) | 5 | KTP | 1/4 | - | 1-5 | Total (100) | 6-12 meses | Hiperpigmentación |
| No recidiva | Hipopigmentación | |||||||
| Bittencourt et al.42 (2001) | 10 | CO2 | 7/3 | 30,3 (17-64) | 1 | Excelente (60) | 24 meses | Hipopigmentación (20%) |
| Buena (20) | Recidiva: 80% | Erupción acneiforme (30%) | ||||||
| Moderada (10) | Hiperpigmentación (10%) | |||||||
| Mínima (10) | ||||||||
| Papadavid et al.37 (2002) | 29 | CO2 (13) | 14/15 | 22,6 (9-48) | 2,8 (1-6) | Excelente (82,8) | 24-60 meses | CO2: |
| PDL (12) | Moderada (10,3) | Recidiva: 3,4% | -CHT (53,8%) | |||||
| CO2+PDL (4) | Pobre (6,9) | -Hiperpigmentación: (15,4%) | ||||||
| PDL: Ninguno | ||||||||
| Belmar et al.41 (2005) | 23 | CO2 | 7/16 | 22,5 (12-39) | 1,9 (1-3) | Excelente (39,1) | 6-120 meses | Tasa global: 21,9% |
| Buena (56,5) | Recidiva: 60,9% | |||||||
| Moderada (4,3) | ||||||||
| Weinberger et al.39 (2009) | 6 | TFD+PDL | 4/2 | 22,6 (10-33) | 2,5 (1-4) | ↓ Eritema (100) | 48 meses | No |
| ↓ Tamaño (100) | Recidiva: 33% | |||||||
| ↓ Número (33) | ||||||||
| Weiss et al.40 (2010) | 3 | PDL+LFA | 3/0 | 20 (13-30) | 1,6 (1-2) | ↓ Eritema (100) | 3-10 meses | No |
| ↓ Tamaño (100) | No recidiva |
CHT: cicatrices hipertróficas; KTP: potasio-titanil-fosfato; LFA: láser fraccional ablativo; N: número de pacientes; PDL: láser de colorante pulsado; V/M: varones/mujeres.
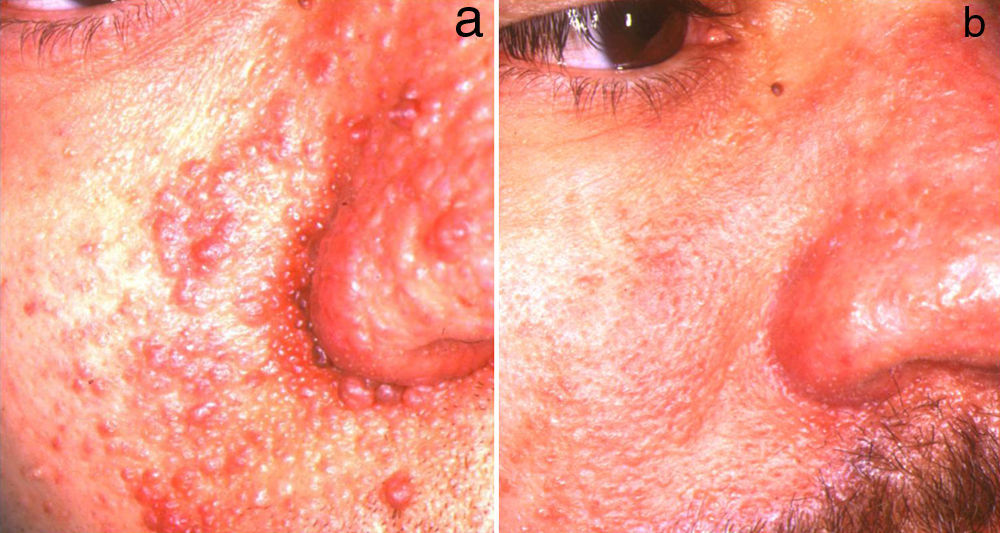
El láser de CO2 ha demostrado eficacia tanto en la modalidad de emisión continua como en la superpulsada con resultados similares (fig. 3). La acción ablativa de este láser ha permitido el tratamiento de AF de mayor tamaño y la realización de resurfacing más profundos, lo que incrementa la eficacia, con el inconveniente aumento de complicaciones como cicatrices hipertróficas, que pueden llegar a aparecer hasta en un 53,8% de los casos37. Salvo en lesiones localizadas en las que puede hacerse bajo anestesia local, la necesidad de anestesia general es la norma. En el estudio con el periodo de seguimiento más largo41 la tasa de recidiva fue del 60,9%, con un tiempo medio de reaparición de 3 años. La recidiva se iniciaba como un aumento del volumen de las lesiones con posterior incremento de su número, hecho observado de forma más precoz en pacientes menores de 20 años. Bittencourt et al.42 trataron 10 pacientes con láser de CO2 mostrando 3 tendencias en cuanto a la respuesta y su mantenimiento a largo plazo. Los 2 primeros grupos evidenciaron una buena respuesta al tratamiento a los 6 meses, manteniéndose la eficacia a largo plazo en uno de ellos y reapareciendo las lesiones en el otro. El tercer grupo presentó una respuesta pobre desde el inicio.
El importante componente vascular de los AF ha impulsado la utilización del PDL para su tratamiento. Papadavid et al.37 obtuvieron buenos resultados en 16 pacientes con AF que tenían un prominente componente vascular. Se observó una mejoría del eritema en más del 90% de los pacientes. Sin embargo, el componente fibroso no mostró disminución, por lo que a más de la mitad de los pacientes se les tuvo que asociar electrocirugía o láser de CO2. Los pacientes en edad pediátrica tratados con PDL fueron los que presentaron mejores resultados, sin mostrar signos de recidiva tras un seguimiento de 2-5 años.
Aunque no existen ensayos clínicos ni estudios prospectivos, las tendencias mostradas en la literatura sugieren que el tratamiento con PDL puede beneficiar a los pacientes jóvenes con AF de gran componente vascular y de menor volumen, mientras que el tratamiento con láser de CO2 sería especialmente útil en aquellos pacientes que presenten un componente fibroso más acusado.
Tratamientos médicosAunque los tratamientos físicos han sido la tónica general a la hora de elegir una terapia para los AF, también se han utilizado algunos fármacos en casos aislados. Recientemente el uso de nuevas formulaciones tópicas ha abierto una nueva perspectiva terapéutica en el tratamiento de los AF.
TranilastTranilast (ácido N-[3,4-dimetoxi-cinamoil] antranílico) es un fármaco antialérgico aprobado en 1982 en Japón y Corea del Sur para el tratamiento del asma bronquial. El descubrimiento de sus propiedades antiproliferativas por la inhibición de factores de crecimiento como el TGF-β y la disminución de la secreción de citocinas por los mastocitos, así como la inhibición de la secreción de la metaloproteinasa de la matriz extracelular, han posibilitado posteriores indicaciones para el tratamiento de queloides y cicatrices hipertróficas43.
Wang et al.44 trataron 3 pacientes adultos con esclerosis tuberosa con tranilast oral en dosis creciente de 1 a 5mg/kg peso/día durante 3 años. Dos pacientes mostraron mejoría del eritema y disminución del tamaño de los AF. También se apreció una reducción de los fibromas periungueales en 2 de los pacientes tratados, aunque ninguno mostró mejoría de las máculas acrómicas. Los autores no observaron efectos adversos. La falta de seguimiento de estos pacientes impide establecer la posibilidad de recrecimiento de las lesiones tras la suspensión del tranilast.
PodofilotoxinaLa podofilotoxina es un derivado alcaloide utilizado desde hace años para el tratamiento de verrugas genitales y queratosis actínicas. Tan solo existe un caso publicado sobre el uso de podofilotoxina para AF asociados a ET45. Los autores utilizaron una solución de podofilotoxina al 25% aplicada mensualmente durante 3 meses, obteniendo una respuesta parcial. El único efecto adverso observado fue sensación de quemazón con la aplicación del preparado.
Sirolimus (rapamicina)Sirolimus es una molécula que pertenece al grupo de los denominados inhibidores del mTOR. Su uso está aprobado en la actualidad para la prevención del rechazo de órganos en pacientes sometidos a un trasplante renal y como recubrimiento de stents coronarios.
El mecanismo de acción molecular del sirolimus es conocido de forma parcial. Su acción inmunosupresora se fundamenta en el bloqueo de la fase G1 a la fase S del ciclo celular de los linfocitos T, obstaculizando la activación de los linfocitos T y la producción de anticuerpos. Por otra parte, su actividad antitumoral se basa en la normalización de la señalización de la vía del mTOR (aumentada de forma aberrante en las células tumorales) y en la actividad antiangiogénica al disminuir los niveles de factor de crecimiento endotelial vascular46.
Estos efectos antiproliferativos del sirolimus y sus análogos (everolimus, temsirolimus, ridaforolimus) han motivado la realización de ensayos clínicos para diversas enfermedades tumorales46–54.
Hofbauer55 y Tarasewicz56 describieron una importante mejoría en los AF de 2 pacientes con ET sometidos a un trasplante renal tras la administración oral de sirolimus para la profilaxis del rechazo. Este hecho ha sido refrendado en un ensayo clínico realizado posteriormente46, en el que los autores observaban una mejoría subjetiva de los AF en el 57% de los pacientes tras 52 semanas de tratamiento oral con sirolimus. No obstante, los potenciales efectos adversos de sirolimus no justificarían su uso oral en pacientes con AF sin otras alteraciones asociadas.
Haemel et al.57 publicaron el primer caso de AF tratados con sirolimus formulado tópicamente. Apoyados en un modelo animal58, y con los datos de seguridad derivados de un ensayo clínico realizado en pacientes con psoriasis59, desarrollaron una pomada de sirolimus al 1%, con la que observaron una reducción en el tamaño y eritema de las lesiones tras 3 meses de tratamiento. Posteriormente han sido publicados 59 casos más con diferentes pautas posológicas y resultados16,57,60–67.
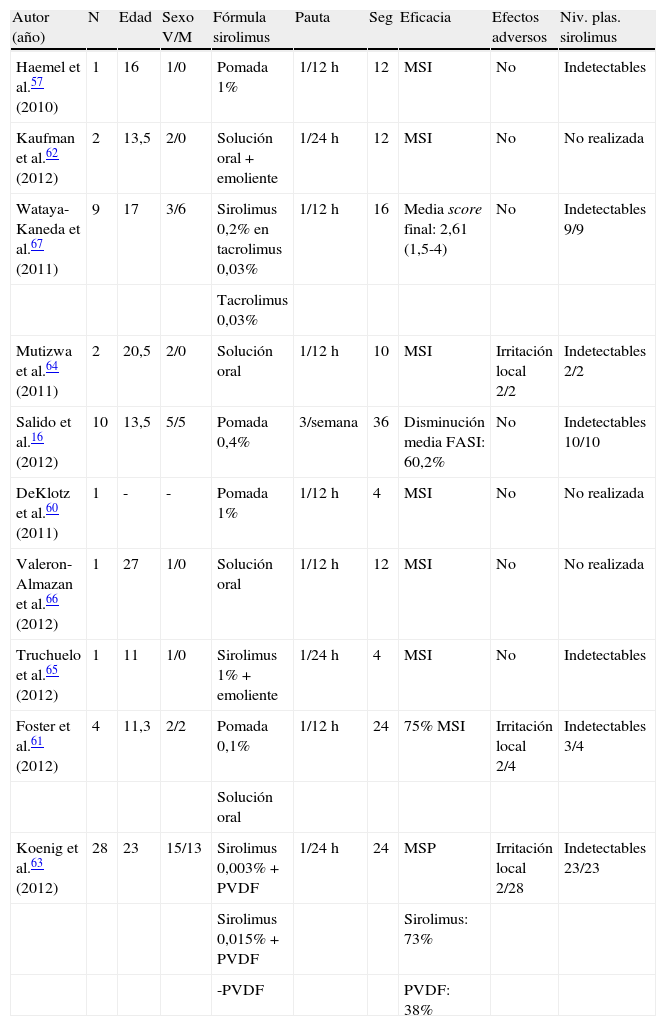
Esta heterogeneidad de las formulaciones empleadas y su posología, así como la inexistencia de sistemas de medición comunes para evaluar la respuesta al tratamiento, han dificultado extraordinariamente la interpretación de los datos resultantes (tabla 2). Tan solo en 2 trabajos16,67 han utilizado escalas sistematizadas en las que se valore el eritema, tamaño, extensión o relieve de los AF, de las cuales solo el Facial Angiofibroma Severity Index ha presentado datos de fiabilidad inter e intraobservador16.
Artículos publicados sobre el tratamiento de angiofibromas faciales con sirolimus tópico
| Autor (año) | N | Edad | Sexo V/M | Fórmula sirolimus | Pauta | Seg | Eficacia | Efectos adversos | Niv. plas. sirolimus |
| Haemel et al.57 (2010) | 1 | 16 | 1/0 | Pomada 1% | 1/12h | 12 | MSI | No | Indetectables |
| Kaufman et al.62 (2012) | 2 | 13,5 | 2/0 | Solución oral+emoliente | 1/24h | 12 | MSI | No | No realizada |
| Wataya-Kaneda et al.67 (2011) | 9 | 17 | 3/6 | Sirolimus 0,2% en tacrolimus 0,03% | 1/12h | 16 | Media score final: 2,61 (1,5-4) | No | Indetectables 9/9 |
| Tacrolimus 0,03% | |||||||||
| Mutizwa et al.64 (2011) | 2 | 20,5 | 2/0 | Solución oral | 1/12h | 10 | MSI | Irritación local 2/2 | Indetectables 2/2 |
| Salido et al.16 (2012) | 10 | 13,5 | 5/5 | Pomada 0,4% | 3/semana | 36 | Disminución media FASI: 60,2% | No | Indetectables 10/10 |
| DeKlotz et al.60 (2011) | 1 | - | - | Pomada 1% | 1/12h | 4 | MSI | No | No realizada |
| Valeron-Almazan et al.66 (2012) | 1 | 27 | 1/0 | Solución oral | 1/12h | 12 | MSI | No | No realizada |
| Truchuelo et al.65 (2012) | 1 | 11 | 1/0 | Sirolimus 1%+emoliente | 1/24h | 4 | MSI | No | Indetectables |
| Foster et al.61 (2012) | 4 | 11,3 | 2/2 | Pomada 0,1% | 1/12h | 24 | 75% MSI | Irritación local 2/4 | Indetectables 3/4 |
| Solución oral | |||||||||
| Koenig et al.63 (2012) | 28 | 23 | 15/13 | Sirolimus 0,003%+PVDF | 1/24h | 24 | MSP | Irritación local 2/28 | Indetectables 23/23 |
| Sirolimus 0,015%+PVDF | Sirolimus: 73% | ||||||||
| -PVDF | PVDF: 38% |
Edad: edad (media) expresada en años; MSI: mejoría subjetiva evaluada por el investigador; MSP: mejoría subjetiva evaluada por el paciente; N: número de pacientes; Niv. plas. sirolimus: niveles plasmáticos de sirolimus; PDF: fluoruro de polivinilideno; Seg: seguimiento en semanas; V/M: varones/mujeres.
Wataya-Kaneda et al.67 realizaron el primer estudio controlado con sirolimus tópico. Evaluaron la respuesta en 9 pacientes en los que se trató una hemicara con una fórmula de sirolimus 0,2% en pomada de tacrolimus 0,03% en comparación con la otra, que fue tratada solamente con pomada de tacrolimus 0,03%. Los autores cuantificaron la eficacia del tratamiento creando un score resultado de la suma de la mejoría observada en el eritema, tamaño y grosor de los AF. En caso de apreciarse una mejoría del 80% se asignaba un valor de 2, un punto si la mejoría era del 50-80% y 0,5 puntos en caso de que fuera del 20-50%. El score medio final de los 9 pacientes incluidos fue de 2,6 en la hemicara tratada con sirolimus y de 0,5 en la tratada con tacrolimus (p<0,001).
Recientemente se ha publicado un ensayo clínico controlado de 28 pacientes63 que se trataban con una composición de sirolimus y fluoruro de polivinilideno (PVDF), polímero aglutinante utilizado como vehículo para favorecer la oclusión del preparado y la absorción del principio activo. Se aleatorizaron 3 grupos de tratamiento a los que se les asignó sirolimus al 0,015%, 0,003% o PVDF una vez al día durante 24 semanas. Los autores no encontraron diferencias estadísticamente significativas entre los grupos de tratamiento, aunque de los 23 pacientes que completaron el estudio el 73% de los que habían recibido tratamiento referían sentirse mejor con respecto al inicio por tan solo el 38% en el grupo placebo. No se detectaron niveles plasmáticos de sirolimus ni alteraciones en el hemograma. Uno de los pacientes desarrolló un shock séptico tras una neumonía por aspiración secundaria a una crisis comicial. No obstante, este estudio presenta importantes limitaciones. Los autores no definen la gravedad inicial de las lesiones, no utilizan un método de evaluación de la eficacia por parte del investigador y no realizan controles intermedios durante el tratamiento para monitorizar la evolución de los pacientes.
Puesto que no existen preparados tópicos de sirolimus comercializados, se han desarrollado fórmulas magistrales a diferentes concentraciones a partir del producto obtenido tras la trituración y tamizado de los comprimidos de sirolimus disponibles (Rapamune®)60. Posteriormente, la utilización de sirolimus en polvo ha mejorado considerablemente las propiedades organolépticas de la fórmula y abaratado su coste68. La solución oral de sirolimus (1mg/ml) disponible en el mercado también ha sido utilizada, tanto aplicada directamente sobre las lesiones61,64–66 como mezclada con emolientes62.
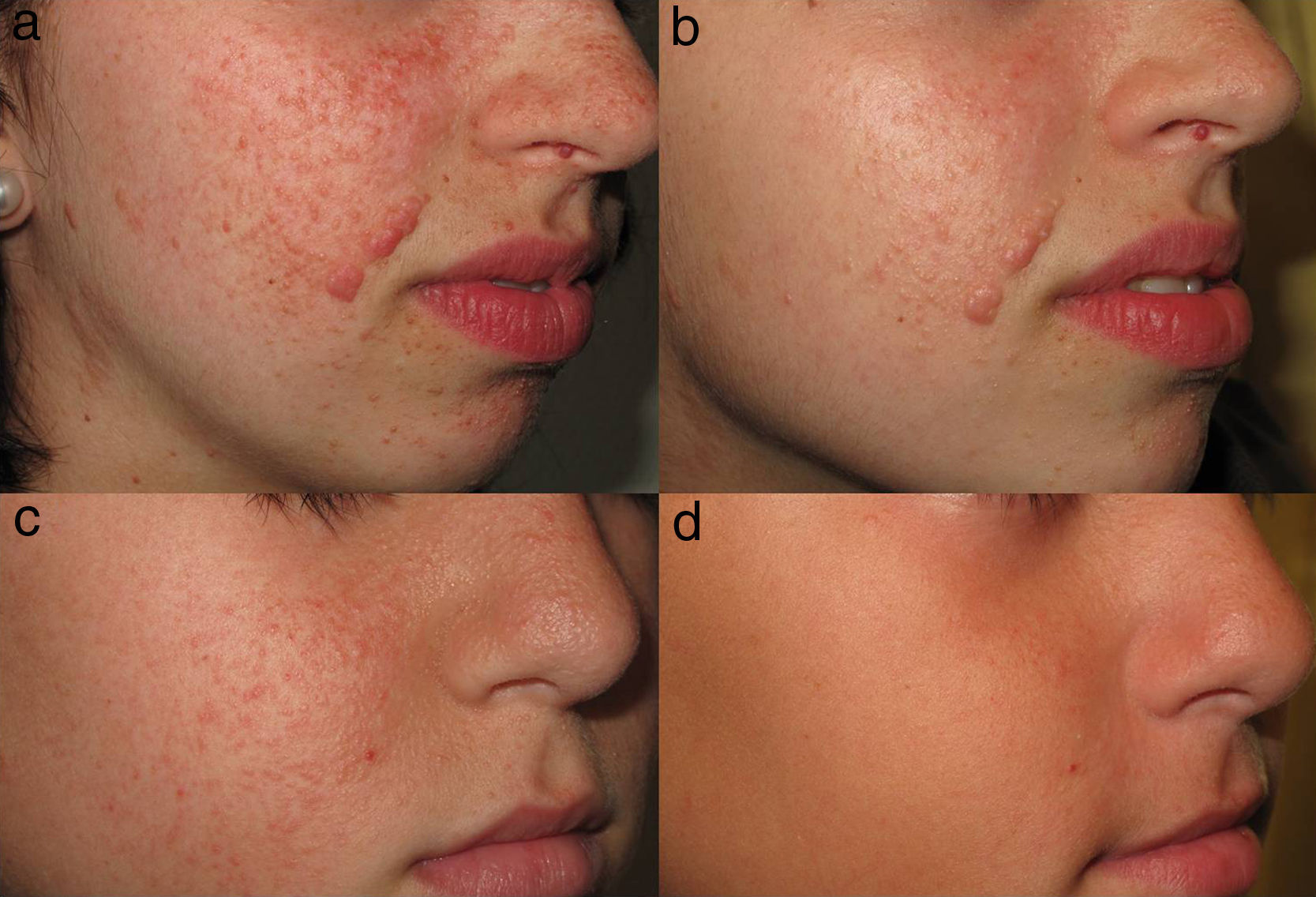
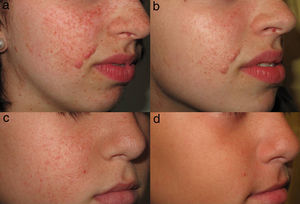
El tratamiento tópico con sirolimus ha mostrado una disminución del tamaño de los AF, y una reducción precoz del eritema (fig. 4). Se ha sugerido una mayor eficacia en los pacientes de menor edad16,61. Sin embargo, estas tendencias observadas deben ser demostradas mediante la realización de estudios con mayor muestra.
Los artículos publicados han mostrado un buen perfil de seguridad. Tan solo se han detectado 6 casos de irritación local, 4 de ellos en relación con la aplicación directa de la solución oral de sirolimus (1mg/ml) y los 2 restantes con la fórmula de sirolimus en PVDF. No se han notificado efectos adversos sistémicos y los niveles plasmáticos de sirolimus se han mantenido por debajo de los límites de detección en 49 de los 50 pacientes a los que se les realizó la determinación. Solo uno de los pacientes presentaba niveles de sirolimus en sangre, manteniéndose lejos de los valores terapéuticos y del rango de toxicidad61.
El uso de sirolimus y everolimus se ha asociado con una posible obstaculización en el proceso de cicatrización69,70, por lo que se recomienda evitar la aplicación de sirolimus tópico en heridas.
El aumento de incidencia de linfomas y cáncer de piel sugerido inicialmente en pacientes tratados con sirolimus oral71, ha sido refutado por diversos artículos que han demostrado tanto una disminución global de la incidencia de cánceres en pacientes tratados con sirolimus a largo plazo72, como una reducción específica de las tasas de linfomas73 y cáncer cutáneo no melanoma74.
No existen datos sobre la posibilidad de recrecimiento de los AF tras la suspensión del tratamiento. Tan solo uno de los trabajos publicados ha observado una reaparición del eritema un mes tras la retirada de la fórmula67.
Sirolimus tópico también ha sido empleado en 2 pacientes con máculas hipomelanóticas asociadas a ET, obteniendo la desaparición de las mismas tras 3 meses de tratamiento75.
Otros fármacos inhibidores de mTOR han mostrado también eficacia en el tratamiento de los AF. En un ensayo clínico con everolimus para el tratamiento de astrocitomas subependimarios de células gigantes se observó una mejoría subjetiva de los AF en 13 de los 15 pacientes incluidos50. No hay artículos publicados sobre su posible uso tópico.
El desarrollo de nuevos inhibidores de mTOR, como temsirolimus o ridaforolimus, utilizados actualmente para el tratamiento de cánceres de diversas estirpes48,49, podría tener un papel en el control de las manifestaciones cutáneas de la ET.
ConclusionesTodavía hoy en día es difícil realizar un intento de sistematización de los tratamientos empleados para los AF. La baja prevalencia de estas tumoraciones ha condicionado la existencia de ensayos clínicos y la utilización de las diversas alternativas terapéuticas en pacientes aislados o series cortas.
Tradicionalmente, los tratamientos empleados para los AF han consistido en técnicas invasivas con posibilidad de complicaciones y secuelas permanentes. La cirugía, electrocoagulación, crioterapia, peelings químicos y el láser han sido los tratamientos más utilizados. En los últimos años, la aparición de sirolimus ha revolucionado el campo del tratamiento de los AF. Su uso de forma tópica, para evitar potenciales efectos adversos derivados de su uso sistémico, ha mostrado una gran seguridad. Hasta la fecha, los pacientes tratados con sirolimus tópico han mostrado unos datos de eficacia esperanzadores, tanto en la reducción del eritema como en del tamaño de las lesiones.
En nuestra experiencia con sirolimus tópico hemos observado una rápida respuesta al tratamiento en la práctica totalidad de los pacientes. En pocos días se observa una reducción del eritema y posteriormente una disminución progresiva del tamaño y extensión de las lesiones. Además, hemos encontrado mejores resultados en pacientes jóvenes con AF de pequeño tamaño y volumen, que pueden llegar a experimentar una resolución completa con el tratamiento. Por contra, los pacientes adultos con lesiones de mayor componente fibroso responden de forma más lenta y alcanzan resultados inferiores. La estabilización de los AF tras la adolescencia podría influir en esta respuesta favorable de los pacientes más jóvenes. Estos hallazgos también han sido observados por otros autores61, lo que permite definir como posible perfil de buenos respondedores a los pacientes jóvenes con AF de componente eritematoso más desarrollado que el fibroso y con lesiones no muy sobreelevadas.
Los tratamientos físicos siguen manteniéndose vigentes hoy día a pesar de las posibles complicaciones que puedan presentar. Los pacientes con afectación severa que presentan una desfiguración importante son los que mayor beneficio pueden obtener de estas técnicas. Aunque los resultados suelen ser satisfactorios, la posibilidad de recidiva es bastante alta. La combinación de tratamientos de láser o dermoabrasión con sirolimus tópico de mantenimiento, una vez se haya alcanzado la completa cicatrización, podría resultar de gran utilidad en estos pacientes con un mayor grado de severidad.
El considerable control del gasto farmacéutico por parte de instituciones públicas y entidades privadas puede representar una limitación y condicionar el uso de estos tratamientos debido a su elevado coste. Las fórmulas utilizadas inicialmente se elaboraban a partir de comprimidos de sirolimus oral, lo que unido a las concentraciones y pautas usadas representaba un coste mensual por paciente muy alto. La posterior adquisición del principio activo como producto en polvo a través de laboratorios farmacéuticos a un precio mucho menor, así como la disminución de las concentraciones utilizadas, ha posibilitado el abaratamiento de los costes para la preparación de la fórmula. Este hecho ha permitido que la relación coste-beneficio sea muy favorable y pueda extenderse su uso continuado a los pacientes con AF.
Por contra, el elevado coste de los tratamientos con láser, tanto por la necesidad de disponibilidad del equipo como de un quirófano con anestesia general y hospitalización posterior, dificulta la accesibilidad de este tratamiento a los pacientes.
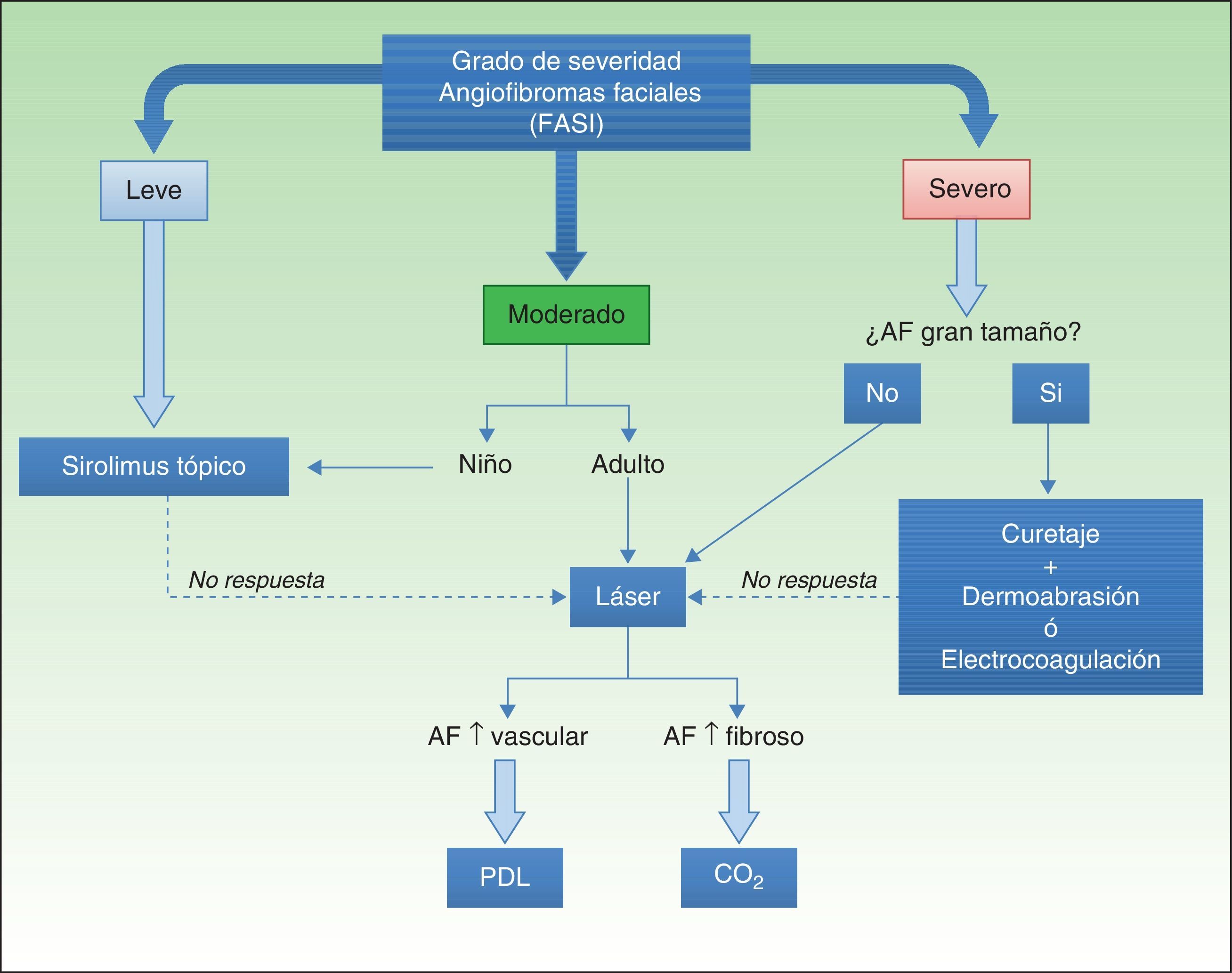
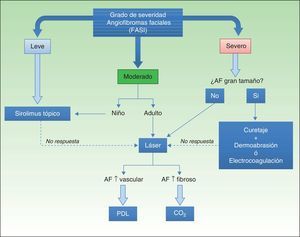
La irrupción de sirolimus tópico ha permitido mejorar significativamente el aspecto de los pacientes con AF evitando las posibles complicaciones derivadas de los tratamientos clásicos. En función de los datos publicados y aportando la experiencia de nuestro grupo proponemos un algoritmo para el manejo de los AF (fig. 5). La existencia de ensayos clínicos en marcha76, y el diseño de futuros ensayos comparativos, posibilitará la obtención de datos de seguridad y eficacia con un mayor nivel de evidencia científica para el establecimiento de una indicación más precisa del tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Al Dr. Juan Salvatierra, del Servicio de Anatomía Patológica del Hospital Universitario Reina Sofía.