En la actualidad se conoce que todos los fármacos biológicos, incluidos los de estructura totalmente humana, son capaces de inducir una respuesta inmune por parte del huésped, conocida como inmunogenicidad. La presencia de anticuerpos antifármaco puede condicionar los niveles y la función del fármaco y, por lo tanto, el efecto terapéutico e incluso el perfil de seguridad en función de su mecanismo de acción —neutralizante o no neutralizante— y/o de un aclaramiento acelerado. La inmunogenicidad es un factor dinámico a tener en cuenta en la terapia biológica de la psoriasis, en particular en el tratamiento a largo plazo, y en la evaluación de la pérdida secundaria de respuesta. El conocimiento y manejo de la inmunogenicidad de los distintos tratamientos biológicos representa un instrumento útil no solo en la optimización de las estrategias terapéuticas para cada fármaco, sino también en el diseño de modelos predictivos de respuesta, e incluso en la personalización de la terapia.
It is now known that all biologic drugs, even those that are fully human, are immunogenic, that is, they have the ability to induce an immune response in the treated patient. Since the presence of antidrug antibodies may influence the levels and function of the drug in the body, this immune response can alter the efficacy of the biologic treatment and even its safety profile, depending on the mechanism of action (neutralizing or nonneutralizing) and/or an accelerated clearance of the drug. Immunogenicity is a dynamic factor that should be taken into account when prescribing biologic therapy in psoriasis, especially in the case of long-term treatment and when assessing secondary loss of response. An understanding of the immunogenicity of biologic therapies and how this can be managed is useful not only for optimizing the treatment strategy used with each drug, but also for designing predictive models of response and even for tailoring therapy on a case-by-case basis.
Conforme avanzamos en el manejo de la terapia biológica de la psoriasis emergen nuevos conceptos que pueden ser, en el largo plazo, al menos tan trascendentes como la propia eficacia intrínseca del fármaco lo es durante las primeras semanas. Transcurridos unos años desde los primeros ensayos clínicos —ya en fase abierta o finalizados— y con una creciente experiencia clínica disponible conocemos cómo, en algunos pacientes, los impresionantes resultados de los primeros meses de tratamiento se atenúan más adelante, sin que cambien la molécula o el receptor, haciendo necesarios cambios en la dosificación, asociaciones o incluso cambios terapéuticos. En este punto es lícito preguntarse qué ha cambiado con respecto al inicio del tratamiento que pueda explicar esta evolución. De hecho, la naturaleza especial de los fármacos biológicos, que justifica sus peculiaridades y ventajas desde el punto de vista de eficacia y seguridad, asegura por otro lado una interacción constante y dinámica de 2 entidades biológicas: el receptor del fármaco y la propia molécula. Uno de los factores que condiciona el devenir de esta relación dinámica —sin duda no el único y quizás tampoco necesariamente el más importante en todos los casos— es el conocido como inmunogenicidad.
Más allá de la aridez que para el dermatólogo clínico pueda presuponer el propio concepto y su desarrollo, lo cierto es que la inmunogenicidad es una cuestión de gran actualidad que facilita la comprensión de algunos aspectos fundamentales del manejo de los fármacos biológicos en la psoriasis y en otras indicaciones. De este modo, no solo permite explicar, al menos en parte, algunos de los aspectos dinámicos que condicionan la eficacia y seguridad de la terapia biológica, sino que podría representar —por el momento en un futuro próximo— incluso una oportunidad para optimizar la respuesta de los pacientes.
ConceptoLa inmunogenicidad se define como la capacidad de una determinada sustancia para inducir una respuesta inmune específica, humoral o celular, y es el resultado de diferencias en la estructura tridimensional de cualquier molécula exógena frente a las proteínas propias1.
Los anticuerpos son glucoproteínas secretadas desde las células plasmáticas, forman parte del sistema inmunológico adaptativo y representan el resultado de millones de años de evolución del sistema de defensa, capaz de detectar aun pequeñas diferencias moleculares de cualquier sustancia exógena e intentar eliminarlas a través de distintos mecanismos, tales como la neutralización de su acción o marcando la molécula y facilitando la fagocitosis o la acción del complemento.
Aunque existen diversos isotipos, los anticuerpos IgG representan la mayor parte de protección inmunitaria frente a fármacos exógenos.
Inmunogenicidad en terapia biológica: dianas de los anticuerpos antifármacoSon varios los factores —muchos de ellos no bien definidos— que condicionan la inmunogenicidad de los distintos fármacos biológicos, dependientes no solo de la molécula empleada, sino de la enfermedad, de la propia idiosincrasia del paciente y de la forma en cómo el propio fármaco es administrado2.
Por un lado, los condicionantes genéticos del paciente determinarán su facilidad para desarrollar anticuerpos frente a moléculas exógenas. También lo será la enfermedad subyacente, de forma que es conocido que enfermedades como la artritis reumatoide son particularmente inmunogénicas.
Por supuesto un determinante de gran relevancia va a ser la estructura molecular del fármaco, distinta en relación con su diseño y síntesis: anticuerpos quiméricos, humanizados, completamente humanos y proteínas de fusión.
En moléculas quiméricas, como infliximab, perviven un 25% de estructuras murinas, las cuales serán, como parece razonable esperar, la diana prioritaria de los anticuerpos generados por el organismo frente al fármaco (anti drug antibody en inglés), cuyas siglas, ADA, constituye la abreviatura comúnmente empleada en la literatura, junto con la de AAA, y la que se empleará de aquí en adelante. Sin embargo, la experiencia acumulada permite afirmar que la presencia de ADA es una realidad para todos los fármacos biológicos, incluyendo no solo anticuerpos monoclonales humanizados, en los que más del 90% de la estructura final es completamente humana, y proteínas de fusión (etanercept), sino también los anticuerpos totalmente humanos, en ausencia de participación de estructuras murinas (adalimumab, ustekinumab).
Otros condicionantes son la vía de administración. De este modo, en el estudio EXPRESS II se encontraron ADA frente a infliximab en el 35,8% tratados a dosis de 5mg/kg frente al 51,5% en aquellos que recibieron 3mg/kg. La administración a demanda, y por lo tanto asociada a dosis menores de infliximab a partir de la semana 14, se asoció a una mayor prevalencia de ADA en la semana 66 frente al esquema de tratamiento continuo (41,5 vs 35,8%)3. En los estudios PHOENIX 1 y 2 la incidencia de ADA fue también mayor en los pacientes tratados con dosis de 45mg de ustekinumab (18,4 y 13,6%) que aquellos que recibieron 90mg (2,2 y 6,7%)4.
También la administración subcutánea, al permitir un contacto prolongado de la molécula con las células dendríticas, resulta más inmunogénica que la administración oral o endovenosa2.
El resultado final del equilibrio entre el efecto terapéutico para el que el fármaco ha sido diseñado y los esfuerzos del sistema inmunológico del hospedador por eliminar la molécula va a depender, por lo tanto, no solo de la capacidad de ese organismo para desarrollar una respuesta eficaz, sino de la habilidad de la propia molécula —condicionada por su diseño— para pasar desapercibida a los sistemas diseñados para eliminarla, o de actuaciones relacionadas con la administración que permitan mantener el número de moléculas de fármaco en número superior al que puede ser bloqueado por los ADA. De hecho, finalmente va a ser este último punto, es decir, el mantenimiento de niveles suficientes de fármaco para obtener el resultado requerido, el elemento fundamental que permita conservar el éxito terapéutico, de forma independiente a los efectos que la inmunogenicidad u otros factores pudiesen ejercer.
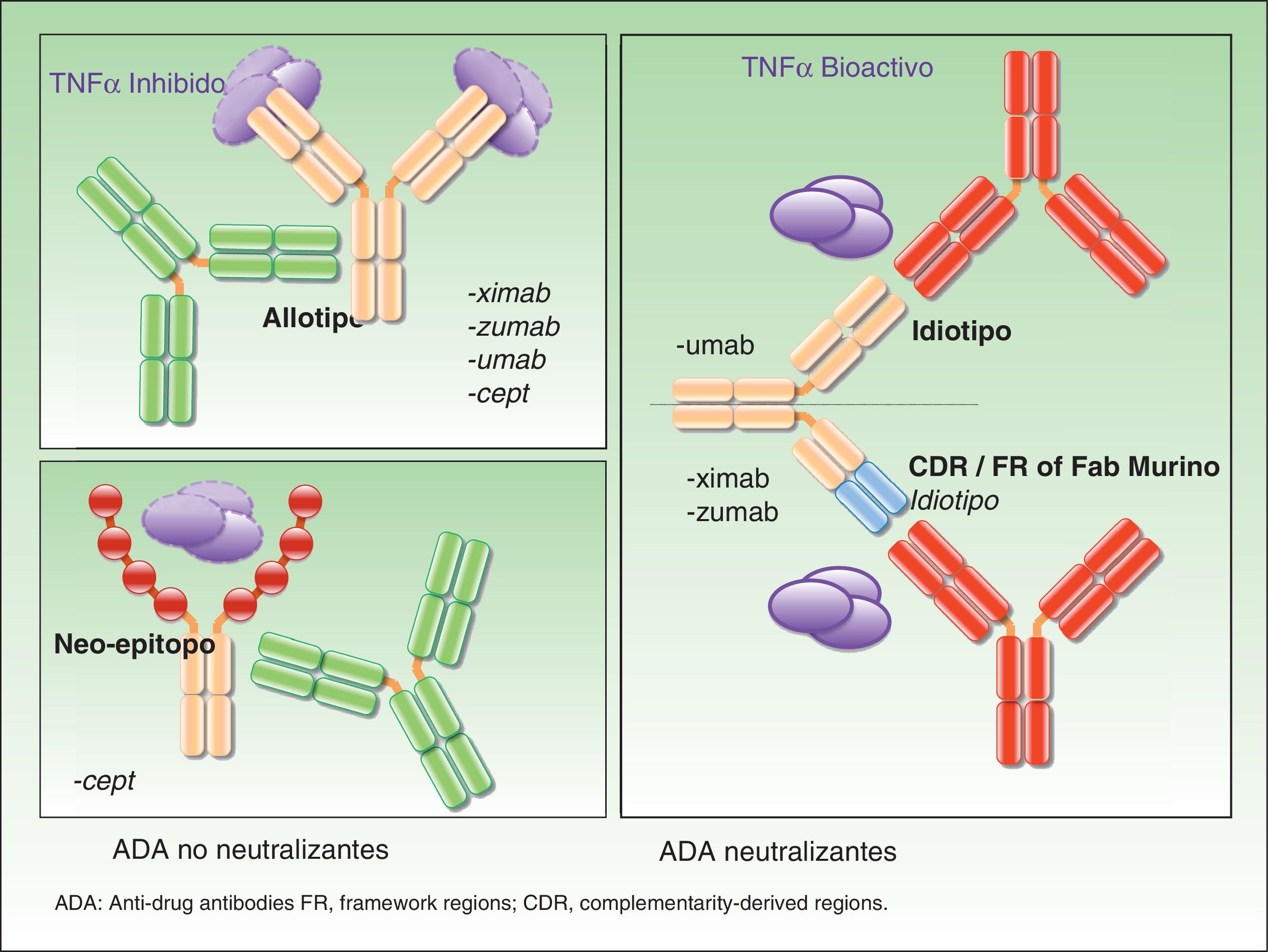
En la actualidad están disponibles para el manejo terapéutico de las enfermedades inflamatorias diversos fármacos biológicos, de los cuales 4 de ellos están aprobados en el tratamiento de la psoriasis moderada y grave: etanercept, infliximab, adalimumab y ustekinumab. Aunque el resultado clínico final buscado es similar cuando el fármaco obtiene su objetivo, la estructura, mecanismo de acción e interacción con las dianas terapéuticas son variables. Por lo tanto, es presumible, como así lo sugieren diversos estudios al respecto, que las dianas de los ADA sean distintas de unas moléculas a otras, en general en relación con su estructura. Los ADA pueden estar dirigidos frente al alotipo, el idiotipo o frente a epítopos generados a resultas de la génesis de nuevas estructuras, como en el caso de las proteínas de fusión. Los efectos derivados de la acción de cada uno de ellos van a ser diferentes y se discutirán en los párrafos siguientes. Sin embargo, debe recordarse que pueden coexistir ADA dirigidos frente a diversas estructuras de un mismo fármaco en un único paciente.
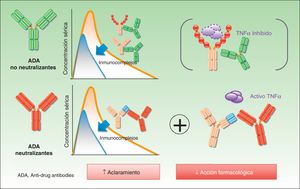
Anticuerpos neutralizantes y no neutralizantesUno de los conceptos fundamentales, aunque también más controvertidos, cuando se habla de ADA es el de su naturaleza neutralizante o no neutralizante. La especificidad de un anticuerpo terapéutico viene definida por el ensamblaje de la porción hipervariable de las cadenas ligeras y las cadenas pesadas —conocido como paratopo— que es la encargada de contactar directamente con el epítopo del antígeno. Estas zonas hipervariables son específicas de una clona linfocitaria B determinada. Los epítopos presentes en estas regiones se denominan idiotopos, y el ensamblaje de los idiotopos constituye el idiotipo. Teniendo en cuenta que no existen idiotopos específicos para TNF-alfa o subunidad p40 en humanos, pueden resultar inmunogénicos incluso en los anticuerpos totalmente humanos5. Los ADA dirigidos frente al idiotipo, comunes en anticuerpos quiméricos (infliximab), humanizados y humanos (adalimumab ustekinumab, certolizumab o golimumab) son, con gran probabilidad aunque no siempre, neutralizantes, ya que interfieren de forma directa en la acción terapéutica del fármaco6. La presencia de estos ADA no supone necesariamente la ausencia de acción terapéutica final del fármaco, ya que aquella dependerá del equilibrio entre los niveles del fármaco y de los ADA, así como de los niveles necesarios de fármaco para obtener los resultados clínicos. Como se recordaba, el paradigma para una respuesta suficiente pasa por el mantenimiento de niveles de fármaco adecuados, no necesariamente los mismos para cada individuo.
Contrariamente a ello, los ADA no neutralizantes se unen al fármaco en una porción no fundamental para el desarrollo de su acción terapéutica, por ejemplo al alotopo. En este caso son los polimorfismos expresados en la porción constante de las cadenas ligeras y pesadas, distintos entre diferentes individuos, lo que hace posible la presencia de anticuerpos incluso cuando la estructura es totalmente humana.
Finalmente, otra diana potencial de ADA no neutralizantes son los nuevos epítopos generados en las proteínas de fusión como etanercept.
En la figura 1 se ilustra el mecanismo de acción de los distintos ADA.
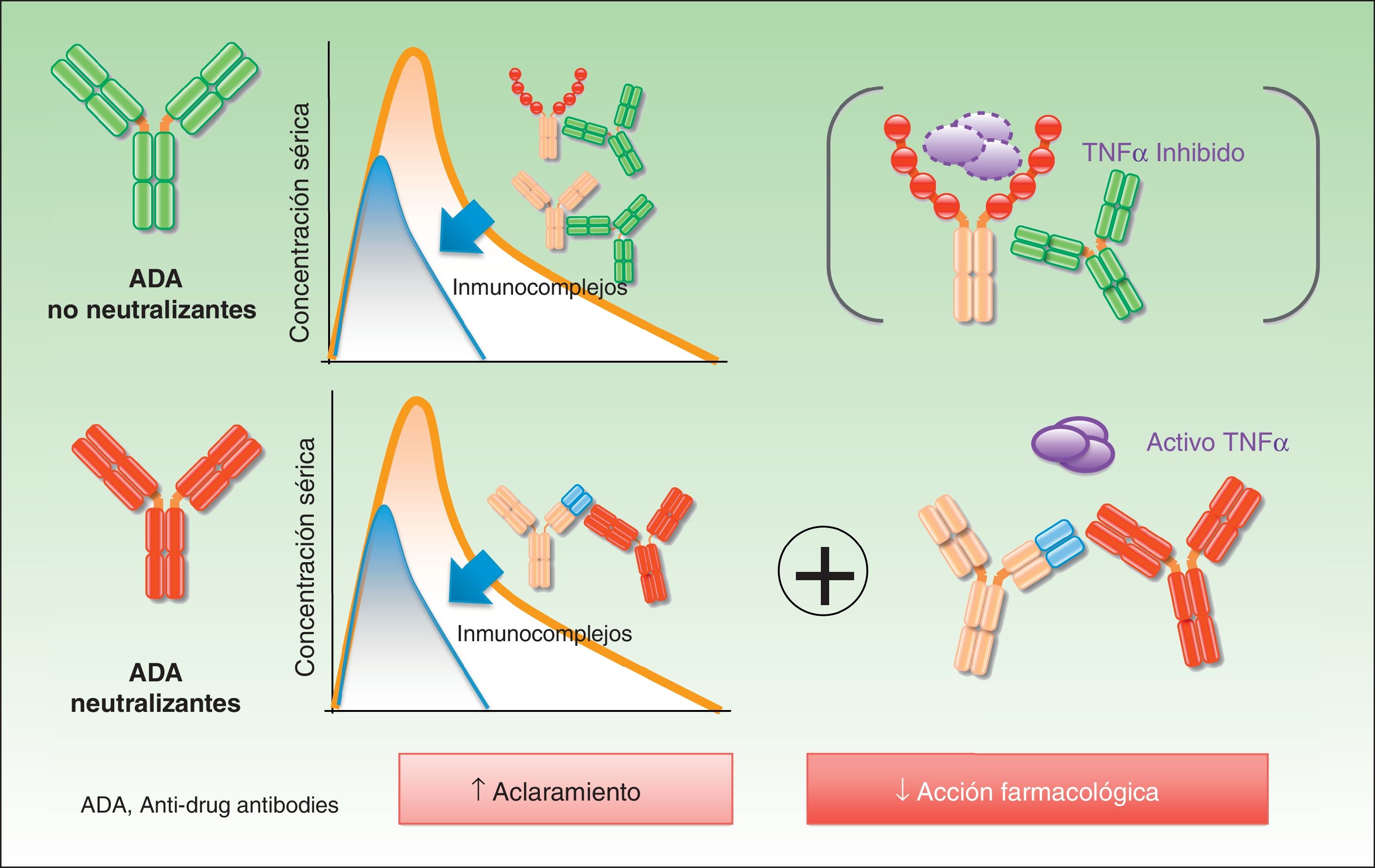
En el caso de los ADA no neutralizantes el efecto biológico está menos establecido, lo cual dista de afirmar que es inexistente. De este modo, de forma adicional al bloqueo directo del idiotipo por parte de los anticuerpos, pueden existir mecanismos adicionales de eliminación de fármaco, tales como la formación de inmunocomplejos, que son eliminados por el sistema reticuloendotelial —de nuevo, de forma independiente a que el fármaco sea capaz de mantener actividad, lo que ocurrirá si los niveles del fármaco son adecuados— y, por lo tanto, aceleran el aclaramiento del fármaco7 (fig. 2).
Según lo comentado, la presencia de ADA debe considerarse como un factor negativo derivado de la interacción del fármaco biológico con el sistema inmunológico del individuo, el cual, a través de diversos mecanismos, en ocasiones coincidentes, podría disminuir las probabilidades de conseguir un número suficiente de moléculas terapéuticas libres para interaccionar con las dianas terapéuticas durante los intervalos establecidos de dosificación8.
Técnicas de detección de anticuerposDe forma previa a cualquier consideración deben conocerse las limitaciones actuales para poder determinar los ADA frente a los distintos fármacos biológicos de forma accesible y eficiente en la clínica diaria. Entre los procedimientos empleados se encuentran técnicas de ELISA —a menudo con problemas de falta de sensibilidad— y, más recientemente, otros conocidos como two-site (bridging) assay y de radioinmunoensayo (RIA). Uno de los problemas en la determinación de anticuerpos es la presencia concomitante del fármaco en el suero, inevitable en el tratamiento crónico de la mayoría de los pacientes9. De este modo, en presencia de moléculas del fármaco en número igual o superior a las de ADA, estas últimas no serán detectables al permanecer unidas a su diana molecular. Por este motivo la determinación debe realizarse siempre en el momento en el que los niveles del fármaco son presumiblemente más bajos, de forma previa a la administración del mismo. En estas circunstancias, una actuación racional en la determinación de inmunogenicidad pasaría por evaluar, en aquellos pacientes con problemas de eficacia o seguridad, en primer lugar los niveles del fármaco, y pasar a evaluar los de ADA en aquellos en los que resultasen inusualmente bajos.
Impacto de la inmunogenicidad: eficacia y seguridadLa inmunogenicidad en la terapia biológica de la psoriasis es una realidad indiscutible, aunque sí existe margen para la controversia a la hora de establecer su magnitud y, sobre todo, su trascendencia terapéutica. En diversos estudios de laboratorios se han detectado ADA en proporciones variables entre el 5 y el 45% en función del fármaco, las técnicas de detección empleadas y el tiempo y estrategias de tratamiento9–12. Sin embargo, la importancia asociada a la presencia de ADA no viene condicionada por su presencia o ausencia, ni siquiera por el porcentaje en el que se presentan, sino por sus implicaciones reales en eficacia y seguridad.
La implicación de los ADA en la eficacia puede venir condicionada por la capacidad de estas moléculas para inhibir el efecto del fármaco, así como por su papel en la eliminación acelerada del mismo. En cualquiera de los supuestos, los fármacos implicados verán mermada su capacidad terapéutica y esto tendrá una repercusión negativa en el curso terapéutico.
Debe decirse que la mayor parte de los datos disponibles son indirectos y las técnicas de laboratorio empleadas no siempre comparables entre los distintos estudios y fármacos. Por otro lado, también son distintas las enfermedades estudiadas, por lo que los resultados no van a ser inequívocamente aplicables a la terapia biológica en la psoriasis.
En fármacos como infliximab y adalimumab se ha comprobado cómo la presencia de ADA neutralizantes disminuye los niveles séricos del fármaco, lo que puede explicarse no solo por un posible más rápido aclaramiento, sino directamente por un efecto en la función5,13. A modo de ejemplo, Bendtzen et al. demostraron cómo el suero procedente de pacientes con ADA requería mayores cantidades de infliximab para bloquear un mismo número de moléculas de TNF-alfa cuando se comparaba con pacientes no tratados con estos fármacos14. En ningún caso la presencia de ADA es un factor que determine de forma absoluta la eficacia, pero sí la condiciona, en el sentido de que el porcentaje de pacientes con ADA es mayor en el conjunto de respondedores moderados o de no respondedores con respecto a los respondedores15. Por otro lado, es interesante resaltar el aspecto dinámico de la inmunogenicidad, que puede incrementarse o decrecer con el tiempo condicionada por una interacción constante de la molécula con un sistema diseñado para adaptarse a nuevas agresiones, como el sistema inmunológico del individuo. Esta circunstancia podría ayudar a explicar, al menos en parte, por qué algunos pacientes inicialmente respondedores —es decir, pacientes en los que idiosincrásicamente el mecanismo de acción del fármaco es adecuado— dejan de responder al tratamiento de forma paralela al incremento de los niveles de ADA16. De forma teórica, la exposición continua al fármaco también podría facilitar la tolerancia en algunos individuos.
La experiencia acumulada en psoriasis con respecto a estos fármacos es limitada. En el estudio EXPRESS, en el que se evaluaba la eficacia de infliximab en la psoriasis moderada y grave, solo el 39% de los pacientes con respuesta PASI 75 en la semana 10 y que desarrollaron ADA fueron capaces de mantenerla en la semana 50 de tratamiento, frente al 81% de los que no los desarrollaron15. Esta peor perspectiva de respuesta en los pacientes con ADA ha sido comprobada en otros estudios11.
Para adalimumab, en el estudio pivotal REVEAL se comprobó cómo de los 240 pacientes respondedores en la semana 33, 3 de 7 (43%) de aquellos que tenían ADA frente a 65 de 233 (28%) de los que no los presentaron perdieron la respuesta PASI 75 en la semana 5217. En un trabajo prospectivo se comprobó cómo aquellos pacientes con niveles moderados o elevados de ADA presentaron concentraciones séricas menores de adalimumab, con peores perspectivas de respuesta inicial y mayores pérdidas de respuesta en el tiempo10.
La experiencia acumulada en ustekinumab, condicionada como es lógico a su indicación solo en psoriasis, es limitada. En la evaluación realizada en un subgrupo de pacientes procedentes de los estudios pivotales PHOENIX la incidencia global de pacientes con ADA fue baja (4,9%), en general a títulos reducidos y aparentemente no relacionada con la dosis empleada o con el tiempo de tratamiento. En estudios in vitro se comprobó la naturaleza neutralizante de los ADA, y los niveles séricos del fármaco fueron inferiores en los pacientes que los presentaron, con un aclaramiento del fármaco un 35% superior, aunque no fueron identificados como un factor predictivo de mala respuesta18.
Las implicaciones de los ADA tampoco están bien establecidas en el caso de etanercept. Aunque se ha detectado su presencia hasta en el 18,5% de los pacientes tratados hasta 96 semanas, no se comprobó que esta se acompañase de variaciones en la perspectiva de respuesta. Estos resultados serían coherentes con la naturaleza aparentemente no neutralizante de los ADA observada en estudios de laboratorio, que indicarían que estos anticuerpos van dirigidos de forma predominante frente a neoepítopos creados en la zona de fusión entre la IgG y el receptor del TNF, sin interferencia directa con la porción encargada de la función terapéutica19. En el caso de este último fármaco, aunque se ha encontrado una relación entre la respuesta clínica y los niveles séricos de etanercept, esta aparece independiente a la presencia de ADA. Esta circunstancia recuerda que la inmunogenicidad es uno de los factores, pero no el único, que puede condicionar la presencia de niveles suficientes para el efecto clínico buscado20.
La segunda gran cuestión en relación con la inmunogenicidad es su repercusión en seguridad. En su conjunto puede afirmarse que la presencia de ADA en los fármacos anti-TNFalfa solo se ha relacionado con una mayor incidencia de reacciones infusionales en el caso de infliximab, mientras que esta circunstancia no ha sido establecida en el caso de adalimumab, etanercept o ustekinumab21. En este sentido, los efectos adversos de la presencia de fenómenos tromboembólicos resultantes de la activación de las plaquetas y el complemento, observada en pacientes afectos de diversas enfermedades inflamatorias tratados con adalimumab22, no han sido demostrados en individuos psoriásicos.
Estrategias para disminuir la inmunogenicidadSi consideramos la inmunogenicidad como un elemento relevante a tener en cuenta en la estrategia terapéutica global, con capacidad para interferir en el curso terapéutico del paciente, el objetivo del dermatólogo será el de llevar a cabo actuaciones dirigidas a dificultar la génesis de ADA. Existen diversas aproximaciones a este respecto, que se concentrarían en 3 puntos: modificaciones en la administración/manejo del fármaco, incremento de las dosis del fármaco —y, por lo tanto, de las moléculas viables— o interferencia en la capacidad del sistema inmunológico para desarrollar ADA, en general a través de la adición de fármacos inmunosupresores.
En el primero de ellos es conocido que la vía de administración del fármaco condiciona su potencial de inmunogenicidad y que, por ejemplo, la administración endovenosa u oral frente a la subcutánea y las dosis altas frente a dosis bajas o intermitentes limitan la inmunogenicidad. Un ejemplo práctico y evidente es la experiencia adquirida con respecto a infliximab, más allá de la vía de administración endovenosa habitual para este fármaco. En el estudio RESTORE se comprobó cómo, mientras que los pacientes tratados de forma continua durante el periodo de seguimiento mantenían la respuesta de forma estable en la mayoría de los casos (78%), las perspectivas de respuesta satisfactoria —PASI 75— disminuían de forma muy marcada (hasta quedarse en un 20%) cuando se suspendía el tratamiento y se reiniciaba coincidiendo con la recaída. La mayor incidencia de efectos adversos observada en el grupo de tratamiento intermitente, en particular en forma de reacciones relacionadas con la infusión, advierten también de cómo el manejo del fármaco puede condicionar el curso clínico. Esta experiencia, y la adquirida en la práctica clínica, han condicionado que infliximab sea empleado de forma continua con la intención de optimizar al máximo sus prestaciones terapéuticas23.
Si la pérdida secundaria de respuesta atribuible a la acción de los ADA puede explicarse a través de una disminución en el número de moléculas viables de fármaco con acción terapéutica, el efecto inicial podría recuperarse a través de un incremento de dosis o de una variación del intervalo posológico, acortando los intervalos de administración y, por lo tanto, favoreciendo una nueva situación de desequilibrio a favor del fármaco. Aunque el reflejo de esta propuesta teórica puede encontrarse en diversos ensayos clínicos —en particular en las fases abiertas de seguimiento— de todos los fármacos disponibles en la psoriasis, deberá asumirse, en la práctica clínica, un incremento del coste terapéutico y una exposición, al menos en el momento inicial, a dosis mayores24.
Finalmente, la interferencia del sistema inmunológico con el objetivo de que aquel sea menos eficaz en su identificación y eliminación de estructuras moleculares exógenas y en el desarrollo de ADA, es el principal fundamento de la adición de metotrexato (MTX), habitual en Reumatología y no tanto en Dermatología, junto a diversos fármacos biológicos25. Aunque el mecanismo de acción no es del todo conocido, la utilidad de dosis bajas de MTX (subterapéuticas) parece hablar más a favor del citado efecto que apoyar una acción terapéutica sinérgica con el fármaco biológico.
Inmunogenicidad, aplicación clínica y optimización terapéuticaEstos datos podrían permitir reflexionar en qué medida la inmunogenicidad subyace ya de hecho al manejo habitual de los fármacos biológicos en la psoriasis. De este modo, es probable que aquella permita explicar qué fármacos con un notable potencial inmunogénico, como infliximab, se recomienda emplear de forma continua y a menudo de forma concomitante con MTX. Por el contrario, también haría razonable que, etanercept, el menos inmunogénico de los fármacos disponibles, haya desarrollado una experiencia notable en su empleo intermitente, incluso con varios ciclos de suspensión y reinicio26–28.
Esta circunstancia no está tan bien establecida para otros fármacos como adalimumab y ustekinumab. En estos, aunque la experiencia acumulada en cuanto al uso intermitente permite afirmar que buena parte de los pacientes tratados con estos fármacos son capaces de recuperar la respuesta después de un ciclo de suspensión y reinicio, en general la respuesta es mejor en aquellos que mantienen el tratamiento de forma continua. En cualquier caso, el número de pacientes tratados de forma intermitente para ambos fármacos es limitado, circunscrito a algún brazo de los ensayos clínicos, lo que impide conclusiones relevantes en uno u otro sentido29. La existencia de anticuerpos neutralizantes condiciona, desde un punto de vista teórico, la prudencia en cuanto a su uso intermitente.
Tras desarrollar en los párrafos previos los conceptos básicos relacionados con la inmunogenicidad en la terapia biológica de la psoriasis, el siguiente paso pasa por evaluar en qué medida su conocimiento y manejo podría ser útil para optimizar el empleo de los fármacos biológicos.
Un ejemplo de ello puede encontrarse en el trabajo de Jamnitski et al., en el que los autores comprobaron, en una serie de 292 pacientes que iniciaron etanercept, bien como primer tratamiento (naive), bien desde infliximab o adalimumab a etanercept, cómo las perspectivas de respuesta fueron similares entre los pacientes naive y aquellos procedentes de otros fármacos en los que se habían detectado ADA mientras que, por el contrario, fue inferior en aquellos que no los presentaron. De este modo, mientras que la ausencia de ADA indicaría una falta de respuesta al mecanismo de acción compartido por los anti-TNF haciendo recomendable el cambio a un fármaco de distinto mecanismo de acción, la presencia de aquellos se postularía como un factor adicional, añadido y adquirido, específico para ese fármaco y para ese paciente, que podría hacer fracasar un tratamiento, aun a pesar de ser susceptible a un mecanismo de acción potencialmente eficaz30. En este último caso la opción a un fármaco de un mecanismo de acción parecido, pero diferente estructura molecular, en este caso etanercept, estaría justificado. Estos datos analíticos adicionales, no disponibles en el momento actual, permitirían poder escoger la mejor opción —probar un nuevo anti-TNF o directamente cambiar de mecanismo terapéutico— con mayores probabilidades de éxito que las actuales, incrementando la efectividad.
Determinación de la inmunogenicidad en la práctica clínica: no solo anticuerpos antifármacoA pesar de los problemas antes referidos en cuanto a la sensibilidad y especificidad de los test disponibles para la detección de ADA, es probable que próximamente dispongamos de kits para su detección en la práctica diaria.
Debe recordarse que, en la medida de lo posible, la prioridad debe ir dirigida a la detección de los niveles de fármaco, signo sérico más fiable de que la administración del fármaco, según las pautas aceptadas, no se ve interferida por la participación de la inmunogenicidad o de otros factores, complementada con la determinación de ADA31.
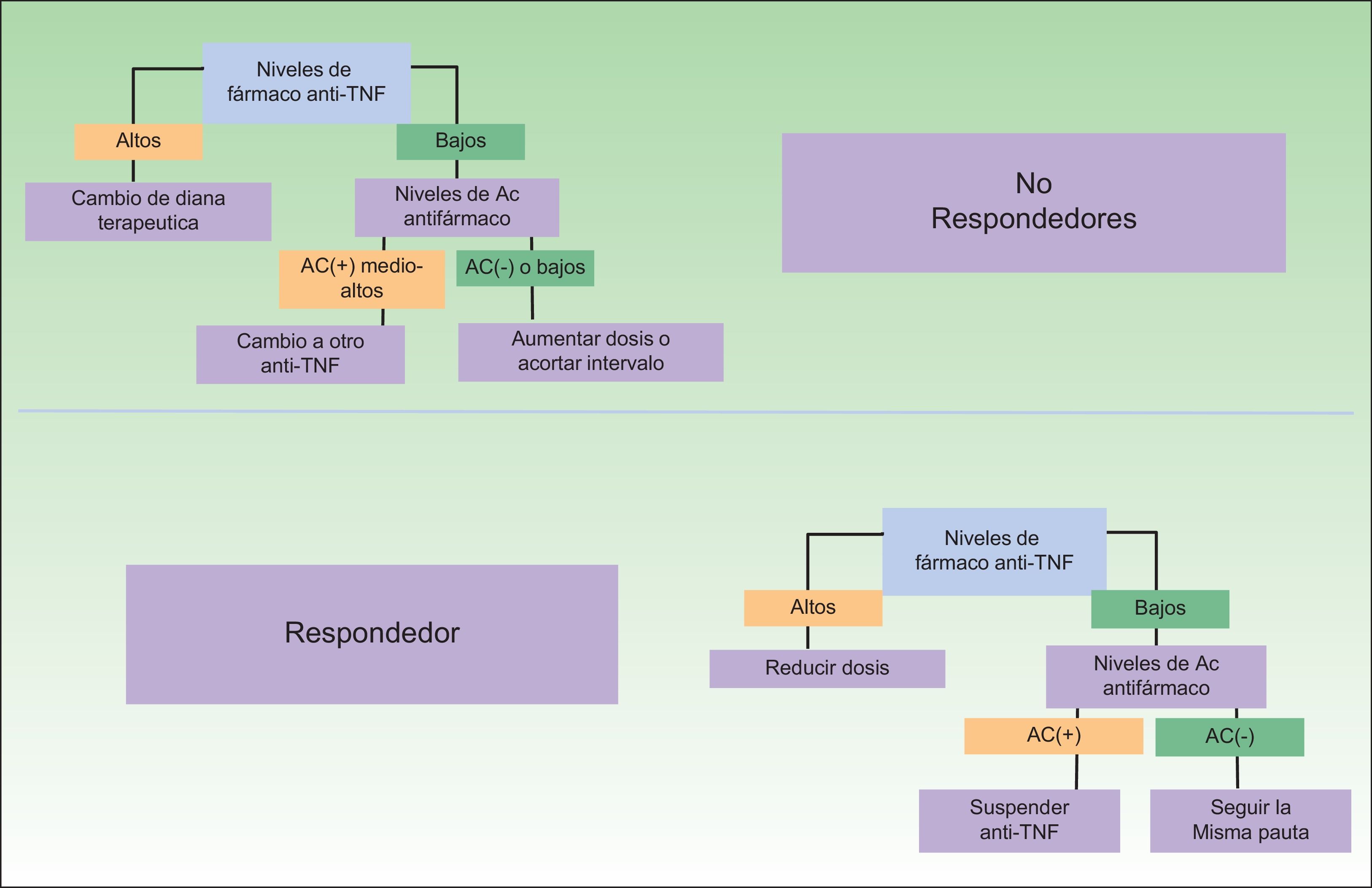
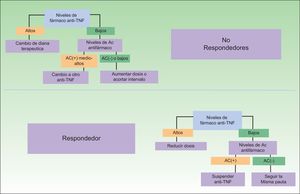
Un problema en esta determinación viene dado por el hecho de que no están disponibles, en los datos procedentes de los ensayos clínicos, el intervalo terapéutico necesario o suficiente para obtener una respuesta satisfactoria —en el caso en el que el paciente sea susceptible a responder—, aunque es presumible que dispongamos cada vez de mayor información a partir de estudios de investigadores particulares32. Esta posibilidad permite el despliegue de nuevos algoritmos terapéuticos que favorecerán un uso más racional de la terapia biológica y de la toma de decisiones. Algunas de las propuestas terapéuticas derivadas de estas determinaciones aparecen en la figura 3. Como puede verse, no solo la elección ante un paciente no respondedor puede ser más adecuada, sino que potencialmente podría reducirse o incluso eliminarse el tratamiento en pacientes respondedores, con un impacto económico notablemente atractivo33. Este último supuesto vendría justificado por el hecho de que si los niveles del fármaco son muy bajos en el contexto de una elevada inmunogenicidad, no sería posible relacionar la buena evolución clínica a su efecto terapéutico.
Inmunogenicidad como condicionante de la supervivenciaEl concepto de supervivencia es poco académico en su definición, pero relevante en la práctica clínica, y se asocia al tiempo en el que un determinado fármaco se mantiene como una opción adecuada para un paciente concreto. Los límites de lo que puede considerarse «una opción adecuada» son variables para cada paciente y derivan de una asimétrica ecuación en la que se integran eficacia, seguridad, tolerancia y conveniencia junto a otros factores tales como la historia terapéutica del paciente, la respuesta a tratamientos previos y las opciones alternativas disponibles.
Tras el desarrollo de los párrafos previos existe escasa duda de la importancia de la inmunogenicidad como elemento a tener en cuenta en la interacción entre un fármaco concreto y el sistema inmunológico del individuo durante el tiempo de tratamiento. Sin embargo, el impacto global de la inmunogenicidad en las perspectivas terapéuticas de un fármaco determinado no va a implicar a todos los pacientes tratados con un fármaco concreto, ni siquiera a todos los que desarrollen ADA, sino solo a aquellos en los que por su mecanismo de acción, título o ambos, estos anticuerpos lleguen a condicionar los efectos finales. En particular, este concepto se estima relevante en la pérdida secundaria de eficacia; es decir, en aquellos que después de mostrar una respuesta inicialmente satisfactoria, aquella se atenúa en el curso del tratamiento. Por el contrario, aquellos individuos con una respuesta satisfactoria continuada no presentan en la mayoría de casos ADA y no requerirían evaluación en este sentido34.
La inmunogenicidad, por lo tanto, deberá integrarse como un factor adicional en el diseño terapéutico para cada paciente concreto, junto a otros parámetros como la eficacia intrínseca del fármaco, el perfil de seguridad a corto y largo plazo, o la influencia del peso y de las comorbilidades35.
En definitiva, la inmunogenicidad en terapia biológica de la psoriasis debe considerarse una realidad inevitable, inherente a la presencia de cualquier molécula exógena, cuyo objetivo será el de interferir la presencia y acción del fármaco, circunstancia que va a ser más probable en el caso de los ADA neutralizantes.
Reconocida la importancia de la inmunogenicidad en la estrategia terapéutica global con fármacos biológicos, los dermatólogos podemos aplicar este conocimiento como un elemento adicional en la estrategia terapéutica y en su manejo con vistas a limitar su impacto.
Finalmente, también el mejor conocimiento de la inmunogenicidad puede ser un aliado en el diseño de modelos predictivos y, probablemente, en un futuro inmediato, en la personalización del tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl Dr. José Manuel Carrascosa ha recibido honorarios por ponencias, consultorías y/o becas para estudios de investigación por parte de Abbott, Pfizer, Janssen-Cilag, MSD y Amgen.
Agradezco al Prof. Denis Julien la cesión de las figuras 1 y 2 que esquematizan el mecanismo de acción de los anticuerpos antifármaco en terapia biológica.