El término de psoriasis en localizaciones de difícil tratamiento se emplea para hacer referencia a la psoriasis localizada en el cuero cabelludo, las uñas, las palmas y las plantas y que requiere un manejo diferenciado. A menudo los pacientes presentan un importante impacto físico y emocional, unido a la dificultad para controlar adecuadamente sus lesiones con tratamientos tópicos, debido a una insuficiente penetración de los principios activos y la escasa cosmeticidad de los vehículos empleados. Esta circunstancia justifica que la psoriasis en estas localizaciones pueda ser considerada grave, a pesar de su extensión limitada. La experiencia con terapias biológicas en estas localizaciones es escasa, en general en el contexto de ensayos clínicos de formas extensas de psoriasis moderada y grave, junto con series limitadas o casos aislados. En el presente artículo se presenta la calidad de la evidencia científica para los 4 agentes biológicos disponibles en España (infliximab, etanercept, adalimumab y ustekinumab) siendo de nivel i en el caso de la psoriasis ungueal (nivel de recomendación A) y algo inferior en la psoriasis del cuero cabelludo y palmoplantar.
Psoriatic lesions affecting the scalp, nails, palms, and the soles of the feet are described as difficult-to-treat psoriasis and require specific management. Involvement of these sites often has a significant physical and emotional impact on the patient and the lesions are difficult to control with topical treatments owing to inadequate penetration of active ingredients and the poor cosmetic characteristics of the vehicles used. Consequently, when difficult-to-treat sites are involved, psoriasis can be considered severe even though the lesions are not extensive. Scant information is available about the use of biologic therapy in this setting, and published data generally comes from clinical trials of patients who also had moderate to severe extensive lesions or from small case series and isolated case reports. In this article we review the quality of the scientific evidence for the 4 biologic agents currently available in Spain (infliximab, etanercept, adalimumab, and ustekinumab) and report level i evidence for the use of biologics to treat nail psoriasis (level of recommendation A) and a somewhat lower level of evidence in the case of scalp involvement and palmoplantar psoriasis.
El Grupo Español de Psoriasis (GEP) de la Academia Española de Dermatología y Venereología (AEDV) ha actualizado las directrices basadas en la evidencia para el tratamiento de la psoriasis con agentes biológicos1. Para complementarlas, este artículo incluye la información científica disponible para el tratamiento de la psoriasis en localizaciones de difícil tratamiento (uñas, cuero cabelludo, palmas y plantas). No existe evidencia en la literatura acerca de la eficacia y seguridad de los tratamientos biológicos en la psoriasis localizada en pliegues y genitales, por lo que no abordaremos este aspecto.
El término de psoriasis en localizaciones de difícil tratamiento ha sido empleado por diversos autores en los últimos años para hacer referencia a la psoriasis (vulgar habitualmente) (Ps) localizada en el cuero cabelludo, las palmas/plantas y las uñas, y que requiere una consideración especial debido a que, con frecuencia, genera un importante impacto físico, emocional y, en ocasiones, funcional2–4. Muchos autores también incluyen dentro de este grupo la Ps localizada en áreas de piel sensible, esto es, la que afecta a la cara, los pliegues y los genitales2,3,5. Además la Ps en estas localizaciones necesita un tratamiento diferenciado, ya que los medicamentos tópicos suelen resultar ineficaces e incómodos, por lo que se suele indicar una terapia sistémica2–5. En algunos pacientes estas áreas son las únicas manifestaciones fenotípicas de la enfermedad mostrando, además, una marcada resistencia a los tratamientos convencionales.
Hay pocos ensayos controlados que evalúen la eficacia y seguridad de la terapia sistémica (clásica o biológica) en estas localizaciones específicas. En general, se trata de subanálisis de ensayos que incluyen pacientes con Ps y/o artrtitis psoriásica (ApS) en los que se valora concomitantemente la afectación de las uñas, el cuero cabelludo o las palmas y las plantas. En estos estudios, junto al Psoriasis Area and Severity Index (PASI), el Body Surface Area (BSA) y el Physician Global Assessment (PGA) se emplean una serie de escalas para medir la gravedad de estas localizaciones peculiares como son el Nail Psoriasis SeverityIndex (NAPSI) y el NAPSI modificado, junto a sus variantes en diana, en el caso de la Ps ungueal (PsU)6,7. En el caso de la Ps del cuero cabelludo (PsCC) se emplea el Psoriasis Scalp Severity Index (PSSI’)8 y en la de palmas/plantas (PsPP) el Palmoplantar Pustulosis Psoriasis Area Severity Index (PPPASI)9, siendo ambas variantes del PASI. Con la finalidad de ponderar el impacto en la calidad de vida, disponemos de índices que dan idea del impacto psicosocial producido por la Ps en general como el Dermatology Life Quality Index (DLQI) o por alguna de las localizaciones peculiares objeto de este manuscrito, como es el Nail Psoriasis Quality of life scale (NPQ10) en el caso de las uñas10.
Objetivos y metodologíaAnalizar el grado de evidencia científica en torno a la eficacia y seguridad del tratamiento con infliximab (IFX), etanercept (ETN), adalimumab (ADA) y ustekinumab (UST) en la PsU, PsCC y PsPP.
Para ello se ha llevado a cabo una búsqueda bibliográfica de la literatura médica en lengua inglesa y española a través del buscador PubMed (MEDLINE) hasta el 7 de septiembre de 2013, con la estrategia de búsqueda nail psoriasis AND/OR scalp psoriasis AND/OR palmoplantar psoriasis seguida de los diferentes tratamientos utilizados. Posteriormente, ha sido sometida a consenso por parte de los miembros del GEP que han colaborado en la redacción del artículo.
Psoriasis unguealLa afectación ungueal en el transcurso de la Ps se observa entre el 50 y el 80% de los pacientes y su incidencia aumenta hasta el 90% a lo largo de la vida11. Recientemente se ha realizado un estudio epidemiológico en Asturias, en una población de 661 pacientes con Ps, objetivándose que la PsU era un 13,5% más prevalente en hombres que en mujeres. Además el grupo de pacientes con PsU tenía una forma de Ps más grave, con puntuaciones más altas de PASI y un mayor índice de masa corporal asociado12. Hay casos descritos de PsU aislada13, aunque lo habitual es que preceda o acompañe a otras manifestaciones cutáneas y/o articulares. En los últimos años se ha puesto de manifiesto el papel de las uñas como marcador precoz de entesitis en el contexto de la ApS, fenómeno que explicaría su asociación14.
A pesar de los avances en la terapéutica tópica aparecidos en los últimos años, la PsU responde mejor a la terapia sistémica, especialmente cuando los pacientes presentan formas graves (NAPSI>10)13,15,16.
El Cochrane Skin Group Specialised Register ha publicado este año las directrices en el tratamiento de la PsU. Para ello ha incluido 18 estudios clínicos con 1.266 pacientes. Los autores, tras incidir en la escasa calidad de los estudios, concluyen que solo IFX, golimumab, la radioterapia superficial, los rayos Grenz y el electronbeam consiguieron una mejoría significativa de la PsU con respecto a placebo17.
En un estudio retrospectivo que incluyó 84 pacientes con Ps moderada-grave y/o ApS se comparó la efectividad de la terapia sistémica clásica (acitretina, ciclosporina, metotrexato, PUVA y UVB de banda estrecha) respecto a la terapia biológica (efalizumab, IFX, ETN y ADA) en el tratamiento de la PsU a las semanas 12, 24 y 48. Entre los resultados del estudio destacaba la correlación entre el PASI y el NAPSI, así como la mayor efectividad de los biológicos, en especial de IFX y de ADA a las 12 y 24 semanas. Dentro del grupo de fármacos clásicos la ciclosporina fue el más eficaz y la fototerapia UVB de banda estrecha el único ineficaz18.
En otro estudio comparativo y prospectivo sobre la efectividad de los tratamientos sistémicos en la PsU se evaluaron 87 pacientes que fueron divididos en 5 grupos, según fueran tratados con metotrexato, acitretina, NUVB, biológicos o ningún tratamiento (grupo control). Los autores no observaron diferencias significativas en los valores del NAPSI a la semana 16 con ninguno de los tratamientos sistémicos clásicos en comparación con el grupo control. En cambio sí observaron una disminución significativa en el grupo tratado con biológicos19.
Terapias anti-factor de necrosis tumoral αInfliximabEn 2005 el ensayo EXPRESS, multicéntrico, doble-ciego, comparado con placebo y realizado sobre una población de 378 pacientes con Ps moderada-grave, demostró que los pacientes tratados con IFX lograban mejorías significativas en el NAPSI medio desde la semana 10, llegando hasta un 57,2% de reducción en el mismo a la semana 24. Además, los pacientes con una buena respuesta de las lesiones cutáneas (PASI 75/90) mostraban una mejoría media del NAPSI del 80,3% a la semana 5020. Un análisis retrospectivo del ensayo EXPRESS mostró que la mejoría media del NAPSI a la 10 semana fue del 28,3%, siendo seguida del 61,4% y del 67,8% a las 24 y 50 semanas, respectivamente21.
En 2 ensayos fase iii llevados a cabo en Japón, con 90 pacientes, se observó una mejoría significativa de la PsU en los pacientes tratados con IFX22.
Saraceno et al. han publicado, recientemente, un estudio prospectivo cuyo objetivo principal fue comparar la eficacia de los fármacos anti-factor de necrosis tumoral α (anti-FNTα) en la PsU23. Para ello se incluyeron 60 pacientes que fueron divididos en 3 grupos (ADA, ETN e IFX) a lo largo de 24 semanas. Se observó que IFX obtuvo una reducción significativa en el NAPSI en la semana 14 respecto al resto de fármacos, mientras que, a la semana 24, los 3 agentes obtuvieron reducciones similares.
En un estudio prospectivo abierto, no controlado, Rigopoulos et al. evaluaron la efectividad de IFX en 18 pacientes con Ps y afectación ungueal. La mayoría de pacientes mostraron una significativa mejoría de sus uñas a la semana 14, tal como se evidenció mediante una reducción del NAPSI medio (NAPSIm) de 55,8 basal a 29,8. Al cabo de 6 meses el NAPSIm había disminuido a 3,325.
En la tabla 1 figuran el resto de estudios publicados en pacientes con PsU en relación con IFX y el resto de biológicos.
Otros estudios en psoriasis ungueal
| Autor | Tipo de estudio | Pacientes | Resultados |
| Rigopoulos et al. 38 | Estudio prospectivo, abierto, no aleatorizado | 21 | Pacientes con Ps y/o ApS fueron tratados con ADA. Tras 12 y 24 semanas de tratamiento hubo una reducción significativa del NAPSI hasta llegar a 5.57+-0.78 y 1.57 +-0.20 respectívamente. |
| Sánchez-Regaña et al. 18 | Estudio retrospectivo | 84 | Pacientes con Ps moderada-grave y AsP fueron tratados con diferentes fármacos sistémicos. De ellos, 8 pacientes tratados IFX y 8 con ADA alcanzaron una reducción significativa del NAPSI a las 12 y 24 semanas, aunque a las 48 semanas, las diferencias con respecto a efalizumab y ETN desaperecieron. |
| Barrera et al. 31 | Estudio retrospectivo | 66 | Se administró ETN 25 mg o 50 mg dos veces a la semana hasta la semana 24 en donde suspendían el tratamiento a los pacientes respondedores (> 50% de su PASI basal). Cuando el paciente perdía la mitad de su PASI alcanzado durante el tratamiento, se iniciaba un nuevo ciclo de ETN. Uno de los parámetros evaluados fue la afectación ungueal que mejoró significatívamente durante los dos primeros ciclos de tratamiento y también en el tercero, aunque de forma no significativa. |
| Fabroni et al. 27 | Estudio restrospectivo | 48 | Pacientes tratados con IFX mostraron una rápida mejoría de la PsU a las 22 semanas en la mayoría de los casos, a pesar de que solo 5 pacientes (10.4%) se blanquearon totalmente. En la metodología de este estudio, se utilizaron el NAPSI-50, -75 y -90 como marcadores de efectividad del tratamiento. |
| Kyriakou et al. 24 | Estudio restrospectivo | 39 | Un total de 12 pacientes son tratados con IFX, 14 con ADA y 13 con ETA. A las 12, 24 y 48 semanas los tres fármacos consiguieron mejorías significativas en el índice NAPSI, siendo IFX el primero, seguido de ETN y ADA |
| Bianchi et al. 26 | Estudio retrospectivo | 25 | Pacientes con Ps moderada-grave y PsU fueron tratados con IFX. A la semana 14 todos los pacientes ya mostraban una reducción del NAPSI superior al 50%, siendo total a la semana 22. |
| Sola et al. 39 | Estudio retrospectivo | 15 | Pacientes tratados con ADA la puntuación NAPSI descendió desde un valor basal medio de 18.9 a 8.2 a las 24 semanas (p=0.001). |
| Vitiello et al.47 | Estudio retrospectivo | 13 | Pacientes con Ps y ApS tratados con UST y concomitántemente con metotrexato (MTX) (n=6) o ciclosporina (CyA) (n=2). El NAPSI basal medio fue de 22.3 y a la semana 12 de 14.8, con una reducción del NAPSI del 31,8%.. Los 2 tratados con UST más CyA mostraron una completa resolución de las mismas |
| Irla et al. 40 | Casos aislados | 2 | Se presentan dos casos de rápida mejoría de la PsU bajo monoterapia con ADA con eficacia mantenida a pesar del tratamiento intermitente, así como una larga remisión después de interrumpir el tratamiento. |
| Coelho et al. 33 | Casos aislados | 2 | Hombre de 59 años con NAPSI 56 que tras 12 semanas de ETN 50 mg dos veces a la semana, seguido de 50 mg/semana por 36 semanas presenta una mejoría 93% (NAPSI 4) a la semana 48. Hombre de 43 años con NAPSI 53 que inicia ETN 50 mg /2 veces semana y después de la semana 12 se disminuye la dosis a 25 mg /2 veces semana, tras 48 semanas de tratamiento presenta una mejoría del 57% (NAPSI 30). |
| Gómez Vásquez et al. 34 | Caso aislado | 1 | Hombre 43 años tratado con ETN 50 mg/semana presenta una marcada mejoría de la PsU de los pies y resolución casi completa de las uñas de las manos. Después de 2 años se suspende el tratamiento y se mantienen los resultados hasta 6 meses de seguimiento. |
| Puig et al.48 | Caso aislado | 1 | Mujer de 47 años tratada durante 5 meses con ADA por ApS que desarrolló un cuadro de pustulosis palmo-plantar incapacitante y Ps con afectación severa del cuero cabelludo y uñas. El tratamiento con UST 45 mg conllevó una completa resolución de las lesiones. |
Algunos autores piensan que, considerando las características de este fármaco, se podría proponer un perfil específico de paciente candidato a tratamiento con IFX. En concreto, se trataría de individuos con Ps en placa grave asociada a afectación ungueal grave y/o ApS28.
EtanerceptEn el estudio CRYSTEL se determinó la prevalencia de los síntomas ungueales y articulares, así como el impacto de los mismos en la calidad de vida y los efectos que el tratamiento con ETN induce en pacientes con Ps moderada-grave29. Fueron incluidos 711 pacientes (352 en terapia continua y 359 en terapia intermitente) en un ensayo aleatorizado para recibir ETN durante 54 semanas. De ellos el 79% presentaba PsU al inicio del estudio, mostrando una mejoría significativa al final del mismo con disminuciones del NAPSI del 51%.
Recientemente, Ortonne et al. llevaron a cabo un ensayo clínico aleatorizado cuyo objetivo principal fue analizar la eficacia y seguridad de ETN en la PsU en pacientes con Ps moderada-severa (NAIL study)30. Para ello, incluyeron aquellos pacientes con PsU que habían sido tratados, sin éxito, con al menos un tratamiento sistémico. Los pacientes fueron aleatorizados para recibir ETN 50mg 2 veces a la semana (grupo A) durante 12 semanas, seguido por 50mg una vez a la semana (grupo B) durante 12 semanas (grupo A/B) o ETN 50mg (grupo B) durante 24 semanas (grupo B/B). A las 24 semanas de tratamiento se observó una correlación significativa entre los valores de NAPSI y PASI, así como un descenso significativo del NAPSI diana en ambos grupos por igual.
Con el objetivo de evaluar la eficacia de los agentes biológicos anti-FNTα en el tratamiento de la ApS juvenil, se realizó un estudio observacional, prospectivo y multicéntrico en varios centros holandeses. Fueron incluidos un total de 18 pacientes. En el 39% de los pacientes se detectó pitting ungueal. En 17 pacientes se optó por el tratamiento con ETN y en uno con ADA. En la mayoría de casos los autores observaron una buena efectividad en las manifestaciones articulares de la Ps, no así en las cutáneas ni en las ungueales, ya que incluso en 4 pacientes apareció Ps de novo32.
AdalimumabEn una fase iiib del ensayo clínico BELIEVE se evaluó el efecto de ADA en el tratamiento de la ApS, así como la respuesta clínica de otros marcadores de la enfermedad psoriásica: lesiones cutáneas, ungueales, dolor, prurito y calidad de vida35. En este estudio el tratamiento con ADA condicionó una mejoría clínica relevante de las lesiones cutáneas y ungueales.
En el ensayo clínico REACH, aleatorizado y controlado con placebo, se incluyeron 72 pacientes. De ellos, 31 tenían PsU, observándose que el 56,5% de los sujetos tratados con ADA alcanzaron el NAPSI 50 vs placebo (12,5%) a la semana 16 de tratamiento36.
En un estudio prospectivo, no controlado, realizado en 2010 en una población de 442 pacientes con ApS, se evaluó el tratamiento con ADA a dosis de 40mg administrada de forma subcutánea (SC) cada 2 semanas durante 12 semanas. El NAPSI promedio de los 164 pacientes con ApS y PsU grave se redujo en un 57% a las 12 semanas37.
Efectos adversos en las uñas durante el tratamiento con anti-factor de necrosis tumoral αEn los últimos años diversos estudios han puesto de manifiesto que la prevalencia de onicomicosis en los pacientes con PsU es mayor que la de la población sana, con cifras que oscilan entre 4,6 y 47,9%18,41. Desde el punto de vista etiológico, en los diferentes estudios se han aislado tanto levaduras como dermatofitos y no dermatofitos11,18,41. Al-Mutairi et al. han estudiado recientemente la aparición de onicomicosis en pacientes con PsU en tratamiento con terapia biológica en un estudio aleatorizado en el que los pacientes recibieron ETN, IFX o ADA durante 24 semanas. Los resultados fueron comparados con controles y, en total, se incluyeron 315 pacientes. La onicomicosis asociada a PsU fue más frecuente en los varones y en los pacientes tratados con IFX (33%)42. Las prevalencias restantes fueron las siguientes: ETN (15,45%), ADA (13,33%) y grupo control (13,89%).
Por otra parte, se ha comunicado la aparición de Ps, PsU y pustulosis palmo-plantar, en ocasiones en un mismo paciente, en tratamiento con agentes biológicos anti-FNTα para diferentes enfermedades, distintas a la Ps, para las cuales estos fármacos tienen indicación. En una serie de 120 pacientes los 3 fármacos disponibles desencadenaron este tipo de lesiones cutáneas; IFX (n=63), ETN (n=37) y ADA (n=26). Entre aquellas la más frecuentemente observada fue la Ps (n=73), seguida de la pustulosis palmo-plantar (n=37) y la PsU (n=6)43. En 75 pacientes de esta serie se trató de Ps inducida de novo, mientras que en 24 se produjo una exacerbación o agravamiento de la Ps preexistente.
UstekinumabEn el ensayo PHOENIX 1 (aleatorizado, fase iii), con dosis de 45mg de UST, se obtuvo una reducción media del NAPSI del 25% a las 12 semanas y del 50% a las 24 semanas44.
Recientemente, también se han publicado los resultados de otro ensayo fase ii/iii, doble ciego, controlado con placebo, diseñado para analizar la eficacia y seguridad de UST en pacientes japonenes con Ps moderada-grave. Un total de 158 pacientes fueron aleatorizados para recibir UST o placebo con transición a UST a la semana 12. Se puso de manifiesto una reducción significativa del NAPSI desde la semana 12 hasta la semana 7245.
En un estudio prospectivo abierto y no controlado llevado a cabo en Grecia en 2011, con el objetivo de evaluar la efectividad de UST en la PsU, se incluyeron 27 pacientes que fueron tratados con dicho fármaco según la dosis indicada en la ficha técnica. Como índices de gravedad se utilizaron el índice de calidad de vida de onicomicosis (’Onychomycosis QoL score) y el NAPSI. Los autores pusieron de manifiesto reducciones significativas en ambos a las 4, 16, 28 y 40 semanas46.
Psoriasis del cuero cabelludoLa afectación del cuero cabelludo (CC) está presente en un 80% de los pacientes con Ps49, siendo a menudo el lugar de inicio de la enfermedad. La PsCC está asociada con frecuencia a un importante deterioro de la calidad de vida, afectando la autoestima, la vida social y el estilo de vida de los pacientes afectados. De hecho, un 57% de los mismos presentan alteraciones psicológicas y estrés social relacionado con el prurito y la descamación que caracteriza a esta localización de la enfermedad psoriásica.49,50.
A pesar de la gran variedad de tratamientos tópicos existentes en la actualidad, en muchas ocasiones se observa resistencia a los mismos. La evidencia científica de las terapias biológicas para PsCC es escasa, a diferencia de lo que ocurre en la Ps en general51-53.
Terapias anti-factor de necrosis tumoral αInfliximabMenter et al. elaboraron un subanálisis de 3 ensayos aleatorizados, doble ciego, en los cuales se empleó IFX en el tratamiento de la Ps moderada-grave, con la finalidad de analizar su eficacia en distintas áreas de la superficie corporal. En total 1.462 pacientes habían sido aleatorizados en dichos ensayos (EXPRESS, EXPRESS II y SPIRIT). La mejoría en las 4 áreas corporales que se incluyen en el cálculo del PASI (cabeza-cuello, extremidades superiores, tronco y extremidades inferiores) fue paralela a la respuesta global PASI en los pacientes tratados con IFX durante 10 semanas. En concreto, la proporción de pacientes que alcanzaron valores de PASI≥75 o≥90 a las 10 semanas en el grupo de IFX versus (vs) placebo fue del 85,5 vs 22% (≥75%) y del 68,9 vs 12% (≥90%) en el ensayo SPIRIT; del 84,8 vs 12,5% (≥75%) y del 73,1 vs 8,3% (≥90%) en el estudio EXPRESS y, finalmente, del 79 vs 10% (≥75%) y del 66,6 vs 5,5% (≥90%) en el ensayo EXPRESS II54.
EtanerceptEn un estudio aleatorizado abierto, en el cual se evaluó la eficacia y la seguridad de ETN en el tratamiento continuo (n=1.272) vs el tratamiento intermitente (n=1.274), se demostró una disminución del PGA del CC en un 58% a las 12 semanas de tratamiento en ambos grupos por igual. A las 24 semanas se observó mayor eficacia en CC y piel en el grupo de tratamiento continuo55.
Bagel et al. publicaron un estudio aleatorizado, doble ciego, controlado con placebo con el objetivo de evaluar la eficacia de ETN en pacientes con Ps moderada-grave y afectación del CC. Se puso de manifiesto que ETN 50mg administrado 2 veces a la semana disminuyó el PSSI en un 87% a las 12 semanas, comparado con un 20% en el grupo placebo. Asimismo, ETN administrado 50mg una vez por semana mantuvo la respuesta en el CC hasta la semana 2453.
En un estudio aleatorizado, doble ciego y controlado con placebo de Tyring et al., en donde se evaluaron pacientes con Ps y afectación del CC tratados con ETN, valorando el resultado comunicado por los pacientes (, Patient-reportedoutcomes [PRO]) que incluía prurito, dolor, la calidad de vida relacionada con el estado de salud (HRQoL), la depresión, el estrés emocional y la satisfacción del paciente con el tratamiento los autores observaron una diferencia significativa entre el PRO de los pacientes que fueron tratados con ETN y el de los pacientes tratados con placebo a las 12 semanas de tratamiento56.
AdalimumabEn el ensayo clínico BELIEVE (multicéntrico y aleatorizado) se evaluó la eficacia de la combinación de ADA, según la pauta indicada en su ficha técnica, junto con tratamiento tópico (calcipotriol 50μg/g más betametasona 0,5mg/g) en pacientes con Ps moderada-grave que habían tenido una respuesta insuficiente a tratamientos sistémicos previos. A pesar de que no se contemplaba la aplicación del tratamiento tópico en el CC ni en las uñas, se evaluó la respuesta a ADA utilizando el PSSI y el NAPSI a las semanas 0, 8 y 16 del inicio del tratamiento. El 91,3% (663/730) de los pacientes del estudio tenían PsCC (PSSI>0).Tras 16 semanas de tratamiento la reducción media en el índice PSSI fue del 77,2%36.
Autores japoneses, en un estudio observacional prospectivo cuyo objetivo fue comparar la eficacia terapéutica de ADA vs la de IFX en el tratamiento de la PsV, evaluaron también el impacto de ambos en la PsCC. Para ello, se incluyeron 21 pacientes, alguno de los cuales estaba en tratamiento tópico concomitante con análogos de la vitamina D, que fueron tratados con ADA o IFX, según la preferencia del paciente. Los autores observaron una tendencia significativa a alcanzar PSSI 75 en el grupo tratado con ADA (90%) comparado con el grupo de IFX (54,5%) a la semana 1657.
En su estudio retrospectivo Sola et al. pusieron de manifiesto una mejoría significativa de la PsCC a las 24 semanas de tratamiento con ADA a las dosis indicadas en la ficha técnica39.
UstekinumabSe han publicado 2 casos de pacientes con Ps moderada-grave, en los que UST, a las dosis indicadas en la ficha técnica, mostró una rápida mejoría en las lesiones del CC a las 8 semanas del inicio del tratamiento, con una alta adherencia al mismo y con un impacto positivo en su calidad de vida58.
.Psoriasis palmoplantarLa PsPP es una variante de la Ps que causa una morbilidad significativa y que genera un gran impacto en la calidad de vida de los pacientes debido a las fisuras, la hiperqueratosis y en ocasiones las pústulas, que provocan dificultad para el movimiento, dolor, prurito y problemas en el ámbito social59,60. Es una de las localizaciones donde la terapia tópica suele ser más insatisfactoria y el curso clínico más recalcitrante61. Hay pocos estudios que incluyan específicamente a pacientes con PsPP, de hecho, es frecuente que constituya un criterio de exclusión para los ensayos clínicos. Por otro lado la evidencia científica es tan escasa en esta localización que no permite diferenciar entre el tratamiento de la PsPP y la pustulosis palmo-plantar. Dado que hay publicaciones sobre la inducción paradójica de Ps pustulosa palmoplantar (PsPPP) con el uso o la suspensión de fármacos biológicos anti-FNTα, el tratamiento con estos agentes en la PsPP ha sido cuestionado62.
Terapias anti-factor de necrosis tumoral αInfliximabEn un estudio multicéntrico, aleatorizado y controlado con placebo que incluyó 24 pacientes se evaluó la eficacia y la seguridad del tratamiento con IFX en la PsPP no pustulosa. A la semana 14 del inicio del tratamiento se observó una reducción significativa del 50% del área palmoplantar afectada (15% en el grupo placebo). Sin embargo, el estudio no alcanzó uno de sus objetivos principales, ya que solo un 33% de pacientes alcanzó mPPPASI 75 a la semana 14. Los autores atribuyeron estos resultados al bajo tamaño muestral del estudio y al hecho de que los pacientes incluidos tenían valores medios de PPPASI muy bajos63.
En la tabla 2 figuran el resto de estudios y casos aislados de PsPP que han sido tratados con IFX o el resto de biológicos.
Estudios retrospectivos, series de casos y casos aislados publicados en pacientes con psoriasis palmoplantar
| Fármaco | Autor | Tipo de estudio | Pacientes | Resultados |
| Infliximab | Brunasso et al.65 | Estudio retrospectivo | 5 | La media de mejoría del PASI fue 89% y la del mPPPASI del 41% a la semana 30 de tratamiento |
| Di Lernia et al.64 | Serie de casos | 4 | PPPASI 50 a las 8 semanas de tratamiento. A la semana 16: un paciente 100% de reducción del PPPASI, 2 pacientes alcanzaron PPPASI 75, y un paciente PPPASI 50 | |
| Etanercept | Weinberg66 | Caso aislado | 1 | Mujer de 59 años, tras 19 semanas de tratamiento con ETN 25mg 2 veces por semana, presentó una mejoría completa de las lesiones |
| Floristan et al.68 | Caso aislado | 1 | Niño de 10 años tratado con ETN (0,4 mg/kg) 2 veces a la semana con mejoría al mes de tratamiento y persistencia de la respuesta a los 8 meses | |
| Adalimumab | Ghate et al.70 | Caso aislado | 1 | Buena respuesta a ADA a nivel palmoplantar después de 16 semanas de tratamiento |
| Yawalkar et al.71 | Caso aislado | 1 | Mujer 59 años con PsPP severa resistente a otros tratamientos sistémicos. Recibió terapia con IFX con buena respuesta inicial, siendo suspendido por efectos secundarios. Finalmente, la paciente fue controlada con ADA | |
| Ustekinumab | Morales-Múnera et al.75 | Serie de casos | 5 | Se alcanzó una resolución completa de las lesiones a las 20 semanas con una respuesta mantenida, en una media de 15 meses, en todos los pacientes |
| Gerdes et al.77 | Serie de casos | 4 | Uno de ellos con resolución completa, otro con respuesta parcial (ambos tratados con 45mg) y 2 de ellos con respuesta no satisfactoria (uno de ellos tratado a dosis de 45mg y otro con 90mg) | |
| Bulai Livideanu et al.72 | Serie de casos | 2 | Un hombre de 42 años presenta mejoría del PPASI en un 85% a los 7 meses de tratamiento. Una mujer de 29 años con PsPP presenta una disminución del PPPASI de 40 a 14 tras 4 meses de tratamiento | |
| Nuño-González et al.73 | Caso aislado | 1 | Varón de 56 años tras 2 dosis de ustekinumab 45mg presentó resolución completa | |
| De Unamuno-Bustos et al.76 | Caso aislado | 1 | Mujer de 14 años que tras 2 dosis de 45mg presentó un blanqueamiento casi total de las lesiones |
Bissonnette et al. realizaron un estudio aleatorizado frente a placebo cuyo objetivo fue analizar la eficacia de ETN en el tratamiento de la PsPPP. Se aleatorizaron 15 pacientes (2:1), que fueron tratados con ETN 50mg o con placebo 2 veces a la semana durante 3 meses, tras los cuales todos los pacientes fueron tratados con ETN 50mg 2 veces a la semana durante 3 meses más. Se objetivó una reducción estadísticamente significativa del PPPASI en los pacientes tratados con ETN a las 24 semanas respecto a placebo (p=0,038, n=10)67.
AdalimumabEn el ensayo clínico REACH, aleatorizado y controlado con placebo, el objetivo principal fue evaluar la eficacia de ADA en el tratamiento de la PsPP. Para ello se incluyeron 72 pacientes (49 ADA, 23 placebo) que fueron aleatorizados 2:1 (ADA:placebo) durante 16 semanas. Los autores observaron que en el grupo de pacientes tratados con ADA aquellos que alcanzaron valores de NAPSI 50 o mayores también obtuvieron grados de aclaramiento en la Physician's Global Assessment (PGA) de manos y/o pies36.
Richetta et al. llevaron a cabo un estudio abierto en el que incluyeron 11 pacientes tratados con ADA administrado a dosis de 40mg sc cada 2 semanas. El 54% de ellos (6/11) mejoraron al menos un punto en el PGA, 8 de los cuales también mejoraron significativamente el DLQI a la semana 1269.
UstekinumabEn un estudio abierto de Au et al. se evaluó el tratamiento con UST según las pautas indicadas en la ficha técnica en pacientes con PsPP que habían sido refractarios al tratamiento con corticoides tópicos. Doce pacientes mejoraron al menos 2 puntos en el PGA palmoplantar, pero solo 7 de ellos alcanzaron la resolución completa. También se observó que 6 de los 9 pacientes de más de 100kg que fueron tratados con 90mg alcanzaron la mejoría completa a las 16 semanas. Por el contrario, solo uno de los 11 pacientes de menos de 100kg tratados con 45mg alcanzó la resolución completa a las 16 semanas. A la luz de estos resultados los autores sugirieron que la dosis de 90mg podría ser la dosis efectiva de UST en el tratamiento de la PsPP74.
Efectos adversos en el cuero cabelludo y las palmas-plantas durante la terapia biológicaDe la misma forma que se ha comentado para las uñas, tanto en el CC como en las palmas y las plantas se ha descrito la aparición de lesiones psoriasiformes en el curso de la terapia biológica.
En la literatura se han comunicado 15 casos de alopecia en el CC asociada a lesiones psoriasifomes en el curso de la terapia con anti-FNTα. Dos de los casos descritos han sido formas de alopecia cicatricial, y en el resto parecidas clínicamente a las de la alopecia areata o a las de la alopecia psoriásica78,79. En la biopsia cutánea se observan cambios epidérmicos psoriasifomes, a diferencia de la alopecia areata, e infiltrados en la dermis de células plasmáticas y eosinófilos, a diferencia de la alopecia psoriásica. Con estos hallazgos clínicos e histológicos Doyle et al.80 sugieren que se trata de una nueva causa de alopecia no cicatricial. Respecto al tratamiento, en general, los pacientes mostraron buena respuesta al tratamiento tópico. En casos graves se aconseja suspender la terapia anti-FNTα debido al riesgo de alopecia cicatricial78–80.
Más frecuentes son los efectos adversos paradójicos observados en las palmas y las plantas durante el tratamiento con agentes anti-FNTα. Así lo han estudiado Joyau et al., quienes han llevado a cabo una búsqueda bibliográfica exhaustiva en la literatura y en el registro de farmacovigilancia de Francia acerca de las reacciones paradójicas que acontecen en el transcurso de dicha terapia. Los autores han encontrado un total de 57 casos en el registro (enero 2002-septiembre 2009) y 184 casos en la literatura. Las lesiones más comunicadas fueron las pústulas, localizadas en las palmas/plantas en el 33,3% de los casos (registro francés) y en el 42,9% en la literatura. La mayor parte de estos pacientes eran mujeres de edades comprendidas entre los 40-50 años. En la actualidad se considera que estas formas de Ps que aparecen durante la terapia con anti-FNT α son formas de novo y no agravamientos de Ps preexistentes81.
Asimismo, se ha descrito un caso de agravamiento en los cambios inflamatorios, fisuras e hiperqueratosis palmoplantar tras 6 semanas de tratamiento con UST en una mujer de 35 años con espondilitis anquilosante que previamente había desarrollado una erupción eritematosa pustular en la misma región palmoplantar durante el tratamiento con IFX82.
ConclusionesEl uso de fármacos biológicos en pacientes con Ps localizada en áreas de difícil tratamiento (uñas, cuero cabelludo, palmas y plantas) está indicado cuando la Ps cumpla alguna de las siguientes condiciones: no controlable con tratamiento tópico o sistémico convencional; formas extensas (NAPSI>10); empeoramiento rápido; percepción de gravedad subjetiva (DLQI>10) y, por último, en caso de ApS asociada (tabla 3).
Recomendaciones: criterios de elegibilidad para el tratamiento biológico en localizaciones de difícil tratamiento (uñas, cuero cabelludo, palmas y plantas)
| El tratamiento con fármacos biológicos en pacientes con psoriasis localizada en áreas de difícil tratamiento está indicado cuando la psoriasis cumpla alguna de las siguientes condiciones: |
| a) No controlable con tratamiento tópico o sistémico convencional |
| b) Formas extensas: NAPSI>10 |
| c) Empeoramiento rápido |
| d) Percepción de gravedad subjetiva: DLQI>10 |
| e) Artropatía psoriásica asociada |
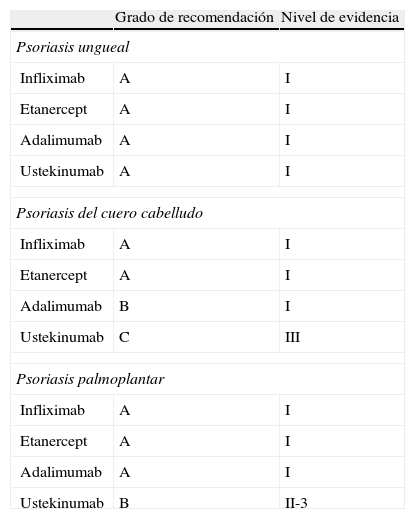
En el caso de la Ps ungueal, los 4 biológicos evaluados (IFX, ETN, ADA y UST) disponen de un nivel i de calidad científica y un grado A de recomendación. En cambio, el nivel de evidencia es algo inferior tanto en el caso de la PsCC como palmoplantar (tabla 4).
Grado de recomendación y calidad de la evidencia de los tratamientos biológicos para la psoriasis en localizaciones de difícil tratamiento
| Grado de recomendación | Nivel de evidencia | |
| Psoriasis ungueal | ||
| Infliximab | A | I |
| Etanercept | A | I |
| Adalimumab | A | I |
| Ustekinumab | A | I |
| Psoriasis del cuero cabelludo | ||
| Infliximab | A | I |
| Etanercept | A | I |
| Adalimumab | B | I |
| Ustekinumab | C | III |
| Psoriasis palmoplantar | ||
| Infliximab | A | I |
| Etanercept | A | I |
| Adalimumab | A | I |
| Ustekinumab | B | II-3 |
Los Dres. Manuel Sánchez-Regaña, Isabel Belinchón, José Manuel Carrascosa, Carlos Ferrándiz, David Vidal, Ricardo Ruiz y Eduardo Fonseca han participado en ensayos clínicos, han efectuado asesorías y/o han recibido honorarios por conferencias, o financiación para asistir a actividades de formación con el patrocinio de alguna de las siguientes compañías farmacéuticas: Abbvie (antes Abbott), Janssen, MSD y Pfizer.
El Dr. Esteban Daudén realiza o ha realizado las siguientes actividades: miembro de Advisory Board, consultor, recepción de becas, apoyo a la investigación, participación en ensayos clínicos, honorarios por impartir ponencias con las siguientes compañías farmacéuticas: Abbvie (Abbott), Amgen, Astellas, Biogen, Centocor Ortho Biotech Inc., Galderma, Glaxo, Janssen-Cilag, Leo Pharma, MSD, Pfizer, Novartis, Stiefel y Celgene.
| Calidad de la evidencia | Tipo de estudio |
| I | Al menos un ensayo clínico controlado y aleatorizado diseñado de forma apropiada |
| II-1 | Ensayos clínicos controlados bien diseñados, pero no aleatorizados |
| II-2 | Estudios de cohortes o de casos y controles bien diseñados, preferentemente multicéntricos |
| II-3 | Múltiples series comparadas en el tiempo, con o sin intervención, y resultados sorprendentes en experiencias no controladas |
| III | Opiniones de autoridades respetadas basadas en experiencias clínicas, estudios descriptivos, observaciones clínicas o informes de comités de expertos |
| IV | Evidencia inadecuada debido a problemas de metodología (por ejemplo tamaño de la muestra, tiempo de seguimiento o conflictos de evidencia) |
Fuente: Harris et al.83
Grado de recomendación y calidad de la evidencia de los tratamientos biológicos para la psoriasis en localizaciones de difícil tratamiento
| Grado de recomendación | Significado |
| A | Extremadamente recomendable (buena evidencia de que la medida es eficaz y los beneficios superan ampliamente a los perjuicios) |
| B | Recomendable (al menos moderada evidencia de que la medida es eficaz y los beneficios superan a los perjuicios) |
| C | Ni recomendable ni desaconsejable (al menos moderada evidencia de que la medida es eficaz, pero los beneficios son muy similares a los perjuicios y no puede justificarse una recomendación general) |
| D | Desaconsejable (al menos moderada evidencia de que la medida es ineficaz o de que los perjuicios superan a los beneficios) |
| E | Evidencia insuficiente, de mala calidad o contradictoria, y el balance entre beneficios y perjuicios no puede ser determinado |