La mayoría de las evaluaciones económicas publicadas sobre terapias biológicas en el tratamiento de la psoriasis no reflejan la práctica clínica habitual ni incorporan el coste asociado al manejo de los pacientes.
ObjetivoEl objetivo del presente estudio es establecer un modelo de la eficiencia de los fármacos biológicos en el tratamiento de la psoriasis, incorporando el coste asociado al manejo de los pacientes en función de la respuesta que se hace en la práctica clínica habitual.
MétodosSe ha desarrollado un modelo de árbol de decisión que incorpora la probabilidad de respuesta y fracaso de adalimumab, etanercept, infliximab y ustekinumab tras 24 semanas de tratamiento (final de la fase de inducción) obtenida a partir de un metaanálisis. Se han considerado costes sanitarios directos: farmacológicos y de administración (euros, 2015). Este análisis se ha llevado a cabo desde la perspectiva del hospital, considerando un horizonte temporal de un año.
ResultadosSegún el modelo propuesto, el coste medio anual por estrategia de tratamiento de inicio más bajo corresponde a aquellos pacientes que inician tratamiento con ustekinumab, aunque las diferencias porcentuales con infliximab y adalimumab no llegan al 3%. Considerando un presupuesto fijo de 1.000.000€, la estrategia de inicio que permite tratar con éxito a mayor número de pacientes durante un año según este modelo sería ustekinumab (66), seguido de infliximab (62), adalimumab (59) y etanercept (50). Los análisis de sensibilidad confirman la consistencia de estos resultados, aunque, teniendo en cuenta los intervalos de confianza de la eficacia incremental observada en el metaanálisis, las diferencias encontradas probablemente no sean significativas en todas las posibles comparaciones binarias, y las posibles modificaciones en la estructura real de precios, en las características de la población o en las estrategias y objetivos terapéuticos en cada centro pueden dar lugar a variaciones importantes en la vida real.
ConclusionesEl coste del manejo de los pacientes que no alcanzan una respuesta adecuada durante la fase de inducción no debe ser ignorado, puesto que es determinante a la hora de establecer la eficiencia del tratamiento. La información que proporciona este análisis debe contrastarse con los datos reales de la práctica clínica española en cada contexto geográfico y hospitalario para optimizar la asignación de recursos y tratar a un mayor número de pacientes de manera eficiente.
Most economic evaluations in the literature on the subject of biologic therapy for the treatment of psoriasis do not reflect normal clinical practice or consider the cost of patient management.
ObjectiveThe objective of the present study is to establish a model for assessing the efficiency of biologic therapies in the treatment of psoriasis taking into account the cost of managing treatment which, in routine clinical practice, depends on patient response.
MethodsWe developed a model based on a decision tree that incorporates the probability of treatment response or failure with adalimumab, etanercept, infliximab, and ustekinumab after 24 weeks of therapy (end of the induction phase). The probability in each case was calculated using data from a meta-analysis. The following direct health costs were taken into account: the cost of drugs and their administration in euro (2015). Our analysis was based on the cost of 12 months of treatment administered in a hospital setting.
ResultsAccording to the proposed model, the mean cost per year by initial treatment strategy was lowest for patients who started treatment with ustekinumab, although the percentage cost difference between ustekinumab and infliximab or adalimumab was less than 3%. With a fixed budget of €1,000,000, the initial treatment option that would achieve success in the largest number of patients for one year would, according to this model, be ustekinumab (66 patients), followed by infliximab (n = 62), adalimumab (n = 59), and etanercept (n = 50). Sensitivity analysis confirmed the reliability of these results. However, considering the confidence intervals of the incremental efficacy observed in the meta-analysis, the differences found are probably not significant in all the possible binary comparisons. Likewise, possible differences in actual price structures, populations, and the strategies and therapeutic objectives of each hospital could all give rise to considerable variations in real life.
ConclusionsThe cost of managing treatment in patients who fail to achieve an acceptable response during the induction phase should also be considered since such costs are a determining factor in any assessment of treatment efficiency. To achieve the optimum allocation of resources and to treat more patients efficiently, the information provided by this analysis should be cross-checked with real data taken from actual clinical practice in Spain collected in each geographical region and hospital.
Los fármacos biológicos han supuesto un gran avance en el tratamiento de la psoriasis moderada a grave, al permitir un mayor control de la enfermedad. Actualmente se dispone en el mercado español de 4 fármacos biológicos para el tratamiento de la psoriasis: adalimumab, etanercept, infliximab y ustekinumab1.
Debido al elevado coste de estos tratamientos, resulta muy relevante evaluar su eficiencia2 (relación entre los resultados en salud que ofrecen y el coste que conllevan), mediante estudios que ayuden a optimizar su utilización en la práctica clínica, para permitir una mejor asignación de recursos que maximice el beneficio obtenido por los pacientes. A tal fin, deben combinarse los modelos teóricos, basados en asunciones derivadas de la evidencia científica disponible, con los resultados en la práctica real. Los costes indirectos resultan muy difíciles de evaluar en la práctica clínica y de incluir en modelos económicos, por lo que el análisis de los costes de adquisición (y de administración, cuando sean relevantes) del fármaco representa una alternativa válida. Sin embargo, la evaluaciones económicas disponibles se centran en la pauta posológica recomendada en la ficha técnica o en el consumo de fármacos realizado en el Servicio de Farmacia y no reflejan la práctica clínica habitual, ya que no incorporan el coste asociado al manejo de los pacientes en función de la respuesta3–8.
Una particularidad del tratamiento de la psoriasis con fármacos biológicos es que requiere un periodo de inducción, al final del cual pueden tomarse diversas decisiones de forma individualizada en función de la respuesta. En pacientes con fracaso terapéutico o respuesta insuficiente se puede intensificar la exposición (aumentar la dosis o la frecuencia de administración) o sustituir el fármaco original por otro tratamiento; ambas opciones conllevan un sobrecoste significativo9,10. En pacientes con respuesta excelente, puede ajustarse la exposición a la baja (reducción de dosis o frecuencia de administración)11, lo que implica una disminución del coste de adquisición.
El objetivo del presente estudio es evaluar un modelo de la eficiencia de los fármacos biológicos en el tratamiento de la psoriasis, incorporando el coste asociado al manejo de los pacientes en función de la respuesta que se hace en la práctica clínica habitual.
MétodosSe ha desarrollado un modelo que integra la eficacia comparada de los tratamientos biológicos tras 24 semanas de tratamiento (momento en que, por lo general, se recomienda tomar una decisión respecto al mantenimiento, minoración o intensificación de la dosis o la sustitución del fármaco11) y el coste asociado al tratamiento farmacológico hasta el final del primer año desde el inicio del tratamiento.
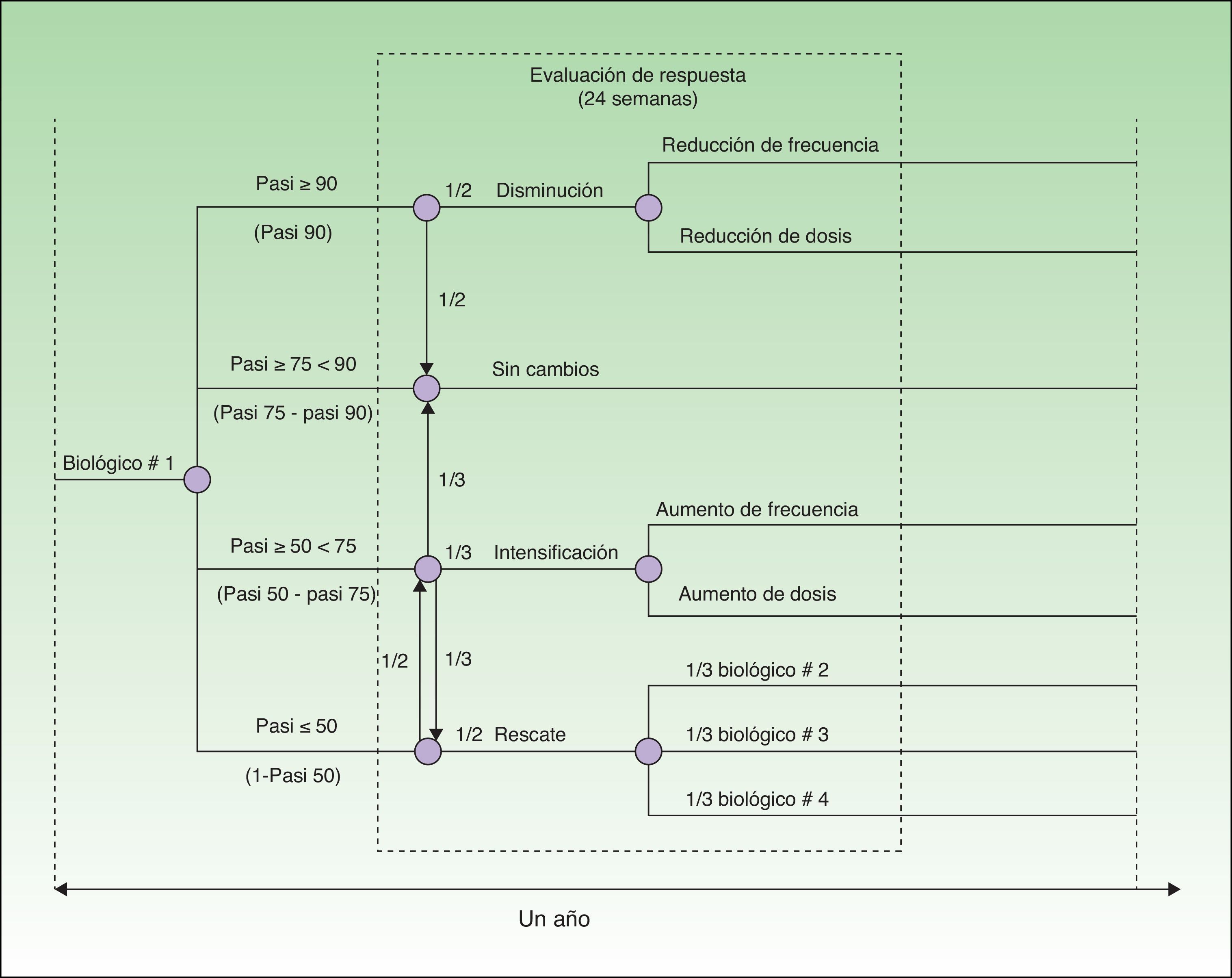
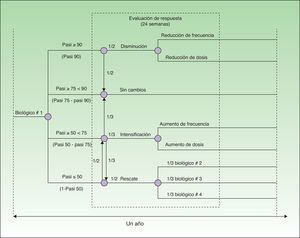
Diseño del modeloEl modelo se ha realizado desde la perspectiva del hospital (farmacia hospitalaria) y abarca un horizonte temporal de 52 semanas. Está basado en un árbol de decisión con cada una de las alternativas evaluadas (adalimumab, etanercept, infliximab o ustekinumab) que tiene en cuenta la intensificación o minoración de la dosis y la sustitución del fármaco en función de la probabilidad de respuesta en la semana 24 obtenida a partir de un metaanálisis recientemente publicado12 (fig. 1).
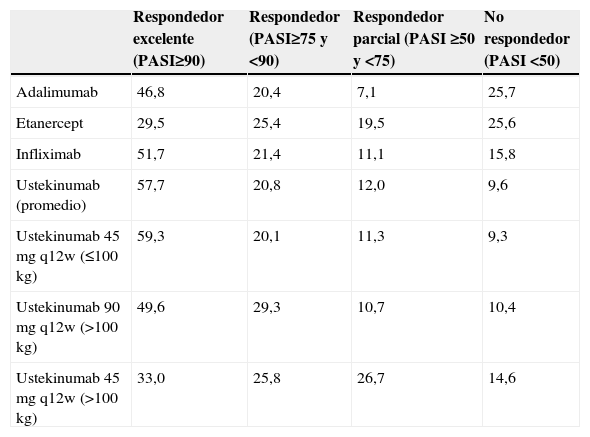
Para el desarrollo del modelo se ha tomado como referencia el Consenso Europeo sobre objetivos de tratamiento13, adaptándolo a la práctica clínica de nuestro país. En este modelo se distribuye a los pacientes en 4 grupos en función de las tasas de respuesta PASI50, PASI75 y PASI90 (mejoría en el Psoriasis Area and Severity Index [PASI] de al menos un 50, 75 y 90%, respectivamente). Los pacientes que alcanzan respuesta PASI90 (respondedores excelentes) pueden continuar con la pauta posológica inicial o bien reducir la dosis o frecuencia de administración del biológico. Los pacientes con respuesta PASI75 que no alcanzan una respuesta PASI90 (respondedores) continúan con la pauta posológica inicial. Los pacientes con respuesta comprendida entre PASI50 y PASI75 (respondedores parciales) pueden continuar con la pauta posológica inicial, intensificarla (aumentar dosis o frecuencia) o cambiar de biológico. En los pacientes que no alcanzan una respuesta PASI50 se puede intensificar la pauta posológica o sustituir el biológico.
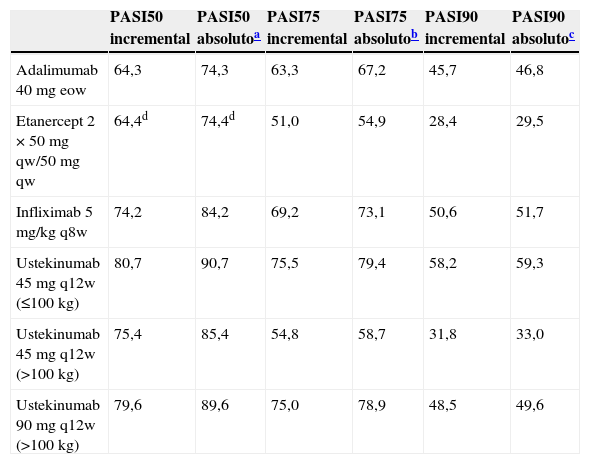
Datos de eficaciaLa distribución de pacientes en función de la respuesta (tabla 1) se ha determinado según las tasas de eficacia absolutas de cada fármaco biológico obtenidas a partir de las tasas de eficacia incremental frente a placebo publicadas en el metaanálisis de referencia12 (tabla 2). Para el cálculo de las tasas de eficacia absolutas se ha considerado una tasa de respuesta al placebo promedio del 10,0, 3,9 y 1,1% para la respuesta PASI50, 75 y 90 respectivamente (obtenidas a partir de la imputación de la última observación realizada hasta la semana 24, agrupando a los pacientes tratados con placebo en el metaanálisis12).
Distribución de pacientes en función de la respuesta
| Respondedor excelente (PASI≥90) | Respondedor (PASI≥75 y <90) | Respondedor parcial (PASI ≥50 y <75) | No respondedor (PASI <50) | |
|---|---|---|---|---|
| Adalimumab | 46,8 | 20,4 | 7,1 | 25,7 |
| Etanercept | 29,5 | 25,4 | 19,5 | 25,6 |
| Infliximab | 51,7 | 21,4 | 11,1 | 15,8 |
| Ustekinumab (promedio) | 57,7 | 20,8 | 12,0 | 9,6 |
| Ustekinumab 45mg q12w (≤100kg) | 59,3 | 20,1 | 11,3 | 9,3 |
| Ustekinumab 90mg q12w (>100kg) | 49,6 | 29,3 | 10,7 | 10,4 |
| Ustekinumab 45mg q12w (>100 kg) | 33,0 | 25,8 | 26,7 | 14,6 |
q12w: cada 12 semanas.
Tasas de respuesta en la semana 24
| PASI50 incremental | PASI50 absolutoa | PASI75 incremental | PASI75 absolutob | PASI90 incremental | PASI90 absolutoc | |
|---|---|---|---|---|---|---|
| Adalimumab 40mg eow | 64,3 | 74,3 | 63,3 | 67,2 | 45,7 | 46,8 |
| Etanercept 2×50mg qw/50mg qw | 64,4d | 74,4d | 51,0 | 54,9 | 28,4 | 29,5 |
| Infliximab 5mg/kg q8w | 74,2 | 84,2 | 69,2 | 73,1 | 50,6 | 51,7 |
| Ustekinumab 45mg q12w (≤100kg) | 80,7 | 90,7 | 75,5 | 79,4 | 58,2 | 59,3 |
| Ustekinumab 45mg q12w (>100 kg) | 75,4 | 85,4 | 54,8 | 58,7 | 31,8 | 33,0 |
| Ustekinumab 90mg q12w (>100kg) | 79,6 | 89,6 | 75,0 | 78,9 | 48,5 | 49,6 |
eow: a semanas alternas; qw: semanal; q8w: cada 8 semanas; q12w: cada 12 semanas.
Datos en porcentaje.
Fuente: Mrowietz et al.13.
Este análisis se ha realizado desde la perspectiva del hospital, considerando únicamente los costes directos sanitarios (costes del tratamiento farmacológico y coste de administración, si procede) de cada uno de los fármacos biológicos al precio financiado vigente en abril de 201514, menos la deducción obligatoria correspondiente15, más el 4% de IVA. En el caso de infliximab, para el cálculo de costes se ha considerado el aprovechamiento de viales y el coste asociado a la infusión intravenosa (259,21€)16. Los costes anuales se han calculado prorrateando la última dosis recibida, ajustando el coste al intervalo de semanas restantes hasta alcanzar la semana 52.
Los costes de tratamiento se han calculado de acuerdo con las pautas posológicas recomendadas en la ficha técnica17–20: adalimumab 40mg administrado cada 2 semanas, tras una dosis de inducción de 80mg y otra de 40mg al cabo de una semana; etanercept 50mg 2 veces a la semana durante 12 semanas seguido de 50mg cada semana; infliximab 5mg/kg administrado en semana 0, 2 y 6, seguido de 5mg/kg cada 8 semanas y ustekinumab 45mg o 90mg en semanas 0 y 4, y después cada 12 semanas. A partir de la semana 24, los costes de tratamiento se han calculado según la pauta posológica en función de la respuesta (fig. 1).
En el caso de tratamientos con administración en función del peso (ustekinumab e infliximab), se ha calculado un coste promedio según la distribución de peso corporal de la población española con psoriasis tratada con fármacos biológicos, proporcionada por el Registro Español de tratamientos sistémicos en psoriasis (BiobadaDerm)21: <60 kg (13,2%); 61-80kg (41,6%); 81-100 kg (36,0%); 101-120 (6,8%); >120 kg (2,5%).
Evaluación de la eficienciaA partir del coste medio anual y de la proporción de pacientes que continúan con el biológico de inicio, se ha calculado el coste por paciente tratado con éxito al cabo de un año para cada estrategia de inicio de tratamiento.
Dicho coste medio anual por estrategia de inicio refleja el coste asociado a la decisión de iniciar el tratamiento con un determinado fármaco, y se compone del coste del tratamiento biológico administrado en primer lugar más el coste del tratamiento posterior en función de la respuesta observada en la semana 24.
Otra manera de evaluar la eficiencia sería determinar qué opción, con un mismo presupuesto, ofrece mejores resultados en salud (máximo número de pacientes tratados con éxito y mínimo número de pacientes tratados sin éxito). En este caso, para un presupuesto anual fijo de 1.000.000€ se ha determinado, en función del coste medio anual y de la respuesta en la semana 24, cuántos pacientes mantienen el tratamiento inicial (tratados con éxito) y cuántos necesitan ser rescatados con otro biológico (tratados sin éxito) al cabo de un año.
Caso baseLos pacientes considerados respondedores excelentes (respuesta PASI90, o mejoría ≥90% con respecto al PASI basal) mantienen la pauta posológica de inicio sin cambios o la disminuyen, en la misma proporción (1:1). Los respondedores (respuesta PASI75-90, o mejoría ≥75% pero <90% con respecto al PASI basal) mantienen la pauta posológica de inicio. Los respondedores parciales (respuesta PASI50-75, o mejoría ≥50% pero <75% con respecto al PASI basal) mantienen la pauta posológica de inicio, la intensifican o cambian a otro biológico en la misma proporción (1:1:1). En el caso de pacientes no respondedores (respuesta PASI <50), intensifican la pauta posológica de inicio o son rescatados con otro biológico en proporción 1:1. El biológico seleccionado de rescate puede ser cualquiera de los otros 3 tratamientos disponibles en proporción 1:1:1. En ausencia de datos de la vida real, se ha asumido que estas proporciones pueden ser representativas del promedio de las prácticas clínicas en diversos entornos.
En este modelo se asume que los pacientes con peso superior a 100kg (9,3%) que reciben ustekinumab son tratados con 90mg o 45mg en igual proporción (1:1), puesto que ambas dosis son eficaces y están recomendadas para este tipo de pacientes en la ficha técnica20.
En los pacientes con respuesta óptima en los que se disminuye la exposición al tratamiento, la modificación de la pauta posológica implica una reducción de la dosis o de la frecuencia de administración. En este modelo se han asumido los supuestos que se enuncian a continuación. Con adalimumab se reduce la frecuencia de administración cada 3 (33% de disminución en el coste de adquisición) y cada 4 semanas (50% de disminución) en proporción 3:1. Con etanercept se reduce la dosis a 25mg semanales o la frecuencia a 50mg cada 2 semanas (50% de reducción del coste de adquisición) en la misma proporción. Con etanercept, cuya ficha técnica recoge el tratamiento intermitente, los respondedores (respuesta PASI75-90) y los respondedores excelentes (respuesta PASI90) que no reducen dosis ni frecuencia, reciben tratamiento continuo o intermitente en proporción 3:1. Con infliximab, por razones de inmunogenicidad, muchos clínicos prefieren no disminuir la exposición ni la dosis de infliximab; en el modelo hemos asumido que para los respondedores óptimos (PASI90), un 50% no modifican la dosis ni el intervalo de administración, un 25% pasan a recibir el tratamiento cada 10 semanas (el equivalente de bajar la dosis a 4mg/kg/día manteniendo la frecuencia) y un 25% pasan a recibirlo cada 12 semanas (33% de reducción). Con ustekinumab 45mg, se reduce la frecuencia cada 18 y cada 24 semanas en proporción 3:1. Con ustekinumab 90mg, se reduce la dosis a 45mg y se reduce la frecuencia en la misma proporción, y los que reducen la frecuencia lo hacen a cada 18 semanas y cada 24 semanas en proporción 3:1.
En caso de intensificación, la modificación de la pauta posológica implica un aumento de la dosis o de la frecuencia. Con adalimumab el modelo asume que los prescriptores aumentan la frecuencia a semanal y aumentan la dosis a 80mg cada semana en proporción 3:1. Con etanercept se aumenta la frecuencia a 50mg 2 veces por semana. Con infliximab se aumenta la frecuencia a cada 6 y cada 4 semanas en proporción 3:1. Con ustekinumab 45mg se aumenta la dosis a 90mg y se aumenta la frecuencia en proporción 1:3, y el aumento de frecuencia se hace con administración cada 10 semanas y cada 8 semanas en proporción 3:1. Con ustekinumab 90mg se aumenta la frecuencia a cada 10 semanas y cada 8 semanas en proporción 3:1.
En el caso base se considera que el cambio de tratamiento se efectúa sin período de lavado, administrando la primera dosis del nuevo fármaco en el momento en que correspondería la administración del fármaco que se considera inefectivo.
Análisis de sensibilidadPara determinar la consistencia del modelo, se han llevado a cabo varios análisis de sensibilidad deterministas sobre los parámetros más relevantes.
En el primer análisis de sensibilidad se considera que los rescates con otro biológico se realizan, con cualquiera de los otros 3 biológicos, tras un periodo de lavado de 4 semividas.
En el segundo análisis de sensibilidad los tratamientos con una frecuencia de administración en múltiplos de 4 semanas, se administran en múltiplos de meses9,22,23 (infliximab cada 2 meses y ustekinumab cada 3 meses, en lugar de cada 8 y cada 12 semanas, respectivamente).
En el tercer análisis de sensibilidad se varía la proporción de pacientes con peso corporal >100kg que son tratados con ustekinumab 45mg y 90mg en 2 escenarios extremos: todos tratados con la dosis de 90mg y todos tratados con la dosis de 45mg.
Un cuarto análisis de sensibilidad incluye el empleo de dosis de inducción (50mg 2 veces por semana durante 12 semanas) en tan solo el 50% o el 0% de los tratamientos con etanercept.
Como las asunciones sobre las proporciones de desintensificación e intensificación empleadas en el caso base son arbitrarias, se han realizado varios análisis de sensibilidad sobre la modificación de la pauta posológica en función de la respuesta. En los respondedores excelentes se analizan los 2 extremos: todos disminuyen y todos mantienen la pauta posológica de inicio. En los pacientes respondedores parciales, todos intensifican la pauta posológica y, en los no respondedores, todos son rescatados con otro biológico.
Con la finalidad de añadir información adicional y así evitar que el modelo resulte obsoleto ante posibles cambios en el precio de los tratamientos, se ha incorporado un último escenario que recoge una reducción del precio de venta de laboratorio de un 5% y 10% para adalimumab y etanercept. Debido a que infliximab y ustekinumab han variado su precio recientemente no se ha considerado ninguna variación respecto al precio de estos 2 tratamientos.
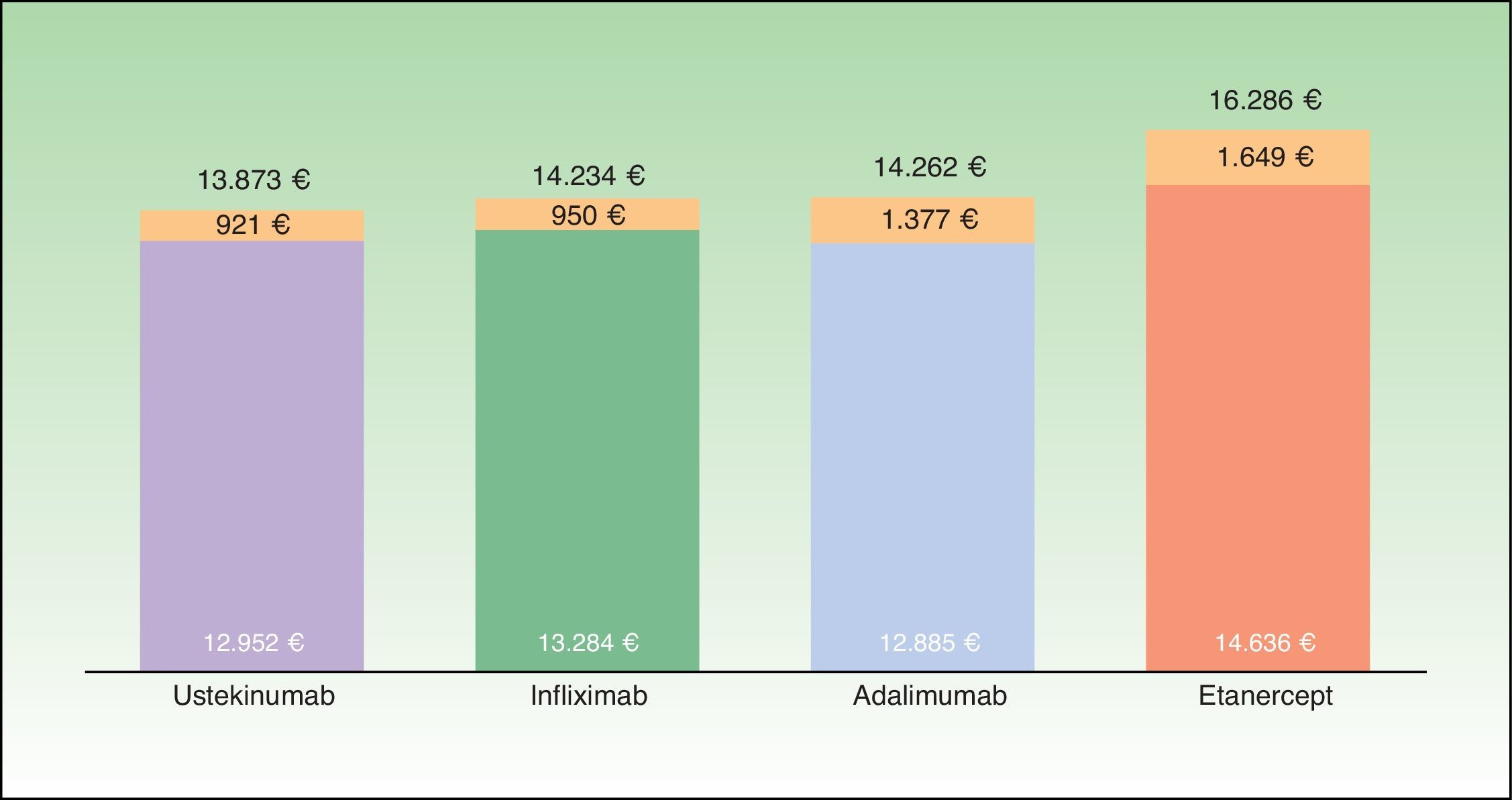
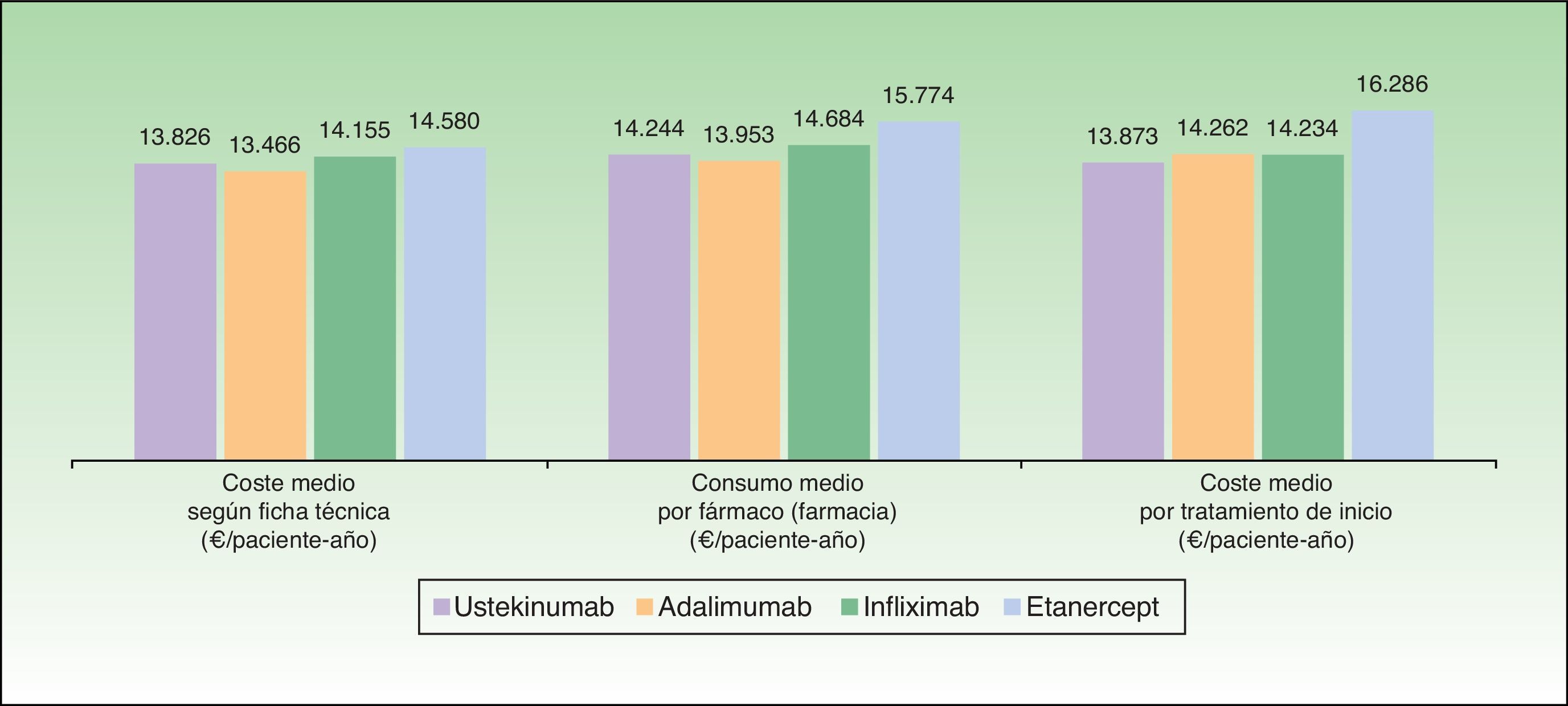
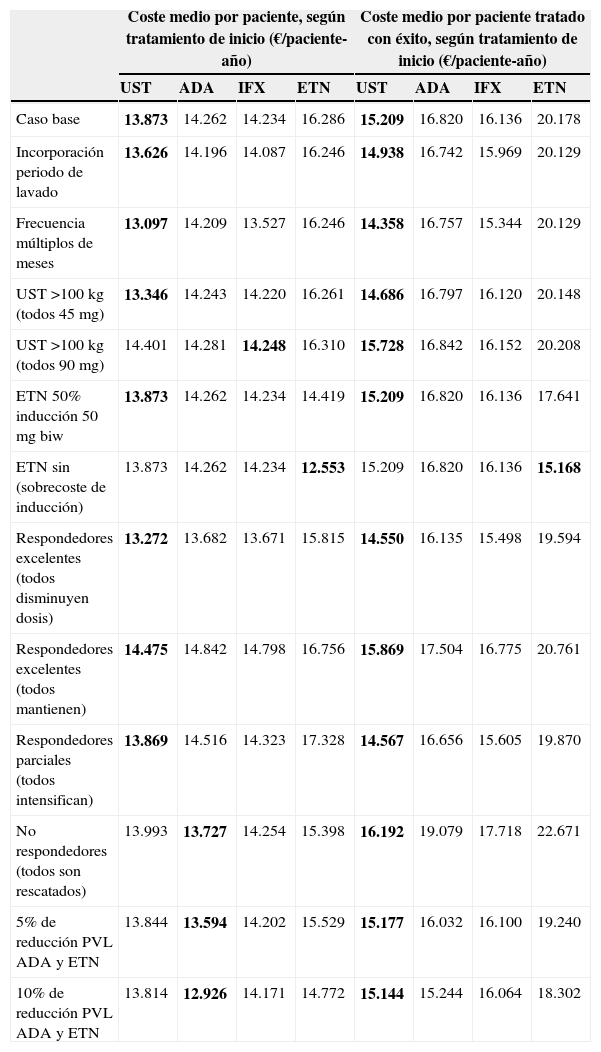
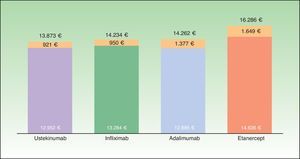
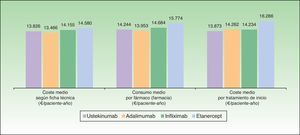
ResultadosCaso baseSegún el modelo, el coste medio anual por estrategia de tratamiento de inicio más bajo corresponde a aquellos pacientes que inician tratamiento con ustekinumab (13.873€), seguido de infliximab (14.234€), adalimumab (14.262€) y etanercept (16.286€) (fig. 2), aunque las diferencias porcentuales con respecto al tratamiento más coste efectivo según el modelo son escasas en el caso de infliximab (2,6%) y adalimumab (2,8%). En este modelo, los costes por estrategia de tratamiento inicial difieren del coste medio teórico calculado únicamente en función de la pauta posológica recomendada en la ficha técnica (que no tiene en cuenta la disminución de la dosis en los respondedores óptimos, la intensificación o el rescate) y del consumo por paciente observado en el Servicio de Farmacia (que no tiene en cuenta que una parte del consumo corresponde al rescate de pacientes que han fracasado con otro biológico) (fig. 3).
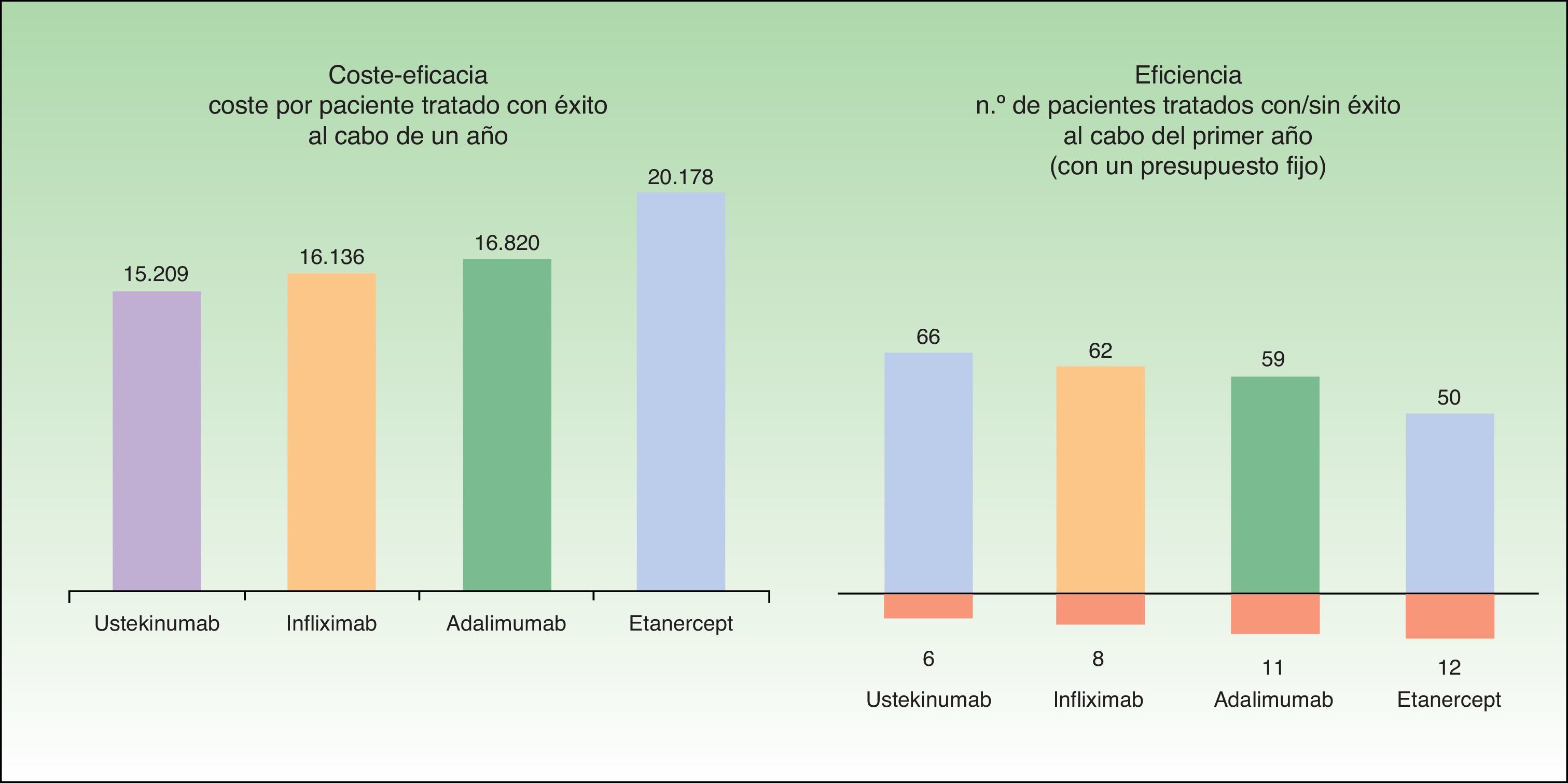
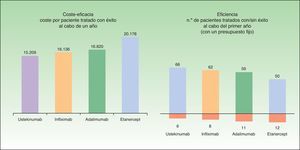
El coste medio por paciente tratado con éxito al cabo de un año según este modelo sería menor en aquellos pacientes que inician tratamiento con ustekinumab (15.209€), seguido de infliximab (16.136€), adalimumab (16.820€) y etanercept (20.178€) (fig. 4).
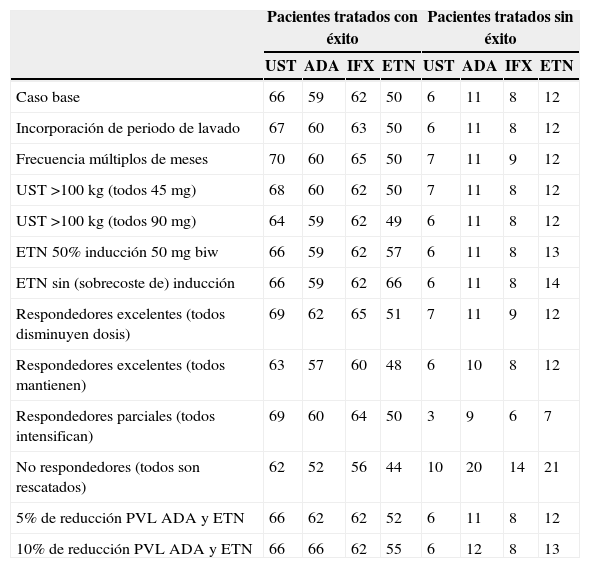
Según el modelo empleado, para un presupuesto fijo de 1.000.000€, el número de pacientes tratado con éxito (que continúan con el biológico inicial) al cabo de un año es mayor para los tratamientos iniciados con ustekinumab (66), seguido de infliximab (62), adalimumab (59) y etanercept (50). Para el mismo presupuesto, el número de pacientes tratado sin éxito (que deben ser rescatados con otro biológico) al cabo de un año es menor para los tratamientos iniciados con ustekinumab (6), seguido de infliximab (8), adalimumab (11) y etanercept (12) (fig. 4).
Análisis de sensibilidadLos resultados de los análisis de sensibilidad muestran que ustekinumab presenta el menor coste medio anualizado por tratamiento de inicio en todos los escenarios, excepto si se tratan con la dosis de 90mg todos los pacientes de más de 100kg de peso (el coste más bajo correspondería a infliximab), en el supuesto de que la inducción de etanercept no acarreara sobrecoste (el coste más bajo correspondería a etanercept) y si se rescataran con otro fármaco (sin intensificación de la dosis del fármaco inicial) todos los no respondedores o se redujera el precio de adalimumab y etanercept en un 5% o un 10% (en todos estos casos adalimumab pasaría a ser la alternativa dominante, con un menor coste anual por tratamiento) (tabla 3).
Análisis de sensibilidad. Coste medio anualizado por tratamiento de inicio y por paciente tratado con éxito, según el tratamiento inicial
| Coste medio por paciente, según tratamiento de inicio (€/paciente-año) | Coste medio por paciente tratado con éxito, según tratamiento de inicio (€/paciente-año) | |||||||
|---|---|---|---|---|---|---|---|---|
| UST | ADA | IFX | ETN | UST | ADA | IFX | ETN | |
| Caso base | 13.873 | 14.262 | 14.234 | 16.286 | 15.209 | 16.820 | 16.136 | 20.178 |
| Incorporación periodo de lavado | 13.626 | 14.196 | 14.087 | 16.246 | 14.938 | 16.742 | 15.969 | 20.129 |
| Frecuencia múltiplos de meses | 13.097 | 14.209 | 13.527 | 16.246 | 14.358 | 16.757 | 15.344 | 20.129 |
| UST >100kg (todos 45mg) | 13.346 | 14.243 | 14.220 | 16.261 | 14.686 | 16.797 | 16.120 | 20.148 |
| UST >100kg (todos 90mg) | 14.401 | 14.281 | 14.248 | 16.310 | 15.728 | 16.842 | 16.152 | 20.208 |
| ETN 50% inducción 50mg biw | 13.873 | 14.262 | 14.234 | 14.419 | 15.209 | 16.820 | 16.136 | 17.641 |
| ETN sin (sobrecoste de inducción) | 13.873 | 14.262 | 14.234 | 12.553 | 15.209 | 16.820 | 16.136 | 15.168 |
| Respondedores excelentes (todos disminuyen dosis) | 13.272 | 13.682 | 13.671 | 15.815 | 14.550 | 16.135 | 15.498 | 19.594 |
| Respondedores excelentes (todos mantienen) | 14.475 | 14.842 | 14.798 | 16.756 | 15.869 | 17.504 | 16.775 | 20.761 |
| Respondedores parciales (todos intensifican) | 13.869 | 14.516 | 14.323 | 17.328 | 14.567 | 16.656 | 15.605 | 19.870 |
| No respondedores (todos son rescatados) | 13.993 | 13.727 | 14.254 | 15.398 | 16.192 | 19.079 | 17.718 | 22.671 |
| 5% de reducción PVL ADA y ETN | 13.844 | 13.594 | 14.202 | 15.529 | 15.177 | 16.032 | 16.100 | 19.240 |
| 10% de reducción PVL ADA y ETN | 13.814 | 12.926 | 14.171 | 14.772 | 15.144 | 15.244 | 16.064 | 18.302 |
En negrita, la alternativa dominante.
ADA: adalimumab; biw: dos veces por semana; ETN: etanercept; IFX: infliximab; PVL: precio financiado vigente; UST: ustekinumab.
El menor coste promedio anualizado por paciente tratado con éxito correspondería también a ustekinumab en todos los supuestos del análisis de sensibilidad, excepto si la inducción de etanercept no acarreara sobrecoste, en cuyo caso el coste más bajo correspondería a etanercept (tabla 3). A partir de un presupuesto fijo, ustekinumab (seguido de infliximab, adalimumab y etanercept) sería el fármaco que permite tratar con éxito a un mayor número de pacientes, con un menor número de pacientes tratados sin éxito en la mayoría de los escenarios evaluados (tabla 4).
Análisis de sensibilidad. Pacientes tratados con y sin éxito con un presupuesto anual de 1.000.000€, según tratamiento de inicio
| Pacientes tratados con éxito | Pacientes tratados sin éxito | |||||||
|---|---|---|---|---|---|---|---|---|
| UST | ADA | IFX | ETN | UST | ADA | IFX | ETN | |
| Caso base | 66 | 59 | 62 | 50 | 6 | 11 | 8 | 12 |
| Incorporación de periodo de lavado | 67 | 60 | 63 | 50 | 6 | 11 | 8 | 12 |
| Frecuencia múltiplos de meses | 70 | 60 | 65 | 50 | 7 | 11 | 9 | 12 |
| UST >100kg (todos 45mg) | 68 | 60 | 62 | 50 | 7 | 11 | 8 | 12 |
| UST >100kg (todos 90mg) | 64 | 59 | 62 | 49 | 6 | 11 | 8 | 12 |
| ETN 50% inducción 50mg biw | 66 | 59 | 62 | 57 | 6 | 11 | 8 | 13 |
| ETN sin (sobrecoste de) inducción | 66 | 59 | 62 | 66 | 6 | 11 | 8 | 14 |
| Respondedores excelentes (todos disminuyen dosis) | 69 | 62 | 65 | 51 | 7 | 11 | 9 | 12 |
| Respondedores excelentes (todos mantienen) | 63 | 57 | 60 | 48 | 6 | 10 | 8 | 12 |
| Respondedores parciales (todos intensifican) | 69 | 60 | 64 | 50 | 3 | 9 | 6 | 7 |
| No respondedores (todos son rescatados) | 62 | 52 | 56 | 44 | 10 | 20 | 14 | 21 |
| 5% de reducción PVL ADA y ETN | 66 | 62 | 62 | 52 | 6 | 11 | 8 | 12 |
| 10% de reducción PVL ADA y ETN | 66 | 66 | 62 | 55 | 6 | 12 | 8 | 13 |
ADA: adalimumab; biw: dos veces por semana; ETN: etanercept; IFX: infliximab; PVL: precio financiado vigente; UST: ustekinumab.
Se han publicado diversos estudios que analizan la relación coste-eficacia de los tratamientos biológicos en psoriasis3,4,7,8,24–28, pero ninguno se ha realizado a las 24 semanas, cuando se recomienda evaluar la eficacia en la práctica clínica, ni tiene en cuenta el coste asociado al manejo de los pacientes en la práctica clínica habitual. Por otra parte, son escasos los estudios realizados a partir de costes aplicables a España.
Este modelo ofrece una visión novedosa sobre la evaluación de la eficiencia comparada de los tratamientos biológicos en psoriasis al incorporar el coste asociado al manejo de los pacientes en la práctica clínica. En este caso, para costes similares de tratamiento según ficha técnica (entre 13.466 y 14.580€) la eficiencia viene determinada principalmente por las tasas de respuesta y las posibilidades de manejo de cada biológico. La consistencia de los resultados obtenidos se confirma por los análisis de sensibilidad, que reflejan diversas alternativas reales en el manejo de los pacientes y resulta de mayor utilidad práctica que otros estudios publicados hasta la fecha.
Según este modelo, la elección de ustekinumab como tratamiento de inicio supondría un menor coste por paciente tratado con éxito y sería la alternativa que mantendría un mayor número de pacientes en tratamiento al cabo de un año y minimizaría el número de pacientes que deben ser rescatados con otro biológico. La eficacia relativa, junto con otros factores como podrían ser la escasa inmunogenicidad del fármaco o su administración trimestral, contribuiría a explicar los resultados observados en diversos registros y cohortes de pacientes en la práctica clínica habitual, que indican que ustekinumab es el biológico con mayor tasa de retención al año29–32.
El presente estudio muestra cómo las diferencias de eficacia entre los distintos biológicos12,31–35 determinan la eficiencia del tratamiento y, por tanto, tienen importantes implicaciones en la optimización del presupuesto, por lo que no debería asumirse su equivalencia terapéutica de forma general35. Según este análisis, ni el coste teórico según la ficha técnica ni el consumo observado en el Servicio de Farmacia serían apropiados para evaluar la eficiencia de los fármacos biológicos ni, por tanto, para la toma de decisiones, ya que no tienen en cuenta el coste asociado al manejo de los pacientes con respuesta insatisfactoria o excelente en la práctica clínica habitual.
Una de las principales limitaciones de este análisis es que el modelo no contempla posibles variaciones de eficacia de los tratamientos entre la semana 24 y 52, lo que perjudica a los biológicos con mayor tasa de retención durante el primer año. Asimismo, al no disponer de datos suficientes en la literatura y al evaluarse la eficacia del tratamiento de rescate al final del primer año, se ha considerado que todos los pacientes responden adecuadamente a la modificación del régimen de tratamiento o al fármaco biológico que reciben en segunda línea. En el caso de la combinación con tratamientos sistémicos clásicos, además de carecer de datos, su impacto económico es mínimo y, por tanto, no se ha incorporado en el modelo. Sería deseable disponer de datos de efectividad, a partir de registros nacionales o institucionales, para realizar un análisis que refleje aún mejor la práctica clínica habitual.
Aplicando los precios oficiales financiados vigentes en España y las tasas de respuesta comparadas basadas en el metaanálisis empleado en este modelo, ustekinumab sería el biológico más coste-eficaz en pacientes con psoriasis moderada a grave con un horizonte temporal de un año. En cualquier caso, los intervalos de confianza de la eficacia incremental de los diferentes fármacos12 no permiten afirmar que las diferencias numéricas encontradas sean significativas en todas las posibles comparaciones binarias, y las posibles modificaciones en la estructura real de precios, en las características de la población o las estrategias y objetivos terapéuticos en cada centro pueden dar lugar a variaciones importantes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónJanssen-Cilag, S.A. financió el análisis de datos independiente realizado por Pértica, España.
Conflicto de interesesLluís Puig ha recibido honorarios en concepto de consultoría y ha participado en ensayos clínicos patrocinados por Abbvie, Pfizer, Janssen y Merck. Anna López-Ferrer ha recibido honorarios como conferenciante de Janssen. Eva Vilarrasa ha participado en ensayos clínicos patrocinados por Janssen. Ignacio García y Raquel Fernández del Olmo son empleados de Janssen.