Larva migrans cutánea (LM) es una erupción serpiginosa causada por helmintos nematodos que circulan por la epidermis. Se adquiere cuando la piel entra en contacto con tierra contaminada por heces de animales infestados por estos nematodos. Hasta ahora se consideraba como enfermedad importada de zonas tropicales y subtropicales. El objetivo fue estudiar los casos de LM diagnosticados como autóctonos por no haber salido de la provincia de Guipúzcoa recientemente.
Material y métodosEstudio observacional transversal retrospectivo de los casos diagnosticados de LM en el Hospital Universitario Donostia de 2011 a 2015, sin viaje previo a ninguna zona endémica de este cuadro. El diagnóstico fue clínico ante las lesiones características. Las variables estudiadas fueron: edad, género, localización de las lesiones, fecha de inicio de los síntomas, posible fuente de contagio, datos anatomo-patológicos, tratamiento y evolución.
ResultadosSe han recogido 4 casos, todos varones, con una media de edad de 60 años. Tres casos presentaron lesiones en las extremidades inferiores, mientras que uno lo hizo en el tronco. Todos nuestros pacientes habían estado en contacto con tierra que pudiera estar contaminada por heces, siendo este el mecanismo de transmisión más probable. Se instauró tratamiento con albendazol oral, con resolución de las lesiones.
ConclusionesLa aparición de nuevos casos de LM de origen autóctono en Europa obliga al estudio de la/s especie/s causal/es, a una revisión epidemiológica de esta infestación y a planificar qué medidas se deberían tomar para evitar que una enfermedad considerada hasta ahora como importada, se convierta en autóctona.
Cutaneous larva migrans (LM) infection forms a serpiginous eruption caused by the migration of nematode helminths through the epidermis. The parasites are acquired when the skin comes into contact with soil contaminated by the feces of infected animals. Until now, infections have been believed to be imported from tropical and subtropical regions. Our aim was to study cases of cutaneous LM diagnosed in residents of the Spanish province of Guipúzcoa who had not recently traveled to such regions.
Material and methodsCross-sectional observational study of LM cases diagnosed in Hospital Universitario Donostia from 2011 to 2015 in patients who had not visited a region where this nematode infection is endemic. Clinical diagnoses were based on characteristic lesions. We studied the following variables: age, sex, site of lesions, date of onset of symptoms, possible source of contagion, pathologic findings, treatment, and clinical course.
ResultsWe found 4 cases, all in men (mean age, 60 years). Lesions were on the lower extremities in 3 patients and on the trunk in 1 patient. All had been in contact with soil that could have been contaminated by feces and was the most likely source of the parasite. The lesions disappeared after treatment with oral albendazole.
ConclusionsThe appearance of cases of autochthonous LM in Europe requires investigation of the culprit species, a review of the epidemiology of this infection, which was once considered imported, and the planning of public health measures to prevent it from becoming endemic.
El término larva migrans (LM) cutánea se aplica a la erupción eritematosa y pruriginosa de morfología serpiginosa que avanza por uno de sus extremos, causada por la migración de larvas de helmintos nematodos a través de la epidermis1,2. Es la enfermedad importada de origen tropical más frecuente3,4. El diagnóstico es clínico, basado en la observación de las lesiones cutáneas características. El estudio anatomo-patológico no es necesario para su diagnóstico; si se realiza, debe saberse que la larva se encuentra uno o 2 cm por delante del extremo de avance de la lesión serpiginosa, por lo que es poco probable encontrar estructuras parasitarias en la biopsia2.
Existen múltiples especies de nematodos que pueden dar lugar a este proceso, siendo el Ancylostoma braziliense el principal agente causal en humanos5. La mayor parte de estas especies se localizan en regiones de clima cálido, siendo por tanto considerada como enfermedad importada en nuestro medio.
Las especies causales de LM en su forma adulta colonizan el tracto digestivo de perros y gatos, desde donde producen huevos que serán eliminados por las heces6. Estos animales son los huéspedes definitivos2, ya que la larva puede completar su ciclo vital en ellos. Si se reúnen las condiciones ambientales óptimas de temperatura y humedad7, los huevos eliminados por las heces eclosionan dando lugar a larvas que maduran hasta llegar al estadio filariforme (infectivo). Al alcanzar esta fase pueden entrar por la piel infestando a un nuevo animal y así completar su ciclo vital, o bien introducirse en la piel del ser humano. Al penetrarla, la larva origina una pápula o vesícula de pequeño tamaño eritematosa y pruriginosa, que se abre camino a través de la epidermis, avanzando a un ritmo aproximado de 2-3 cm al día1; dando lugar a las lesiones características: serpiginosas, eritematosas e intensamente pruriginosas. Es frecuente observar varios trayectos serpiginosos simultáneos en un mismo paciente8. A medida que la larva avanza, el extremo distal de la lesión se vuelve seco y costroso. Al carecer de la enzima necesaria para atravesar la membrana basal cutánea humana (colagenasa)9 no pueden llegar a los vasos sanguíneos ni linfáticos, por lo que migran por la epidermis durante un tiempo indeterminado hasta que mueren sin poder completar su ciclo vital. Aun así, se ha descrito un caso de LM visceral por Ancylostoma caninum10.
La evolución natural es la resolución espontánea de las lesiones en uno o 2 meses2 debido a la respuesta inmunitaria desencadenada. Se han descrito casos de lesiones persistentes durante 2 años11. Las posibles complicaciones (sobreinfección bacteriana o reacciones alérgicas) y el intenso prurito hacen recomendable el tratamiento.
El objetivo de este trabajo fue revisar los casos de LM sin antecedente epidemiológico de viaje reciente a regiones endémicas, tratándose, por tanto, de casos autóctonos.
Material y métodosEstudio observacional retrospectivo de los pacientes diagnosticados de LM en el servicio de Dermatología del Hospital Universitario Donostia, entre agosto del 2011 y junio del 2015. Todos ellos eran habitantes de Guipúzcoa, sin antecedentes de viaje reciente fuera de esta provincia.
Las variables analizadas fueron edad, género, fecha de inicio del cuadro, cuál fue el posible contacto con tierra contaminada por larvas, localización de las lesiones en el cuerpo de los pacientes, características de la biopsia en caso de que se realizara y condiciones climatológicas durante los meses previos que podrían haber favorecido la aparición de este proceso.
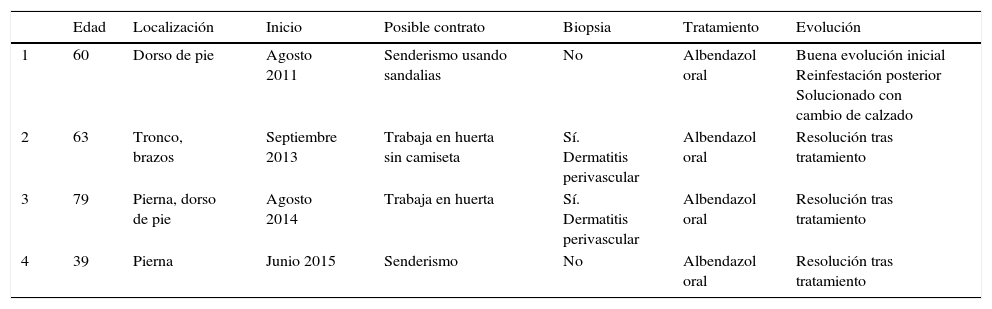
ResultadosSe estudió a 4 pacientes, todos varones, de edades comprendidas entre los 39 y 79 años, con una media de edad de 60 años. Negaban viaje reciente al extranjero, aunque sí explicaban contacto reciente con tierra posiblemente contaminada por heces de animales en hábitat rural. En la tabla 1 se recogen las principales características clínicas y epidemiológicas de todos ellos, así como el posible contexto en el que se produjo el contacto con la larva.
Características clínicas y epidemiológicas de los pacientes de la serie
| Edad | Localización | Inicio | Posible contrato | Biopsia | Tratamiento | Evolución | |
|---|---|---|---|---|---|---|---|
| 1 | 60 | Dorso de pie | Agosto 2011 | Senderismo usando sandalias | No | Albendazol oral | Buena evolución inicial Reinfestación posterior Solucionado con cambio de calzado |
| 2 | 63 | Tronco, brazos | Septiembre 2013 | Trabaja en huerta sin camiseta | Sí. Dermatitis perivascular | Albendazol oral | Resolución tras tratamiento |
| 3 | 79 | Pierna, dorso de pie | Agosto 2014 | Trabaja en huerta | Sí. Dermatitis perivascular | Albendazol oral | Resolución tras tratamiento |
| 4 | 39 | Pierna | Junio 2015 | Senderismo | No | Albendazol oral | Resolución tras tratamiento |
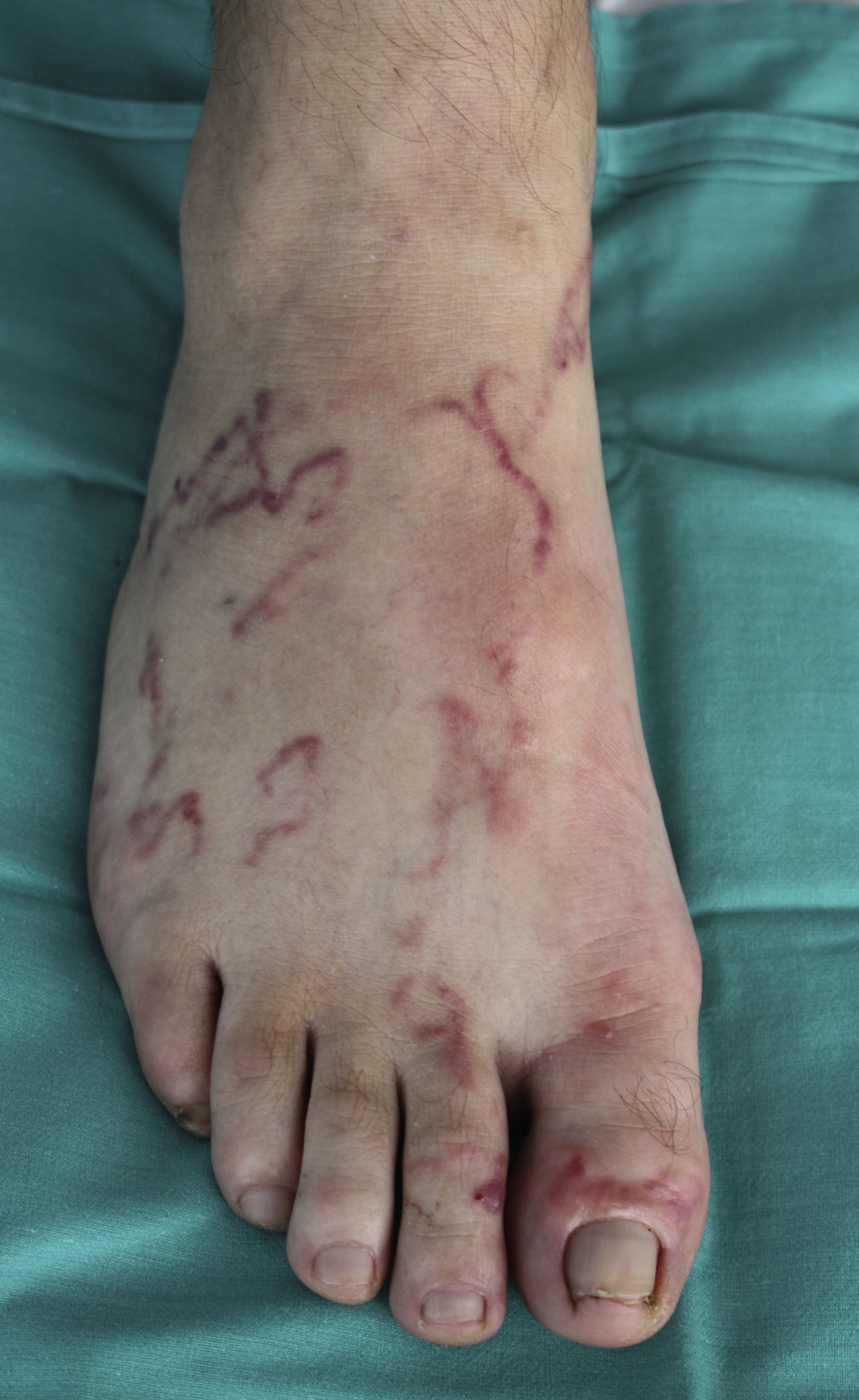
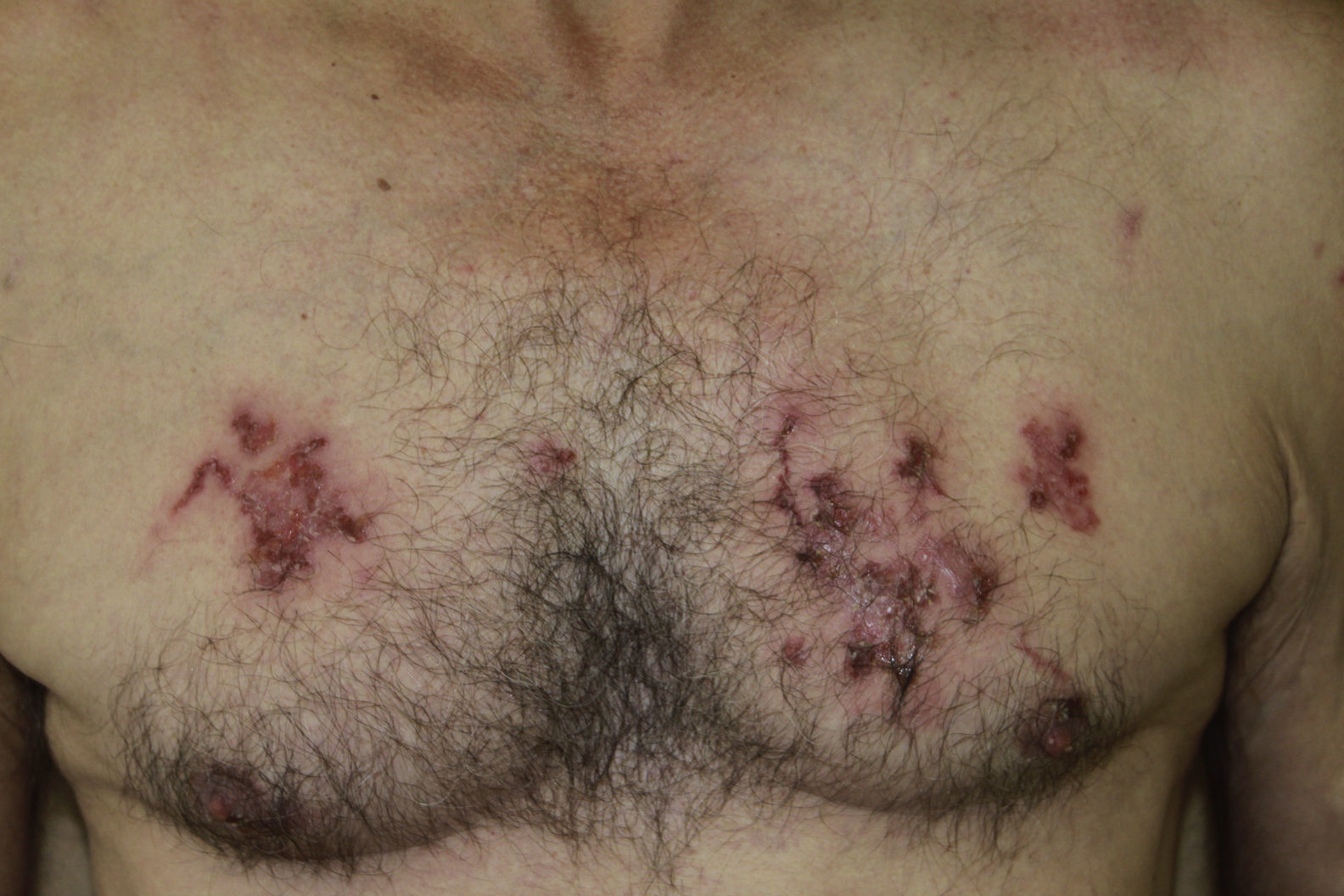
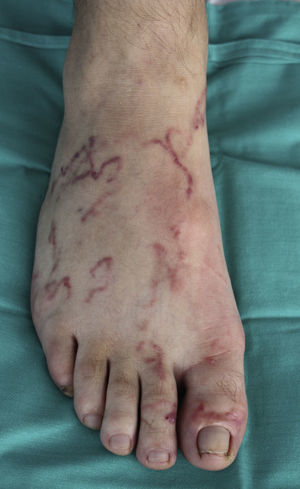
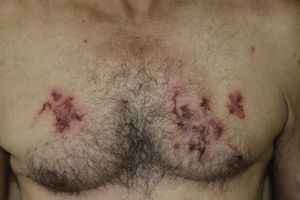
La localización de las lesiones cutáneas fue en las extremidades inferiores en 3 de los casos (fig. 1) y en el tronco en uno de ellos (fig. 2). Este último refería trabajar en la huerta sin camiseta, entrando en contacto de forma repetida con tierra que pudiera estar contaminada.
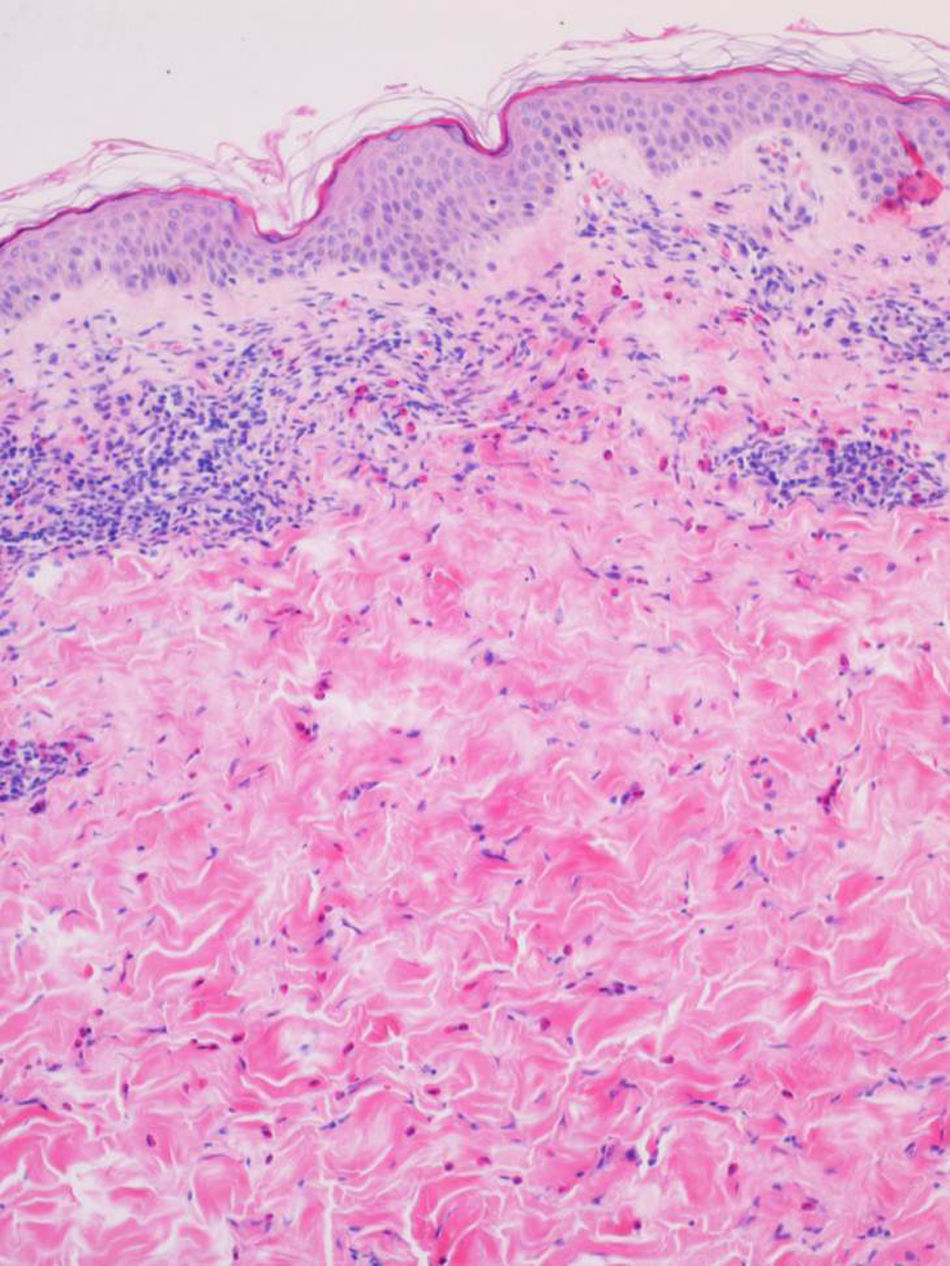
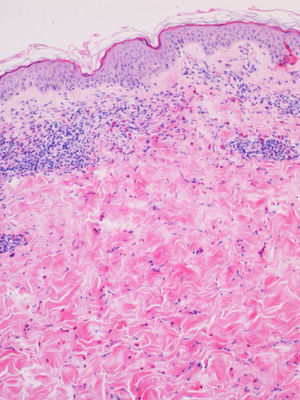
A 2 de ellos se les realizó biopsia y analítica, presentando hallazgos similares en ambos casos. La anatomía patológica mostró una dermatitis perivascular superficial y profunda con predominio de eosinófilos (fig. 3). En el análisis sanguíneo se objetivó una eosinofilia periférica del 13 y el 17%, respectivamente, siendo el resto de las determinaciones normales.
El diagnóstico fue clínico, por la observación de lesiones cutáneas características, así como el antecedente epidemiológico de contacto con tierra posiblemente contaminada por heces de animales.
El tratamiento establecido en los 4 casos fue albendazol 400mg al día durante 5 días, con buena respuesta clínica en 3 de ellos. El cuarto sujeto experimentó una recaída posterior a pesar de presentar una buena evolución inicial al recibir tratamiento antiparasitario. Se observó que sus sandalias estaban macroscópicamente contaminadas con tierra. Tras cambiar el calzado y reiniciar el tratamiento sistémico, las lesiones desaparecieron.
DiscusiónDe 2011 a 2015 se han diagnosticado en nuestro centro 4 casos de LM que no referían viaje reciente fuera de la provincia de Guipúzcoa, tratándose, por tanto, de casos autóctonos de LM. Tanto la anamnesis como la localización de las lesiones indican una exposición ocupacional al haber estado los 4 pacientes en contacto con tierra probablemente contaminada por heces de animales parasitados.
La LM se observa predominantemente en viajeros provenientes de regiones cálidas y húmedas, sobre todo África subsahariana, América Latina, el Caribe y Asia2. En los últimos años se han detectado un total de 15 casos autóctonos adquiridos en Europa occidental: en Alemania12, Inglaterra13-16, Francia17-19, Italia20, España2,21 y Serbia22. En la tabla 2 recogemos las principales características clínicas y epidemiológicas de todos los casos de LM de origen autóctono en Europa. A los 15 casos ya descritos en nuestro continente, aportamos 4 nuevos (21% del total). Un total de 6 casos (32%) han sido descritos en España, convirtiéndose en el país europeo con más incidencia de LM autóctona en la última década.
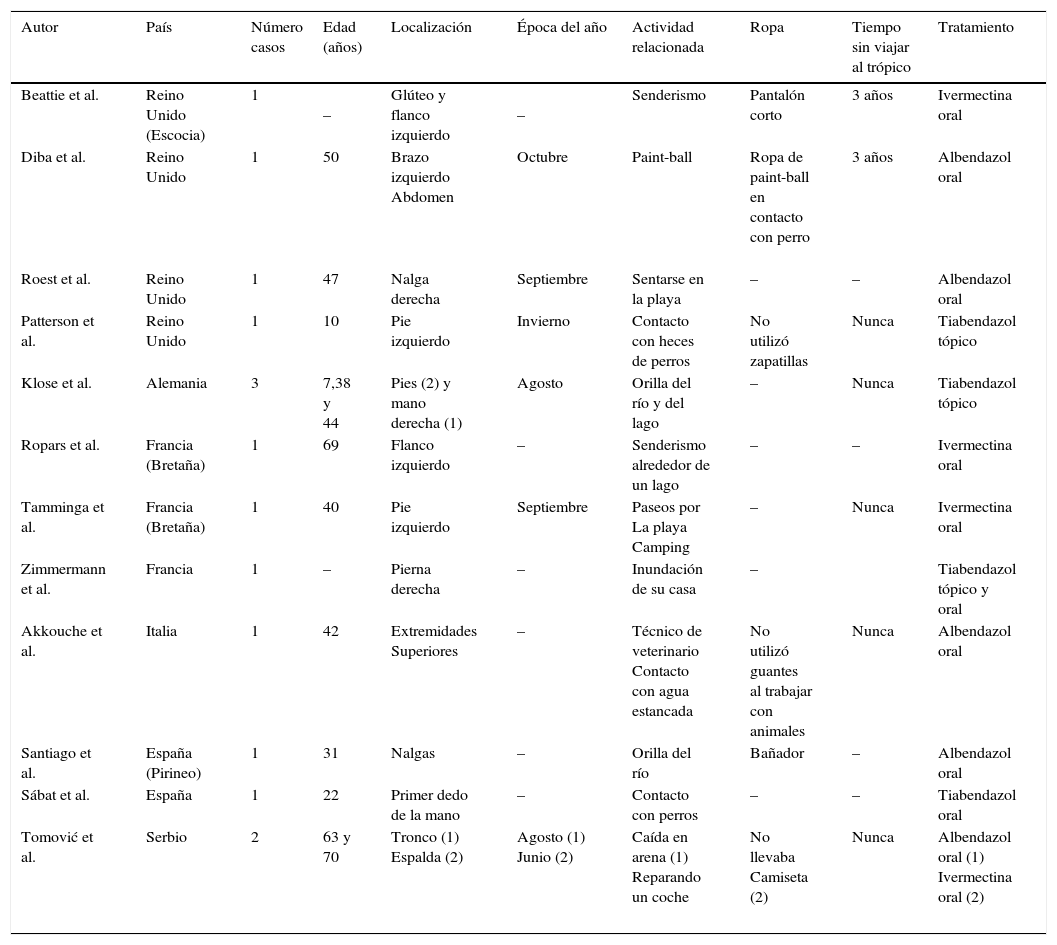
Características clínicas y epidemiológicas de los casos de larva migrans de origen autóctono en Europa
| Autor | País | Número casos | Edad (años) | Localización | Época del año | Actividad relacionada | Ropa | Tiempo sin viajar al trópico | Tratamiento |
|---|---|---|---|---|---|---|---|---|---|
| Beattie et al. | Reino Unido (Escocia) | 1 | – | Glúteo y flanco izquierdo | – | Senderismo | Pantalón corto | 3 años | Ivermectina oral |
| Diba et al. | Reino Unido | 1 | 50 | Brazo izquierdo Abdomen | Octubre | Paint-ball | Ropa de paint-ball en contacto con perro | 3 años | Albendazol oral |
| Roest et al. | Reino Unido | 1 | 47 | Nalga derecha | Septiembre | Sentarse en la playa | – | – | Albendazol oral |
| Patterson et al. | Reino Unido | 1 | 10 | Pie izquierdo | Invierno | Contacto con heces de perros | No utilizó zapatillas | Nunca | Tiabendazol tópico |
| Klose et al. | Alemania | 3 | 7,38 y 44 | Pies (2) y mano derecha (1) | Agosto | Orilla del río y del lago | – | Nunca | Tiabendazol tópico |
| Ropars et al. | Francia (Bretaña) | 1 | 69 | Flanco izquierdo | – | Senderismo alrededor de un lago | – | – | Ivermectina oral |
| Tamminga et al. | Francia (Bretaña) | 1 | 40 | Pie izquierdo | Septiembre | Paseos por La playa Camping | – | Nunca | Ivermectina oral |
| Zimmermann et al. | Francia | 1 | – | Pierna derecha | – | Inundación de su casa | – | Tiabendazol tópico y oral | |
| Akkouche et al. | Italia | 1 | 42 | Extremidades Superiores | – | Técnico de veterinario Contacto con agua estancada | No utilizó guantes al trabajar con animales | Nunca | Albendazol oral |
| Santiago et al. | España (Pirineo) | 1 | 31 | Nalgas | – | Orilla del río | Bañador | – | Albendazol oral |
| Sábat et al. | España | 1 | 22 | Primer dedo de la mano | – | Contacto con perros | – | – | Tiabendazol oral |
| Tomović et al. | Serbio | 2 | 63 y 70 | Tronco (1) Espalda (2) | Agosto (1) Junio (2) | Caída en arena (1) Reparando un coche | No llevaba Camiseta (2) | Nunca | Albendazol oral (1) Ivermectina oral (2) |
Estos hallazgos hacen previsible un aumento de la incidencia de casos autóctonos de este cuadro en los próximos años. Por tanto, ante la observación de lesiones cutáneas compatibles con LM, no se debe excluir del diagnóstico diferencial que se plantee, a pesar de no referir desplazamiento reciente fuera de Europa.
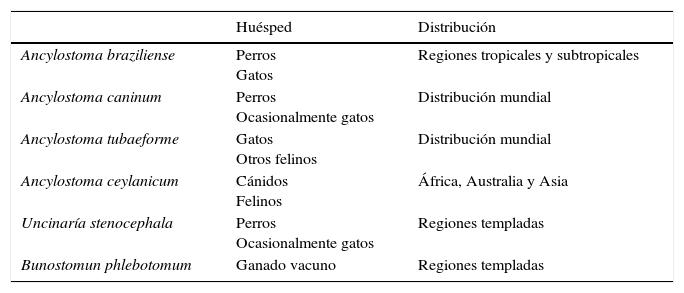
Múltiples especies pueden ser los agentes etiológicos de la LM. En la tabla 3 recogemos los posibles huéspedes y la distribución geográfica de cada una de ellos2,6,7.
Huéspedes y distribución geográfica de las especies causales de larva migrans cutánea
| Huésped | Distribución | |
|---|---|---|
| Ancylostoma braziliense | Perros Gatos | Regiones tropicales y subtropicales |
| Ancylostoma caninum | Perros Ocasionalmente gatos | Distribución mundial |
| Ancylostoma tubaeforme | Gatos Otros felinos | Distribución mundial |
| Ancylostoma ceylanicum | Cánidos Felinos | África, Australia y Asia |
| Uncinaría stenocephala | Perros Ocasionalmente gatos | Regiones templadas |
| Bunostomun phlebotomum | Ganado vacuno | Regiones templadas |
Los nematodos intestinales Ancylostoma spp. y Uncinaria spp. son de los grupos de parásitos más prevalentes entre las mascotas a nivel mundial, siendo uno de los más importantes en la difusión y el riesgo para la salud de humanos y animales6. Esto se debe principalmente a su ciclo biológico, su método de transmisión y la gran cantidad de huevos que elimina cada hembra. En animales, las lesiones cutáneas suelen ser interdigitales y pasan inadvertidas debido al pelo6. Tras penetrar en la piel, alcanzan el torrente sanguíneo y migran hacia los pulmones para luego ser deglutidos y pasar al intestino, donde maduran hasta llegar a la fase adulta. Allí se alimentan de la sangre de los animales produciendo anemia, diarrea sanguinolenta o incluso la muerte en animales jóvenes7. Las hembras producen gran cantidad de huevos (alrededor de 20.000 huevos al día) que salen al exterior con las heces del hospedador7. Una vez en el exterior, y con condiciones climáticas apropiadas de calor y humedad (temperaturas óptimas que oscilan entre los 25-30 °C, suelos húmedos, arenosos, sombreados y oxigenados), los huevos eclosionan, dando lugar a larvas que pasan por 2 estadios hasta llegar a L3. La larva L3 es filariforme, mide unos 660μm de longitud y 2μm de grosor, y es infectiva para perros y humanos, ya que es capaz de penetrar en la piel7.
En humanos, la infección se adquiere generalmente al andar descalzo o sentarse sobre suelo contaminado con larvas L3 procedentes de heces de animales infestados, por lo que las lesiones de LM suelen acontecer en las extremidades inferiores y las nalgas2,5. También se pueden afectar otras regiones, como el tronco o el cuero cabelludo.
El diagnóstico diferencial debe hacerse con la larva currens, que está causada por el Strongyloides stercoralis, en regiones tropicales y subtropicales23. Clínicamente, se diferencian fundamentalmente por la mayor velocidad de migración a través de la epidermis: avanza a 5-15 cm por hora2, siendo su trayecto más rectilíneo, en comparación con los 2-3 cm al día que avanza la LM, presentando un recorrido más sinuoso. La especie humana puede ser huésped definitivo de estas larvas, ya que tienen potencial para atravesar la membrana basal cutánea llegando a vasos sanguíneos y linfáticos, completando así su ciclo vital23. Debido a su migración por el cuerpo humano, pueden producir anemia por déficit de hierro, síntomas gastrointestinales y síndrome de Loeffler23. También se han descrito casos de síndrome de Loeffler producidos por LM24. Este síndrome se caracteriza por la presencia de eosinofilia periférica e infiltrados pulmonares migratorios debido al avance de la larva por los pulmones23.
El cambio climático está alterando la ecología de varias especies de helmintos con potencial zoonótico. El aumento de las temperaturas es especialmente importante para dichas especies de parásitos, en las que parte de su ciclo vital se desarrolla en el suelo, una de las principales fuentes de transmisión de esta zoonosis. Todos los meses en los que se produjo un diagnóstico de LM en nuestro centro reúnen características meteorológicas similares. En agosto del 2011 se produjo una entrada de aire de origen sahariano hasta el Cantábrico, dando lugar a temperaturas extremas. Además, la inestabilidad asociada a dicha depresión dejó varias jornadas con chubascos de carácter tormentoso, registrándose en total 14 días de precipitación. En septiembre del 2013 hubo un total de 15 días de lluvia, siendo en 4 de ellos chubascos tormentosos fuertes. En cuanto a las temperaturas, destacan claramente 2 entradas de aire tropical continental a principios y finales de mes, marcándose temperaturas máximas de hasta 36 °C en la vertiente cantábrica de Guipúzcoa. Agosto del 2014 fue un mes especialmente lluvioso, con 19 días de precipitación. El número de horas de sol estuvo por debajo del promedio (cerca de un 20%), registrándose un único día netamente despejado. En junio del 2015 llovió un total de 16 días, fundamentalmente en el este de Guipúzcoa. Fue un mes muy cálido, registrándose temperaturas máximas de 38 °C en el litoral gipuzcoano.
Es probable que, con el aumento de las temperaturas, la elevada humedad presente en el norte de la península y la baja irradiación solar comparada con el resto de España, se cree en nuestros suelos, sobre todo en los meses más cálidos de verano, un ambiente idóneo para la eclosión de los huevos y la proliferación de las larvas de parásitos causantes de LM.
Pese a que hoy en día la recomendación en las clínicas veterinarias es la de desparasitar a los perros y gatos cada 3 meses, es posible que en ambientes rurales no se realicen estos controles periódicos, que el animal se hubiera reinfestado en ese margen de tiempo o bien que se trate de animales asilvestrados (especialmente gatos), facilitando la diseminación y aparición de nuevos casos.
Hay varias opciones de tratamiento sistémico. El tratamiento vía oral puede consistir en una dosis única oral de albendazol 400mg, siendo más eficaz mantener el tratamiento con dosis de 400 u 800mg al día durante 3 o 5 días25, con una respuesta completa del 99%. El tiabendazol a dosis de 1,25-2,5 g al día también es efectivo26 pero se tolera peor que la ivermectina o el albendazol, ya que puede producir náuseas, vómitos y cefalea. Una única dosis de 12mg de ivermectina es eficaz y bien tolerada27.
En cuanto al tratamiento tópico, la aplicación de tiabendazol a concentraciones del 15 o el 6,25% 2 veces al día consigue la resolución del cuadro en 2-8 días de tratamiento28. No se recomienda el tratamiento con crioterapia debido a que es altamente traumática y a que la larva se encuentra unos centímetros por delante del extremo de progresión de la lesión8,26. También se ha observado la resolución del cuadro tras realizar biopsia cutánea2. Habitualmente, la clínica se resuelve a la semana del inicio del tratamiento. Deberían adoptarse medidas de prevención para evitar una mayor diseminación de este cuadro. Sería recomendable realizar un control veterinario periódico cada 3 meses para desparasitar a perros y gatos, con especial insistencia en los medios rurales. Otro aspecto a tener en cuenta son los animales salvajes y asilvestrados, como zorros y gatos, que también pueden actuar como diseminadores de estas larvas y que son más difíciles de controlar. También se debería instruir al personal sanitario2 acerca de las características clínicas de esta enfermedad para que sea fácilmente identificada. De esta forma, el paciente accedería a un tratamiento precoz y se podría recoger información epidemiológica sobre la posible fuente de contacto para evitar futuros contagios. Para ello sería especialmente interesante poder conocer la especie de las larvas implicadas en cada caso, para así poder enfocar el tratamiento de los animales parasitados o el mecanismo de transmisión. Es importante insistir en los mecanismos de barrera, como el uso de calzado cerrado y ropa adecuada, para evitar entrar en contacto con tierra contaminada por heces de animales. Incluir la limpieza o el cambio de calzado como parte del tratamiento de esta enfermedad es importante para evitar reinfestaciones en un mismo individuo, además de la contaminación de las zonas urbanas. Hay que tener en cuenta la posibilidad de su diseminación a corto plazo en medio urbano ya que con el zapato u otro fómite contaminado podemos infestar las alfombras29, donde los huevos pueden vivir varios días. Los parques urbanos29, al tratarse de zonas húmedas y sombrías, podrían ser un medio adecuado para la eclosión de los huevos eliminados con las heces de los animales de compañía parasitados. La identificación del parásito de los 4 casos descritos nos proporcionaría datos sobre la prevalencia, el ciclo vital y el huésped de dichas larvas, información que podría usarse para evitar una mayor diseminación de las especies causales de este cuadro en nuestro medio.
ConclusiónLa LM es un cuadro clínico fácilmente reconocible que suele contar con el antecedente de viaje a zona endémica de esta dermatosis. No obstante, existen casos autóctonos en Europa, siendo la presente serie la más larga hasta ahora publicada. Cabe pensar en un aumento de la incidencia de esta patología tanto en medio rural como urbano, en los meses más cálidos (junio, julio, agosto y septiembre) y en ambientes húmedos. La rápida identificación de esta dermatosis, la implantación de un tratamiento eficaz, el conocimiento de las fuentes de contagio y las medidas preventivas pueden ser útiles para evitar una mayor diseminación de la LM de origen autóctono.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.