La tricología ocupa un área importante dentro de la práctica asistencial de los dermatólogos por la frecuencia de las diferentes tricosis y por el gran impacto que producen en la calidad de vida de los pacientes. Durante los últimos años hemos comprobado la incorporación de muchas novedades terapéuticas en tricología. El objetivo de la presente revisión es resumir de una forma práctica las principales novedades terapéuticas tricológicas, agrupándolas en 4 apartados: a) alopecia androgénica: nuevos excipientes de minoxidil, dutasterida y finasterida oral y nuevas formas de aplicación de estos antiandrógenos, agonistas y antagonistas de las prostaglandinas, láser de baja potencia y medicina regenerativa —activadores de la vía Wnt y terapia con células madre—; b) alopecia areata: fármacos anti-JAK; c) alopecia frontal fibrosante: antiandrógenos y, en algunos pacientes, pioglitazonas, y d) trasplante capilar: nuevos dispositivos tecnológicos y nuevas técnicas de extracción para optimizar la reserva de unidades foliculares.
The treatment of hair loss is an important part of clinical dermatology given the prevalence of the problem and great impact on patients’ quality of life. Many new treatments have been introduced in recent years. This review summarizes the main ones in 4 groups: a) For androgenetic alopecia, we discuss new excipients for oral minoxidil, dutasteride, and finasteride as well as new forms of topical application; prostaglandin agonists and antagonists; low-level laser therapy; and regenerative medicine with Wnt signaling activators and stem cell therapy. b) For alopecia areata, Janus kinase inhibitors are reviewed. c) For frontal fibrosing alopecia, we discuss the use of antiandrogens and, for some patients, pioglitazone. d) Finally, we mention new robotic devices for hair transplant procedures and techniques for optimal follicular unit extraction.
La tricología ocupa un área importante dentro de la práctica asistencial de los dermatólogos. El objetivo de la presente revisión es resumir de una forma práctica las principales novedades terapéuticas en tricología, agrupándolas en 4 apartados: alopecia androgénica (AGA), alopecia areata (AA), alopecias cicatriciales y trasplante capilar.
La metodología de trabajo ha consistido en la inclusión de artículos publicados entre 2013-2016 en las bases de datos de Pubmed, Medline y en el registro de ensayos clínicos clinicaltrials.gov, así como en la descripción de resultados preliminares de algunas terapias presentados en congresos internacionales de tricología. Los firmantes de la revisión aportan asimismo su experiencia personal acerca de las diferentes terapias.
Alopecia androgénicaEn los últimos tiempos se han incorporado nuevas opciones terapéuticas para hombres y mujeres con AGA. Asimismo, han surgido novedades en el uso de minoxidil y antiandrógenos.
MinoxidilEn el caso de minoxidil, se ha publicado recientemente un metaanálisis1 que demuestra su efectividad frente a placebo en AGA. Los autores describen como gran limitación del uso de minoxidil la baja adherencia terapéutica por su cosmeticidad, que podría mejorarse con las nuevas formulaciones de minoxidil. Asimismo, se ha publicado una revisión Cochrane2 acerca de las intervenciones para AGA femenina incluyendo 47 estudios y 5.290 pacientes, concluyendo que la aplicación de minoxidil tópico en concentraciones entre el 2-5% es efectivo y seguro, por encima de otros tratamientos como antiandrógenos y láser de baja potencia (LLLT). En relación con las nuevas formulaciones de minoxidil, diferentes trabajos muestran la efectividad y mejor tolerancia del minoxidil en espuma frente a la solución hidroalcohólica tanto en hombres3 como en mujeres4 con AGA, por su menor proporción de propilenglicol que mejora su cosmeticidad. Se está evaluando asimismo la posibilidad de utilizar niosomas para mejorar la absorción tópica de minoxidil5. Otra de las novedades es la llegada del «nanoxidil», principio activo con similar estructura que el minoxidil, pero con menor masa molecular, que debería presentar mejor penetración y absorción, aunque aún no hay estudios científicos sólidos publicados al respecto. Aunque de forma anecdótica, están surgiendo publicaciones de la efectividad y seguridad del uso de dosis bajas de minoxidil oral (0,25mg/d) en AGA (Sinclair, comunicación personal), alopecia definitiva por quimioterapia6 y en moniletrix7. Si se confirman estos resultados, el uso de dosis bajas de minoxidil oral podría ser una alternativa de gran interés en pacientes con AGA.
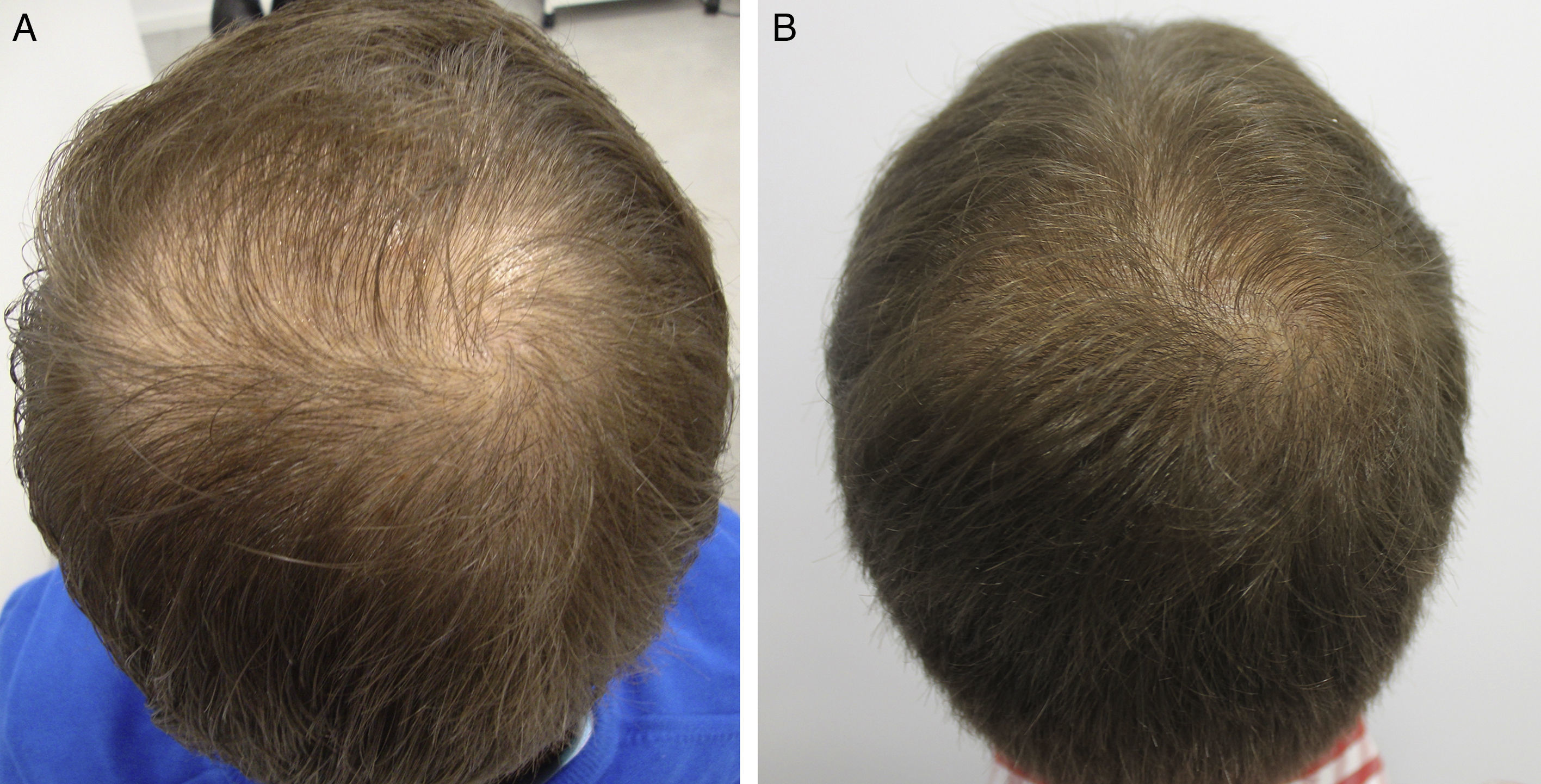
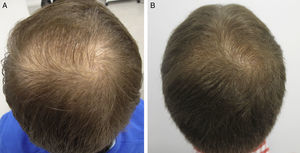
AntiandrógenosRespecto al uso de los antiandrógenos, destacan algunas publicaciones con un alto nivel de evidencia apoyando la seguridad de finasterida/dutasterida en hombres y mujeres con AGA, tanto por el bajo riesgo de efectos adversos sexuales (muy parecido a placebo)8,9, como por el inexistente aumento del riesgo de cáncer10,11. Como una de las grandes novedades de los últimos años en AGA, los autores destacan la irrupción del fármaco dutasterida como una alternativa efectiva y segura en AGA, tanto masculina como femenina12-14. Este inhibidor dual de la 5-alfa-reductasa, con una semivida media mayor que finasterida, ha demostrado tener mayor efectividad que finasterida en AGA masculina de predominio frontal sin presentar más efectos adversos14-17. Respecto a nuevas vías de aplicación de antiandrógenos, queremos destacar el trabajo de Moftah et al.18 que demuestra la utilidad y seguridad de las microinyecciones de dutasterida en AGA femenina. Describen 86 mujeres frente a 40 controles, encontrando una mejora en la densidad del 63% en el grupo activo frente al 17% del grupo control (p<0,05), sin efectos adversos. La utilización de dutasterida infiltrada localmente en el cuero cabelludo previa anestesia troncular puede ser una opción terapéutica útil en AGA masculina y femenina, bien sea en monoterapia (fig. 1) o como complemento al tratamiento clásico. Nuestro grupo de trabajo ha realizado un estudio en 5 hombres con AGA en el que se ha objetivado la efectividad de la infiltración local cada 3 meses de dutasterida, sin efectos adversos ni modificación del nivel de hormonas en sangre (en prensa-datos no publicados). Como vía alternativa para la utilización de antiandrógenos orales hay varias publicaciones que destacan la acción inhibitoria sobre la 5-alfa-reductasa folicular de finasterida tópica al 0,25%, con menor absorción sistémica que finasterida oral19,20. Están pendientes de publicación los estudios de efectividad clínica con finasterida tópico 0,5% de Milani et al. (comunicación personal) en los que mostraban una mejora en AGA masculina a los 6 meses en el 70% de los pacientes tratados en monoterapia.
ProstaglandinasEn relación con las prostaglandinas, es conocido que los análogos de la PGF2 (latanoprost y bimatoprost) estimulan el crecimiento piloso al prolongar la fase anágena21,22. Sin embargo, la concentración de estos fármacos necesaria para mejorar la densidad pilosa en AGA es muy alta (latanoprost 0,1%)22, lo que supone una limitación por su elevado coste. En los últimos años se están investigando otros fármacos antagonistas del receptor de la PGD2 (GPR44), que tiene un efecto inhibitorio sobre el crecimiento piloso y que se sabe que está aumentado en el cuero cabelludo de pacientes con AGA23-25. El setipiprant (KITH-105) es un fármaco oral antagonista del receptor GPR44 que está en fase de ensayo clínico para el asma, pero que podría tener una potencial aplicación en AGA26. De hecho, ya está en marcha un ensayo clínico fase II para evaluar el uso de setipiprant oral, comparado con placebo y con finasterida 1mg/día, en pacientes con AGA masculina de 18 a 41 años (NCT02781311).
Terapias físicasRespecto a las terapias físicas, es interesante destacar la solidez metodológica de varios artículos mostrando la utilidad del LLLT en AGA27-30, tanto masculina como femenina. La estimulación periódica de los folículos pilosos con LLLT favorecería la conversión de folículos en telógeno a folículos en anágeno, y la transformación de folículos vellosos en terminales debido a que la inflamación perifolicular que determina potenciaría el crecimiento folicular por activación de las células madre de la protuberancia. Además, se produciría un aumento del flujo vascular local y una liberación de mediadores inflamatorios y VEGF, favoreciendo el crecimiento de células pluripotentes27-30, lo que estimularía el crecimiento y engrosamiento pilosos. En la opinión de los autores, aún está por definir el protocolo exacto de utilización de la terapia LLLT en varones y mujeres con AGA, aunque parece ser una opción interesante y con un mecanismo de acción diferente a las terapias clásicas. Muy interesantes son las recientes publicaciones relativas a otra terapia física, el microneedling31,32, técnica que consiste en realizar microperforaciones en el cuero cabelludo con el objetivo de producir un daño controlado y una liberación de factores de crecimiento endógeno que estimularían el crecimiento piloso.
Terapias de medicina regenerativaEn el último grupo incluiríamos las terapias de medicina regenerativa encaminadas a estimular las células madre foliculares.
- a)
Se han publicado nuevos estudios acerca de la potencial utilidad del plasma rico en plaquetas (PRP) en AGA masculina y femenina. En los 3 estudios publicados33-35, uno de ellos un metaanálisis34, se muestran resultados positivos del PRP (mayor densidad pilosa y cantidad de folículos en anágeno) sin apenas efectos adversos. En opinión de los autores, se trata de un tratamiento con un perfil de seguridad excelente, pero con un perfil de efectividad heterogéneo, con respuestas muy buenas en algunos pacientes y más discretas en otros.
- b)
También se han publicado los primeros resultados sobre la utilidad y seguridad en AGA de fármacos tópicos activadores de la vía Wnt/β-catenina: metilvanilato36, ácido valproico37 y SM0455438. La vía Wnt/β-catenina regula la activación del nicho de células madre localizado en la protuberancia folicular, proceso necesario para el inicio y mantenimiento de la fase anágena folicular y cuya inhibición se ha relacionado con la pérdida de densidad pilosa en la AGA36-38.
- c)
Asimismo, se ha descrito recientemente que la inhibición farmacológica de 2 de las vías de señalización implicadas en la regulación negativa de la proliferación y diferenciación de las células madre de la protuberancia y en el establecimiento de la fase de reposo folicular, JAK/STAT y mTOR/PI3K, activan eficazmente el crecimiento del pelo en modelos de ratón y en folículos humanos in vitro39,40.
- d)
También se ha demostrado que una producción transitoria de especies reactivas de oxígeno mediante terapia fotodinámica in vivo en la piel del ratón induce distintas vías de señalización que, por último, activan el nicho de células madre del folículo piloso acelerando el crecimiento del pelo41.
- e)
Finalmente, nos referiremos al tratamiento con células madre. Existen básicamente 2 tipos: E1: «clonación capilar» (inyección de células madre foliculares previamente expandidas in vitro, produciendo el crecimiento de nuevos folículos) y E2: «lipoaspirado de células madre mesenquimales» (LPA). En el primer caso, desde las primeras publicaciones en modelos murinos de McElwee et al. en 200342, se han comunicado pocos avances y los resultados preliminares del único ensayo clínico en humanos fueron muy discretos, con porcentajes de crecimiento piloso de tan solo el 6% (McElwee, comunicación en el Congreso Mundial de Tricología en Barcelona 2012). Aunque este tratamiento será un hito en el tratamiento de la AGA, aún requiere cierto tiempo de investigación. La segunda técnica consiste en realizar un lipoaspirado de células madre mesenquimales, acondicionarlas e inyectarlas en el cuero cabelludo, produciendo un estímulo del crecimiento capilar. Existen estudios preliminares de la posible utilidad del LPA en AGA43-45, pero son necesarios estudios más amplios que avalen la seguridad y efectividad de esta terapia.
En el caso de la AA, podemos resumir las novedades terapéuticas en 2 grupos: a) nuevos datos y formas de utilización de tratamientos clásicos, y b) nuevas terapias.
- a)
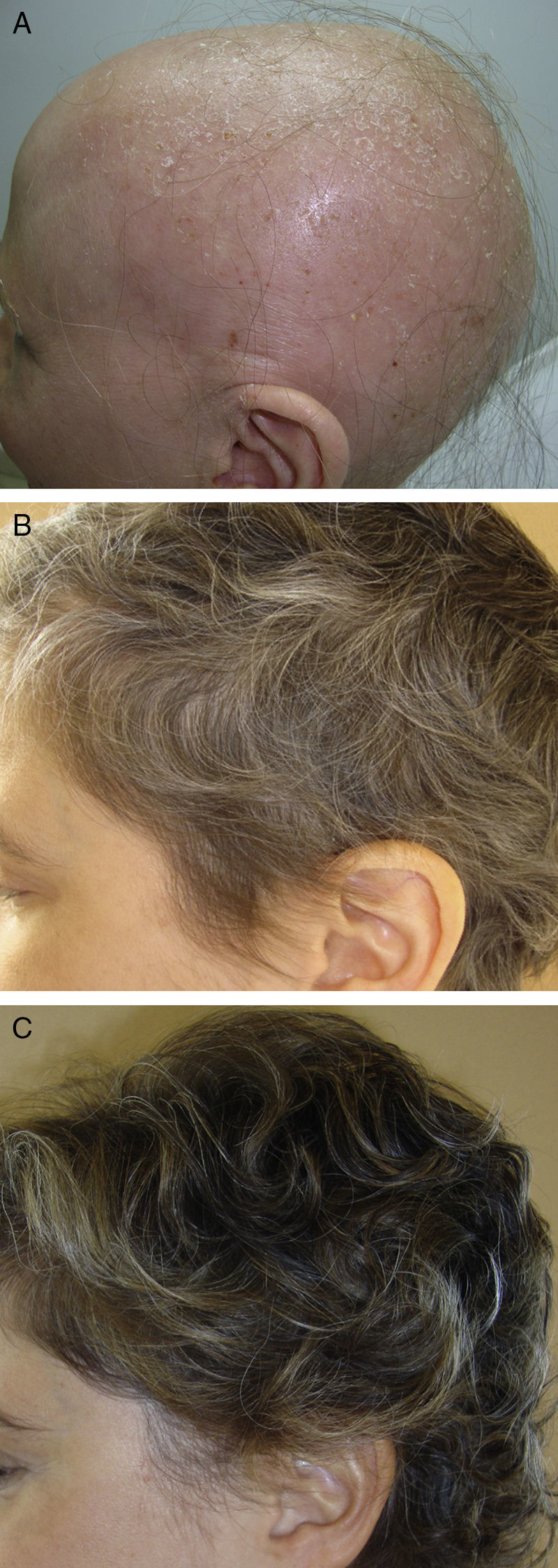
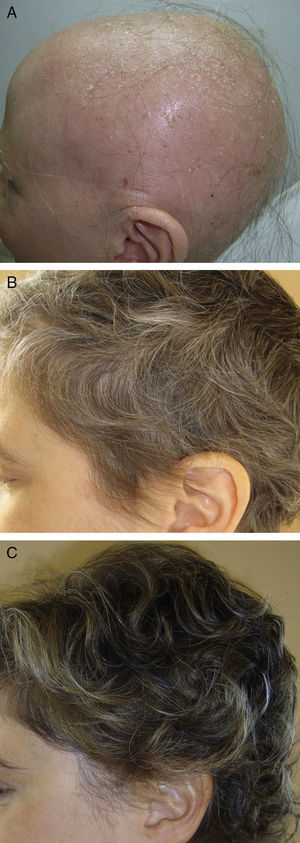
En el primer grupo destacan una revisión de Lamb et al.46 sobre el uso de inmunoterapia con difenciprona en 133 pacientes con AA, observando algún tipo de respuesta en el 72% de los pacientes, con repoblación mayor del 90% en el 16%. Otra novedad importante en este primer grupo se refiere a la forma de utilización pulsátil de los corticoides sistémicos en AA. Existen evidencias de la mayor seguridad y al menos la misma efectividad al utilizar los corticoides en forma de pulsos47,48. En un estudio realizado por el grupo de investigación del Hospital Ramón y Cajal de Madrid48, la utilización de dexametasona oral a dosis de 0,1mg/kg/d 2 días consecutivos a la semana indujo repoblación en 25/31 pacientes con AA total o universal (fig. 2), con efectos adversos leves en un 32%.
- b)
Dentro del segundo grupo de nuevas terapias, cabe destacar la posible utilidad de la combinación de simvastatina-ezetimiba en AA por su efecto inmunomodulador, puesta de manifiesto en un estudio en el que respondieron 14/19 pacientes con areata extensa49. Sin embargo, otros autores han publicado tasas de respuesta bastante inferiores con este tratamiento (1/20 pacientes)50. La combinación de simvastatina y ezetimiba podría ser una terapia concomitante útil para mejorar la respuesta junto con otros tratamientos, pero parece que su acción en monoterapia suele ser muy discreta.
La mayor novedad en el campo de la AA y una de las más importantes en tricología en los últimos años es la utilidad terapéutica de los fármacos anti-Janus kinasa (anti-JAK)51-58, no solo por su aparente efectividad, sino también porque es el primer tratamiento que actúa frente a una diana patogénica específica en AA. La vía de las JAK interviene en la activación de los linfocitos T-CD8 citotóxicos y en la producción de interferón-gamma, agentes fundamentales en el desarrollo de AA. Su inhibición parece inducir la repoblación en estos pacientes. Los fármacos descritos con potencial utilidad en AA son tofacitinib55-58 (cuya indicación aprobada es artritis reumatoide), ruxolitinib51,52,54 (indicaciones aprobadas: mielofibrosis y policitemia vera) y baricinitib53 (pendiente de aprobación de indicación de artritis reumatoide). Son medicamentos de administración oral, con un perfil de seguridad aceptable y que para sus indicaciones se suelen mantener de forma crónica con buena tolerancia. Se ha publicado además el primer estudio de la utilidad del ruxolitinib tópico en AA de cejas52 y existen ya ensayos clínicos en marcha con nuevos fármacos anti-JAK tópicos como LEO-124249 (NCT02561585). El principal limitante de estos tratamientos es el coste. No obstante, abren una nueva línea de investigación terapéutica en AA.
En relación con la alopecia frontal fibrosante (AFF), la interpretación actual de su etiopatogenia es que se relaciona con un doble mecanismo, autoinmune y hormonal59-61, justificando que, además del tratamiento con antiinflamatorios (corticoides) para frenar la inflamación autoinmune, se utilicen los fármacos antiandrógenos (finasterida y dutasterida). En los últimos años se han publicado diversos trabajos59-64 mostrando la potencial utilidad de estos fármacos en AFF, incluyendo un estudio multicéntrico español de 355 pacientes59. El mecanismo por el que los antiandrógenos actuarían en la AFF no está del todo aclarado, pero parece que la inhibición de la acción de las hormonas masculinas sobre la raíz folicular ayudaría a estabilizar la enfermedad59,61. Existen publicaciones en las que se demuestra incluso repoblación con la administración de antiandrógenos64. Sin embargo, hay autores que se muestran escépticos con el uso de estos fármacos en AFF65. A pesar de que aún no esté definido el mecanismo exacto de actuación, existen evidencias de que hay un factor hormonal responsable de la AFF61.
Otra importante novedad terapéutica en AFF y liquen plano folicular (LPF) es la utilización del antidiabético oral pioglitazona por su efecto agonista sobre los receptores activados por proliferadores peroxisomales (PPAR-gamma). Estudios recientes66 consideran que el mal funcionamiento de los PPAR-gamma puede influir en la puesta en marcha de la inflamación en el LPF y la AFF. Se han publicado 4 trabajos67-70 en los que se ha utilizado la pioglitazona para el tratamiento del LPF y de la AFF, con resultados variables ya que se observó efectividad en el 20-70% y efectos secundarios hasta en el 50%. Márquez y Camacho71 han realizado un estudio en 68 mujeres con AFF obteniendo resultados favorables en el 64% con el uso de pioglitazona. La percepción de los autores es que la pioglitazona puede ser efectiva en algunos casos, pero tiene un riesgo considerable de intolerancia, principalmente edema de extremidades inferiores y aumento de peso, que en bastantes casos obliga a su retirada.
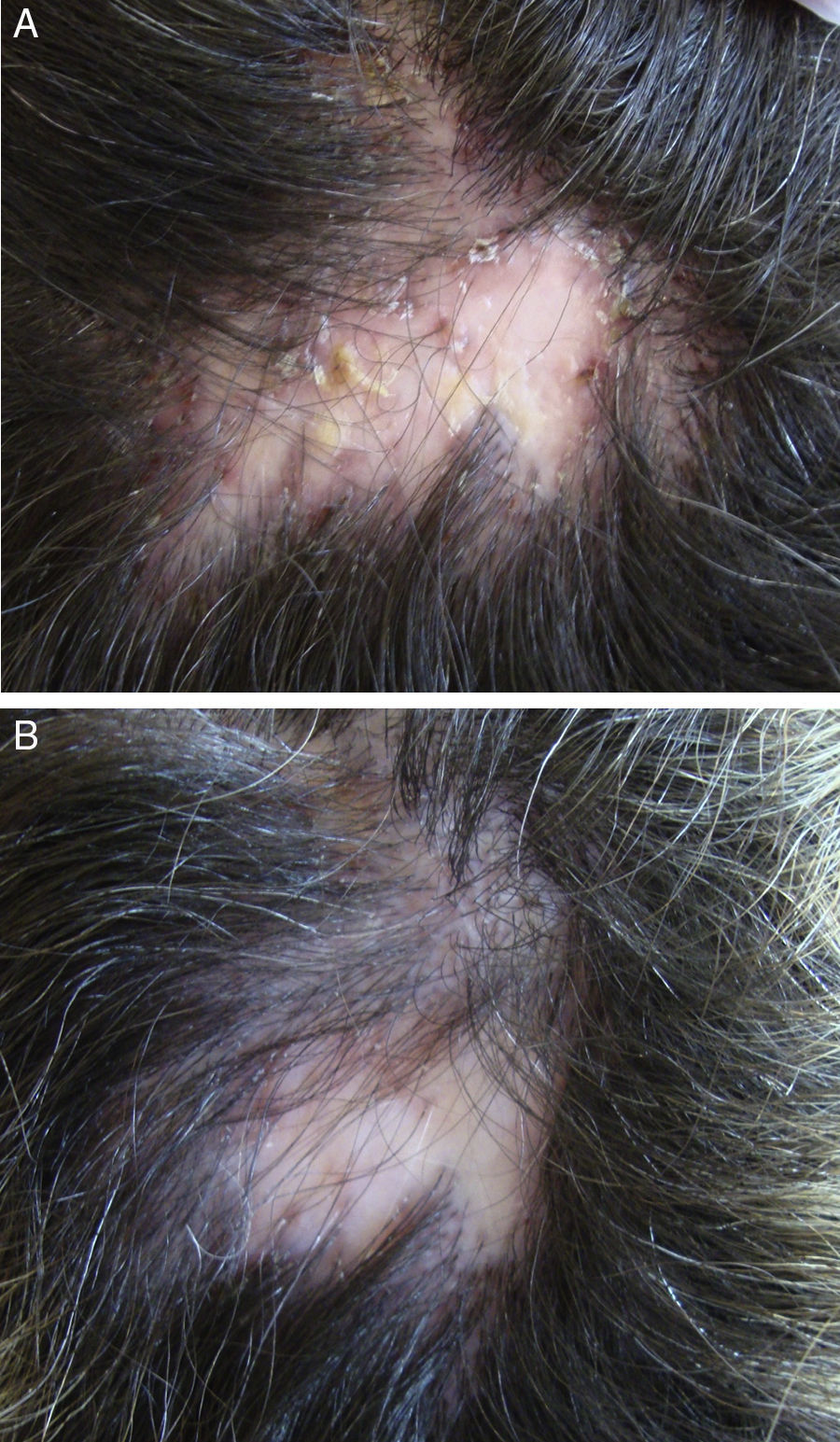
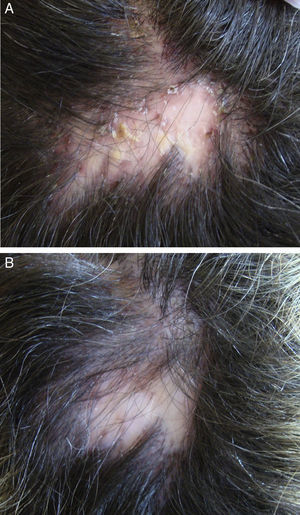
En el caso de la foliculitis decalvante (FD), se ha publicado un estudio multicéntrico español de 82 pacientes72 en el que se concluye que el tratamiento que consigue una mayor efectividad (mejora en 15/15 pacientes tratados) y un mayor periodo de remisión postratamiento (7,2 meses) es la combinación de rifampicina y clindamicina durante 10 semanas (fig. 3). Otra novedad terapéutica ha sido la publicación de la posible utilidad de la terapia fotodinámica (TFD) en 9/10 pacientes con FD73. Sin embargo, otros autores han comunicado una experiencia negativa con TFD en 3/3 pacientes74.
Trasplante capilarPara finalizar, dentro del campo del trasplante capilar, destacan 2 novedades. Por un lado, la llegada de los nuevos sistemas robotizados y automatizados que permiten mejorar la velocidad quirúrgica y, en algunos casos, las tasas de transección folicular en la técnica follicular unit extraction (FUE)75. No obstante, podemos afirmar que para obtener mejores resultados, más importante que el dispositivo que utilicemos es la habilidad quirúrgica del cirujano.
La otra novedad hace referencia a una nueva técnica de extracción folicular, conocida como «extracción longitudinal parcial»76. Consiste en extraer parcialmente las unidades foliculares, con el objetivo de que la porción de folículo que persiste en la zona donante pueda sobrevivir y generar nuevamente una unidad folicular íntegra, evitando de esta forma la despoblación progresiva que se produce en la zona donante. Se trata de un interesante concepto, aunque aún está por desarrollar.
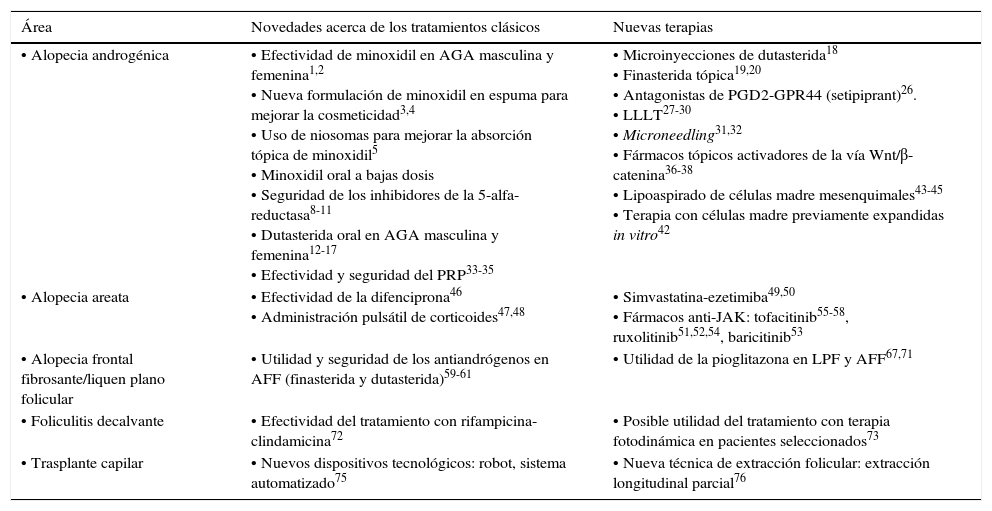
En la tabla 1 se presenta un resumen de las novedades terapéuticas de mayor relevancia en tricología.
Resumen de las novedades terapéuticas en tricología de mayor relevancia
| Área | Novedades acerca de los tratamientos clásicos | Nuevas terapias |
|---|---|---|
| • Alopecia androgénica | • Efectividad de minoxidil en AGA masculina y femenina1,2 • Nueva formulación de minoxidil en espuma para mejorar la cosmeticidad3,4 • Uso de niosomas para mejorar la absorción tópica de minoxidil5 • Minoxidil oral a bajas dosis • Seguridad de los inhibidores de la 5-alfa-reductasa8-11 • Dutasterida oral en AGA masculina y femenina12-17 • Efectividad y seguridad del PRP33-35 | • Microinyecciones de dutasterida18 • Finasterida tópica19,20 • Antagonistas de PGD2-GPR44 (setipiprant)26. • LLLT27-30 • Microneedling31,32 • Fármacos tópicos activadores de la vía Wnt/β-catenina36-38 • Lipoaspirado de células madre mesenquimales43-45 • Terapia con células madre previamente expandidas in vitro42 |
| • Alopecia areata | • Efectividad de la difenciprona46 • Administración pulsátil de corticoides47,48 | • Simvastatina-ezetimiba49,50 • Fármacos anti-JAK: tofacitinib55-58, ruxolitinib51,52,54, baricitinib53 |
| • Alopecia frontal fibrosante/liquen plano folicular | • Utilidad y seguridad de los antiandrógenos en AFF (finasterida y dutasterida)59-61 | • Utilidad de la pioglitazona en LPF y AFF67,71 |
| • Foliculitis decalvante | • Efectividad del tratamiento con rifampicina-clindamicina72 | • Posible utilidad del tratamiento con terapia fotodinámica en pacientes seleccionados73 |
| • Trasplante capilar | • Nuevos dispositivos tecnológicos: robot, sistema automatizado75 | • Nueva técnica de extracción folicular: extracción longitudinal parcial76 |
Podemos afirmar que en los últimos años estamos asistiendo a grandes avances en la terapéutica tricológica, pero lo más importante es que se han abierto líneas de investigación que permitirán seguir avanzando. Lo desarrollado en este trabajo, que se refiere a los 3 últimos años, es algo más que una esperanza, es una realidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.