Los fármacos biológicos son moléculas dirigidas frente a dianas específicas del sistema inmune que han demostrado una gran efectividad en diversas enfermedades dermatológicas, reumatológicas y sistémicas. A pesar de que en su conjunto presentan un perfil de seguridad adecuado, su uso se ha asociado al desarrollo de enfermedades inflamatorias, limitadas a un órgano o sistémicas. Hablamos de verdaderas reacciones paradójicas cuando estas patologías inmunomediadas normalmente responderían a ese mismo agente biológico que las induce, mientras que el resto de reacciones son aún controvertidas. Las hipótesis patogénicas propuestas para estos procesos incluyen un desbalance de citoquinas, con una sobreproducción de IFN-α y una alteración en el reclutamiento y la migración linfocitaria, mediada en parte por CXCR3, así como la producción de autoanticuerpos. Además, algunos de estos fármacos favorecerían la aparición de reacciones granulomatosas. Aunque las reacciones paradójicas se han descrito en la mayoría de casos para los fármacos anti-TNF-α, cada vez son más frecuentes aquellos asociados con terapias biológicas de más reciente aparición, como ustekinumab, secukinumab o ixekizumab. El estudio de estas reacciones no solo favorece un mejor manejo de los pacientes susceptibles de recibir tratamiento biológico, sino que permite mejorar el conocimiento patogénico de las enfermedades inflamatorias crónicas y de sus posibles dianas terapéuticas.
Biologic drugs, which are molecules designed to act on specific immune system targets, have been shown to be very effective in treating various dermatological, rheumatological, and systemic diseases. As a group, they have an acceptable safety profile, but their use has been associated with the onset of both systemic and organ-specific inflammatory conditions. True paradoxical reactions are immune-mediated disorders that would usually respond to the biologic agent that causes them. There is still debate about whether certain other adverse reactions can be said to be paradoxical. The hypotheses proposed to explain the pathogenesis of such reactions include an imbalance in cytokine production, with an overproduction of IFN-α and altered lymphocyte recruitment and migration (mediated in part by CXCR3), and the production of autoantibodies. Some biologic therapies favor granulomatous reactions. While most of the paradoxical reactions reported have been associated with the use of TNF-α inhibitors, cases associated with more recently introduced biologic therapies —such as ustekinumab, secukinumab, and ixekizumab— are increasingly common. The study of paradoxical adverse events not only favors better management of these reactions in patients receiving biologic therapy, but also improves our knowledge of the pathogenesis of chronic inflammatory diseases and helps to identify potential therapeutic targets.
La psoriasis es una enfermedad inmunomediada crónica con una prevalencia estimada del 2,3%1.
Desde un punto de vista etiológico, resulta de una interacción dinámica entre una predisposición genética compleja2 y una respuesta inmunológica y epidérmica aberrante3,4. La terapia biológica se dirige frente a dianas clave en el circuito patogénico y, en la actualidad, destacan los agentes dirigidos selectivamente contra 3 moléculas, TNF-α, IL-12/23 e IL-174,5, con altas tasas de eficacia en la psoriasis moderada y grave, acompañada o no de artropatía psoriásica (APs)6-8.
A pesar de que el perfil de seguridad es globalmente adecuado, un porcentaje de pacientes desarrollarán reacciones adversas que no serían esperables según el mecanismo de acción. Estas se han denominado reacciones paradójicas y consisten en el desarrollo de novo o el empeoramiento de una patología que normalmente respondería a estos agentes9,10. El cese del fármaco o el cambio de biológico frecuentemente resuelve las reacciones paradójicas, pero en ocasiones se requiere la asociación de otras terapias. Estas pueden ser tópicas en algunas reacciones dermatológicas leves o moderadas, pero en otros casos será necesario el uso de inmunosupresores sistémicos11,12.
Estrategia de búsqueda y selección de artículosSe realizó una búsqueda bibliográfica en PubMed y EMBASE de artículos publicados en inglés y castellano desde el año 2000 hasta el 2017. Para identificar los más relevantes se filtró por revisiones, ensayos clínicos y series de casos, y se emplearon los términos de búsqueda: «tumor necrosis factor alpha inhibitor», «TNF», «infliximab»; «etanercept», «adalimumab», «golimumab», «ustekinumab», «secukinumab», «ixekizumab», «psoriasis», «paradoxical», «induced» y «adverse event». Finalmente, se revisaron las referencias de los artículos seleccionados para completar la búsqueda.
DefiniciónLas reacciones paradójicas constituyen un grupo de efectos adversos de la terapia biológica y se definen como el desarrollo de novo o el empeoramiento de una patología inmunomediada de base que normalmente respondería al mismo agente terapéutico que la induce10. De forma previa a considerar la posibilidad de una reacción adversa paradójica debería aplicarse alguna herramienta estandarizada que permita evaluar su causalidad como, por ejemplo, la Escala de Naranjo (tabla 1)13.
Escala de Naranjo: herramienta de evaluación de causalidad en las reacciones adversas farmacológicas
| Sí | No | No conocido | |
|---|---|---|---|
| 1. ¿Hay publicaciones previas concluyentes de esta reacción? | +1 | 0 | 0 |
| 2. ¿Apareció el efecto adverso después de la administración del fármaco sospechoso? | +2 | −1 | 0 |
| 3. ¿La reacción adversa mejoró con la retirada del fármaco o la administración de un antagonista específico? | +1 | 0 | 0 |
| 4. ¿La reacción adversa reapareció cuando el fármaco fue reintroducido? | +2 | −1 | 0 |
| 5. ¿Hay causas alternativas que pudieran explicar la reacción adversa? | −1 | +2 | 0 |
| 6. ¿Reapareció la reacción si se administró un placebo? | −1 | +1 | 0 |
| 7. ¿Se detectó el fármaco en sangre (u otros fluidos) en concentraciones suficientes para la reacción adversa? | +1 | 0 | 0 |
| 8. ¿Fue la reacción más grave cuando la dosis se incrementó, o menos grave, cuando esta se disminuyó? | +1 | 0 | 0 |
| 9. ¿Tuvo el paciente reacciones parecidas al mismo fármaco o similares en una exposición previa? | +1 | 0 | 0 |
| 10. ¿Se confirmó la reacción adversa con alguna evidencia objetiva? | +1 | 0 | 0 |
Puntuación total: categoría de probabilidad, ≤0: dudosa; 1-4: posible; 5-8: probable; ≥9: definitiva.
La mayoría de reacciones paradójicas se han descrito en relación con la terapia anti-TNF-α; sin embargo, es probable que se incremente el número de casos con otros biológicos de reciente introducción14.
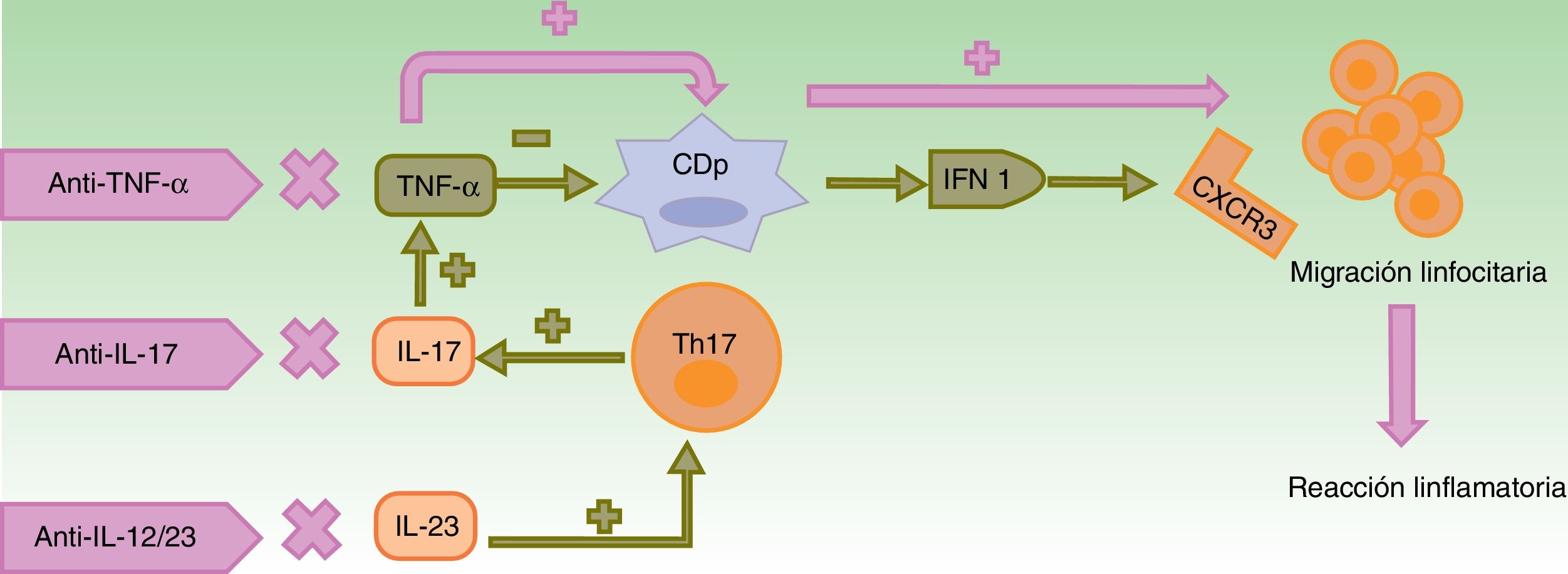
Muchas de las hipótesis patogénicas son compartidas en las distintas entidades inmunomediadas. La psoriasis y otras enfermedades inflamatorias resultan de la interacción de 3 citoquinas fundamentales: TNF-α, IFN tipo 1 y eje IL-23/IL-17, que se relacionan a través de un triángulo en que la actuación farmacológica sobre una de ellas provoca cambios en las otras 214.
Alteración en la contrarregulación entre el TNF-α y el IFN-αEl TNF-α, sintetizado desde varios tipos celulares como queratinocitos, linfocitos Th1, Th17, Th22 y macrófagos, promueve la infiltración por células T, controla la apoptosis y actúa sobre las células dendríticas plasmocitoides (CDp)4, presentes tanto en la piel aparentemente normal como en la piel lesional de los pacientes con psoriasis3 y en otras enfermedades autoinmunes15. En condiciones normales, el TNF-α silencia la producción de IFN-α al forzar la maduración de CDp4,5,14.
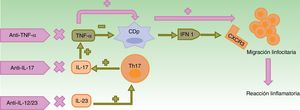
El bloqueo del TNF-α resulta en un exceso de IFN-α, que estimula y amplifica la respuesta de linfocitos T induciéndose la reacción inflamatoria (fig. 1)3,14,16.
Mecanismos patogénicos propuestos para las reacciones paradójicas.
En condiciones normales, el TNF-α inhibe la actividad de las CDp, productoras de IFN-α. El empleo de fármacos anti-TNF-α provoca un exceso de IFN-α que, a su vez, promueve la expresión de CXCR3 en los linfocitos T, permitiendo su migración al tejido inflamado. El uso de otros biológicos con mecanismos de acción distintos como ustekinumab (anti-IL-12/23) y secukinumab e ixekizumab (anti-IL-17A) produce indirectamente una disminución en las concentraciones de TNF-α, entre otros cambios, con las consecuencias anteriormente descritas.
CDp: células dendríticas plasmocitoides; CXCR3: receptor de quimiocinas CXC3; IFN: interferón; IL: interleucina; linfocito Th: linfocito T colaborador; TNF: factor de necrosis tumoral.
El aumento de IFN-α induce una sobreexpresión de receptores de quimiocinas, como el CXCR3, que permite la migración de células T hacia la piel o cualquier tejido inflamado17,18. Además, se reduce el transporte de células Th1 al lugar de inflamación inicial y estas se movilizan a otros lugares, especialmente a la piel, lo que podría explicar la aparición de psoriasis paradójica en pacientes con artritis reumatoide (AR)19,20.
El reclutamiento de linfocitos T CXCR3+ se asocia a la expresión de la proteína MxA (anti-myxovirus-resistance-protein-A) que evidencia, a través de tinciones inmunohistoquímicas, la actividad local del IFN-α en las lesiones psoriasiformes15,21.
El eje IL-23/IL-17La IL-23 induce la supervivencia y expansión de linfocitos Th17, productores de IL-17 y TNF-α. La IL-17 también favorece la producción de TNF e IFN-γ, y el reclutamiento de células Th114,22.
Las reacciones paradójicas descritas con ustekinumab podrían explicarse por la disminución del TNF-α secundaria al bloqueo de la IL-23, con las consecuencias anteriormente descritas23.
Por otro lado, el bloqueo de la IL-17A con secukinumab e ixekizumab podría ser insuficiente, dado que la IL-17F permanece activa14,22. A favor de esto, secukinumab no ha mostrado beneficio en pacientes con enfermedad de Crohn (EC), entidad en la que se sugiere, además, que la pérdida de control por la IL-17, implicada en la defensa frente a hongos, permitiría la participación de la microbioma fúngica en la inflamación intestinal24.
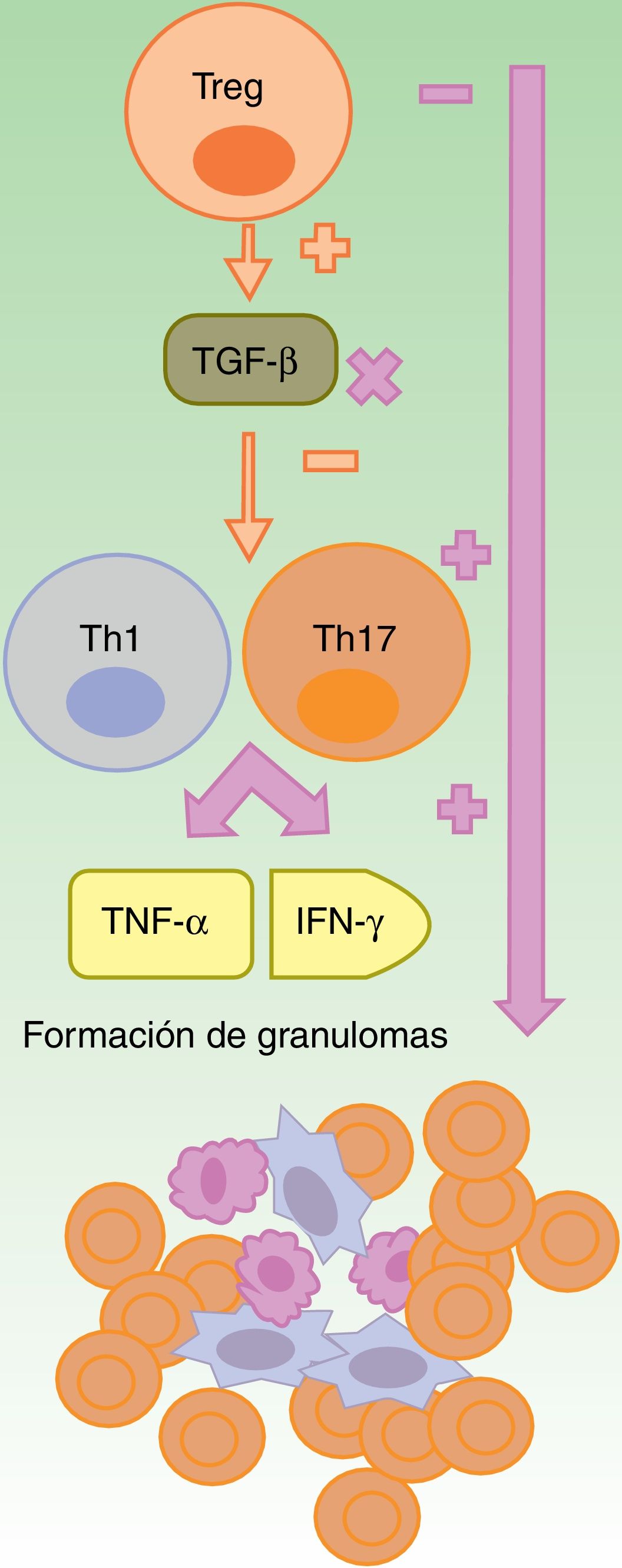
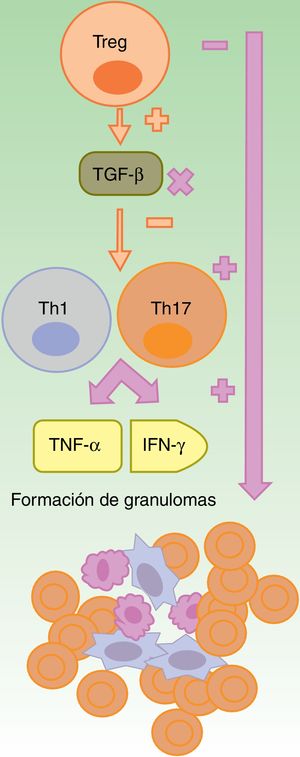
Reacciones granulomatosasLa formación del granuloma no caseificante, tanto en la sarcoidosis como en la EC, requiere de una respuesta Th1, con una participación inicial de IL-1β e IFN-γ, y otra más tardía del TNF-α25. Los anti-TNF-α podrían favorecer las reacciones granulomatosas por un desbalance entre las células Th17 y Treg. La falta de eficacia de etanercept en enfermedades granulomatosas y la aparición paradójica de estas con su uso podría explicarse por la neutralización parcial del TNF26-28 y por la falta de producción de TGF-β, en ausencia del cual se produce una sobreproducción de IFN-γ y de TNF-α (fig. 2)27.
Formación de granulomas estériles en contexto de terapia anti-TNF-α.
Los fármacos anti-TNF-α son parcialmente eficaces, en general, en las enfermedades granulomatosas como la enfermedad de Crohn o la sarcoidosis. Se sugiere que esto es debido a un desbalance secundario a su uso, con un incremento en la función de los linfocitos Th17. Dentro de estos fármacos, etanercept provoca reacciones granulomatosas con mayor frecuencia, de un lado por el bloqueo solo parcial del TNF-α y, del otro, por la falta de producción de TGF-β, lo cual permite una sobreproducción de IFN-γ y de TNF-α, esenciales en el desarrollo del granuloma aséptico.
IFN: interferón; linfocito Th: linfocito T colaborador; linfocito Treg: linfocito T regulador; TGF: factor de crecimiento transformante; TNF: factor de necrosis tumoral.
El bloqueo del TNF-α podría reducir la eliminación de desechos celulares producidos tras la apoptosis. Esto impediría el aclaramiento de linfocitos T y B autorreactivos y facilitaría la producción de anticuerpos frente a antígenos nucleares29,30. En pacientes con AR, psoriasis y APs tratados con infliximab y, en menor frecuencia, con etanercept y adalimumab, se ha objetivado la formación de ANA (29-76,7%) y de anti-DNA-ds (10-29%). Esta inmunogenicidad no influye en la efectividad de la terapia y, generalmente, no tiene repercusión clínica10,29, aunque es posible el desarrollo de reacciones tipo lupus29,31.
Factores genéticosEn el desarrollo de lesiones psoriasiformes secundarias a biológicos se ha evidenciado la relación con distintos polimorfismos de un solo nucleótido que afectan a genes involucrados en la producción de citoquinas, como el IL-23R, el CTLA-4 o el FBXL19. Así, es probable que las reacciones paradójicas ocurran sobre la base de una predisposición genética y que los avances en este campo permitan identificar a aquellos individuos en riesgo de desarrollarlas32.
Reacciones paradójicasReacciones paradójicas verdaderasBajo este término se incluyen aquellas enfermedades inmunomediadas en las que se ha establecido claramente la eficacia de la terapia biológica.
Psoriasis y reacciones psoriasiformesEntre las primeras y más frecuentes reacciones paradójicas destacan las reacciones psoriasiformes y la psoriasis.
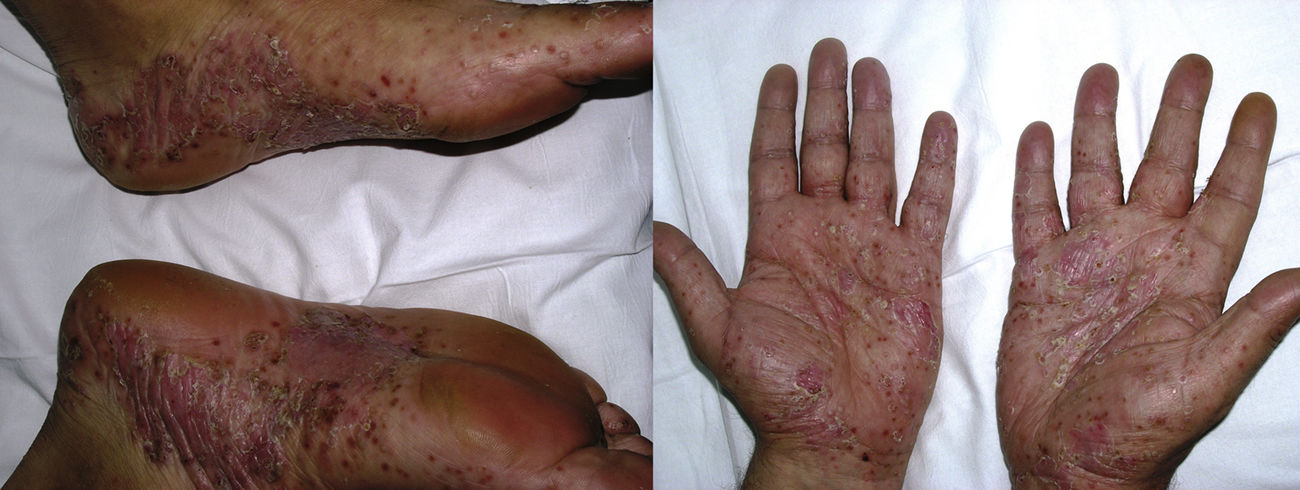
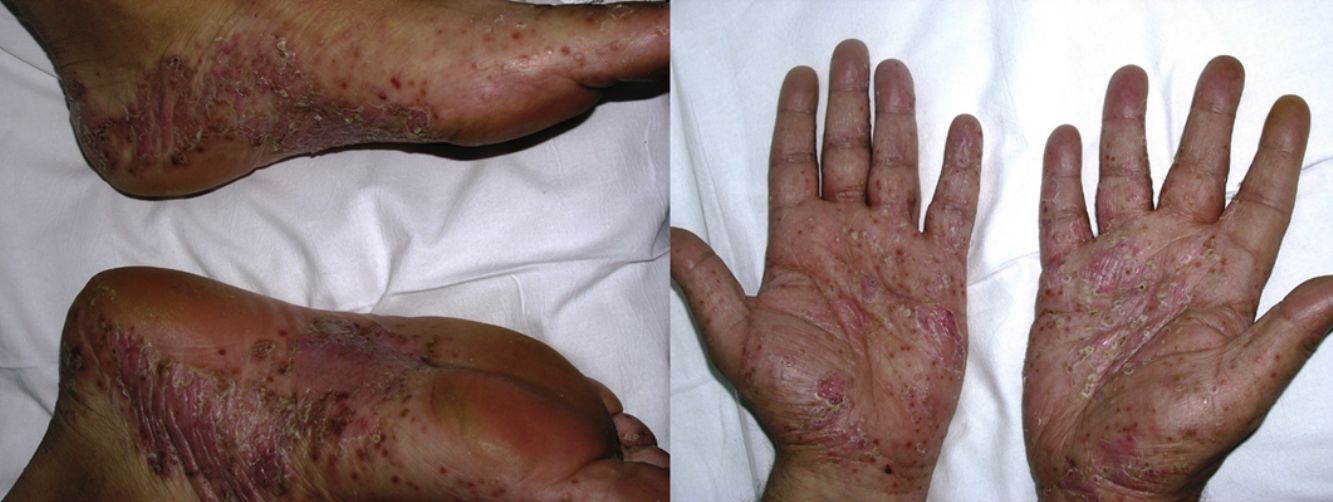
La psoriasis de novo ocurre en pacientes con distintas enfermedades inflamatorias bajo terapia biológica9 con una incidencia del 0,6 al 5,3%21 (fig. 3). De los 207 casos incluidos en la revisión de Collamer y Battafarano19, un 43% presentaban AR, un 26% espondiloartropatía seronegativa y un 20% enfermedad inflamatoria intestinal (EII). El fármaco más frecuentemente implicado es infliximab, que supone alrededor del 50% de los casos11,33, seguido de adalimumab34 y etanercept, siendo infrecuentes con certolizumab35 o golimumab9,11,33. Puede aparecer en cualquier momento desde el inicio del fármaco, aunque la latencia media es de 14 meses, y en más de 2/3 partes ocurre dentro del primer año33,35. Aunque existe un predominio femenino, este parece estar en relación con la epidemiología de las enfermedades inflamatorias de base y no se han establecido claros factores de riesgo ni diferencias en cuanto a sexo o edad, con aparición también en niños36. Tampoco la asociación con otro inmunosupresor, como metotrexato, parece tener influencia19.
La psoriasis de nueva aparición puede adoptar cualquier morfología. La revisión de Collamer y Battafarano19 establece como más frecuente la psoriasis pustulosa en las palmas y las plantas (56%), seguida de la psoriasis en placas (50%) y en gotas (12%), con hasta un 15% de los pacientes afectados con múltiples formas a la vez. En el 92% de las ocasiones no existía historia previa de psoriasis. La revisión de Brown et al.33 únicamente incluye aquellos casos de nueva aparición y describe como más frecuente la psoriasis en placas (44,8%), seguida de la forma pustulosa de las palmas y las plantas (36,3%). Tienden a aparecer, por orden de frecuencia, en las palmas y las plantas, las extremidades, el cuero cabelludo y el tronco33. La afectación del cuero cabelludo también se ha asociado a alopecia37,38. La psoriasis ungueal se manifiesta con cambios característicos como decoloración, onicólisis y piqueteado, así como paroniquia11,19,39.
Por otro lado, el uso de agentes biológicos puede empeorar una psoriasis ya existente antes del tratamiento11,21,40,41. En estos casos, no existen diferencias en cuanto al sexo y el fármaco habitualmente implicado es etanercept (62%), seguido por infliximab (23%) y adalimumab (15%)21.
El agravamiento de una psoriasis previa puede cursar sin cambio de morfología, con una latencia altamente variable (desde 15 días hasta 32 meses). Cuando se produce un cambio en la morfología de las lesiones, la forma más característica es el desarrollo de una exacerbación con lesiones en gotas en pacientes que presentaban psoriasis en placas, mientras estas se encuentran en remisión. Este empeoramiento ocurre desde 15 días hasta 18 meses tras el inicio del tratamiento21.
Las características histológicas de la psoriasis paradójica son indistinguibles de la psoriasis espontánea; sin embargo, la presencia —en ocasiones escasa— de eosinófilos o de células plasmáticas puede mostrar el desarrollo inducido por fármacos33,42,43.
En general, el pronóstico es favorable y la aparición de una psoriasis paradójica no siempre implica el abandono del biológico, especialmente cuando se controla la enfermedad subyacente y las lesiones cutáneas son leves y tolerables, a las que puede asociarse un tratamiento específico que, en la mayoría de las ocasiones, será tópico10,19,21. A pesar del mantenimiento del fármaco, es frecuente la resolución total (32,9%) o la mejoría parcial (57,3%) de las lesiones. Las remisiones completas se consiguen con mayor frecuencia al retirar el fármaco (47,7%)33. El cambio a otro anti-TNF-α distinto al inicial es posible, pero la reaparición de las lesiones es incierta al considerarse un efecto adverso de clase12,44. Hasta un 44,9% podría no mejorar con el cambio a otro anti-TNF-α y un 9% conseguiría solamente una mejoría parcial33. Se ha sugerido, alternativamente, el uso de un fármaco con un mecanismo de acción distinto, como ustekinumab, con buena respuesta17,45. Sin embargo, también este último fármaco se ha asociado a un empeoramiento paradójico de la psoriasis23 e incluso a APs en pacientes con psoriasis en placas46.
Inflamación articularLa aparición de inflamación articular paradójica se ha descrito sobre todo en pacientes con EII durante la terapia anti-TNF-α, con aparición de artritis en hasta un 11% de los casos, fundamentalmente con afectación periférica de las manos y los carpos y, con menor frecuencia, en forma de espondiloartropatía47,48.
Son también numerosos los casos de APs de nueva aparición en pacientes con psoriasis tratados con ustekinumab y fármacos anti-TNF-α, especialmente etanercept (45,4%)49. A menudo, la inflamación articular ocurre asociada a lesiones cutáneas graves y se ha descrito la aparición simultánea de artritis interfalángica distal con dactilitis, psoriasis pustulosa y afectación ungueal50. La psoriasis y la APs comparten vías patogénicas, como la participación de las células Th1751. Ello permite mostrar que en la APs inducida por ustekinumab, y probablemente por otros biológicos, existen casos de artritis de aparición precoz, resultante del desbalance de citoquinas que el fármaco genera, y casos tardíos, en que se manifestaría una APs subclínica debido a la menor eficacia del biológico a nivel articular, que no evitaría, por tanto, su expresión clínica46,52.
Enfermedad inflamatoria intestinalTanto el empeoramiento paradójico de la EII como los casos de novo inducidos por anti-TNF-α se han descrito en pacientes con distintas enfermedades inflamatorias, entre ellas psoriasis y APs53,54. Existe un claro predominio de desarrollo de EC (50%), o formas similares (43,7%), sobre el de colitis ulcerosa (CU) (6,25%). El fármaco responsable en más del 80% de los casos es etanercept53 que, a diferencia de infliximab o adalimumab, no ha demostrado claramente eficacia en la EII27,55. En la mayoría de los casos, existe una respuesta completa con el cambio de biológico53,55.
A diferencia de lo que ocurre con infliximab o adalimumab, el desarrollo de EII con los anti-IL-17 se considera un efecto adverso no paradójico. La inhibición de la IL-17 no es eficaz en la EII, probablemente debido a la función protectora de la IL-17 sobre el epitelio intestinal56,57. Secukinumab58 e ixekizumab59 (antagonistas de la IL-17A), así como brodalumab60 (antagonista del IL-17RA), se han asociado a la exacerbación y, con menor frecuencia, a la inducción de la EII. En términos generales, es un efecto adverso con una incidencia infrecuente y similar a la asociación entre EII y psoriasis; sin embargo, brodalumab está formalmente contraindicado en la EC activa y para el resto de fármacos se recomienda el uso con precaución en pacientes con EII56, siendo preferibles alternativas que actúen sobre otras vías, como ustekinumab.
Hidradenitis supurativaLos anti-TNF-α pueden ser eficaces en el tratamiento de la hidradenitis supurativa (HS)61. Se han publicado al menos 30 casos de HS secundarios a dicha terapia en pacientes con enfermedades inflamatorias, entre ellas psoriasis62,63. Aunque la HS puede asociarse a otras entidades, como la EC64, la pronta aparición tras el inicio del fármaco y en enfermedades inflamatorias distintas hacen probable la relación con el biológico62,63. Además, el 44% de pacientes desarrollaron otras reacciones paradójicas simultáneamente, como psoriasis, alopecia areata (AA), EC e HS. La HS paradójica es demográficamente similar a la espontánea: predominio femenino, fumadores, con sobrepeso u obesidad. Adalimumab es el fármaco asociado con más frecuencia (48%)63. En la mayoría de casos, la retirada o cambio de fármaco y el tratamiento específico para la HS consiguieron su mejoría parcial o completa62,63.
Reacciones paradójicas controvertidasExisten múltiples enfermedades inmunomediadas que ocurren durante el uso de agentes biológicos que no han demostrado formalmente su eficacia en el tratamiento de las mismas, si bien existen datos clínicos o fisiopatogénicos a favor de su uso. Por ello, hasta la fecha, no pueden considerarse auténticas reacciones paradójicas.
Alopecia areataSe ha descrito la aparición de AA parcheada (79%) en el cuero cabelludo o la barba, en pacientes con psoriasis, AR y EII tratados con anti-TNF-α65. Aunque la AA podría aparecer como manifestación autoinmune asociada en pacientes predispuestos66, el predominio masculino y el desarrollo simultáneo (25%) de vitíligo o psoriasis apuntan al origen inducido por fármacos65. De forma paralela, se ha definido la alopecia psoriásica/alopecia tipo AA por anti-TNF-α como aquella en que se desarrollan lesiones eritematodescamativas asociadas a placas de alopecia y que histológicamente muestran cambios psoriasiformes epidérmicos y cambios de AA en la dermis43,67,68. En la mayoría de los casos, puede mantenerse el fármaco y es suficiente la asociación de corticoides tópicos o intralesionales65,67,68. Recientemente, se han demostrado eficaces en la AA, vía tópica o sistémica, los inhibidores de la janus kinasa (JAK). Su uso tópico podría suponer una alternativa en la AA inducida por biológicos69.
También se han reportado 3 casos de AA en pacientes con psoriasis tratados con ustekinumab42, a pesar de que la implicación de la IL-12 en la patogénesis de la AA haría esperable que este actuase favorablemente en la enfermedad66,70. Además de vías patogénicas compartidas con otras entidades, el fenómeno de Renbök, es decir, el crecimiento normal de pelo en lesiones psoriásicas en pacientes que además presentan AA42 podría explicar que la inmunorregulación que resuelve la psoriasis desenmascara una AA latente por la propia inflamación psoriásica70,71.
VitíligoLa elevación de TNF-α en el suero de pacientes con vitíligo justificó el tratamiento con anti-TNF-α de esta dermatosis sin obtenerse, en términos generales, buenos resultados41,72. Por el contrario, se han descrito 18 casos de novo y otros 18 de empeoramiento de vitíligo preexistente en pacientes con enfermedades inflamatorias crónicas, la más frecuente psoriasis, tratadas con anti-TNF-α, ustekinumab y secukinumab73. A pesar de la asociación —al menos epidemiológica— entre psoriasis y vitíligo74, la temporalidad y la ausencia de factores predisponentes en la mayoría de pacientes sugiere su origen inducido farmacológicamente73,75. Un 72,2% se ha asociado a infliximab y adalimumab, mientras que el 22,2% se atribuyó a ustekinumab y secukinumab. No se han descrito casos con etanercept. En la mayoría se consiguió la estabilización o mejoría del vitíligo a pesar del mantenimiento del biológico73, por lo que la decisión de retirarlo debe individualizarse.
Erupciones acneiformesCon menor frecuencia, infliximab, adalimumab76 y etanercept77 se han asociado al desarrollo de acné quístico y comedoniano. La latencia es de unos 2 meses desde el inicio del fármaco y no existen factores predictivos para su desarrollo. En muchos casos, el tratamiento adicional con isotretinoína podría ser suficiente76.
Liquen plano y reacciones liquenoidesPueden encontrarse en la literatura más de 20 casos de liquen plano (LP), LP pilar y LP oral, así como reacciones liquenoides, secundarios a inhibidores del TNF-α78,79. Aunque la terapia anti-IL-17 podría tener alguna utilidad en el tratamiento del LP80, se han descrito casos de mucositis liquenoide en relación con secukinumab81.
Dermatitis granulomatosa intersticialLa dermatitis granulomatosa intersticial (DGI) ocurre de manera espontánea asociada a enfermedades como la AR, el lupus eritematoso sistémico (LES) y las neoplasias hematológicas82. Se ha descrito su aparición en pacientes con AR o APs tratados con anti-TNF-α con resolución completa de las lesiones tras su retirada83,84.
LupusLos fármacos anti-TNF-α son causa de lupus y de reacciones tipo lupus, en particular etanercept e infliximab30,85. A diferencia del lupus inducido por fármacos (LIF) clásico, el causado por anti-TNF-α tiene un mayor predominio femenino, con una relación mujer:hombre de 5:1, y se caracteriza por títulos elevados de anti-DNA-ds (70-90%), un mayor consumo de complemento (59%) y una menor relación con los anticuerpos anti-histonas (57%), presentes en el 95% de los LIF clásicos10,30. El LIF por anti-TNF-α presenta manifestaciones similares a la forma clásica, aunque con una mayor afectación cutánea, especialmente con etanercept, y un marcado predominio de la fotosensibilidad, el eritema malar y rasgos de lupus cutáneo subagudo o crónico30. También se ha reportado la aparición de paniculitis lúpica con adalimumab86.
Por otro lado, cabe mencionar la difícil distinción —casi basada en la temporalidad de aparición— entre un síndrome «rhupus», esto es, la combinación de LES y AR, de aquel LIF que aparece en un paciente con AR tratado con anti-TNF-α29.
En todos los casos es de elección la retirada del fármaco, sin que ello impida necesariamente utilizar otro del mismo grupo terapéutico10,29,30,47.
VasculitisLas vasculitis pueden ocurrir secundariamente al uso de biológicos como rituximab y anti-TNF-α; de hecho, estos últimos se han convertido en la causa más habitual de vasculitis inducida por fármacos, por delante de otros como el propiltiouracilo o la hidralacina87. Son más de 200 los casos descritos por terapia anti-TNF-α en pacientes con AR, EC, APs y psoriasis, entre otras41,87,88. Sus características son similares a las provocadas por otras terapias y aparecen durante el primer año en mujeres de mediana edad87,88. En general, son vasculitis cutáneas, que se manifiestan como púrpura y, menos frecuentemente, como nódulos o lesiones ulcerativas88. Existen también casos de vasculitis sistémica, como la arteritis de Takayasu89 y la vasculitis de Schonlein-Henoch90. En un 90% la retirada del anti-TNF es eficaz en la resolución de la vasculitis41,87,88.
SarcoidosisSon numerosos los casos de sarcoidosis inducida por anti-TNF-α en pacientes con EII91,92, psoriasis cutánea93, AR, espondilitis anquilosante (EA) y APs25,26,94,95. Más de la mitad de los casos publicados afectaban a mujeres de mediana edad y en tratamiento con etanercept, mientras que son menos frecuentes con infliximab o adalimumab26,94. La sarcoidosis inducida por fármacos se comporta de forma similar a la espontánea. Las manifestaciones clínicas más comunes son las pulmonares y las cutáneas, en forma de eritema nudoso o nódulos cutáneos. En un 89% se observa remisión tras la retirada del fármaco10,26,94. Por otro lado, se ha reportado la aparición de sarcoidosis en una paciente con APs tratada con ustekinumab con buena respuesta a su retirada96, aunque este fármaco, a diferencia de infliximab y adalimumab, no parece útil en la sarcoidosis espontánea97.
ConclusionesLas terapias biológicas utilizadas en psoriasis se dirigen frente a moléculas específicas, como el TNF-α, la IL-12/23 o la IL-17 (tabla 2). Cuando se interrumpe una parte de estas vías inmunitarias puede generarse, en individuos predispuestos, un desbalance de citoquinas que dé lugar a un proceso inflamatorio. Este puede afectar a un único órgano, frecuentemente la piel, o ser sistémico. Cuando el fármaco que induce dicha enfermedad inflamatoria forma parte de su terapéutica habitual, hablamos de reacción paradójica verdadera. En general, tienen una baja incidencia; sin embargo, el incremento en el uso de nuevos fármacos biológicos hace esperable un aumento en el número de casos, así como en la diversidad de la expresión clínica de dichas entidades. De este modo, es recomendable una monitorización estrecha de los pacientes en tratamiento biológico para poder detectarlas. Además, es deseable evaluar mediante métodos estandarizados el grado de asociación causal entre la reacción paradójica y el agente biológico, lo que permitiría incrementar el conocimiento clínico y la comprensión de los mecanismos inmunológicos subyacentes a estos efectos. Por último, el desarrollo de nuevos agentes biológicos incrementará el número de alternativas para el control de la enfermedad de base en aquellos pacientes que desarrollen alguna reacción paradójica clínicamente relevante.
Puntos clave
| • Las reacciones paradójicas consisten en la aparición de novo o el empeoramiento de una patología que normalmente respondería al mismo biológico que la induce |
| • Se han descrito fundamentalmente con el uso de agentes anti-TNF-α, donde se considera un efecto de clase; sin embargo, cada vez son más los casos secundarios a otros biológicos, como ustekinumab y los anti-IL-17 |
| • El bloqueo, directo o indirecto, del TNF-α resulta en un exceso de IFN-α, que estimula la respuesta y la migración de los linfocitos T, provocando la reacción inflamatoria |
| • La psoriasis paradójica es la más frecuentemente descrita. Las formas más habituales son la pustulosa y en placas, y predomina la afectación de las palmas y las plantas |
| • Otras entidades dermatológicas secundarias al uso de biológicos son la hidradenitis supurativa, la alopecia areata, el vitíligo, la dermatitis granulomatosa intersticial y las reacciones acneiformes |
| • La aparición de una reacción paradójica no implica siempre la retirada del fármaco; en ocasiones, bastará con añadir tratamiento tópico o sistémico para la misma. Si la afectación es grave o extensa, debe plantearse el cambio a otro agente biológico |
Jose Manuel Carrascosa ha recibido honorarios por ponencias y/o ha participado en ensayos clínicos y/o en advisories para Abbvie, Pfizer, Janssen, Novartis, Lilly y Amgen.