Este último año ha sido rico en novedades dermatopatológicas que se vislumbran como el inicio de una nueva era. Los avances en las técnicas de biología molecular y su simplificación, que las hace asequibles al uso rutinario, han supuesto un cambio radical en el concepto de lesiones como el melanoma, cuya caracterización genética será en el futuro un requisito indispensable para establecer el diagnóstico, el pronóstico y la terapéutica. Las innovaciones tecnológicas también han llegado a los servicios de Dermatología; la introducción de ecógrafos ha propiciado el uso de técnicas de citología por punción-aspiración que pueden ser teñidas y estudiadas de manera inmediata, facilitando el diagnóstico de lesiones superficiales y ganglionares, y permitiendo la estadificación de neoplasias como el melanoma. La aparición de tratamientos oncológicos dirigidos contra «dianas terapéuticas» ha conllevado la introducción de sistemas más sensibles y específicos para su idetificación, ha reactivado el interés por patologías olvidadas como el carcinoma basocelular agresivo y ha comportado la aparición de reacciones dermatológicas que, junto con las secundarias a fármacos biológicos, empezamos a reconocer. Técnicas consolidadas como la inmunohistoquímica continúan progresando con la incorporación de nuevos anticuerpos que contribuyen de manera notable al diagnóstico. Este año, además, se han descrito o caracterizado nuevas entidades clinicopatológicas, y entre ellas 2 nuevos tipos de melanoma. También se ha avanzado en el conocimiento de otras, como el linfoma T pleomórfico CD4+ de células pequeñas/medianas. Estos temas, junto con novedades en tumores anexiales, alopecias y otras lesiones, serán comentados en esta revisión.
This past year has seen a wealth of new developments in dermatopathology that appear to herald the dawning of a new era. Advances in molecular biology and the simplification of techniques have put molecular tests within reach of routine clinical practice and led to a radical change in our approach to lesions such as melanoma; in the future, the genetic characterization of these lesions will be an essential requirement for establishing diagnosis, prognosis, and therapy. Technological innovations have also reached dermatology departments: the introduction of ultrasound scans has propitiated the use of fine-needle aspiration cytology, which allows samples to be stained and studied immediately, thereby facilitating diagnosis of superficial and lymph-node lesions, and allowing staging of tumors such as melanoma. Targeted cancer therapies have led to the introduction of more sensitive and specific systems for identifying new targets, have reawakened interest in forgotten diseases such as aggressive basal cell carcinoma, and have led to dermatological reactions that, together with those caused by biologic drugs, we are just beginning to recognize. Consolidated techniques such as immunohistochemistry continue to advance with the addition of new antibodies that contribute considerably to improved diagnosis. New clinicopathologic diseases have also been described or characterized this year, including 2 new types of melanoma, and progress has been made in our knowledge of other diseases, such as primary cutaneous CD4+ small/medium-sized pleomorphic T-cell lymphoma. These topics, together with new developments in adnexal tumors, alopecia, and other lesions, will be discussed in this review.
Este último año ha sido muy rico en novedades dermatopatológicas, muchas de ellas relacionadas con progresos técnicos y terapéuticos. En esta breve revisión se comentarán algunos de los avances que pueden tener mayor repercusión en el diagnóstico dermatopatológico, agrupándolos en 6 grandes temas: proliferaciones melanocíticas, enfermedades inflamatorias (incluyendo las reacciones a fármacos), procesos linfoproliferativos, alteraciones anexiales, tumores epidérmicos y tumores mesenquimales.
Proliferaciones melanocíticasEn los últimos años el melanoma ha sido uno de los temas estrella en Dermatopatología. La reciente introducción del FISH (fluorescent in situ hybridization) como técnica auxiliar en la identificación de tumores melanocíticos malignos supuso un gran paso adelante en un problema estancado desde hacía décadas1. Por desgracia, la evidencia demuestra que la combinación de sondas dirigidas contra cromosomas 6 y 11, disponible comercialmente, es insuficiente en casos problemáticos2–4, obteniéndose una sensibilidad y especificidad menores a las esperadas; por este motivo deberán incluirse nuevas sondas, posiblemente dirigidas contra regiones génicas del cromosoma 9, para optimizar los resultados del kit diagnóstico. De cualquier modo, cada vez resulta más evidente que las alteraciones genéticas presentes en cada melanoma se correlacionan con características clinicopatológicas y su comportamiento biológico5,6, y pueden ayudar a explicar las grandes diferencias en la evolución de melanomas que aparentemente se encuentran en un mismo estadio.
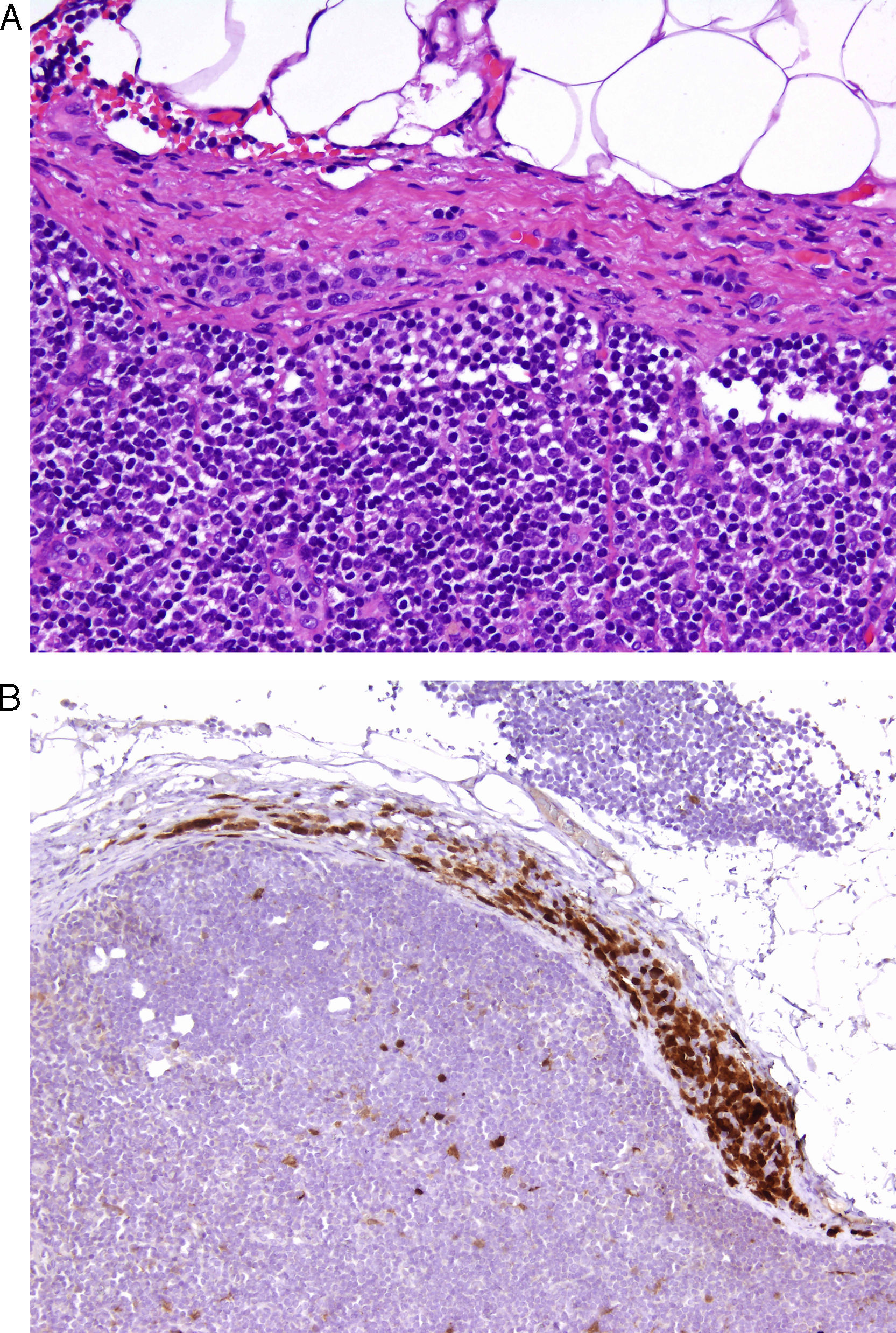
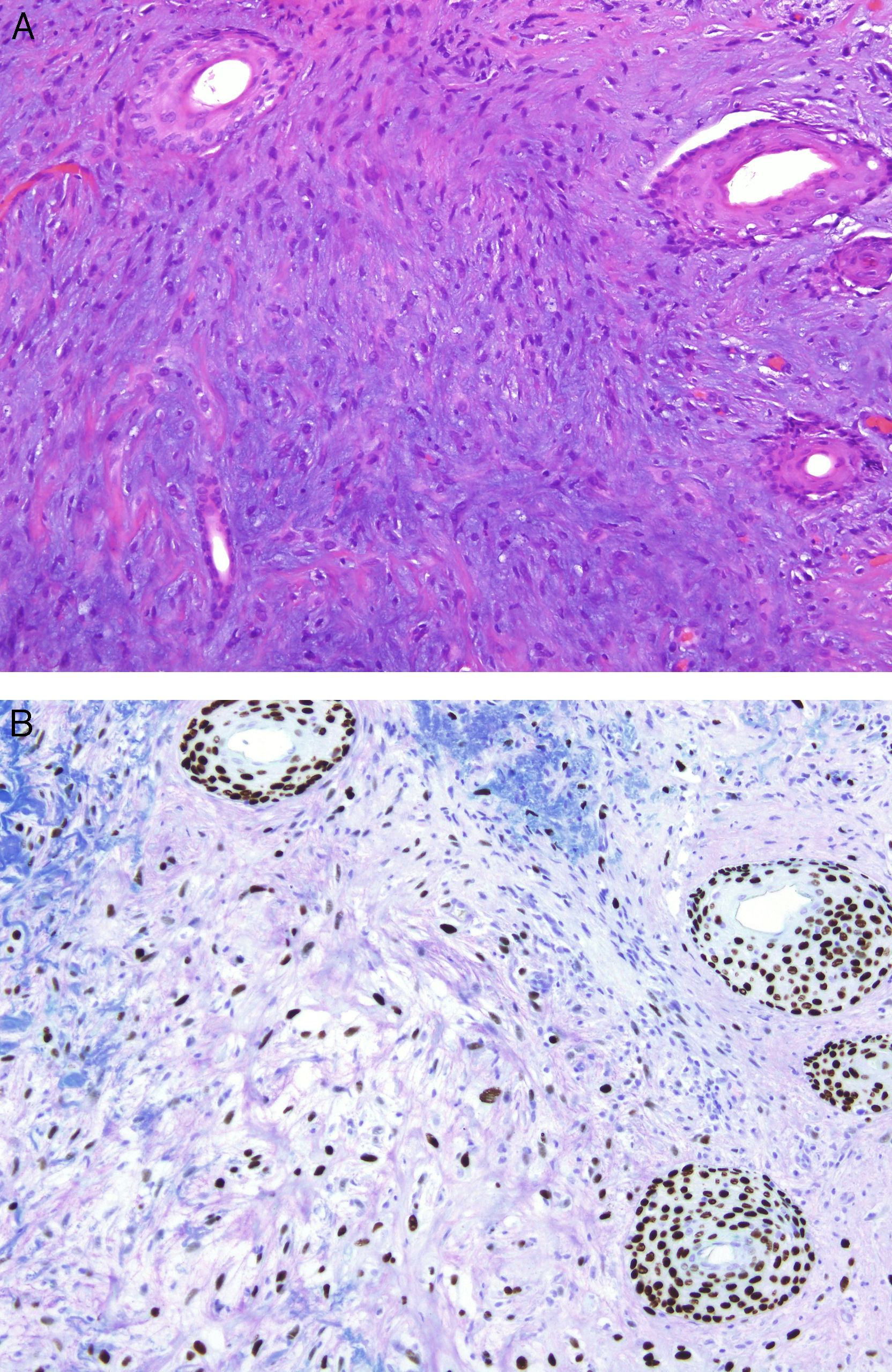
Desde un punto de vista práctico y en el momento actual, en la mayor parte de los laboratorios de Patología las técnicas inmunohistoquímicas son las más asequibles y manejables. Por este motivo resultan especialmente interesantes los trabajos que demuestran la utilidad de estos marcadores. Un ejemplo de ello es un estudio en el que la sobreexpresión de CD10 apareció como un factor independiente de mal pronóstico en el melanoma7. Igualmente han aparecido bastantes trabajos que muestran cómo la pérdida de expresión inmunohistoquímica de p16 en lesiones melanocíticas se asocia a transformación maligna, contribuyendo a la diferenciación entre nevus de Spitz y melanoma infantil8, o entre inclusiones névicas en ganglios centinela y pequeñas metástasis de melanoma9 (fig. 1). Su utilidad no resulta tan clara en otros casos como nevus fusocelulares pigmentados4. Además, en algunos pacientes con síndrome de nevus displásico se observa de manera característica una pérdida de expresión de esta proteína, cuya ausencia constituye un paso inicial al desarrollo del melanoma10.
A. La presencia de pequeñas inclusiones névicas en la porción capsular de los ganglios centinelas de melanoma no es un fenómeno infrecuente, y puede causar dificultades diagnósticas cuando el tumor primario era un melanoma nevoide. (HE × 200.) B. La preservación de la expresión de p16 podría ser un dato adicional que apuntara a benignidad. (p16 [inmunohistoquímica] × 200.)
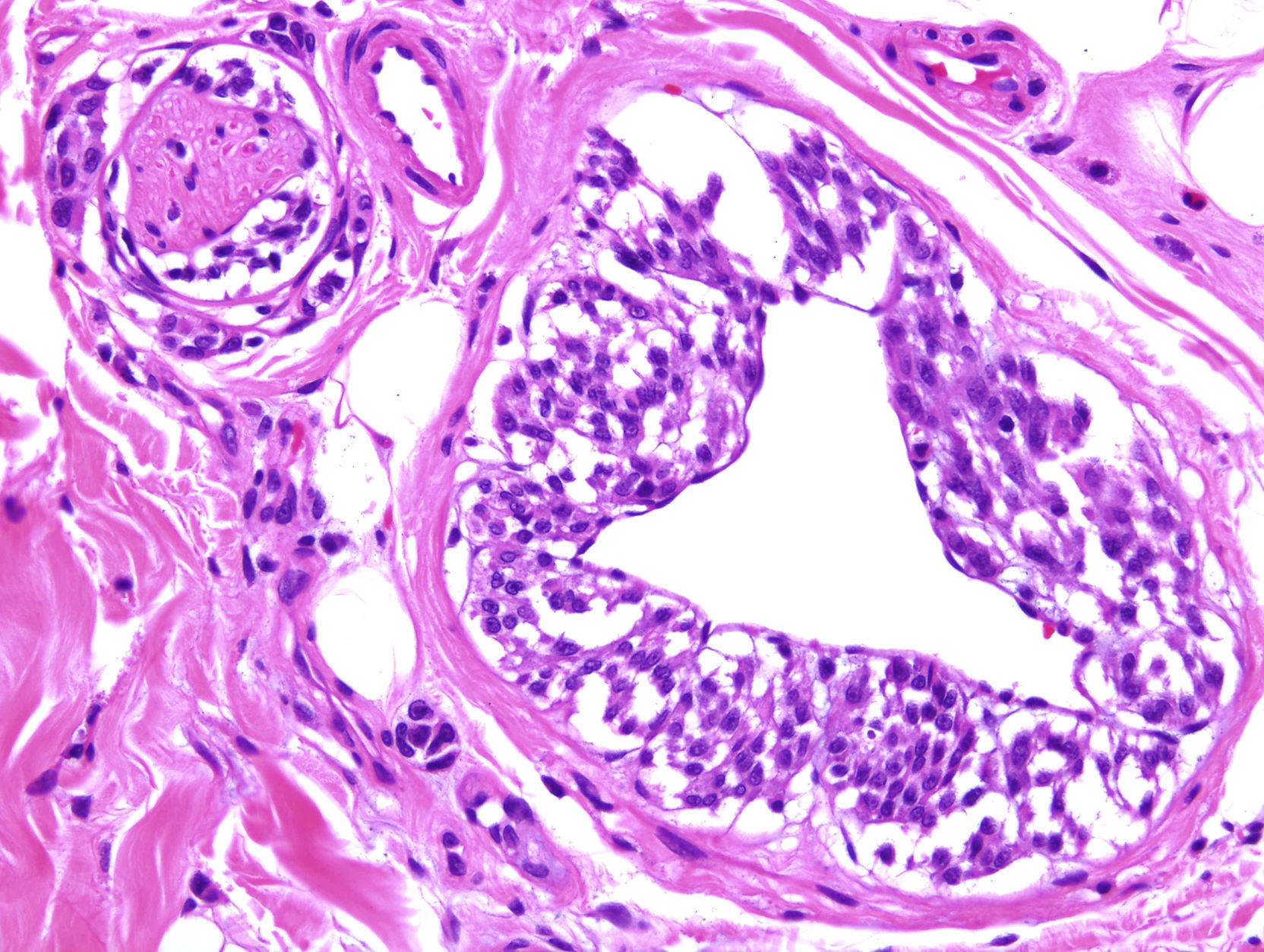
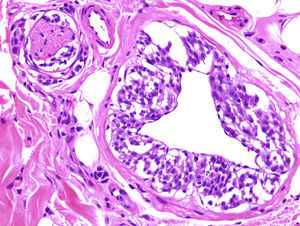
Se han publicado un par de trabajos tranquilizadores sobre el bajo riesgo de metástasis en tumores spitzoides y melanocíticos atípicos en niños11,12. Una posible explicación de que estas lesiones lleguen a ganglios centinela, pero carezcan del potencial de generar metástasis diseminadas, sería el angiotropismo: las células melánicas se extenderían hasta los ganglios por el espacio perivascular, pero carecerían del potencial de invadir el torrente linfático o hemático. Este fenómeno es similar a la infiltración perineural y puede observarse también en algunos melanomas (fig. 2). Las células que llegarían por este mecanismo a los ganglios linfáticos no podrían considerarse metástasis en sentido estricto. Un grupo de reputados dermatopatólogos aconsejan el uso de los marcadores vasculares D2-40 y CD34 para definir claramente la relación de las células tumorales con las estructuras vasculares13.
Imagen de un melanoma con angiotropismo y neurotropismo. El fenómeno de angiotropismo es análogo a neurotropismo y está presente en algunos tumores melanocíticos benignos y malignos. Podría explicar la llegada de células melánicas a ganglios linfáticos, sin que se trate de auténticas metástasis. (HE × 200.)
Junto con la introducción de ecógrafos en los servicios de Dermatología, se ha planteado la posibilidad de efectuar punciones-aspiraciones con aguja fina en tumores superficiales o ganglios sospechosos de metástasis (una práctica que no tiene por qué estar restringida a radiólogos o patólogos intervencionistas; por analogía, algunos endocrinólogos realizan punciones de tiroides). Se ha propuesto14,15 aplicar esta técnica en el estudio de ganglios sospechosos de metástasis de melanoma, incluyendo los ganglios centinela. En la experiencia de los autores una ecografía negativa del ganglio centinela ofrece una elevada fiabilidad y, de existir algún foco sospechoso, bastaría con una punción-aspiración con aguja fina —guiada ultrasonográficamente— para efectuar un diagnóstico citológico inmediato. En caso de que se demostraran metástasis permitiría pasar directamente a la linfadenectomía, disminuyendo por consiguiente la morbilidad y el gasto sanitario, mientras que los ganglios ecográficamente sospechosos, pero cuyas extensiones citológicas no demuestren la presencia de metástasis, deberían ser estudiados exhaustivamente siguiendo los protocolos habituales en los ganglios centinela.
En este año se han descrito 2 nuevas variantes histopatológicas de melanoma. La primera es el melanoma de extensión superficial con grandes nidos junturales16, que puede pasar microscópicamente inadvertido por carecer de muchos criterios microscópicos de malignidad. Suele desarrollarse sobre zonas con daño actínico y, aunque tiende a mostrar crecimiento radial, puede infiltrar la dermis. La segunda es el melanoma asociado a inactivación germinal de BAP1 (BRCA1 associated protein-1)17, un nuevo síndrome hereditario que predispone a los pacientes a padecer nevus melanocíticos epitelioides, tumores spitzoides atípicos, melanoma cutáneo y uveal, carcinoma de pulmón, meningioma, mesotelioma y otros cánceres18. Del mismo modo, individuos que no padecen este síndrome pueden también presentar proliferaciones melanocíticas epitelioides atípicas con inactivación de BAP1 y mutación de BRAF (v-Raf murine sarcoma viral oncogene homolog B1)19. Las lesiones asociadas a inactivación de BAP1 se caracterizan por una descorrelación entre su aspecto microscópico de nevus de Spitz atípico y una apariencia clínica bastante anodina, semejante a un nevus de Unna o nevus de Miescher.
Finalmente, la introducción de un tratamiento de los melanomas metastásicos con BRAF mutado ha traído consigo la automatización de los procesos de detección, que aporta una mayor sensibilidad que la tradicional PCR con posterior secuenciación. Siguiendo la tendencia bastante generalizada de crear alianzas entre las empresas que comercializan técnicas de detección de biomarcadores con las que producen los fármacos que los toman como diana terapéutica, la misma empresa que comercializa un fármaco anti BRAF distribuye el aparato que detecta la mutación que determina su indicación terapéutica, ofreciendo mayor sensibilidad y especificidad que las técnicas convencionales de secuenciación o PCR.
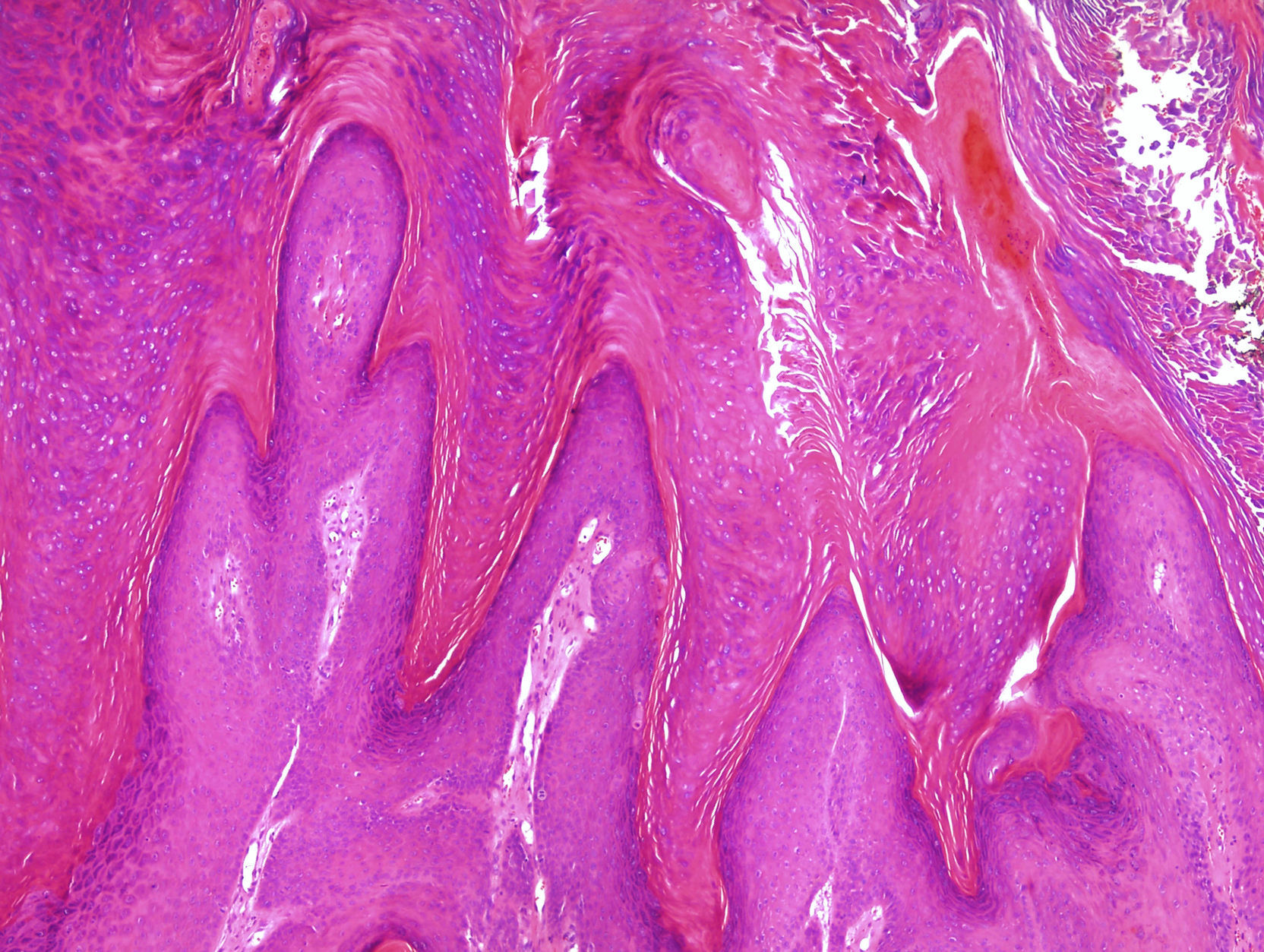
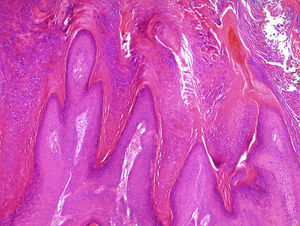
Reacciones a fármacos y otros procesos inflamatoriosLa introducción de nuevos fármacos conlleva a menudo la aparición de reacciones cutáneas con patrones histopatológicos hasta entonces desconocidos, y las reacciones a tratamientos dirigidos contra biomarcadores son un buen ejemplo. En pacientes en tratamiento con vemurafenib, un inhibidor de BRAF que actúa en melanomas con mutaciones V600e, se han descrito diversos cuadros cutáneos, entre ellos una paniculitis lobulillar neutrofílica20 que suele ser dolorosa y asociada a artritis, microscópicamente los cambios son focales y a veces muy sutiles. En cualquier caso, en los pacientes que reciben este tratamiento las lesiones más biopsiadas son proliferaciones verrugosas que poseen rasgos intermedios entre verrugas víricas comunes, queratoacantomas y carcinomas escamosos21(fig. 3).
Los pacientes en tratamiento con sorafenib22, que se ha prescrito entre otras indicaciones, en casos de melanoma metastásico con mutaciones en KIT, también desarrollan proliferaciones epiteliales que no suelen ser papilomatosas, sino que tienden a la quistificación, frecuentemente en relación con folículos pilosos. Este tratamiento también puede producir cuadros similares a la pitiriasis rubra pilaris23.
Los medicamentos biológicos, introducidos hace ya varios años, han comportado asimismo la aparición de reacciones diversas que comienzan a estar bien caracterizadas. En una revisión reciente de efectos adversos a antagonistas del TNF-alfa se incluyen, junto con patologías ricas en neutrófilos (dermatitis psoriasiformes, psoriasis pustulosa palmoplantar, foliculitis pustulosa, síndrome de Sweet, hidradenitis ecrina neutrofílica o vasculitis leucocitoclástica), lesiones tipo eritema multiforme o tipo lupus eritematoso24. En otro trabajo los antagonistas del TNF-alfa fueron responsables de una reacción pseudolinfomatoide25. Este tipo de reacciones también ha sido descrito en tratamientos con ustekinumab26.
Siguiendo en el terreno de las reacciones a fármacos, un trabajo recientemente publicado refuta la idea de que la presencia de eosinófilos en el lupus eritematoso subagudo sea indicativa de un origen medicamentoso27; y otro revisa una serie de casos con diagnóstico clinicopatológico de toxicodermia28 en los que se demostró posteriormente otra causa, sugiriendo que este recurso diagnóstico es usado en exceso, especialmente ante erupciones maculopapulares.
Un estudio reciente29 ha puesto en entredicho el valor pronóstico de la densidad del infiltrado inflamatorio en la necrólisis epidérmica tóxica30, cuya intensidad se consideraba que se correlacionaba directamente con el riesgo de fallecimiento en el curso de la enfermedad. En este trabajo29 únicamente tendría significado pronóstico el grosor de la necrosis epidérmica, y aun así no supondría un factor predictivo independiente.
En una vasculitis leucocitoclástica severa la exocitosis de neutrófilos a la superficie puede provocar la aparición de microabscesos en punta de papilas que simulan una dermatitis herpetiforme. La publicación de un caso de dermatitis herpetiforme que comenzó con petequias y vasculitis leucocitoclástica31 nos alerta de la posibilidad de cometer el error opuesto. También han aparecido 4 nuevos casos de dermatitis neutrofílica difusa no ampollosa del lupus eritematoso, usualmente sistémico, con lo que se configura definitivamente como una nueva variante muy difícil de reconocer microscópicamente32.
Un trabajo muy curioso estudia el efecto de la inmersión accidental en formol de biopsias que estaban destinadas a la congelación para realizar estudios mediante inmunofluorescencia33. No resulta sorprendente conocer que en solo 2 min desaparece la tinción en casos de pénfigo y en menos de 10 min en los de penfigoide. Lo asombroso es que los depósitos inmunológicos en una dermatitis herpetiforme pueden resistir en muestras que han pasado hasta 2 h sumergidas en formol. También es bueno saber que tras una inmersión prolongada en formol los núcleos queratinocitarios adquieren autofluorescencia, simulando un lupus eritematoso.
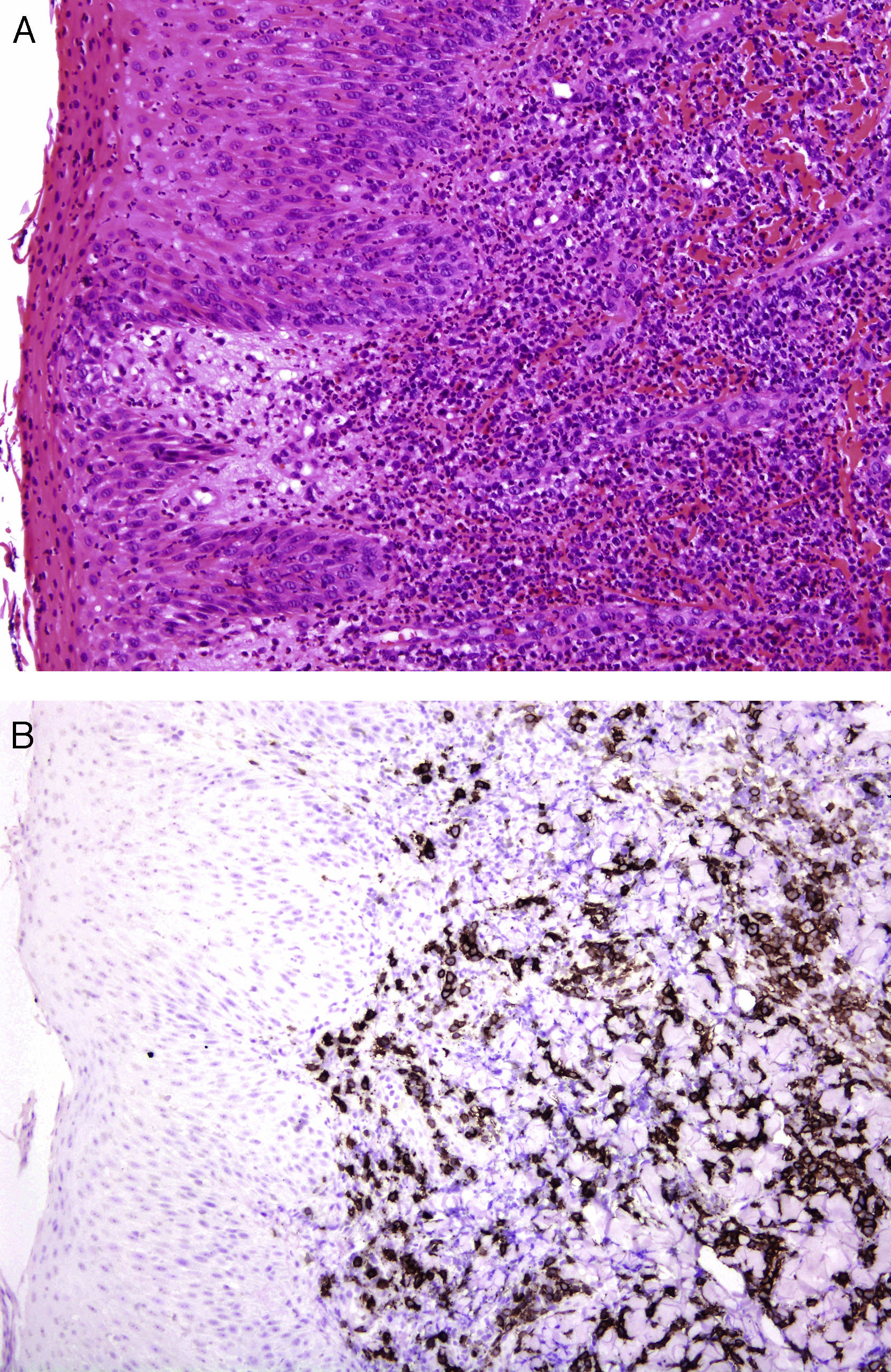
Un grupo internacional de dermatopatólogos europeos ha recogido y estudiado 13 casos de lesiones con apariencia clínica y comportamiento propio de una pitiriasis liquenoide aguda, pero que en la biopsia pueden tener clonalidad T y contienen un gran número de células CD30+ (fig. 4) que a menudo coexpresan CD8. Estas lesiones no solo simulan microscópicamente una papulosis linfomatoide, sino que podrían formar un espectro con esta entidad. Los autores han encontrado ADN de parvovirus 19 en un 40% de los casos, lo que junto con el inmunofenotipo CD8+, CD30+ sugiere una posible etiología vírica34.
Se ha descrito asimismo una nueva variante de granuloma anular pseudolinfomatoso35, rico en linfocitos T CD8+ que se suma a las formas conocidas de esta enfermedad (necrobiótica, intersticial incompleta y las raras sarcoidea o tuberculoide)35.
Siguiendo en el capítulo de lesiones pseudolinfomatosas, se ha descrito un caso pediátrico de paniculitis lipoatrófica de probable causa autoinmune con apariencia microscópica de linfoma T paniculítico36. Otras paniculitis que pueden causar problemas de diagnóstico diferencial son las secundarias a mucormicosis cutánea y mucosa, que pueden simular de manera convincente una paniculitis pancreática o gotosa37, lo que en parte puede explicarse por la capacidad de estos hongos de producir lipasa extracelular.
Procesos linfoproliferativosEn el campo de los linfomas son especialmente interesantes los avances en la caracterización del linfoma T CD4+, pleomórfico de células pequeñas/medianas primario cutáneo, una entidad provisional para la Organización Mundial de la Salud (OMS) que por su escasa agresividad, especialmente cuando se trata de un proceso unilesional, se ha considerado una forma de trastorno linfoproliferativo T clonal de comportamiento indolente. Este proceso se caracteriza por una proliferación de linfocitos con inmunofenotipo T helper de centro folicular que se caracterizan por expresar PD1 (programmed cell death 1)38, lo que contribuye a distinguirlos de otros linfomas cutáneos de células T.
Es posible que los casos agrupados en esta entidad provisional puedan dividirse en 2 categorías. Una gran mayoría de pacientes presentaría un transtorno linfoproliferativo de bajo grado análogo a un pseudolinfoma T38 (usualmente lesiones solitarias), mientras que una pequeña proporción presentaría un linfoma de linfocitos T helper centrofoliculares (usualmente lesiones múltiples), con un comportamiento biológico mucho más agresivo39 que requiere tratamiento potente. En estos linfomas la presencia de numerosos linfocitos B en el infiltrado, y la expresión de CD10 en los linfocitos neoplásicos, pueden causar confusión con un linfoma folicular.
Alteraciones anexialesEn los últimos meses se han descrito 2 casos de hiperplasia eruptiva de glándulas sebáceas ectópicas, tras episodios de erosión epidérmica causados por una escaldadura en un caso40 y por un síndrome de Stevens-Johnson en otro41.
En el terreno de las alopecias se han publicado 2 nuevas claves diagnósticas42,43. Una de ellas muestra la utilidad de la luz polarizada para diferenciar las cicatrices de alopecia cicatricial (que son polarizables), de las estelas foliculares (streamers) fibrosas de la alopecia androgenética, que pese a tener un aspecto microscópico muy similar no polarizan42. Un segundo trabajo de la misma autora nos proporciona una clave diagnóstica para la alopecia frontal fibrosante. Se trata de la «tríada folicular» que consiste en la afectación simultánea de folículos en 3 estadios (anagen-telogen-catagen) y de 3 tipos (terminal-vello-intermedio)43. Esta clave puede ser muy útil para identificar esta variante de alopecia liquenoide que no está restringida a la región frontal, sino que puede afectar a todo el cuero cabelludo y a otras áreas cutáneas, a las que recientemente se ha añadido el cuadro de pápulas faciales por afectación del vello facial44.
Siguiendo con las alopecias, 2 trabajos independientes muestran que la alopecia permanente secundaria a la quimioterapia sistémica presenta un patrón idéntico al de la alopecia androgenética y puede plantear el diagnóstico diferencial con ella45,46. Finalmente, se ha propuesto una nueva manera de optimizar un único punch para obtener cortes horizontales o transversales, muy útiles en el diagnóstico de alopecia, al tiempo que se examinan cortes verticales que permiten valorar la afectación de la epidermis y la porción más superficial de la dermis, que aporta asimismo información relevante47. Su propuesta es efectuar secciones verticales (perpendiculares a la epidermis) en el milímetro superficial y cortar el resto del punch en secciones horizontales (paralelas a la epidermis).
Pasando a los tumores anexiales, uno de los artículos más llamativos aparecido en el último año es la descripción de invasión perineural en tricoblastomas desmoplásicos, un rasgo extremadamente infrecuente en los tumores benignos, pero que en este contexto no puede seguir siendo considerado fiable para diferenciarlos de carcinomas48. También se ha propuesto la eosinofilia como una clave para el diagnóstico del carcinoma anexial microquístico49.
Tumores epidérmicosLa introducción de tratamientos inhibidores de la vía hedgehog contra el carcinoma basocelular avanzado50 parece haber animado la publicación de numerosos casos de carcinoma basocelular agresivo51,52. No está claro por qué algunos de estos tumores poseen un potencial maligno tan elevado, alcanzado gran tamaño, invadiendo tejidos profundos o incluso causando metástasis. En una revisión de la literatura51 el carcinoma basoescamoso aparece como una de las variantes más agresivas del tumor y de las que con mayor frecuencia metastatizan, mientras que en otro trabajo esta variante, que se considera rara, tiene un pronóstico similar a la del carcinoma basocelular usual53, incluso en pacientes trasplantados. En cualquier caso para confirmar el diagnóstico de este tumor recomiendan el uso de Ber-EP4 (clona Ber-EP4), positivo en las áreas de basocelular y negativas en las de escamoso53. Siguiendo con este anticuerpo es interesante una observación realizada por autores españoles que han apreciado tinción con Ber-EP4 a ambos lados de las hendiduras que rodean los nidos epiteliales del carcinoma basocelular54. Este anticuerpo, también conocido como EpCAM (epithelial cell adhesion molecule), está dirigido contra un antígeno epitelial específico (una glucoproteína de superficie), por lo que la tinción en la parte externa de las hendiduras indicaría que corresponde a un elemento epitelial. En resumen, los espacios de retracción típicos del carcinoma basocelular no aparecen entre epitelio y estroma, como siempre se había dicho, sino en la porción más periférica del epitelio54.
Por último, han aparecido diversos artículos confirmando el valor predictivo del nuevo sistema de estadificación del carcinoma escamoso (American Joint Committe of Cancer [AJCC])55 que incluye datos de mal pronóstico que no aparecen en el sistema de estadificación del cáncer TNM, como la mala diferenciación histológica, el espesor mayor a 2mm, un nivel de Clark superior a iv, la presencia de invasión vascular y/o perineural y la localización en la oreja o en el labio.
Tumores mesenquimalesUn artículo reciente56 confirma que la expresión de p63 es rara en los tumores mesenquimales, y cuando aparece es usualmente focal o débil, confirmado su utilidad para la identificación de los carcinomas pseudosarcomatosos (fig. 5). De igual manera, nuevos estudios confirman la amplificación de MYC (avian myelocytomatosis virus) como un excelente marcador de los angiosarcomas que aparecen tras radioterapia o en áreas de linfedema, frente a los otros angiosarcomas y los otros tumores malignos que se desarrollan tras radioterapia. Además, para detectarlo es tan fiable la sobreexpresión inmunohistoquímica como la realización de FISH57,58.
Finalmente se ha propuesto la denominación de sarcoma pleomorfo de la dermis para aquellas lesiones que microscópicamente se parecen a fibroxantomas atípicos pero invaden tejidos profundos, o que muestran extensa necrosis o invasión vascular o perineural59. Incluso hemos tenido espacio para la polémica, como la surgida en la descripción del hemangioendotelioma pseudomiogénico, anteriormente descrito como sarcoma epitelioide-like60.
ConclusiónEn conclusión, en este año pródigo en novedades se han producido avances significativos en el diagnóstico, estadificación y tratamiento de lesiones melanocíticas. Se han descrito nuevas formas de reacciones a fármacos, especialmente frente a los más recientemente introducidos en el arsenal terapéutico. Se han llevado a cabo importantes avances en la caracterización del linfoma T CD4+ pleomórfico de células pequeñas/medianas primario cutáneo, una entidad todavía provisional para la OMS que en muchos casos es superponible a los pseudolinfomas T. Asimismo, se han publicado nuevas claves diagnósticas en alopecias, se ha reportado la presencia de invasión perineural en un tricoblastoma desmoplásico y se ha confirmado la utilidad de la p63 y MYC en la identificación de proliferaciones epiteliales pseudosarcomatosas y angiosarcomas posradioterapia o sobre linfedema, respectivamente. Asimismo, se ha confirmado la buena correlación con el comportamiento biológico de la nueva estadificación de la AJCC para el carcinoma escamoso de piel.
Estos y otros excelentes trabajos, que por razones de espacio no han podido ser incluidos en esta revisión, son reflejo de la brillante producción científica que de manera continuada enriquece el campo de la dermatopatología y que nos permite ser muy optimistas en el porvenir de esta disciplina.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.


![A. La presencia de pequeñas inclusiones névicas en la porción capsular de los ganglios centinelas de melanoma no es un fenómeno infrecuente, y puede causar dificultades diagnósticas cuando el tumor primario era un melanoma nevoide. (HE × 200.) B. La preservación de la expresión de p16 podría ser un dato adicional que apuntara a benignidad. (p16 [inmunohistoquímica] × 200.) A. La presencia de pequeñas inclusiones névicas en la porción capsular de los ganglios centinelas de melanoma no es un fenómeno infrecuente, y puede causar dificultades diagnósticas cuando el tumor primario era un melanoma nevoide. (HE × 200.) B. La preservación de la expresión de p16 podría ser un dato adicional que apuntara a benignidad. (p16 [inmunohistoquímica] × 200.)](https://static.elsevier.es/multimedia/00017310/0000010400000003/v1_201304241344/S0001731012004802/v1_201304241344/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)
![A. Erupción liquenoide en un niño con características clínicas de PLEVA que histológicamente muestra atipia linfocitaria. (HE × 200.) B. Contiene abundantes células linfoides CD30+. (CD30 [inmunohistoquímica] × 200.) A. Erupción liquenoide en un niño con características clínicas de PLEVA que histológicamente muestra atipia linfocitaria. (HE × 200.) B. Contiene abundantes células linfoides CD30+. (CD30 [inmunohistoquímica] × 200.)](https://static.elsevier.es/multimedia/00017310/0000010400000003/v1_201304241344/S0001731012004802/v1_201304241344/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)
![A. Dermis sustituida por colágeno denso englobando células fusiformes de aspecto mesenquimal. (HE × 100.) B. La positividad para p63 demuestra un origen epitelial y permite el diagnóstico de carcinoma escamoso fusocelular. (p63 [inmunohistoquímica] × 100.) A. Dermis sustituida por colágeno denso englobando células fusiformes de aspecto mesenquimal. (HE × 100.) B. La positividad para p63 demuestra un origen epitelial y permite el diagnóstico de carcinoma escamoso fusocelular. (p63 [inmunohistoquímica] × 100.)](https://static.elsevier.es/multimedia/00017310/0000010400000003/v1_201304241344/S0001731012004802/v1_201304241344/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)



