* Esta tesis doctoral obtuvo el Premio Glaxo-SmithKline 2001 a la mejor tesis.
Algunos de los experimentos realizados no se muestran debido a limitaciones de espacio. Pueden encontrarlos en las siguientes referencias:
Peñas PF, Gómez M, Buezo GF, et al. Differential expression of activation epitopes of beta1 integrins in psoriasis and normal skin. J Invest Dermatol 1998;111:19-24.
Peñas PF, García-Díez A, Sánchez-Madrid F, Yánez-Mo M. Tetraspanins arel localized at motility-related structures and involved in normal human keratinocyte wound healing migration. J Invest Dermatol 2000;114:1126-35.
INTRODUCCIÓN
Integrinas
Las integrinas son un grupo de proteínas transmembrana que pertenecen a la familia de las moléculas de adhesión (1). Se componen de dos subunidades contiguas y diferentes (heterodímeros), unidas de manera no covalente y denominadas ay β(Fig. 1). En función de la cadena βse han clasificado en subfamilias. En humanos algunas subfamilias de integrinas se han descrito involucradas en interacciones entre célula y matriz extracelular y otras en la unión célula-célula. El lugar de unión al ligando está formado por ambas cadenas y necesita de la presencia de cationes divalentes (Ca2+, Mg2+, Mn2+) (2-4).
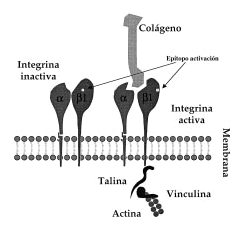
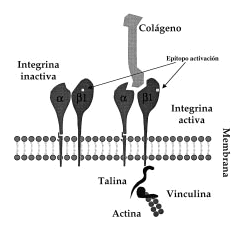
FIG. 1.--Esquema de integrinas ß1. Cuando las integrinas ß1 adquieren la conformación activa exponen epítopos de activación en su superficie que pueden ser detectados con anticuerpos monoclonales. En esta situación se pueden unir a ligandos extracelulares (por ejemplo, colágeno) y además se unen a las proteínas intracelulares (talina, vinculina) que median la unión al citoesqueleto de actina.
La función de las integrinas se regula a dos niveles diferentes: expresión selectiva (5, 6) y modulación de sus propiedades de unión (7, 8). Respecto a esta última, las integrinas tienen la capacidad de modificar de forma rápida, reversible y transitoria tanto su afinidad como su avidez por su o sus ligandos (7-9). Esta capacidad se relaciona con dos fenómenos:
--Cambio de la conformación de la integrina, que incrementa su afinidad por el ligando. Las integrinas se pueden encontrar en estado activo (con alta afinidad por sus ligandos) o inactivo. Su activación ocurre en respuesta a ciertos agentes que se unen a sus dominios extracelulares (señalización fuera-dentro), a señales generadas dentro de la célula (señalización dentro-fuera) o a ambos (7).
--Agrupamiento de las integrinas en un sitio determinado de la membrana celular, lo que permite interacciones múltiples y estables que se denomina avidez. Esta regulación conlleva el cambio en la localización topográfica de las integrinas en la membrana celular, influye en la fuerza de interacción de las moléculas con su ligando y parece estar relacionado con modificaciones en el citoesqueleto (7). Recientemente se ha implicado a las tetraspaninas en la movilidad de las integrinas.
Hasta ahora la mayor parte de los estudios se han centrado en la regulación de la expresión de las integrinas; sin embargo, la aparición de anticuerpos que reconocen su estado de activación permite el estudio de la modulación de sus propiedades de adhesión (10-14). Estos anticuerpos reconocen epítopos que aparecen en la integrina cuando cambia su conformación en el momento de su unión al ligando (Fig. 1), permitiendo diferenciar la conformación inactiva (no unida al ligando) de la activa (o unida a ligando). Para la familia de integrinas β1 el anticuerpo monoclonal (acm) HUTS-21, generado y caracterizado por el Servicio de Inmunología del Hospital de La Princesa (15), es capaz de detectar la conformación activa de las integrinas β1.
Las integrinas β1 se han implicado principalmente en la adhesión a matriz extracelular y se considera que sirven como vía de integración entre los medios intra y extracelular (16). En los queratinocitos tienen una localización preferente en unas regiones de la membrana denominadas contactos focales. Estructuralmente están compuestos por integrinas que por un extremo se ligan a la matriz extracelular y dentro de la célula enlazan con el citoesqueleto de actina mediante un complejo de proteínas entre las que se incluyen la α-actinina, vinculina, talina, paxilina y tensina (Fig. 1) (17). Cada una de estas proteínas parece tener misiones específicas singulares en la regulación de los contactos focales, uniéndose o modificando otras proteínas intracelulares involucradas en la generación de señales de activación como FAK, tirosincinasas (Src, Csk) y posiblemente GTPasas de bajo peso molecular. La activación de estas enzimas induciría fenómenos tales como la reorganización del citoesqueleto o la inducción de la expresión de diversos genes (16). Los queratinocitos basales expresan integrinas α2β1, α3β1 y α6β4. En situaciones especiales, como la curación de heridas, aparecen en el queratinocito la α5β1, αvβ5 y la αvβ6 (18, 19). En los contactos focales aparece α2β1 cuando los queratinocitos crecen sobre colágeno y en cambio es α3ß1 la que se encuentra si crecen sobre laminina (20). Además de α3β1, la integrina α6β4 es un receptor abundante para la laminina 5, aunque localizado exclusivamente en los hemidesmosomas (21).
Las integrinas parecen jugar un papel en otras funciones del queratinocito. Durante la estratificación, los queratinocitos reducen su capacidad para adherirse a la matriz extracelular, parece que mediante un cambio conformacional de las integrinas ß1 (18) ya que precede a la pérdida de las integrinas de la superficie del queratinocito (22). Se ha sugerido que es la proporción de integrinas ß1 unidas a ligando, sobre todo de α5ß1, uno de los factores que intervienen en la regulación de la diferenciación (23). Es muy importante el papel de las integrinas ß1 en la migración celular. Este proceso vincula la coordinación de la generación de proyecciones celulares (filopodios y lamelipodios) con la formación de contactos en el borde de avance y la rotura de estos contactos y retracción celular en el polo caudal (24). Se piensa que los contactos focales sirven como lugares que coordinan la adhesión celular y la movibilidad. Los queratinocitos migran en colágeno y fibronectina y permanecen fijos en vitronectina y laminina. Además, el uso de anticuerpos contra ß1 bloquean la migración de queratinocitos sobre fibronectina o colágeno (25). La implicación de las integrinas ß1 en la adhesión intercelular en queratinocitos ha sido muy debatida y no está aclarada (20, 26-28). Es llamativo que las integrinas presentan una distribución pericelular y no quedan confinadas en la superficie de la célula basal que se encuentra en contacto con la membrana basal. Además, en cultivo, las integrinas tienden a concentrarse en las zonas de unión intercelular. Algunos autores piensan que α2β1 y α3β1 median la adhesión queratinocito-queratinocito (20, 27), mientras que otros lo ponen en duda (29). Recientemente se ha sugerido que el aumento de integrinas en las zonas de contacto intercelular se debe a digitaciones de la membrana y no a un aumento de densidad (30). Por otra parte se desconoce el ligando de las integrinas en la célula vecina.
Integrinas β1 en patología cutánea
En la epidermis la expresión de integrinas β1 está limitada a la capa basal. Sin embargo, en algunas situaciones los queratinocitos suprabasales diferenciados expresan integrinas β1. Así ha sido descrita durante el proceso de curación de heridas (31, 32) y en varias enfermedades cutáneas: psoriasis (31, 33-36), eccema y liquen plano (36). Se ha demostrado que la expresión suprabasal de integrinas β1 en la psoriasis no es consecuencia de la inflamación ya que no es inducida por la inyección intradérmica de citoquinas (37) y se ha sugerido que pueda ser un factor patogénico en la enfermedad (38).
Tetraspaninas
Recientemente se han descrito unas proteínas con cuatro regiones transmembrana, conocidas como tetracruzadoras, tetraspaninas o proteínas TM4 (39). Estas moléculas han sido implicadas en la regulación del desarrollo, proliferación, activación y movilidad celulares y se acoplan a diversas vías de transducción de señales (39-42). Las tetraspaninas coprecipitan con diversas proteínas transmembrana y con integrinas ß1 en particular (41-44). Se ha sugerido que las tetraspaninas podrían constituir un puente entre las integrinas β1 y otras proteínas para generar complejos funcionales que regulan la adhesión intercelular y con matriz extracelular y la movilidad celular (42). Estas uniones integrinas-tetraspaninas parecen ocurrir únicamente en la superficie externa de la célula, no involucran al dominio citoplásmico de las integrinas, y generalmente tienen lugar fuera de los contactos focales. Entre las tetraspaninas se encuentran CD9, CD37, CD53, CD63, CD81, CD82, CD151. El CD9 se expresa en todas las capas de la epidermis viva, pero no tiñe la membrana celular del queratinocito en contacto con la membrana basal (45), y en estudios in vitro se ha encontrado la colocalización del CD9 y α3β1 en los queratinocitos basales, pero no en los contactos focales. El queratinocito expresa también CD53, CD81, CD82 (46) y CD151 (47). Éste se expresa en la membrana celular del queratinocito basal con mayor expresión sobre la membrana en contacto con la lámina basal.
MATERIAL Y MÉTODOS
Cultivo de queratinocitos humanos normales
Los queratinocitos fueron cultivados, con pequeñas modificaciones, tal como se ha descrito previamente (28, 48, 49). La piel, obtenida de cirugía cosmética o reductora, se incubó en una solución de dispasa (Boehringer Mannheim) a 1,2 U/ml durante 24 h a 4° C. Tras lavar en PBS se separó mecánicamente la epidermis de la dermis y se introdujo en tripsina 0,05% con EDTA 0,02% (BioWittaker) durante 25 mi-nutos. La suspensión obtenida fue filtrada y centrifugada y el residuo se resuspendió en medio basal de queratinocitos y se repartió en placas de plástico (Costar) en una cantidad entre 40.000-50.000 células/cm2. A las 24 horas se sustituyó el medio por medio completo, que se reemplazaba 3 días en semana. Todos los experimentos se realizaron con células entre dos y cinco pases.
Medios de cultivo de queratinocitos
Medio con suero
El medio basal se compone de tres partes de DMEM (Life Technologies Inc) y una parte de HAM F-12 (Life Technologies Inc.), a la que se añade gentamicina 20 µ/ml, adenina 1,8 ´104 M (Sigma) y 10% de suero fetal bovino. Se considera medio completo cuando se le añade hidrocortisona 0,5 µg/ml (Sigma); insulina, 5 µg/ml (Boehringer Mannheim); factor de crecimiento epidérmico (EGF), 10 µg/ml (ICN); transferrina, 5 µg/ml (Sigma), y toxina colérica, 10 ng/ml (ICN).
Medio sin suero
Se utilizó Defined Keratinocyte Serum Free Medium (DKSFM, Life Technologies Inc). Se considera medio completo cuando se le añade el suplemento incluido con el mismo. El nivel de calcio es menor de 0,1 mM según especifica la compañía fabricante.
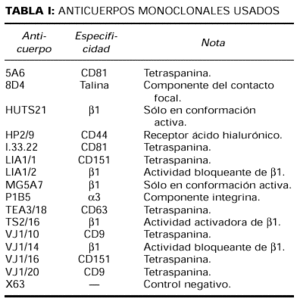
Anticuerpos (tabla I)
Los acm dirigidos contra la cadena β1 de las integrinas fueron: el acm activador TS2/16 (CD 29) (50), los acm bloqueantes Lia1/2 y VJ1/14 (51) y el acm que reconoce epítopos de activación HUTS-21 (15). MG5A7 es un nuevo acm anti-β1 que reconoce un epítopos de activación en las integrinas β1 (28).
El acm anti-CD44 HP2/9 ha sido previamente descrito (52). Los acm que reconocen tetraspaninas fueron: LIA1/ y VJ1/16 (anti-CD151), 5A6 (anti-CD81), proporcionado por el doctor S. Levy (Oncology, Stanford University School of Medicine, Stanford, CA, EE. UU.), y el I.33.22 (anti-CD81), proporcionado por el doctor Vilella (Hospital Clínic de Barcelona).
TEA3/18 (anti-CD63) y VJ1/10 (anti-CD9) fueron obtenidos en el laboratorio de Inmunología del Hospital Universitario de La Princesa. P1B5 (antiintegrina α3) y 8D4 (antitalina) fueron comprados a Chemicon International Inc. y Sigma, respectivamente. La proteína de mieloma de ratón P3X63 (IgG1, κ) se utilizó como control negativo.
Citometría de flujo
Los queratinocitos se repartieron en tubos a concentración de 106 células/ml (100.000 células por tubo). Se lavaron con PBS y se incubaron con los anticuerpos en estudio durante 30 minutos. Tras un lavado con PBS se incubaron con el anticuerpo secundario conjugado con isotiocianato de fluoresceína [fluorescein isothiocyanate (FITC)] (DAKO) durante otros 20 minutos. Tras volver a lavar se resuspendieron en PBS con yoduro de propidio a 10 mg/ml. La fluorescencia se cuantificó pasando las células por un citómetro de flujo FACScan® (Becton Dickinson Labware) con el programa Lysys II. En el análisis se descartaron las células muertas según los parámetros de tamaño y complejidad y la presencia de fluorescencia roja con yoduro de propidio.
Experimentos de adhesión celular
Los experimentos de adhesión celular se realizaron como se ha descrito previamente (15). Se usaron placas de 96 pocillos de base plana (Titertek) que se cubrieron con colágeno tipo I (ICN) o fibronectina (Sigma). Posteriormente se saturaron los sitios libres del plástico con albúmina sérica bovina [bovine serum albumine (BSA)] y se lavaron con PBS y una vez más con un tampón Hepes/NaC1. En ese momento se añadió a cada pocillo 50 ml de tampón Hepes/NaC1 que contenía bien 2,5 mg del acm purificado y/o 2 mM MnC12. Se añadieron posteriormente 2,5 ´ 105 queratinocitos en 50 ml del tampón Hepes/ NaC1 a cada pocillo. Se transfirieron las placas a un incubador de CO2 a 37° C. Después de 30 minutos se lavaron los pocillos en tres ocasiones. El porcentaje de células que permanecieron adheridas se calculó midiendo la absorbancia de cada pocillo a 540 nm tras fijar y teñir las células con cristal violeta al 0,5% en metanol al 20%.
Experimentos de migración de queratinocitos en un modelo de curación de heridas
Los experimentos de migración en un modelo de curación de herida se realizaron tal como ha sido descrito (53). En resumen, las células se sembraron en placas de 24 pocillos (Costar) y fueron cultivadas hasta confluencia usando medio completo sin suero. Después se cambió a medio basal sin suero que contenía o no los acm purificados a 20 µg/ml. Treinta minutos tras el cambio de medio, la monocapa de queratinocitos fue rayada linealmente con un raspador celular. Se tomaron fotografías a diversos tiempos en un microscopio de inversión de contraste de fases Nikon Diaphot 300 equipado con una videocámara Sony SSC-M350CE CCD y un VCR (Sony). El área de la herida se calculó utilizando un programa de análisis de imagen OPTIMAS (Bioscan). Los experimentos se realizaron por duplicado.
Técnica de inmunohistoquímica e inmunofluorescencia sobre cortes de tejido
Se obtuvo piel afecta de ocho pacientes con psoriasis y piel sana de 10 pacientes sometidos a cirugía en el Departamento de Dermatología del Hospital de La Princesa. Inmediatamente tras la biopsia se introdujeron las muestras en nitrógeno líquido tras embeberlas en OCT (Miles). Se realizaron cortes seriados de 4-6 µm de cada pieza con un microtomo criostático. Los cortes se montaron sobre portaobjetos de cristal, se cubrieron con acetona a 4° C durante 10 mi-nutos y se secaron a temperatura ambiente.
Las tinciones de inmunohistoquímica de piel sana y psoriásica se realizaron en paralelo sobre los cortes congelados usando la técnica de inmunoperoxidasa en dos pasos previamente descrita (54). Los cortes se incubaron con el primer acm durante 45 minutos. Después se lavaron en un tampón de Tris-HC1 1M a pH 7,6 y se cubrieron con un anticuerpo secundario conjugado con peroxidasa de rábano (DAKO-PATTS). Después se incubaron con diaminobencidina y H2O2 (Sigma) para producir la tinción enzimática. Finalmente se contratiñeron con hematoxilina durante 1 minuto, se deshidrataron y se terminó montando con un cubreobjetos. Como control externo se utilizó la tinción con el receptor de hialuronato CD44 y como controles negativos el acm X63 e incubaciones sin anticuerpo. Se anotaron la extensión y la intensidad de la tinción para cada acm y se tomaron fotografías de las preparaciones.
Para los estudios de doble inmunofluorescencia las laminillas se lavaron con tampón Tris pH 8,3. Se bloqueó con TNB y se incubaron con el primer anticuerpo durante 30 min a 37° C. Tras lavar se realizó una incubación con el anticuerpo secundario conjugado con Alexa FluorTM-488 (Molecular Probes) durante 30 minutos a 37° C. Posteriormente se lavaron las lami-nillas, se realizó un bloqueo con suero de ratón y se incubaron con un anticuerpo biotinilado durante 30 minutos a 37° C. Tras nuevos lavados se realizó una última incubación con avidina marcada con Cy3 (Amersham Pharmacia Biotech). Como control nega-tivo se utilizaron X63 e incubaciones sin anticuerpo. Una vez terminada la técnica se cubrieron las laminillas con cubreobjetos fijándolos con una mezcla de Mowiol y Dabco para evitar la pérdida de fluorescencia.
Inmunofluorescencia sobre queratinocitos en cultivo
Los queratinocitos humanos normales se cultivaron sobre cubreobjetos de cristal usando medio completo. Se fijaron con paraformaldehído al 3,7% en PBS y tras lavar con un tampón Tris pH 7,8, se incubaron con el primer anticuerpo secundario conjugado con FITC (DAKO) durante 30 minutos a 37° C. Cuando se realizaron inmunofluorescencias dobles, tras el paso anerior se lavaron los cubreobjetos, se realizó un bloqueo con suero de ratón y se incubaron con un anticuerpo biotinilado durante 30 minutos a 37° C. Tras nuevos lavados se realizó una última incubación con avidina marcada con Cy3 (Amersham Pharmacia Biotech). Una vez terminada la técnica de tinción, los cubreobjetos se dispusieron sobre portaobjetos fijándolos con una mezcla de Mowiol y Dabco para evitar la pérdida de fluorescencia.
Microscopía
Convencional
Las laminillas fueron estudiadas en un microscopio Nikon Labophot-2 con objetivos de inmersión de ´60 y ´100. Las imágenes se tomaron con película Ektachrom 200 o con una cámara CCD de alto rendimiento (COHU). Esta última estaba conectada a una estación de trabajo Leica Q550CW. Las imágenes se visualizaron, procesaron y almacenaron mediante el programa Leica Qfish versión 1.01 (Leica Imaging Systems. Ltd.) en discos Zip (Iomega).
Digital confocal
Se utilizó un sistema digital MRC 1024 Bio-Rad (Bio-Rad) montado sobre un microscopio Zeiss Axiovert 135 microscope (Zeiss) equipado con un objetivo ´63, 1,4 NA plano acromático. Las imágenes obtenidas se almacenaron en discos Zip. Este sistema sólo detecta la señal luminosa del plano enfocado, rechazando la señal que procede de planos superiores o inferiores, permitiendo la realización de una tomografía óptica.
Imagen digital
Todas las imágenes digitales han sido tratadas corriegiendo el contraste y brillo utilizando el programa Adobe Photoshop 5.0.2 (Adobe Systems Inc.) en un Macintosh G3 (Apple Computer Inc.).
RESULTADOS
Expresión de los epítopos de activación de las integrinas β1 por citometría de flujo
Primero observamos que al incubar los queratinocitos a 4° C existía una alta expresión de TS2/16 y LIA1/2, acm que reconocen todas las integrinas β1 sea cual sea su conformación (reconocen epítopos expresados constitutivamente), pero no se detectaban epítopos de activación (que aparecen cuando las integrinas β1 se unen al ligando). Sin embargo, a 37° C encontramos una expresión significativa de los epítopos de activación, sin modificación de la expresión de TS2/16 y LIA1/2. En segundo lugar evaluamos la expresión de estos epítopos en diversas condiciones de cationes divalentes, que cambian las integrinas β1 a un estado de alta afinidad. Encontramos que el manganeso era el catión que más intensamente activaba las integrinas β1 en el queratinocito. Además pudimos demostrar que la inducción de la expresión de los epítopos de activación se correlacionaba con la concentración de manganeso en el medio.
Localización de los epítopos de activación de integrinas β1 por inmunofluorescencia
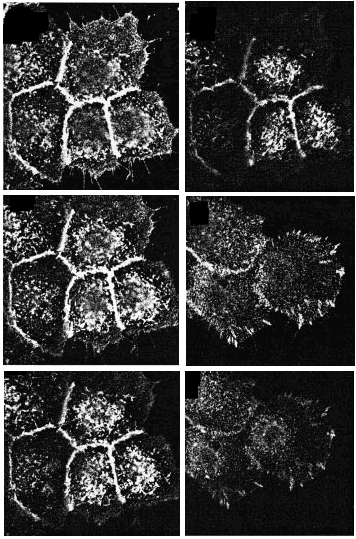
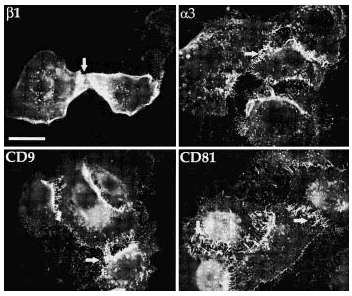
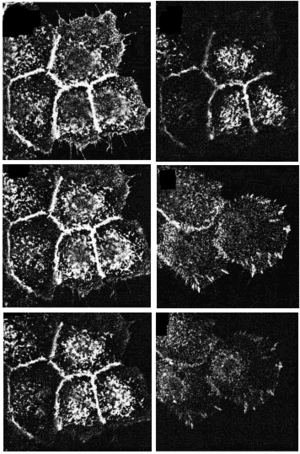
Para precisar la localización tanto de las integrinas ß1 totales como de las dispuestas en conformación activa usamos el microscopio de inmunofluorescencia digital confocal. Los acm TS2/16 y LIA1/2 mostraron fluorescencia en las cuatro secciones ópticas tomadas con un rango de 0,5 µm desde la base de la célula, delimitando toda la membrana celular, y más intensa en los espacios intercelulares (Fig. 2, paneles A-D). En contraste, los acm contra los epítopos de activación (HUTS-21 y MG5A7) no mostraron tinción en la membrana celular en las secciones ópticas por encima de la superficie basal. En las regiones intercelulares no se observó una tinción reproducible. Sólo encontramos una llamativa fluorescencia en la zona basal de la célula en forma de trayectos lineales que, como veremos más adelante, corresponden con los contactos focales (Fig. 2, paneles E y F).
FIG. 2.--Localización de integrinas ß1 en toda la superficie del queratinocito (A-D), mientras que la conformación activa sólo está presente en los contactos focales (E y F). Mediante microscopia de inmunofluorescencia digital confocal determinamos que la conformación activa de las integrinas ß1 se sitúa principalmente en los contactos focales. Para cada campo se cogían cuatro secciones ópticas desde la unión a la matriz extracelular separadas 0,5 µm. Sólo se muestran dos secciones con HUTS-21 debido a la ausencia de fluorescencia en el resto.
Influencia de la expresión de epítopos de activación en la adhesión de los queratinocitos
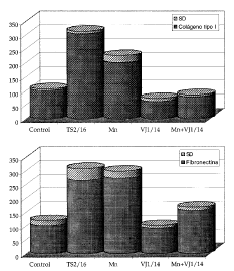
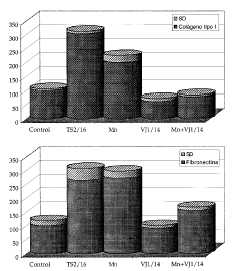
Para confirmar que el aumento en la expresión de epítopos de activación se correlacionaba con una actividad funcional evaluamos la adhesión de los queratinocitos a ligandos de integrinas β1 en diversas condiciones. Encontramos que tanto el acm activador TS2/16 como el Mn2+ aumentan la adhesión a fibronectina (0,5 a 1 µg/ml) y a colágeno tipo I (0,25 a 0,5 µg/ml) (Fig. 3). También observamos cómo este aumento de adhesión, en el caso del Mn2+, es revertido por un potente inhibidor de integrinas β1, el acm VJ1/14.
FIG. 3.--El manganeso estimular la adhesión de queratinocitos a colágeno y fibronectina mediante las integrinas ß1. Este efecto se demuestra por la parcial inhibición del efecto que se consigue usando un anticuerpo monoclonal (VJ1/14), que es un potente inhibidor de la actividad de las integrinas ß1. El anticuerpo activador TS2/16 utilizó como control positivo. Se muestra un experimento representativo realizado en triplicado. Los datos se dan como porcentaje de absorvancia con respecto al control.
Expresión en piel sana y psoriasis de integrinas ß1 en conformación activa
Debido a que se había implicado a la expresión suprabasal de las integrinas β1 como un factor etiopatogénico en la psoriasis, decidimos valorar la actividad de dichas integrinas en biopsias de la enfermedad y compararlas con la piel sana.
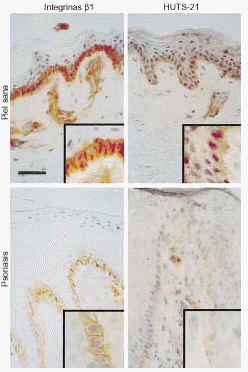
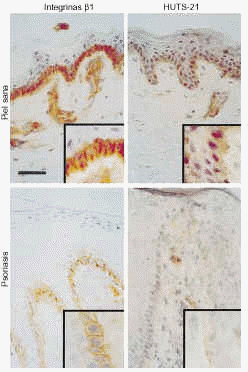
En piel normal las integrinas β1, evaluadas con TS2/16 y LIA1/2, están presentes sólo en la capa de células basales, con más intensidad en la membrana celular, tanto en la superficie en contacto con la membrana basal como en la situada en contacto con otros queratinocitos (Fig. 4). Los acm contra los epítopos de activación también mostraron tinción sólo de la capa basal de la epidermis. La expresión se localizaba en toda la membrana celular, con una tinción difusa citoplásmica (Fig. 4).
FIG. 4.--Disminución en la expresión de integrinas ß1 en conformación activa en la psoriasis comparada con la piel sana. Los estudios de inmunohistoquímica mostraron que en piel psoriásica exitía una expresión suprabasal de integrinas ß1. Tanto estas integrinas como las situadas en caras laterales y apicales de los queratinocitos basales de piel psoriásica se encuentran en conformación inactiva. Sin embargo, en piel sana existía tinción de integrinas ß1 en conformación activa en caras laterales y apicales de los queratinocitos basales. Barra de escala: 50 um.
En la piel psoriásica, existía una fuerte expresión de integrinas ß1, evaluada con TS2/16 y LIA1/2, en la capa basal, con tinción predominante en la membrana celular. De forma consistente encontramos tinción de la membrana celular de los queratinocitos suprabasales, pero limitada a la epidermis situada sobre los vértices de las papilas dérmicas (Fig. 4). Los epítopos de activación se detectaron, de manera consistente, sólo en la membrana celular de las células basales en contacto con la unión dermoepidérmica, con escasa o ninguna tinción en el resto del queratinocito basal (Fig. 4). No se observó tinción en otras capas epidérmicas. El control interno de la tinción de endotelio dérmico fue similar en todas las preparaciones, lo que indica que las diferencias entre piezas no se deben a problemas en la técnica. Además, el control externo CD44 mostró una tinción similar en piel normal y psoriásica.
Expresión de las tetraspaninas en queratinocitos en cultivo por citometría de flujo
Encontramos una alta expresión de CD9 y CD81, mientras que CD151 y CD63 mostraron una intensidad de fluorescencia menor, pero consistentemente positiva.
Localización de las tetraspaninas en queratinocitos en cultivo con inmunofluorescencia
En células aisladas encontramos que los acm anti-CD9 y anti-CD81 delineaban claramente los filopodios y los microvillis de toda la membrana de los queratinocitos. También observamos algo de tinción parcheada intracelular con ambos acm. Los acm anti-CD151 mostraron una tinción intracelular difusa de las células individuales sin delimitar los filopodios, mientras que el acm anti-CD63 teñía predominantemente vesículas intracelulares con algo de fluorescencia de los filopodios.
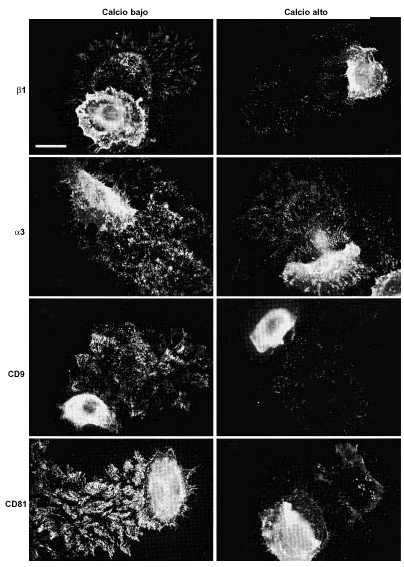
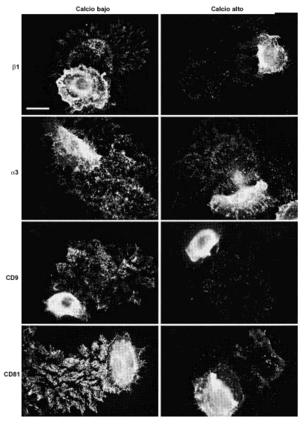
Para analizar más detalladamente la localización y el posible papel de las tetraspaninas en estructuras de adhesión crecimos queratinocitos en medios con calcio alto (1 mM) y calcio bajo (< 0,1 mM) hasta que formaron pequeñas colonias. Las células cultivadas en calcio alto mostraban unas uniones intercelulares muy estechas con tendencia a la estratificación. Los acm antiintegrinas β1 mostraron un esfuerzo de la tinción en los contactos intercelulares. Las moléculas CD9, CD81 y CD151 se concentraban claramente en las uniones intercelulares y, además, CD9 y CD81 teñían los filopodios. En medio con calcio bajo la actividad de las cadherinas desaparece, las uniones intercelulares se relajan, observándose la formación de una cremallera de filopodios que conecta células adyacentes y los queratinocitos no se estratifican. En estas condiciones los acm antiintegrinas β1 y α3 mostraban un refuerzo de la fluorescencia en los filopodios que contactaban con las células vecinas (Fig. 5). La fluorescencia con acm antitetraspaninas CD9 y CD81 mostró el mismo refuerzo de los filopodios que enlazaban célula a célula (Fig. 5). Los acm anti-CD151 mostraron una tinción más débil en la membrana, pero específicamente localizada en algunas uniones intercelulares y sin teñir filopodios. No se encontró tinción celular con acm anti-CD63.
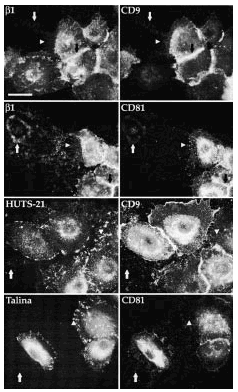
FIG. 5.--Las tetraspaninas se acumulan en las uniones intercelulares. En medios con calcio bajo (< 0,1 mM) las uniones intercelulares se relajan por ausencia de la actividad de las cadherinas y se observa que en los filopodios que unen las células se acumulan tanto integrinas α3ß1 como tetraspaninas CD9 y CD81. Barra de escala: 30 µm.
Expresión en piel sana de tetraspaninas con inmunofluorescencia
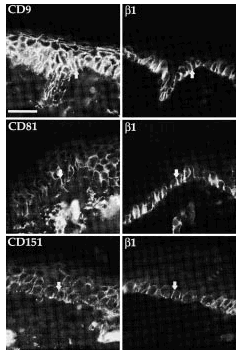
Comprobamos que CD9, CD81 y CD151 se expresan en las uniones intercelulares en los queratinocitos de las capas basal y espinosa (Fig. 6). Como era esperable, las integrinas β1 mostraron tinción exclusivamente en la capa basal, con un refuerzo en las uniones intercelulares. La fluorescencia doble permitió comprobar que en las uniones intercelulares se expresaban tanto integrinas β1 como tetraspaninas (Fig. 6). Los estudios con acm anti-CD63 no demostraron fluorescencia en ninguna estructura.
FIG. 6.--Las tetraspaninas se expresan en piel normal. CD9, CD81 y CD151 tiñen las capas basal y espinosa mientras que las integrinas ß1 sólo tiñe la capa basal. Ambos grupos de moléculas se localizan en uniones intercelulares de los queratinocitos basales. Las flechas están dispuestas en paralelo para señalar las mismas estructuras. Se utilizó un anticuerpo secundario marcado con Alexa flúor para la primera columna y con avidina marcada con Cy3 para la segunda. Barra de escala: 30 µm.
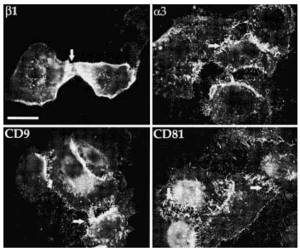
Migración de queratinocitos: detección de integrinas a3b1 y tetraspaninas en las huellas
Mientras realizamos los estudios de localización celular observamos que los acm antitetraspaninas mostraban una intensa señal de fluorescencia en las huellas que los queratinocitos dejan al desplazarse por los cubreobjetos en los que se cultivan. Decidimos estudiar la composición de las huellas, evaluando la probable colocalización con integrinas β1 y su relación con los contactos focales.
Los acm antiintegrinas β1 y α3 mostraron una intensa fluorescencia en las huellas tanto en medios con calcio bajo como alto. CD9 y CD81 también estaban claramente presentes en las huellas de los queratinocitos. En calcio bajo la tinción era más intensa y más llamativa y los rastros eran más largos que con calcio alto (Fig. 7). CD63 mostró una fluorescencia débil, pero consistente en los cubreobjetos cultivados en medio con calcio bajo, pero no se detectó en calcio alto. Con anti-CD151 no encontramos tinción. Usando doble inmunofluorescencia confirmamos que tanto CD9 como CD81 se expresaban en los rastros de los queratinocitos con un patrón similar al de las integrinas β1. Adicionalmente observamos, como era esperable, que ambos tipos de moléculas colocalizaban en las uniones intercelulares y en los filopodios (Fig. 8).
FIG. 7.--En las huellas de los queratinocitos se encuentran tetraspaninas e integrinas α3ß1. La señal es más intensa en los cultivos con calcio bajo (< 0,1 mM) que calcio alto (2 mM). Barra de escala: 30 µm.
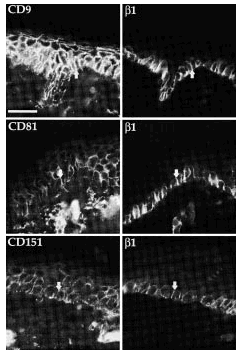
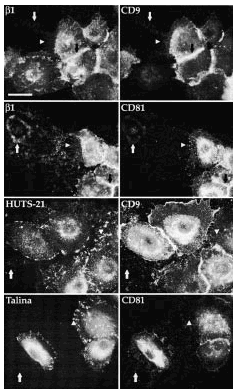
Para valorar el estado de conformación de las integrinas β1 en los complejos integrina-tetraspanina y la presencia de proteínas del citoesqueleto en los rastros realizamos inmunofluorescencias dobles usando, además de los acm antitetraspaninas, HUTS-21, que reconoce las integrinas β1 en conformación activa, y un acm antitalina, proteína que media la unión al citoesqueleto de las integrinas β1 en los contactos focales. Ambos acm, HUTS-21 y antitalina teñían claramente los contactos focales, mientras que las tetrasplaninas estaban ausentes en esas localizaciones (Fig. 8). Además, en los rastros, aunque se observaba una fluorescencia débil con HUTS-21, no encontramos expresión de talina. Finalmente, la reactividad intermolecular de los acm antitetraspaninas no se correspondía con los acm HUTS-21 o antitalina (Fig. 8).
FIG. 8.--CD9 y CD81 colocalizan con integrinas ß1 en las uniones intercelulares, filopodios y huellas, pero no en los contactos focales. Se observa cómo CD9 y CD81 colocalizan con las integrinas ß1 valoradas con TS2/16 en uniones intercelulares, filopodios y huellas. Sin embargo, ambas tetraspaninas no colocalizan con HUTS-21, anticuerpo monoclonal que detecta las integrinas ß1 en conformación activa. Tanto HUTS-21 como el anticuerpo antitalina delimitan perfectamente los contactos focales. Las flechas están dispuestas en paralelo para señalar las mismas estructuras. Se utilizaron un anticuerpo secundario marcado con FITC para la primera columna y avidina marcada con Cy3 para la segunda. Barra: 20 µm.
Implicación funcional de los complejos integrina-tetraspanina en la curación de heridas
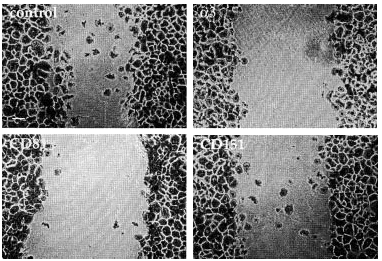
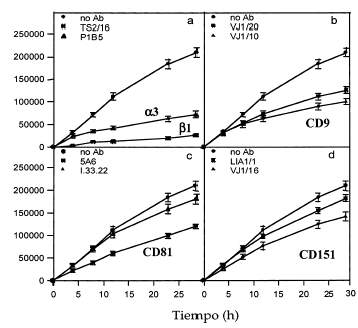
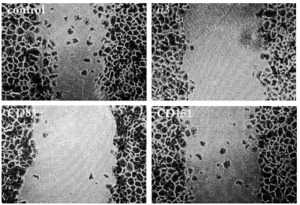
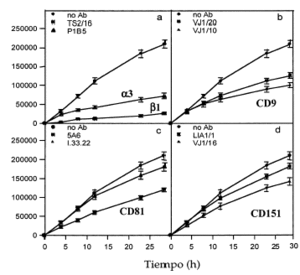
Dado que habíamos detectado tetraspaninas junto con integrinas α3ß1 en los rastros decidimos estudiar la posible implicación funcional de los complejos integrina-tetraspanina en la migración. Valoramos el efecto de la presencia de acm contra tetraspaninas (CD9, CD81 y CD151), así como contra las cadenas α3 y β1 de las integrinas en el modelo de curación de heridas. En una monocapa de queratinocitos creamos una «herida» arañando la superficie y evaluamos el movimiento de invasión durante 28 horas. El acm activante de integrinas β1 TS2/16 y el antiintegrina α3 P1B5 inhibieron fuertemente la migración (Figs. 9 y 10). Los acm anti-CD9 VJ10/10 también retrasaron la migración (Fig. 10). Observamos que el acm anti-CD81 5A6 inhibía la migración, mientras que el I.33.22 mostró sólo un efecto inhibitorio ligero (Figs. 9 y 10). De la misma manera, el acm anti-CD151 VJ1/16 mostró mayor efecto inhibitorio que el LIA1/1 (Fig. 10).
FIG. 9.--Modelo de cicatrización de heridas. Situación a las 28 horas de haber provocado una herida en la monocapa de queratinocitos. Mientras que en el control los queratinocitos están cerrando el defecto, el uso de acm contra α3, CD81 o CD151 retrasa el proceso en distinto grado. Las placas se fijaron y se tiñeron con violeta-cristal.
FIG. 10.--Efecto inhibitorio de algunos anticuerpos monoclonales en el modelo de cicatrización de heridas. Los anticuerpos contra integrinas ß1 y α3 inhiben fuertemente la movilidad de los queratinocitos. Los anticuerpos anti-CD9 y alguno anti-CD81 también muestran un importante efecto, que es moderado con los anti-CD151. Unidades en micrometros cuadrados de herida cubiertos con queratinocitos a diversos tiempos en un área de 1.000 µm. Se muestra la media ± error estándar de los experimentos realizados por duplicado.
DISCUSION
Las integrinas son unas moléculas muy importantes en las interacciones célula-matriz extracelular y célula-célula. También son capaces de regular las funciones celulares y el comportamiento de las mismas en muchos tipos celulares (8). Las propiedades de la adhesión celular son reguladas mediante la expresión selectiva de integrinas (5), así como mediante la modulación de sus propiedades adhesivas. La afinidad y la avidez de las integrinas para sus ligandos no es constante y está regulada de manera dinámica (7). La existencia de diversas conformaciones de integrinas β1 in vivo había sido inferida de estudios de adhesión y de la observación de la expresión de la conformación activa de las integrinas β1 in vitro (26). Sin embargo, no se había realizado hasta ahora una valoración directa de la expresión de integrinas β1 activadas en piel normal y enferma.
Hemos encontrado que los queratinocitos expresan epítopos de activación de las integrinas β1 y que la aparición de estos epítopos puede ser modulada por manganeso, un inductor de adhesión en queratinocitos (55) y un potente inductor de epítopos de activación de integrinas β1 en otros tipos celulares (15). También hemos visto cómo este aumento de expresión está relacionado con un aumento de adhesión a fibronectina y a colágeno tipo I como se había obervado previamente en los linfocitos T (15). En cultivo de queratinocitos humanos normales nuestros resultados muestran que mientras las integrinas β1 se encuentran en toda la membrana de los queratinocitos, las dispuesta en conformación activa aparecen principalmente en los contactos focales (26).
La expresión de integrinas β1 ha sido relacionada con el estado de proliferación de los queratinocitos (48, 56). De forma paralela al aumento de la proliferación aumenta la expresión de integrinas β1 in vitro y según ésta se enlentece, la expresión disminuye (56). Además, las integrinas β1 sufren una regulación en disminución (downregulation) cuando los queratinocitos inician su diferenciación terminal (48, 57). Sin embargo, in vitro, los queratinocitos están en situación del alta proliferación (58) similar a la epidermis psoriásica y expresan integrinas β1 junto con marcadores de diferenciación (involucrina o queratinas K1/K10) (56, 57). Por otra parte, los ratones transgénicos con expresión suprabasal de integrinas β1 muestran lesiones cutáneas similares a la psoriasis, sugiriendo que la relación entre la expresión suprabasal de integrinas β1 y la hiperproliferación podría ser causal (38). No obstante, la situación funcional de estas integrinas β1 no ha sido estudiada hasta ahora. Nuestros estudios de inmunohistoquímica indican que aunque existe una expresión suprabasal de integrinas β1 en la psoriasis, estas moléculas parecen estar en conformación inactiva. Además, la mayor parte de las integrinas β1 en las caras laterales y apicales de los queratinocitos basales de la psoriasis también están en conformación inactiva, implicando una disminución de la actividad cuando se compara con la piel sana, en la que las integrinas β1 en conformación activa están distribuidas por toda la superficie del queratinocito basal.
Se ha propuesto que la presencia de integrinas en los estratos diferenciados de la epidermis estimularía la proliferación de la capa basal, quizá señalando que existe un déficit en el comportamiento diferenciado que debe ser repuesto mediante un aumento de la proliferación (38). Nuestros resultados muestran una disminución de la actividad funcional de las integrinas β1 en la psoriasis. La expresión suprabasal de integrinas β1 inactivas puede ser debido al estado hiperproliferativo de los queratinocitos, o sea, los mecanismos que conducen a la eliminación de las integrinas β1 de la membrana (59, 60) pueden no ser suficientemente eficaces para destruir la proteína en el corto espacio de tiempo que le lleva al queratinocito a migrar de la capa basal a la suprabasal.
La expresión de integrinas β1 en las superficies apicales y laterales del queratinocito en cultivo y en las biopsias de piel sana han sugerido su implicación en la adhesión intracelular (18, 20, 27). Aunque los estudios en cultivos de queratinocitos con otros acm antiepítopos de activación de integrinas β1 (26) han mostrado que las integrinas β1 en los contactos intercelulares no están en la conformación activa, tal como hemos encontrado con HUTS-21 y MG5A7, nuestros resultados en piel normal implican que las integrinas β1 intercelulares están, al menos en parte, en un estado activado in vivo. La disminución de los epítopos de activación en la psoriasis sugiere que las integrinas β1 en conformación activa en las superficies apicales y laterales de la célula normal puede estar señalando una inhibición de la proliferación. Es tentador especular que la desaparición de las integrinas β1 en conformación activa en estas superficies laterales y apicales del queratinocito basal de la psoriasis activaría la proliferación de los queratinocitos.
En relación con la posible participación de las integrinas β1 en las uniones intercelulares hemos estudiado la presencia y actividad de las tetraspaninas en el queratinocito. Estas moléculas han sido recientemente implicadas en activación celular, proliferación, diferenciación, adhesión y motilidad en diversos tipos celulares (42) y se ha demostrado que coprecipitan con integrinas β1 (43). En queratinocitos, hemos mostrado que tanto CD9 como CD81 perfilan claramente los filopodios en las superficies apicales y laterales. CD63 está presente en su mayor parte en el comportamiento intracelular, pero también tiene algo de expresión en la membrana, sobre todo en los filopodios, como en algunas líneas celulares (61). CD151, que no ha sido estudiado previamente en queratinocitos en cultivo, está localizado en las uniones intercelulares y en el comportamiento intracelular.
Cuando los queratinocitos contactan con otros queratinocitos se produce un acúmulo de las moléculas CD9, CD81 y CD151 junto con las integrinas α3 y β1 en las zonas de contacto. En medio con calcio bajo el contacto entre queratinocitos es más lábil y el espacio intercelular está cruzado por una cremallera de filopodios donde se acumulan las tetraspaninas y las integrinas α3β1. Estos resultados sugieren la implicación de los complejos integrina-tetraspanina en la adhesión célula-célula en condiciones en las que la adhesión mediada por cadhrinas está abolida. La presencia de estos complejos en los filopodios pueden estar indicando un papel de esta integrina en la exploración del ambiente celular. En relación a esto, ha sido publicado recientemente que la integrina α3ß1 actúa como un inhibidor transdominante de la función de las integrinas en queratinocitos de ratón (62), sugiriendo que las interacciones vía integrinas α3ß1 induce señales inhibitorias a otras integrinas; además, las especiales características de esta integrina podrían venir de su fuerte asociación con tetraspaninas (63). Quizá los resultados aparentemente contradictorios en la implicación de las integrinas β1 en la adhesión intercelular provengan de que los estudios realizados hasta ahora nunca apuntaron a la expresión y el efecto de las tetraspaninas. Todos estos hallazgos podrán ser reinterpretados cuando se obtenga más información acerca del papel de la asociación molecular entre integrinas y tetraspaninas.
Estudios previos sobre la expresión de las tetraspaninas en la piel han demostrado que tanto CD9 como CD81 se encuentran en todas las capas vivas de las epidermis (45, 46), que CD151 lo hace en la capa basal de la epidermis y que no es posible encontrar marcaje con CD63 (46, 47). Nuestros estudios de inmunofluorescencia doble en piel normal apoyan la colocalización de las integrinas β1 y las tetraspaninas en las uniones intercelulares de la capa basal. Según el queratinocito se diferencia, la expresión de integrinas β1 desaparece mientras que persiste hasta la capa granulosa las de CD9, CD81 y CD151.
Hemos mostrado que la expresión de CD9, CD81 y CD63 en los rastros de queratinocitos móviles tiene un patrón similar al encontrado con integrinas β1 o α3. Estos datos indican que las tetraspaninas están también asociadas a integrinas β1 en los contactos célula-matriz extracelular, implicándolas tanto en adhesión a matriz extracelular como en la movilidad de los queratinocitos. La presencia de CD9, CD81 y CD63 en los rastros de los queratinocitos no ha sido previamente descrita, aunque las tetraspaninas ya han sido detectadas en las huellas de otras líneas celulares (43, 61). Nuestros resultados con los acm HUTS-21 y antitalina indican claramente que CD9 y CD81 están presentes en algunas estructuras que contienen integrinas β1, como uniones intercelulares, filopodios y rastros, pero no en los contactos focales. Recientemente ha sido publicada la ausencia de colocalización de vinculina y paxilina con las tetraspaninas en líneas de células tumorales (64). La ausencia de talina en los rastros apoya la idea de que los complejos integrina-tetraspanina pueden estar implicados en las adhesiones débiles y temporales que son necesarias para la migración. Es tentador especular que el cambio de conformación en las integrinas β1 que conduce a la formación de adhesiones fuertes (contactos focales) y al reclutamiento de proteínas de enlace con el citoesqueleto podría ser la causa de la disociación de los complejos integrina-tetraspanina.
La migración de los queratinocitos es crucial para restaurar las heridas. Los complejos integrina-tetraspanina pueden tener un papel potencial en la migración dado que están localizados tanto en las extensiones de membrana como en los sitios de adhesión célula-matriz. De hecho hemos mostrado que tanto acm antiintegrinas β1 y α3 como algunos acm anti-tetraspaninas son capaces de inhibir la migración de queratinocitos en el modelo de curación de heridas. Estos resultados concuerdan con una observación previa en la que un acm anti-CD9 inhibía la movilidad de queratinocitos aislados (45). Sin embargo, es la primera vez que se demuestra que tanto CD9, CD81 como CD151 están implicadas en la curación de heridas. Por otra parte, el acm antiintegrina α3 y el acm activante antiintegrina β1 TS2/16, que aumenta la adhesión de las integrinas β1 a la matriz, son también capaces de bloquear la movilidad de las células.
Es posible que el efecto de los acm antitetraspaninas en la migración celular estén debidos, al menos parcialmente, a la presencia de integrinas de la familia β1 en los complejos con tetraspaninas que están implicados en la adhesión célula-matriz. CD9 y CD81 se coexpresan con las integrinas β1 y α3 en las huellas de los queratinocitos, sugiriendo un efecto directo sobre las tetraspaninas asociadas a integrinas ß1. El efecto de CD151, que no expresa claramente en las huellas y sí específicamente tiñe las uniones intercelulares, sugiere que la modificación de las interacciones célula-célula podría llevar a una modificación en la migración de los queratinocitos. No podemos excluir que esto se puede aplicar también a CD9 y CD81 dada su alta expresión en las uniones intercelulares. Como otra posibilidad, los acm antitetraspaninas pueden estar actuando en la red de tetraspaninas de la superficie celular y por tanto alterando otras moléculas que intervienen en distintas funciones celulares (40, 42, 65, 66) y que influirían en la movilidad por vías distintas de las integrinas β1.
Agradecimientos
A los compañeros de los Servicios de Dermatología, Inmunología y Biología Molecular del Hospital Universitario de La Princesa. Este trabajo ha sido financiado por el Fondo de Investigaciones Sanitarias FIS 95/0196 y FIS 96/2009.