Dupilumab es un anticuerpo monoclonal inhibidor de la IL-4/IL-13 aprobado para el tratamiento de la dermatitis atópica (DA) con perfiles de eficacia y seguridad notables. Sin embargo, estudios previos han informado de un aumento de los eosinófilos séricos durante el tratamiento, con un significado clínico indeterminado.
El objetivo de este estudio es evaluar los cambios en los eosinófilos en sangre y otros parámetros de laboratorio durante el tratamiento con dupilumab.
MétodosSe realizó un estudio observacional prospectivo multicéntrico entre 2018 y 2022 con pacientes adolescentes y adultos con DA moderada a grave tratados con dupilumab del Hospital Universitario Virgen de las Nieves, España, y del Hospital Universitario de Coimbra, Portugal. Se recogieron puntuaciones clínicas de la dermatitis, hemograma completo, IgE sérica total y niveles de LDH al inicio y en las semanas 8, 16, 24 y 48 de tratamiento.
ResultadosSe incluyeron 81 pacientes (41 mujeres/40 hombres; edad media de 30,86±12,26 años). Las características clínicas y demográficas fueron similares entre centros. Las escalas de gravedad de la DA (EASI, SCORAD y EVA para picor y sueño) mostraron una mejoría sostenida a partir de las 8 semanas de tratamiento. Los niveles de eosinófilos fueron significativamente mayores en la semana 16 (0,69×103/μL) que al inicio (0,41×103/μL) (p=0,018) y volvieron a los niveles basales en la semana 48 (0,59×103/μL, p>0,05). Los niveles de LDH e IgE disminuyeron durante el estudio.
ConclusiónNuestro estudio mostró una mejoría clínica significativa de la DA de los pacientes tratados con dupilumab, con un aumento leve y autolimitado de los niveles de eosinófilos en la semana 16, no asociado a ninguna manifestación clínica. Por lo tanto, el aumento de los eosinófilos séricos en pacientes con DA tratados con dupilumab no es clínicamente relevante y no debe condicionar la suspensión del tratamiento.
Dupilumab is an IL-4/IL-13 inhibitor monoclonal antibody approved for the treatment of moderate-to-severe atopic dermatitis (AD) with remarkable safety and efficacy profiles. However, former studies have reported an increase in serum eosinophils during treatment, with undetermined clinical significance.
The objective of this study is to evaluate changes in blood eosinophils and other laboratory parameters while on dupilumab.
MethodsWe conducted a multicenter, prospective, observational study from 2018 to 2022 with adolescent and adult patients with moderate-to-severe atopic dermatitis treated with dupilumab from Hospital Universitario Virgen de las Nieves, Spain, and Coimbra University Hospital, Portugal. Clinical scoring of the dermatitis, complete blood count, total serum IgE and LDH levels were collected at baseline and on weeks 8, 16, 24 and 48.
ResultsWe included a total of 81 patients (41 women/40 men; mean age of 30.86±12.26 years). Clinical and demographic characteristics were similar across centres. AD severity scales (EASI, SCORAD, ItchVAS and SleepVAS) showed sustained improvement from week 8 of treatment onwards. Eosinophil levels were significantly higher on week 16 (0.69×103/μL) vs baseline (0.41×103/μL) (p=0.018) and returned to baseline levels on week 48 (0.59×103/μL, p>0.05). LDH and IgE levels decreased during the study.
ConclusionOur study showed a significant clinical improvement of AD but a mild and self-limited increase in eosinophil levels on week 16, not associated with any clinical signs. Therefore, elevated serum eosinophil levels in AD patients on dupilumab does not seem clinically relevant and should not condition treatment withdrawal.
El dupilumab es un anticuerpo monoclonal humano que se une a la IL-4R-α e IL-13R-α1 inhibiendo la señalización de IL-4 e IL-13, que son fundamentales para la cascada inflamatoria y el compromiso de la función de barrera de la piel en la dermatitis atópica (DA)1. El dupilumab actúa específicamente para regular a la baja los eventos de señalización que causan la liberación de mediadores proinflamatorios y el reclutamiento de células inmunitarias responsables de las características clínicas de la DA1.
El dupilumab se convirtió en el primer agente biológico aprobado para el tratamiento de la DA moderada-grave, con una elevada eficacia y un buen perfil de seguridad frente a opciones terapéuticas anteriores, como eran la ciclosporina, la azatioprina, el metotrexato o el micofenolato de mofetilo2,3. Los efectos adversos notificados incluyen eritema local transitorio y edema en el punto de inyección, enfermedad de la superficie ocular, reacciones paradójicas eccematosas en la cabeza y el cuello, erupciones similares a la psoriasis, artralgia y artritis, y alopecia, siendo los efectos adversos sistémicos extremadamente raros2.
En los ensayos clínicos ya se observaron niveles elevados de eosinófilos en sangre durante el tratamiento con el dupilumab. Sin embargo, dado que no existe ninguna recomendación formal para controlar los valores analíticos durante el tratamiento con el dupilumab, sigue sin estar claro, en condiciones reales, con qué frecuencia se produce una elevación de los eosinófilos en relación con este fármaco. De hecho, un estudio retrospectivo reciente no informó de ninguna elevación significativa de eosinófilos en suero, sino incluso de una normalización de estos valores mientras se recibía este tratamiento4.
El criterio de valoración principal de este estudio fue evaluar los niveles de eosinófilos en sangre en pacientes adolescentes y adultos con DA mientras reciben dupilumab, y así poder definir el momento, la dimensión y las implicaciones clínicas de los niveles de eosinófilos elevados. Los criterios secundarios de valoración pretenden correlacionar los niveles de eosinófilos con otros parámetros analíticos, como la IgE sérica y la lactato deshidrogenasa (LDH).
MétodosDiseño del estudio y participantesSe realizó un estudio observacional multicéntrico ambispectivo (retrospectivo y prospectivo) de abril de 2018 a junio de 2022, en el Departamento de Dermatología del Hospital Universitario Virgen de las Nieves, Granada (España), y el Departamento de Dermatología del Hospital Universitario de Coimbra (Portugal).
Los participantes elegibles fueron adolescentes (>12 años) y pacientes adultos con DA moderada-grave programados para iniciar un tratamiento con el dupilumab por primera vez y que, tras explicarles los objetivos del estudio, firmaron el consentimiento informado.
Los criterios de exclusión fueron una infección cutánea o sistémica –en concreto, infección por VIH–, antecedentes de cáncer, enfermedad inmunológica y uso de antibióticos sistémicos.
En los pacientes adultos, se administraron 300mg de dupilumab por vía subcutánea cada 2 semanas tras una dosis de carga de 600mg, mientras que los adolescentes (12-17 años) recibieron una dosis de carga de 400mg seguida de una dosis de 200mg cada 2 semanas o la posología de adultos si pesaban>60kg.
Resultados y medidasSe recogieron datos sobre la edad, el sexo, la edad de inicio de la enfermedad, los antecedentes familiares de la DA, los antecedentes de asma, rinitis, conjuntivitis y alergias alimentarias, así como los tratamientos previos. Se evaluó la gravedad de la DA al inicio y en las semanas 8, 16, 24 y 48 mediante las puntuaciones Eczema Area Severity Index (EASI), SCORing Atopic Dermatitis (SCORAD), Body Surface Area (BSA), y escala visual analógica (EVA) para picor y sueño. En los mismos puntos temporales, se recogió sangre venosa en ayunas y se evaluaron los siguientes parámetros: recuento de leucocitos, neutrófilos, eosinófilos, linfocitos, monocitos y basófilos, IgE sérica total y LDH.
Análisis estadísticoSe utilizaron métodos estadísticos de tipo descriptivo para presentar las características de las muestras. Los datos continuos se expresaron como media y desviación estándar, y los cualitativos como frecuencia relativa y absoluta. Se utilizaron la prueba de Shapiro-Wilk y la de asimetría/curtosis para determinar la normalidad de la distribución de los datos, y la prueba de Levene para comprobar la homogeneidad de la varianza, la prueba t de Student para muestras independientes para comparar variables cuantitativas entre distintas poblaciones, y la prueba t de Student para muestras emparejadas para comparar diferencias en los parámetros entre distintas semanas de tratamiento. La significación estadística se definió como una p<0,05 de 2 colas. Para los análisis estadísticos se utilizó el SPSS® versión 25.0 (SPSS Inc., Chicago, IL, EE. UU.).
ÉticaEste estudio fue aprobado por el Comité Ético del Hospital Universitario Virgen de las Nieves (Biomarcadores analíticos en pacientes con dermatitis atópica).
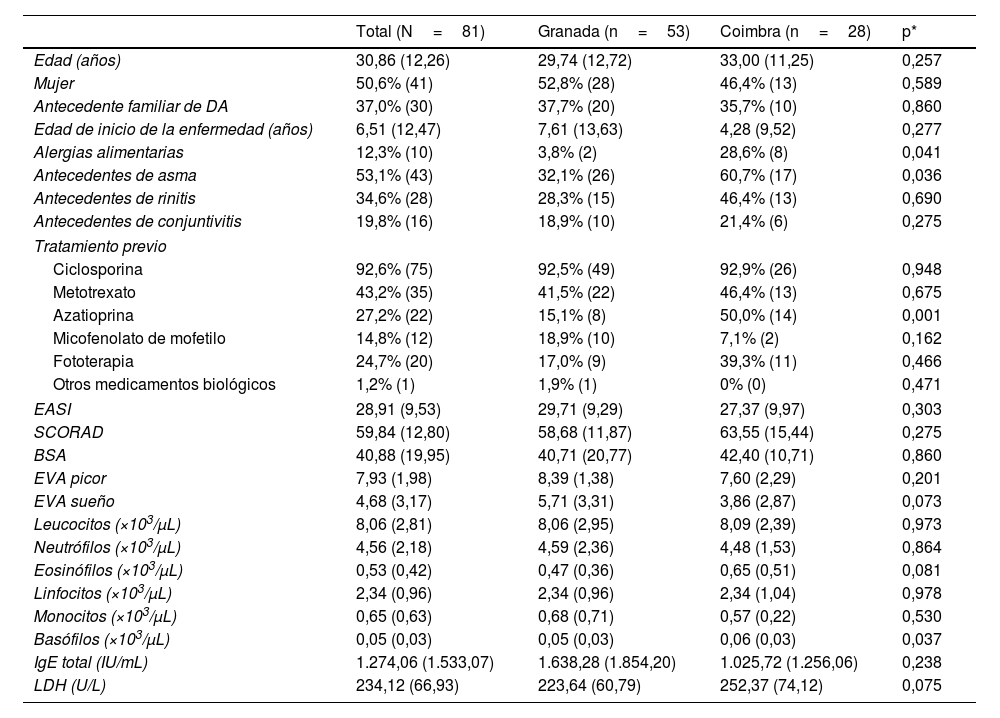
ResultadosDatos demográficos y características clínicas basalesSe incluyeron en el estudio 81 pacientes (41 mujeres/40 hombres); edad media de 30,86 (12,26) años con DA moderada-grave; y EASI medio de 28,91 (9,53), 53 (65,4%) del hospital español y 28 (34,6%) del portugués, con características similares (tabla 1). El inicio de la enfermedad se produjo a los 6,51 años, aproximadamente el 60% tenían antecedentes de conjuntivitis alérgica, asma o rinitis alérgica; todos los pacientes habían recibido tratamientos sistémicos previos, más frecuentemente ciclosporina (92,6%) (tabla 1).
Características sociodemográficas y clínicas al inicio del tratamiento
| Total (N=81) | Granada (n=53) | Coimbra (n=28) | p* | |
|---|---|---|---|---|
| Edad (años) | 30,86 (12,26) | 29,74 (12,72) | 33,00 (11,25) | 0,257 |
| Mujer | 50,6% (41) | 52,8% (28) | 46,4% (13) | 0,589 |
| Antecedente familiar de DA | 37,0% (30) | 37,7% (20) | 35,7% (10) | 0,860 |
| Edad de inicio de la enfermedad (años) | 6,51 (12,47) | 7,61 (13,63) | 4,28 (9,52) | 0,277 |
| Alergias alimentarias | 12,3% (10) | 3,8% (2) | 28,6% (8) | 0,041 |
| Antecedentes de asma | 53,1% (43) | 32,1% (26) | 60,7% (17) | 0,036 |
| Antecedentes de rinitis | 34,6% (28) | 28,3% (15) | 46,4% (13) | 0,690 |
| Antecedentes de conjuntivitis | 19,8% (16) | 18,9% (10) | 21,4% (6) | 0,275 |
| Tratamiento previo | ||||
| Ciclosporina | 92,6% (75) | 92,5% (49) | 92,9% (26) | 0,948 |
| Metotrexato | 43,2% (35) | 41,5% (22) | 46,4% (13) | 0,675 |
| Azatioprina | 27,2% (22) | 15,1% (8) | 50,0% (14) | 0,001 |
| Micofenolato de mofetilo | 14,8% (12) | 18,9% (10) | 7,1% (2) | 0,162 |
| Fototerapia | 24,7% (20) | 17,0% (9) | 39,3% (11) | 0,466 |
| Otros medicamentos biológicos | 1,2% (1) | 1,9% (1) | 0% (0) | 0,471 |
| EASI | 28,91 (9,53) | 29,71 (9,29) | 27,37 (9,97) | 0,303 |
| SCORAD | 59,84 (12,80) | 58,68 (11,87) | 63,55 (15,44) | 0,275 |
| BSA | 40,88 (19,95) | 40,71 (20,77) | 42,40 (10,71) | 0,860 |
| EVA picor | 7,93 (1,98) | 8,39 (1,38) | 7,60 (2,29) | 0,201 |
| EVA sueño | 4,68 (3,17) | 5,71 (3,31) | 3,86 (2,87) | 0,073 |
| Leucocitos (×103/μL) | 8,06 (2,81) | 8,06 (2,95) | 8,09 (2,39) | 0,973 |
| Neutrófilos (×103/μL) | 4,56 (2,18) | 4,59 (2,36) | 4,48 (1,53) | 0,864 |
| Eosinófilos (×103/μL) | 0,53 (0,42) | 0,47 (0,36) | 0,65 (0,51) | 0,081 |
| Linfocitos (×103/μL) | 2,34 (0,96) | 2,34 (0,96) | 2,34 (1,04) | 0,978 |
| Monocitos (×103/μL) | 0,65 (0,63) | 0,68 (0,71) | 0,57 (0,22) | 0,530 |
| Basófilos (×103/μL) | 0,05 (0,03) | 0,05 (0,03) | 0,06 (0,03) | 0,037 |
| IgE total (IU/mL) | 1.274,06 (1.533,07) | 1.638,28 (1.854,20) | 1.025,72 (1.256,06) | 0,238 |
| LDH (U/L) | 234,12 (66,93) | 223,64 (60,79) | 252,37 (74,12) | 0,075 |
Los datos se expresan como % (n) o media (desviación estándar).
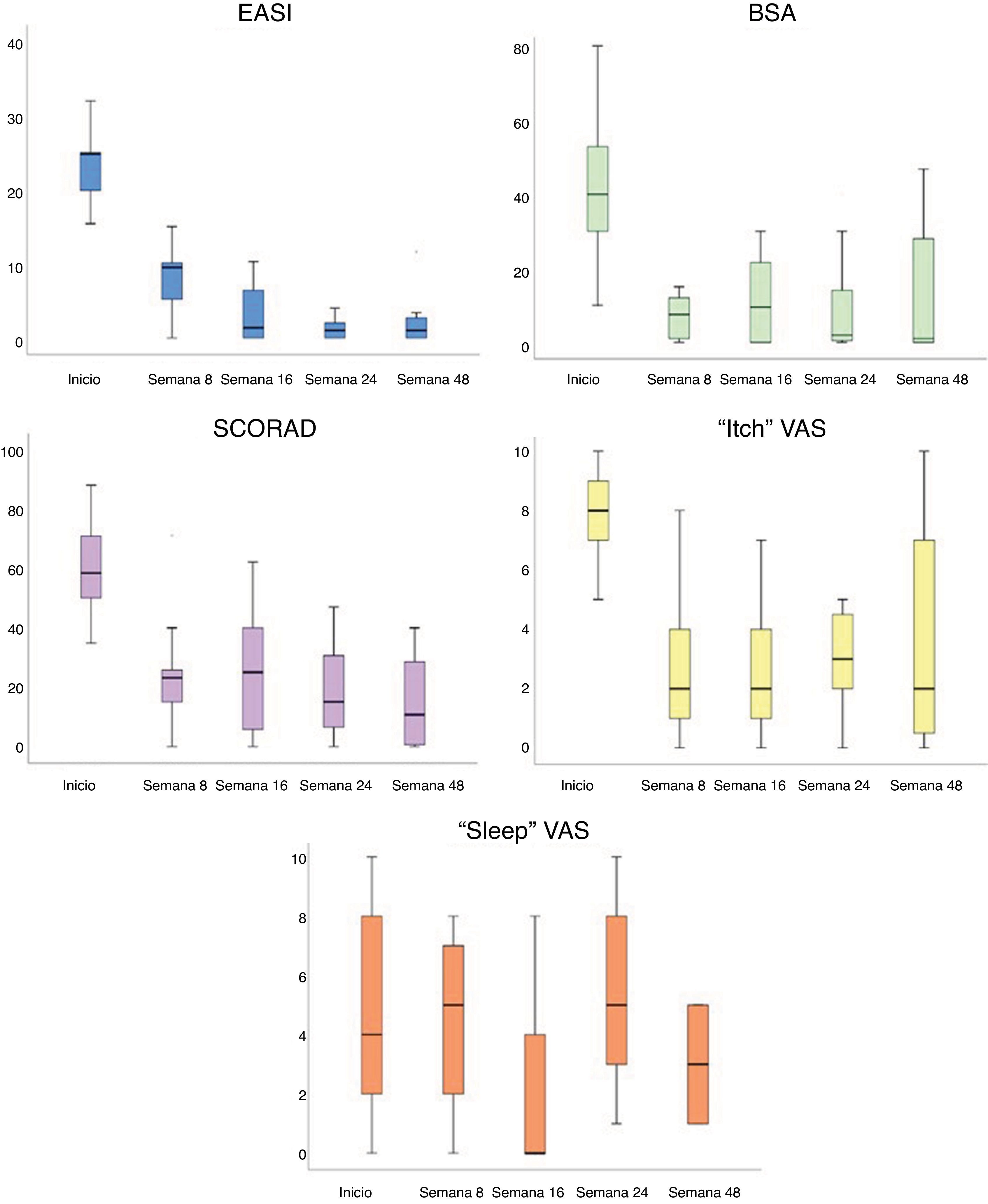
Todas las escalas de gravedad de la DA mejoraron significativamente tras el tratamiento con el dupilumab (fig. 1). Tras 8 semanas con el dupilumab, se observó una disminución del EASI (28,91 vs. 7,45, p<0,001), del SCORAD (61,50 vs. 23,87, p<0,001), del BSA (29,44 vs. 6,62, p=0,002) y de la EVA del picor (7,34 vs. 3,09, p<0,001) y del sueño (6,57 vs. 5,43, p<0,001). Esta mejoría también fue significativa en la semana 48: el EASI disminuyó una media de 20,05 (9,20) puntos, p<0,001; el SCORAD, 42,13 (36,5), p=0,37; el BSA, 24,80 (22,53), p=0,043; y la EVA del picor, 4,20 (2,77), p=0,028.
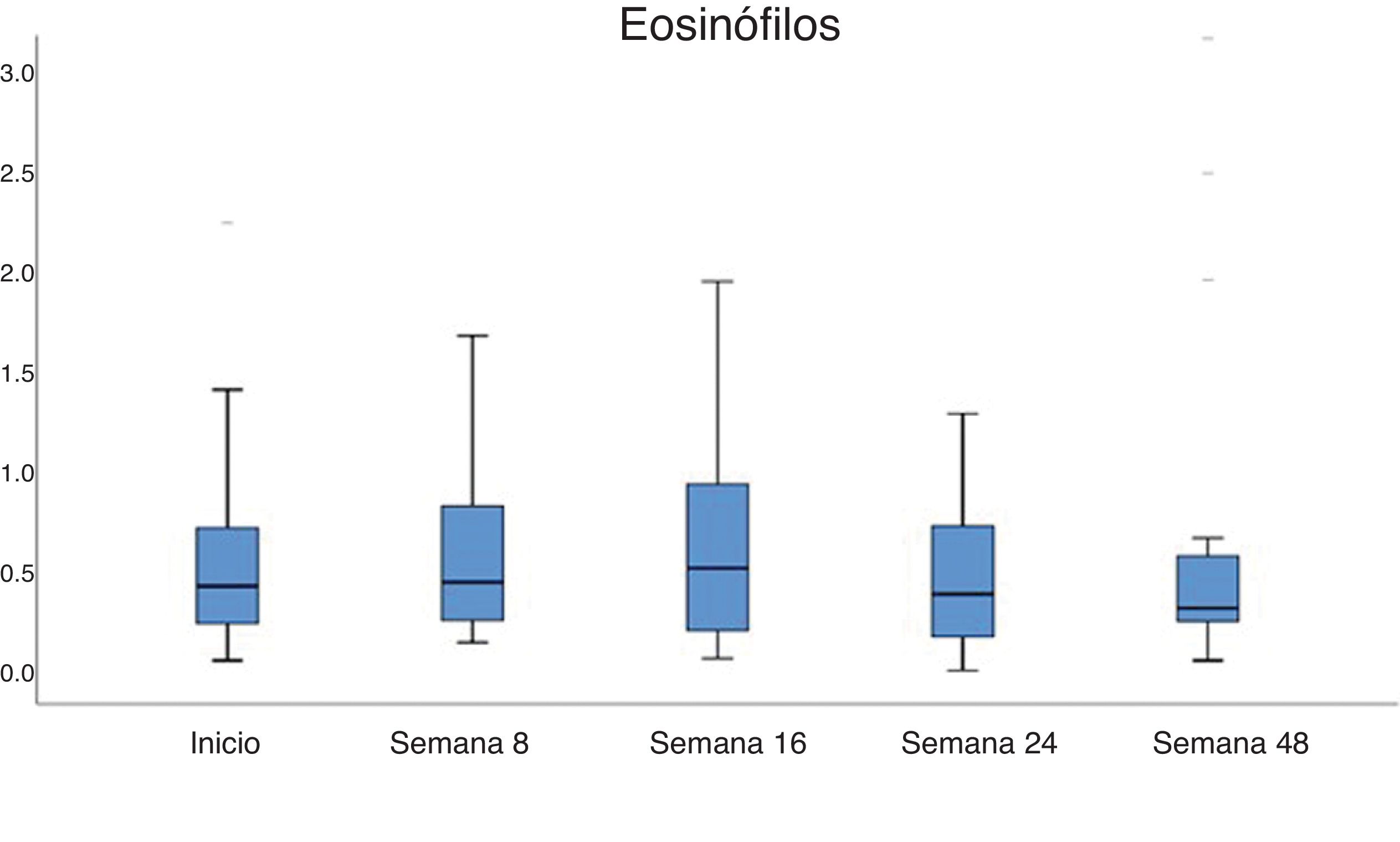
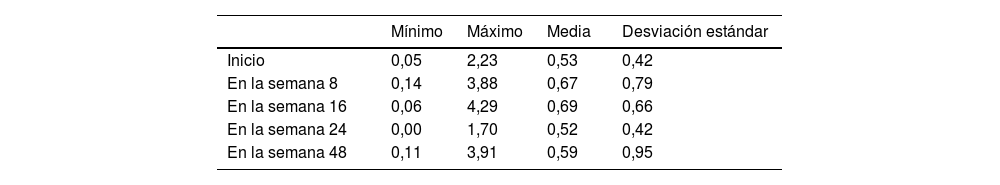
Cambios analíticos en el seguimientoEn el seguimiento se registraron cambios en el recuento de las células sanguíneas (fig. 2, tabla 2). Los niveles de eosinófilos, que ya eran elevados al inicio (0,53×103/μL; desviación estándar 0,42), no cambiaron significativamente en las primeras 8 semanas de tratamiento con el dupilumab. Sin embargo, se registró un ligero aumento entre el inicio y la semana 16 (0,53 vs. 0,69×103/μL, p=0,018). En la semana 48, los eosinófilos séricos volvieron a niveles que no fueron significativamente diferentes frente a los basales (0,59×103/μL, p>0,05).
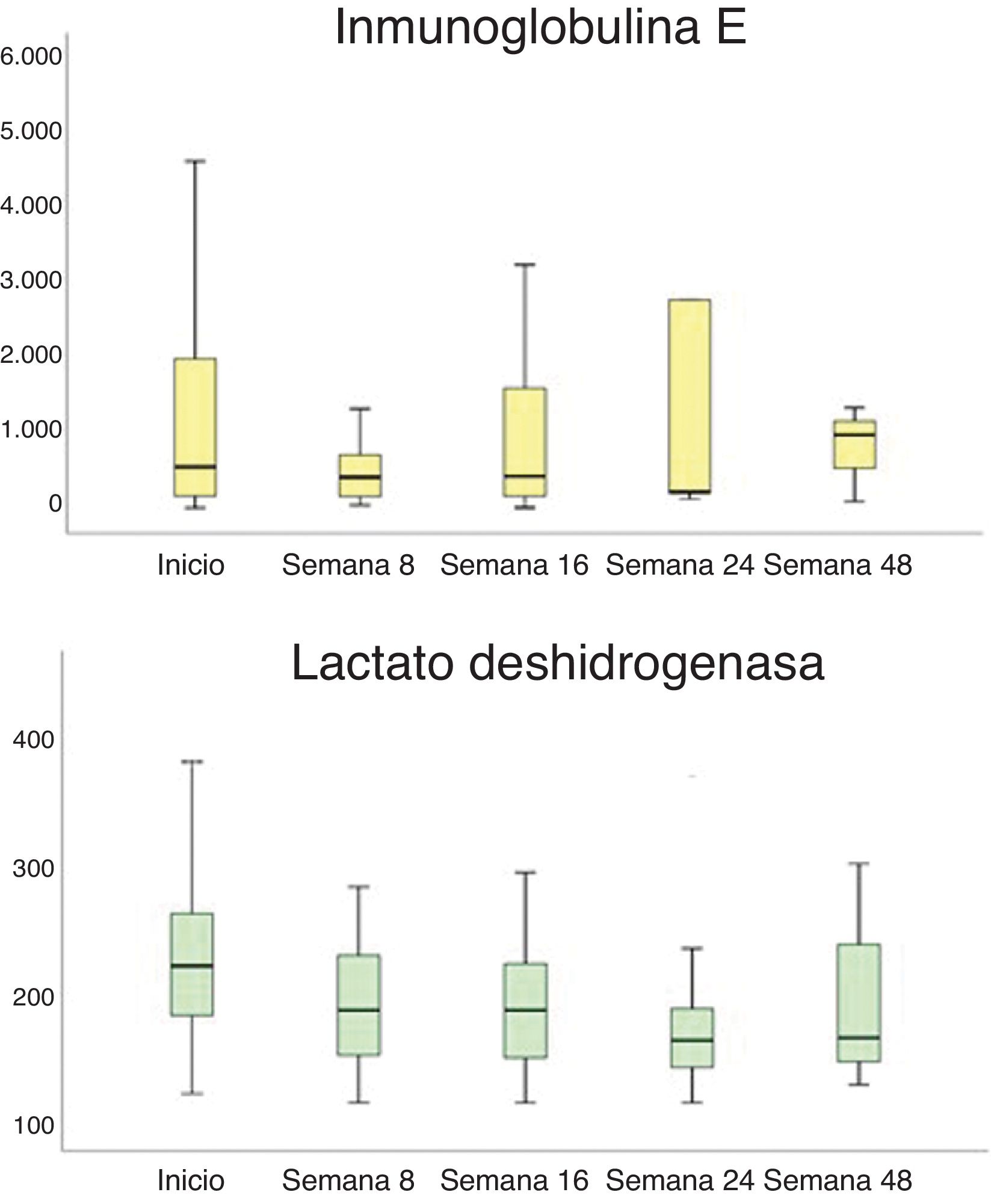
La LDH y la IgE disminuyeron durante el período estudiado (fig. 3). La LDH disminuyó comparando cada período estudiado: 234,12U/L (inicio) vs. 192,04U/L (semana 8), p=0,003; vs. 195,07U/L (semana 16), p=0,005; vs. 181,29U/L (semana 24), p=0,043; vs. 191,94U/L (semana 48), p=0,003. La IgE disminuyó principalmente desde el inicio hasta la semana 8 de tratamiento (1.274,06 vs. 647,80IU/mL, p=0,024). No se encontraron otros cambios analíticos.
Los niveles de eosinófilos aumentaron de forma más significativa en 9 pacientes (>1×103/μL), 7 de los cuales tenían comorbilidades atópicas. Dos de estos pacientes tenían asma y rinitis y ya presentaban recuentos elevados de eosinófilos al inicio del estudio (1,27 y 1,09×103/μL), junto con una IgE sérica total muy elevada (6.193 y 42.298IU/mL). Estos 2 pacientes aumentaron el recuento de los eosinófilos en la semana 8 hasta 1,77 y 3,88×103/μL, respectivamente, y el primer paciente incluso subió hasta 4,29×103/μL en la semana 16, siempre en paralelo a un descenso brusco de la IgE hasta 1.681 y 15.803IU/mL en la semana 16. Los valores de eosinófilos volvieron a la normalidad tras un año de tratamiento en todos los pacientes. No se notificaron signos clínicos ni progresión de comorbilidades atópicas o signos sistémicos relacionados con la eosinofilia.
En toda la muestra no se observó ninguna asociación estadísticamente significativa entre los niveles elevados de eosinófilos e IgE y ningún parámetro demográfico o clínico de estos pacientes.
DiscusiónEste estudio evaluó el impacto clínico y analítico del dupilumab en una cohorte de pacientes con DA grave y confirmó la mejoría clínica esperada.
El aumento de los eosinófilos circulantes asociado al tratamiento con el dupilumab se ha descrito previamente como transitorio, leve y no relacionado con el éxito terapéutico. Nuestros resultados confirman aún más esta tendencia. Aunque algunos pacientes pueden presentar niveles muy elevados de eosinófilos circulantes, no se observó progresión asociada de los signos atópicos ni de ningún otro signo sistémico, y ningún paciente tuvo que interrumpir el tratamiento. El análisis no arrojó ninguna repercusión clínica significativa en los pacientes con elevación de eosinófilos inducida por el dupilumab y no se encontró ninguna correlación con los niveles de IgE o LDH. Además, los niveles de eosinófilos volvieron a los valores basales cuando se continuó con el tratamiento.
En diversos estudios se ha observado una elevación similar de los eosinófilos en sangre durante el tratamiento con el dupilumab. Se ha comunicado que, en la DA y la rinosinusitis crónica con pólipos nasales, estos cambios suelen ser leves (con niveles de hasta 3.000cél/μL), transitorios, no asociados a síntomas clínicos o complicaciones, y no relacionados con una menor eficacia del tratamiento5. Además, al igual que en estudios anteriores, los pacientes que presentaron desde el inicio niveles elevados de eosinófilos fueron los que experimentaron en las primeras semanas de tratamiento con el dupilumab los mayores incrementos. La excepción es un caso clínico de neumonía eosinofílica en un paciente de 63 años con DA6. Por el contrario, un subgrupo de pacientes con asma grave que iniciaron tratamiento con el dupilumab desarrolló una granulomatosis eosinofílica con poliangitis7.
El mecanismo del aumento de eosinófilos durante el tratamiento con el dupilumab está aún por dilucidar, pero se atribuye a la inhibición de eotaxina-3, VCAM-1 y CCL17/TARC debida al bloqueo de la IL-4/IL-13, que disminuye la migración de eosinófilos sin un efecto sobre la eosinofilopoyesis7. Otros autores asociaron este aumento con un bajo número de CD203+ basófilos y una mayor expresión de CD23 en los linfocitos B en un subgrupo de pacientes con DA en tratamiento con el dupilumab8.
Nuestro análisis de los resultados no aclara el mecanismo patológico ni los factores de riesgo asociados a este fenómeno, y no se ha encontrado ninguna correlación estadísticamente significativa entre la elevación de los eosinófilos y factores demográficos, clínicos o analíticos.
En cuanto a los criterios de valoración secundarios, en otros estudios se ha descrito un aumento transitorio de la IgE durante el tratamiento4. Sin embargo, este no fue el caso de nuestros pacientes, ya que la IgE disminuyó de forma constante durante el tratamiento con el dupilumab. Del mismo modo, la LDH también disminuyó progresivamente, lo que refleja una disminución de la actividad inflamatoria asociada a la mejoría clínica, como se ha descrito en estudios anteriores9.
Por lo que sabemos, este estudio multicéntrico es el más amplio sobre el impacto del dupilumab en el recuento de los eosinófilos en una cohorte de pacientes con DA grave. Sin embargo, lleva asociadas algunas limitaciones, en concreto las inherentes a su diseño retrospectivo y prospectivo, como la heterogeneidad de la muestra y la recogida limitada de los datos analíticos.
ConclusionesConcluimos que aunque los eosinófilos séricos aumentan en una proporción de pacientes con DA tratados con el dupilumab durante los primeros meses de tratamiento, esta elevación es autolimitada, leve y no clínicamente relevante. Por lo tanto, no es necesario interrumpir el tratamiento con el dupilumab. Además, a pesar de la eosinofilia transitoria, con base en la ficha técnica del fármaco y en los hallazgos de este y otros estudios, se considera innecesario el seguimiento rutinario de laboratorio en pacientes en tratamiento con el dupilumab.
FinanciaciónEsta investigación fue financiada por el Instituto de Salud Carlos III a través del proyecto PI23/01875. Además, TMV recibió el apoyo de una beca posdoctoral del Instituto de Salud Carlos III (CM22/00083).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio forma parte de la tesis doctoral de Carolina Montero-Vilchez en el programa de Medicina Clínica y Salud Pública de la Universidad de Granada.