el Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (AEDV) ha puesto en marcha un registro de pacientes con psoriasis en tratamiento con agentes biológicos, con el objetivo de analizar el riesgo de acontecimientos adversos (AA) relevantes a largo plazo: BIOBADADERM.
Material y métodoses un estudio de cohortes multicéntrico, con una cohorte de pacientes con psoriasis en terapia biológica y otra cohorte control de pacientes con psoriasis con tratamiento sistémico no biológico, excluida la fototerapia, en una relación 1:1. Se registraron los datos básicos de cada paciente, de los tratamientos y de los AA relevantes. Se analizó el riesgo asociado a un AA concreto, comparando su frecuencia de aparición en ambas cohortes.
Resultadosse evaluaron los datos desde octubre de 2008 hasta noviembre de 2009 junto con datos retrospectivos desde 2005 sobre pacientes tratados con agentes biológicos. Participaron 13 hospitales de España. Se incluyeron 632 pacientes, 417 con biológicos y 215 controles. La suspensión del tratamiento biológico por AA fue poco frecuente (72 ciclos, 10%). Se comunicaron 232 AA en los pacientes con biológicos, la mayoría no graves, los más frecuentes las infecciones (la mayoría del tracto respiratorio superior/nasofaringitis), seguidos de los trastornos de la piel y el tejido subcutáneo. Entre los controles se notificaron 43 AA. Los más frecuentes fueron los trastornos del metabolismo y la nutrición y las alteraciones en las transaminasas. En términos de incidencia de AA, los biológicos presentaron un riesgo relativo (RR) de AA de 2,2 respecto a los controles (p<0,001). En particular destacaron las infecciones e infestaciones (con un RR de 23 con p<0,01) y los trastornos de la piel y el tejido subcutáneo (RR: 4,9 con p<0,05).
Conclusioneslos pacientes tratados con fármacos biológicos presentan mayor número de AA que los controles, en particular en referencia a las infecciones y los trastornos de la piel. Sin embargo, debe tenerse en cuenta que tanto el tiempo de seguimiento como el limitado número de pacientes reclutados —en particular en el grupo de controles— impide extraer conclusiones definitivas. Por otro lado, la diferencia de porcentajes de AA referidos por los distintos centros pone de manifiesto la dificultad de la consideración del concepto de AA en la práctica clínica, siendo necesario homogeneizar los criterios. Aun a pesar de los problemas planteados, que deberán superarse en los próximos años, BIOBADADERM puede convertirse en la referencia obligada en la evaluación del perfil de seguridad de los fármacos biológicos en Dermatología.
The Working Group on Psoriasis of the Spanish Academy of Dermatology and Venereology has initiated BIOBADADERM, a registry of patients with psoriasis receiving treatment with biologic drugs, in order to assess the long-term risk of adverse events (AEs).
Material and methodsA multicenter study was undertaken in 2 cohorts of patients with psoriasis: patients receiving biologic therapy and patients receiving nonbiologic systemic therapy other than phototherapy. Similar numbers of patients were included in each group. Information was recorded on demographic and clinical variables, treatment, and relevant AEs. The risk of specific AEs was determined by comparison of the frequencies for those events in the 2 cohorts.
ResultsData on the 2 cohorts were evaluated for the period from October, 2008 to November, 2009 alongside retrospective data on patients treated with biologics since 2005. Thirteen Spanish hospitals participated in the study. A total of 632 patients were included in the analysis: 417 treated with biologic drugs and 215 controls. Suspension of biologic therapy due to AEs was rare (72 cycles, 10%). A total of 232 AEs were reported in patients receiving biologic therapy. The majority were not serious. The most frequent AEs were infections (mostly upper respiratory tract infections and nasopharyngitis), followed by conditions affecting the skin or subcutaneous tissue. Forty-three AEs were reported in control subjects. The most frequent events were metabolic and nutritional abnormalities and abnormal transaminase levels. Comparison of the incidence of any AE in patients treated with biologics compared with control subjects revealed a relative risk of 2.2 (P<.001) The relative risks of infections or infestations and disorders of the skin or subcutaneous tissue in patients receiving biologic drugs were 23 (P<.01) and 4.9 (P<.05), respectively.
ConclusionsPatients treated with biologic drugs had a greater number of AEs, particularly infections and skin conditions. Definitive conclusions, however, are difficult to draw due to the small number of patients included in the registry, particularly in the control cohort, and the short follow-up period. Differences in the percentages of events reported by the different hospitals reveal the difficulties associated with the concept of AEs in clinical practice and highlight the need to harmonize criteria in the future. Since the problems identified in this analysis should be overcome in future years, we expect BIOBADADERM to become an important source of information on the safety profile of biologic drugs in dermatology.
La seguridad y la eficacia de los nuevos tratamientos para la psoriasis denominados biológicos se sustenta fundamentalmente en ensayos clínicos, gracias a los cuales, en Europa, hoy tenemos aprobados 4 fármacos para tratar la psoriasis con un adecuado perfil riesgo/beneficio: etanercept, infliximab, adalimumab y ustekinumab. Sin embargo, poco se sabe sobre su eficacia y seguridad a largo plazo en poblaciones no seleccionadas. Los ensayos clínicos son necesarios, pero no son suficientes para establecer el perfil de seguridad de los nuevos fármacos principalmente por tres motivos: el primero es que los ensayos clínicos se realizan habitualmente en poblaciones seleccionadas, de las que se excluyen los grupos de pacientes con mayor comorbilidad o riesgo de toxicidad. El segundo motivo es que el tamaño de los ensayos clínicos sólo ofrece poder estadístico para detectar los efectos adversos más frecuentes. Los acontecimientos adversos (AA) raros, aquellos que aparecen con una frecuencia inferior al 1:1000, no se esperan detectar antes de la comercialización. Los casos o series de casos son un punto de partida y sirven para la detección de efectos raros, pero con ellos no se puede probar una relación causal. Los estudios de cohortes y casos-controles son los mejores para detectar AA1. Por último, los ensayos clínicos no permiten definir la toxicidad a largo plazo, pues sus periodos de seguimiento son cortos.
Los sistemas habituales de farmacovigilancia son la notificación espontánea y los estudios de fase IV realizados por los laboratorios. La notificación espontánea presenta limitaciones como la infranotificación. La estrategia de farmacovigilancia más apropiada en este contexto es el establecimiento de registros de tratamiento. En España, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y la Sociedad Española de Reumatología, establecieron en el año 2000 el registro BIOBADASER, que incluía fármacos biológicos utilizados en enfermedades reumatológicas. Sin embargo, los resultados de seguridad de los fármacos biológicos en otras indicaciones, como las reumatológicas, no pueden extrapolarse en su totalidad a los pacientes dermatológicos. Las comorbilidades de cada una de las patologías de base son diferentes. Y así, por ejemplo, el síndrome metabólico es más frecuente en los pacientes con psoriasis. Además, también son distintos los tratamientos concomitantes. Otros ejemplos de problemas específicos son la posibilidad de agravamiento de la artritis psoriásica y la existencia de brotes de psoriasis asociados a algunos fármacos biológicos. Por todo ello, el Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (AEDV) decidió en 2007 iniciar un registro de tratamientos biológicos en psoriasis (BIOBADADERM). Los objetivos del proyecto BIOBADADERM son:
- 1.
Identificar AA relevantes que aparezcan durante el tratamiento de la psoriasis con terapias biológicas y estimar su frecuencia de aparición.
- 2.
Identificar AA inesperados, en particular aquellos que pueden ocurrir tras periodos largos de exposición.
- 3.
Identificar AA relevantes que aparezcan tras la suspensión del tratamiento.
- 4.
Estimar el riesgo relativo de aparición de AA con terapias biológicas en pacientes con psoriasis frente a pacientes psoriásicos expuestos a otros tratamientos sistémicos (no biológicos).
- 5.
Identificar factores de riesgo de padecer reacciones adversas con estos tratamientos.
Presentamos la metodología del registro y los resultados preliminares tras el primer año de la puesta en marcha de BIOBADADERM.
Material y métodosDiseñoEstudio de cohortes, con una cohorte de pacientes psoriásicos en tratamiento con biológicos y otra cohorte control de individuos psoriásicos en tratamiento con sistémicos no biológicos.
LocalizaciónEn el momento de realizar el trabajo participan en BIOBADADERM los hospitales reflejados en la tabla 1, fundamentalmente grandes hospitales con unidades de psoriasis. La inclusión de pacientes se ha iniciado en octubre de 2008; el inicio de la comercialización de fármacos biológicos en España fue en 2005. El Sistema Nacional de Salud cubre, en su mayor parte, los gastos de los tratamientos incluidos en este estudio.
Inclusión de pacientesSe trata de un registro de tratamientos: los pacientes se incluyen de forma prospectiva a medida que comienzan con el tratamiento diana. Cada centro adquiere el compromiso de incluir todos los pacientes sucesivos que cumplen los criterios de inclusión y aceptan participar. En el caso de los pacientes que reciben biológicos se han incluido todos aquellos que reciben por primera vez un fármaco biológico (cohorte de inicio). Por cada paciente incluido en la cohorte expuesta a biológicos debe incluirse otro paciente del servicio al que se prescriba un fármaco sistémico no biológico (metotrexato, ciclosporina y acitretino) y que no haya recibido previamente un fármaco biológico.
Algunos centros participantes ya tenían un elevado número de pacientes tratados con fármacos biológicos en el momento de la puesta en marcha de BIOBADADERM. Por ello se realizó inicialmente una recogida retrospectiva de datos en aquellos centros que disponían de un listado de todos los pacientes que habían recibido biológicos entre el 1 de enero de 2005 y el 30 de octubre de 2008. Estos pacientes se incluían si existía evidencia de un seguimiento clínico al menos semestral, incluyendo los datos del paciente y de AA.
Definición de la exposiciónAunque es posible que en el futuro se opte por otros métodos de análisis para el estudio de los efectos a largo plazo, en este estudio, con un tiempo de seguimiento corto, se ha considerado que los pacientes están expuestos al biológico durante el tratamiento y hasta dos semividas medias después. Aquellos pacientes de la cohorte de control que reciben biológicos pasan a formar parte de la cohorte expuesta. Las comparaciones se han realizado con la cohorte no expuesta a biológicos. Para adjudicar un efecto secundario a un tratamiento se ha considerado su relación temporal, con un tiempo de retardo para cada efecto secundario de entre 0 días y 5 años (por ejemplo: 0 días para alteraciones en el lugar de administración, tres meses para infecciones, 5 años para neoplasias. La lista de tiempos empleados puede solicitarse a la dirección de correspondencia).
SeguimientoLos pacientes incluidos en BIOBADADERM se seguirán durante un periodo indefinido, inicialmente los 5 años previstos de duración del registro, con posibilidad de prorrogarlo. A medida que se producen cambios clínicos se va introduciendo la información en la base de datos. Los pacientes deben ser vistos al menos una vez al año. Además se les hará anualmente una llamada telefónica para confirmar su estado vital y los datos incluidos en el registro. Para facilitar un seguimiento uniforme y exhaustivo se emplean preguntas estandarizadas y un diario del paciente. Las cohortes expuestas y no expuestas se siguen de la misma forma.
Variables medidasCon la finalidad de poder describir la población incluida y valorar sus posibles efectos como factores de confusión, para cada paciente se recogen los datos incluidos en la tabla 2. También los tratamientos administrados, incluyendo los motivos de suspensión.
Datos de los pacientes.
| Datos generales: fecha de nacimiento, sexo, peso, talla, fototipo |
| Diagnóstico de psoriasis: fecha de diagnóstico, forma clínica |
| Patologías previas: cardiopatía isquémica, insuficiencia cardíaca, hipertensión. |
| Patologías previas tipo infecciones: virus hepatitis B, virus hepatitis C, VIH |
| Hábitos de riesgo: consumo de alcohol y de tabaco |
| Tratamientos previos realizados para la psoriasis (excluyendo los tópicos) |
| Fármaco actual, fecha de inicio, PASI al inicio, fecha de interrupción y motivo |
| Datos sobre tuberculosis: historia previa, vacuna, contactos, quimioprofilaxis, radiografía de tórax, Mantoux, Booster |
El registro tiene como objetivo principal la descripción del perfil de seguridad de los fármacos. Por ello se recogen los AA relevantes, según la nomenclatura del MedDRA (Medical Dictionary for Drug Regulatory Activities; disponible en: http://www.meddramsso.com).
Se define como AA relevante todo suceso desfavorable que, independientemente de los fármacos y dosis recibidas:
- 1.
Se corresponda con la definición legal de AA grave (Real Decreto 711/2002 de Farmacovigilancia. Directiva UE 2001-83) de forma que produzca la muerte, ponga en peligro la vida (de forma real, no hipotética), precise de ingreso hospitalario o lo prolongue, produzca una discapacidad persistente o importante o produzca malformaciones congénitas.
- 2.
También se considerarán AA a registrar: a) acontecimientos médicos importantes que no pongan en peligro inmediato la vida ni produzcan la muerte, pero que comprometan al paciente o requieran intervención para prevenir alguno de los resultados enumerados en la definición anterior; y b) acontecimientos que, aunque no se consideren graves, requieran suspensión del tratamiento o atención médica no programada, incluidos cambios en la enfermedad (empeoramiento o cambios en el tipo de psoriasis).
Los datos de cada paciente se han incluido, anonimizados de forma reversible, en una base de datos. La entrada de datos se hace a través de internet (http://biobadaser.ser.es/biobadaderm/). Los datos son custodiados en la Unidad de Investigación de la Fundación Española de Reumatología.
Análisis estadísticoSe ha realizado con el programa Stata 10 (StataCorp, 2009). Los datos recogidos se han descrito mediante estadísticos convencionales (media y desviación estándar, frecuencias absolutas y relativas y densidad de incidencia [años-persona]).
Los riesgos relativos crudos de acontecimientos adversos específicos se han obtenido comparando su frecuencia de aparición entre las dos cohortes, con y sin biológicos, expresándose con un intervalo de confianza del 95%.
Cálculo del tamaño muestralEn los 5 años de duración de BIOBADADERM previstos inicialmente se espera recoger datos de 5.704 años-persona en cada grupo (expuestos a biológicos y controles). Estos serán suficientes para poder detectar, con un poder del 80% y una significación del 0,05, riesgos relativos entre 1,5 y 2, para acontecimientos con incidencias entre 4 y 10 casos por 1000 años-persona en el grupo de control.
Control de calidadLos datos incluidos son revisados on-line de forma continua por un monitor del estudio, comprobándose su consistencia, exhaustividad y la ausencia de anomalías. Anualmente se realiza una visita de monitorización in situ, en la que se cotejan los datos de la aplicación con los de las historias clínicas. Además se hace una llamada telefónica anual a los pacientes para comprobar la información reflejada en la base de datos.
Aspectos éticosEl estudio se realiza de acuerdo con las normas de buena práctica clínica y la legislación vigente. El protocolo del estudio, realizado a requerimiento de la AEMPS, ha sido aprobado por el Comité de Ética del Hospital 12 de Octubre de Madrid. La prescripción del tratamiento es previa e independiente de la participación en el registro.
BIOBADADERM recibe financiación de la AEDV, de la AEMPS y de la industria farmacéutica. Los laboratorios colaboradores aportan cantidades similares y no participan en el análisis ni en la interpretación de los resultados.
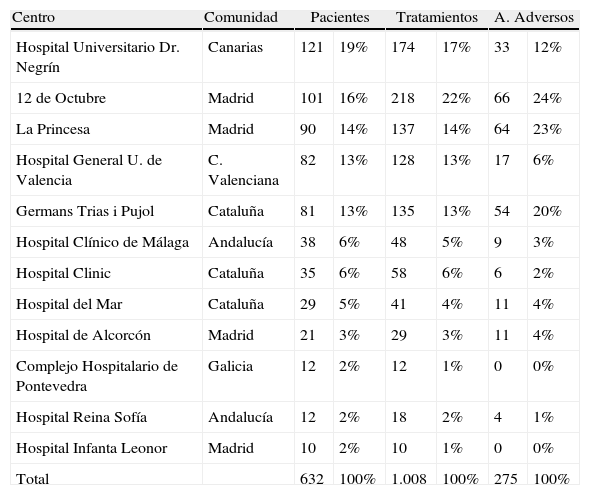
ResultadosBIOBADADERM se puso en marcha en octubre de 2008. Se han incluido los datos disponibles en la aplicación hasta noviembre de 2009. El registro ha contado con la participación voluntaria de 13 hospitales de diferentes Comunidades Autónomas. En la tabla 1 se expone la participación de cada uno de los hospitales.
Hospitales participantes.
| Centro | Comunidad | Pacientes | Tratamientos | A. Adversos | |||
| Hospital Universitario Dr. Negrín | Canarias | 121 | 19% | 174 | 17% | 33 | 12% |
| 12 de Octubre | Madrid | 101 | 16% | 218 | 22% | 66 | 24% |
| La Princesa | Madrid | 90 | 14% | 137 | 14% | 64 | 23% |
| Hospital General U. de Valencia | C. Valenciana | 82 | 13% | 128 | 13% | 17 | 6% |
| Germans Trias i Pujol | Cataluña | 81 | 13% | 135 | 13% | 54 | 20% |
| Hospital Clínico de Málaga | Andalucía | 38 | 6% | 48 | 5% | 9 | 3% |
| Hospital Clinic | Cataluña | 35 | 6% | 58 | 6% | 6 | 2% |
| Hospital del Mar | Cataluña | 29 | 5% | 41 | 4% | 11 | 4% |
| Hospital de Alcorcón | Madrid | 21 | 3% | 29 | 3% | 11 | 4% |
| Complejo Hospitalario de Pontevedra | Galicia | 12 | 2% | 12 | 1% | 0 | 0% |
| Hospital Reina Sofía | Andalucía | 12 | 2% | 18 | 2% | 4 | 1% |
| Hospital Infanta Leonor | Madrid | 10 | 2% | 10 | 1% | 0 | 0% |
| Total | 632 | 100% | 1.008 | 100% | 275 | 100% | |
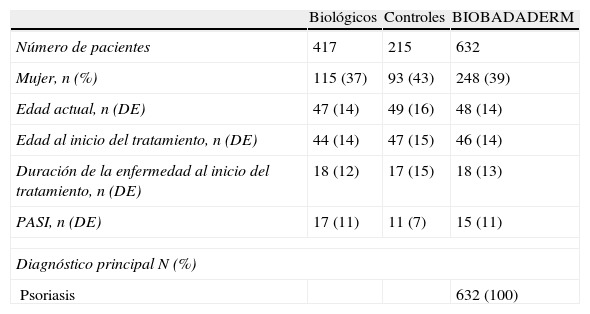
Se han incluido 632 pacientes. La mayoría son hombres (n=384), con una edad media al inicio del tratamiento de 46 años (desviación estándar [DE]=14) y con una duración de la enfermedad de 18 años. La tabla 3 muestra las principales características de los pacientes, de ambas cohortes. Si bien la tendencia ideal es la de incluir pacientes en ambas cohortes de forma homogénea en una proporción 1:1, sin embargo los datos del primer año reflejan un mayor número de pacientes con tratamientos biológicos (n=417), frente a controles (n=215). Destacar que los pacientes con biológicos tienen un PASI medio mayor que los controles (17 frente a 11) y que han realizado mayor número de tratamientos previos.
Descripción de los pacientes.
| Biológicos | Controles | BIOBADADERM | |
| Número de pacientes | 417 | 215 | 632 |
| Mujer, n (%) | 115 (37) | 93 (43) | 248 (39) |
| Edad actual, n (DE) | 47 (14) | 49 (16) | 48 (14) |
| Edad al inicio del tratamiento, n (DE) | 44 (14) | 47 (15) | 46 (14) |
| Duración de la enfermedad al inicio del tratamiento, n (DE) | 18 (12) | 17 (15) | 18 (13) |
| PASI, n (DE) | 17 (11) | 11 (7) | 15 (11) |
| Diagnóstico principal N (%) | |||
| Psoriasis | 632 (100) | ||
DE: desviación estándar.
La tabla 4 muestra la descripción de los ciclos de tratamientos utilizados. Se analizan ciclos de tratamiento porque lo que se compara para calcular la incidencia de un AA no son personas, sino períodos de tiempo de exposición a un tratamiento de cada persona. Se incluyen los datos de los periodos o ciclos de tratamientos en los cuales el paciente no está expuesto a ningún biológico. Dentro de este periodo de no exposición se diferencian los “controles puros” (o aquellos periodos en los cuales el paciente, además de no estar en tratamiento con biológicos, tampoco ha recibido biológicos previamente), que representan un 25%, de los “controles contaminados” (o aquellos periodos de tiempo en los cuales el paciente no está en tratamiento con biológicos, pero previamente si ha estado expuesto a los mismos), un 5% del total de ciclos de tratamiento.
Descripción de los tratamientos.
| Fármaco | N (%) |
| Etanercept | 270 (27) |
| Infliximab | 106 (10) |
| Adalimumab | 172 (17) |
| Efalizumab | 157 (15) |
| Ustekinumab | 17 (2) |
| En tratamiento con sistémicos (controles previamente expuestos a biológicos) | 48 (5) |
| Controles (no expuestos previamente a biológicos) | 238 (24) |
| Ciclos de tratamientos | 1.008 (100) |
El tratamiento que se ha utilizado mayoritariamente ha sido etanercept, seguido de adalimumab, sumando entre los dos más de un 40% de los usos. En tercer lugar se sitúa efalizumab (no incluido a partir de que la EMEA suspendiera el fármaco a finales de febrero de 2009). El número de controles es inferior al número de biológicos utilizados, de forma que representan poco más de la cuarta parte (29%) de todos los tratamientos. Si se excluyen aquellos que no son controles puros, la cifra de controles queda reducida al 25%.
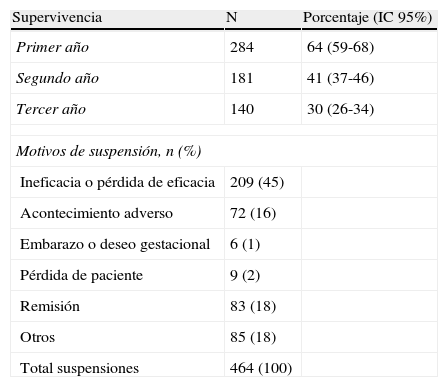
La mediana del tiempo de supervivencia de los tratamientos biológicos se sitúa en torno al año y medio. Los tiempos de seguimiento aún son bastante bajos. Un total de 284 pacientes, que llevan menos de un año en seguimiento, fueron excluidos del análisis al no tener aún suficientes datos. Los motivos de interrupción de los tratamientos se exponen en la tabla 5. El principal de todos es la ineficacia o la pérdida de eficacia, llegando casi a representar la mitad de todas las suspensiones. En segundo lugar están las remisiones y la categoría “otros”, ambos con un 18% (la mayoría de los casos de “otros” se deben a la suspensión de efalizumab, por retirada administrativa del fármaco). También mencionar que se suspendió el tratamiento por embarazo o deseo gestacional en 6 mujeres. Se registraron dos embarazos que terminaron con dos recién nacidos sanos.
Supervivencia y motivos de suspensión del tratamiento.
| Supervivencia | N | Porcentaje (IC 95%) |
| Primer año | 284 | 64 (59-68) |
| Segundo año | 181 | 41 (37-46) |
| Tercer año | 140 | 30 (26-34) |
| Motivos de suspensión, n (%) | ||
| Ineficacia o pérdida de eficacia | 209 (45) | |
| Acontecimiento adverso | 72 (16) | |
| Embarazo o deseo gestacional | 6 (1) | |
| Pérdida de paciente | 9 (2) | |
| Remisión | 83 (18) | |
| Otros | 85 (18) | |
| Total suspensiones | 464 (100) | |
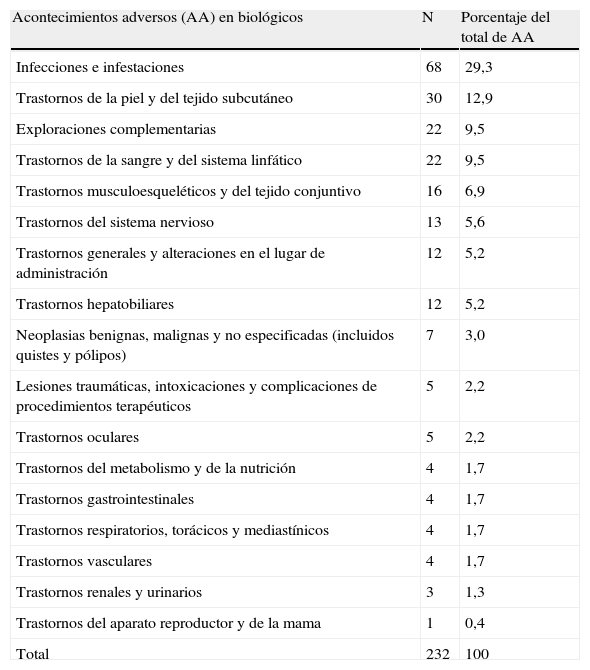
La frecuencia y el porcentaje de los diferentes acontecimientos adversos registrados por grandes grupos de órganos y sistemas queda reflejado en las tabla 6, que muestra los AA que ocurren durante el periodo en el cual el paciente se encuentra expuesto a terapia biológica, y en la tabla 7, que representa los AA que ocurren cuando el paciente no está expuesto a biológicos (controles puros y contaminados). Los AA más frecuentes con biológicos son las infecciones e infestaciones, que suponen casi el 30% de todos los AA registrados. Dentro de las infecciones, la mayoría (un 44%) fueron infecciones del tracto respiratorio superior/nasofaringitis. Hubo dos casos de tuberculosis (TBC), uno pulmonar y otro pleural; también hubo otros tres casos de TBC latente (dos de ellos se reportaron dentro del apartado “Exploraciones complementarias” como positivización del Mantoux). También hubo tres casos de Herpes zoster y uno de Herpes simple. En segundo lugar encontramos los trastornos de la piel y del tejido subcutáneo con un 13%. En este apartado hay muchos términos muy similares y poco específicos desde el punto de vista dermatológico. La mayoría de los AA reportados son: dermatitis psoriasiforme, erupción papular, erupción papuloescamosa, erupción psoriasiforme, erupción generalizada, psoriasis (en algunos casos se especifica que se trata de un rebote o agravamiento de su psoriasis y en otros que son los cuadros descritos con efalizumab, sobre todo de erupciones papulares transitorias). A continuación están las alteraciones en las exploraciones complementarias (9,5%), sobre todo alteraciones del perfil hepático (aumento de transaminasas) (7,5%) y alteraciones hematológicas (9,5%). Hay dos casos de pacientes con tumores, uno con un tumor basocelular y otro con un carcinoma de mama (0,43%).
Frecuencia de los acontecimientos adversos en biológicos por grupos.
| Acontecimientos adversos (AA) en biológicos | N | Porcentaje del total de AA |
| Infecciones e infestaciones | 68 | 29,3 |
| Trastornos de la piel y del tejido subcutáneo | 30 | 12,9 |
| Exploraciones complementarias | 22 | 9,5 |
| Trastornos de la sangre y del sistema linfático | 22 | 9,5 |
| Trastornos musculoesqueléticos y del tejido conjuntivo | 16 | 6,9 |
| Trastornos del sistema nervioso | 13 | 5,6 |
| Trastornos generales y alteraciones en el lugar de administración | 12 | 5,2 |
| Trastornos hepatobiliares | 12 | 5,2 |
| Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) | 7 | 3,0 |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | 5 | 2,2 |
| Trastornos oculares | 5 | 2,2 |
| Trastornos del metabolismo y de la nutrición | 4 | 1,7 |
| Trastornos gastrointestinales | 4 | 1,7 |
| Trastornos respiratorios, torácicos y mediastínicos | 4 | 1,7 |
| Trastornos vasculares | 4 | 1,7 |
| Trastornos renales y urinarios | 3 | 1,3 |
| Trastornos del aparato reproductor y de la mama | 1 | 0,4 |
| Total | 232 | 100 |
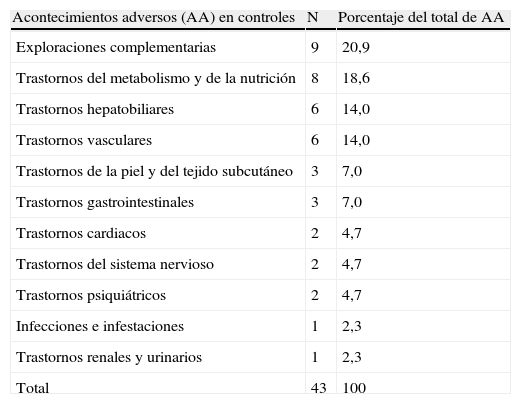
Frecuencia de los acontecimientos adversos en controles por grupos.
| Acontecimientos adversos (AA) en controles | N | Porcentaje del total de AA |
| Exploraciones complementarias | 9 | 20,9 |
| Trastornos del metabolismo y de la nutrición | 8 | 18,6 |
| Trastornos hepatobiliares | 6 | 14,0 |
| Trastornos vasculares | 6 | 14,0 |
| Trastornos de la piel y del tejido subcutáneo | 3 | 7,0 |
| Trastornos gastrointestinales | 3 | 7,0 |
| Trastornos cardiacos | 2 | 4,7 |
| Trastornos del sistema nervioso | 2 | 4,7 |
| Trastornos psiquiátricos | 2 | 4,7 |
| Infecciones e infestaciones | 1 | 2,3 |
| Trastornos renales y urinarios | 1 | 2,3 |
| Total | 43 | 100 |
Los AA más frecuentes en el grupo de controles son las alteraciones hepáticas (18,6%) y los trastornos del metabolismo y la nutrición, hiperlipemia (aumento de triglicéridos y colesterol) en el 21%, que suponen casi el 40% de todos los AA registrados. Las infecciones apenas superan el 2% y los trastornos cardiovasculares representan casi un 20% de los AA. No hay datos registrados de neoplasias en controles.
Según la gravedad de los AA registrados, un 88% (241) han sido considerados como acontecimientos “no graves”. Los porcentajes son parecidos tanto para el grupo de controles, 93%, como para el grupo de biológicos, 87%. No ocurre lo mismo con los AA graves: mientras que en el grupo de biológicos el porcentaje asciende al 13%, en el grupo de controles el porcentaje es del 5%. En el grupo de los controles se ha comunicado una muerte debido a una insuficiencia renal crónica, si bien es un control contaminado, es decir, que previamente había estado expuesto a un biológico, efalizumab.
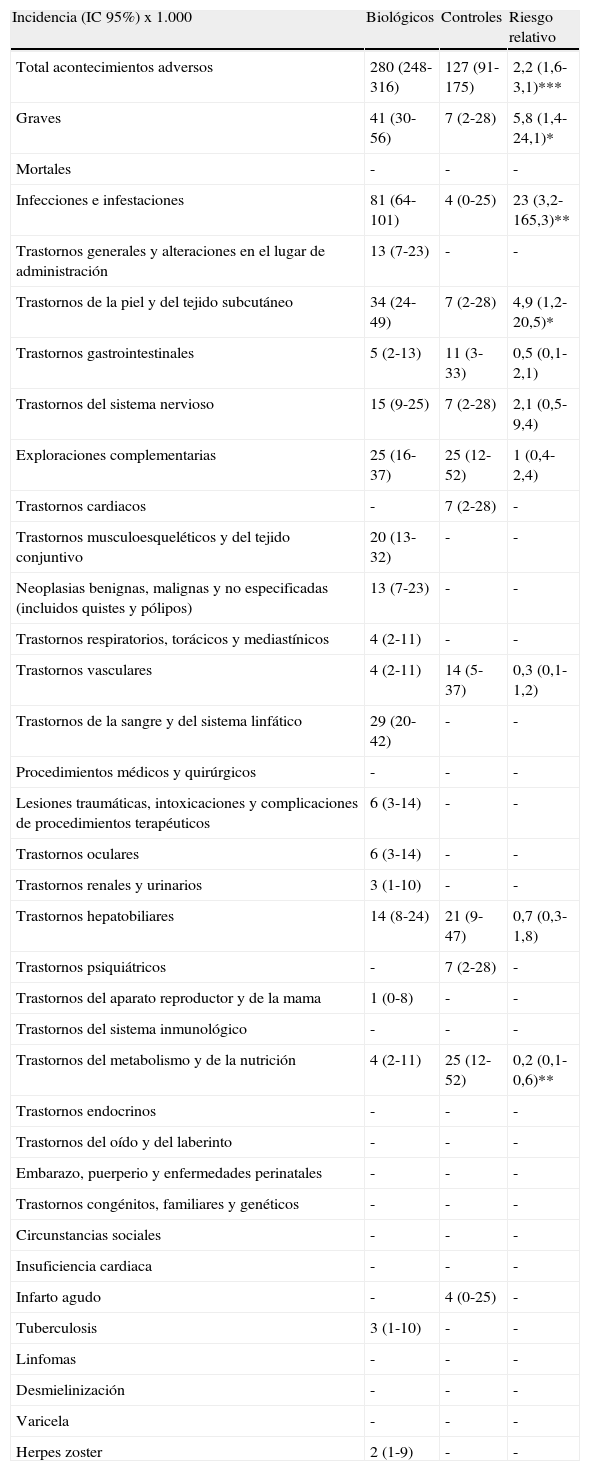
En la tabla 8 se muestran las incidencias de todos los AA ocurridos durante este primer año de seguimiento del registro. Hemos diferenciado entre periodos de exposición a biológicos y controles puros, y posteriormente se han calculado los RR entre ambos grupos. Los tratamientos biológicos presentan un mayor número de AA y más graves que los controles. Destacan las infecciones e infestaciones, los trastornos de la piel y del tejido subcutáneo y los trastornos de la sangre y del sistema linfático, todos ellos más frecuentes entre el grupo de biológicos. Por otra parte, los controles presentan más trastornos del metabolismo y de la nutrición (fundamentalmente aumento de triglicéridos y colesterol), trastornos gastrointestinales y trastornos vasculares. En ambos grupos se da igual número de alteraciones en exploraciones complementarias y trastornos hepatobiliares.
Incidencia de los acontecimientos adversos.
| Incidencia (IC 95%) x 1.000 | Biológicos | Controles | Riesgo relativo |
| Total acontecimientos adversos | 280 (248-316) | 127 (91-175) | 2,2 (1,6-3,1)*** |
| Graves | 41 (30-56) | 7 (2-28) | 5,8 (1,4-24,1)* |
| Mortales | - | - | - |
| Infecciones e infestaciones | 81 (64-101) | 4 (0-25) | 23 (3,2-165,3)** |
| Trastornos generales y alteraciones en el lugar de administración | 13 (7-23) | - | - |
| Trastornos de la piel y del tejido subcutáneo | 34 (24-49) | 7 (2-28) | 4,9 (1,2-20,5)* |
| Trastornos gastrointestinales | 5 (2-13) | 11 (3-33) | 0,5 (0,1-2,1) |
| Trastornos del sistema nervioso | 15 (9-25) | 7 (2-28) | 2,1 (0,5-9,4) |
| Exploraciones complementarias | 25 (16-37) | 25 (12-52) | 1 (0,4-2,4) |
| Trastornos cardiacos | - | 7 (2-28) | - |
| Trastornos musculoesqueléticos y del tejido conjuntivo | 20 (13-32) | - | - |
| Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) | 13 (7-23) | - | - |
| Trastornos respiratorios, torácicos y mediastínicos | 4 (2-11) | - | - |
| Trastornos vasculares | 4 (2-11) | 14 (5-37) | 0,3 (0,1-1,2) |
| Trastornos de la sangre y del sistema linfático | 29 (20-42) | - | - |
| Procedimientos médicos y quirúrgicos | - | - | - |
| Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos | 6 (3-14) | - | - |
| Trastornos oculares | 6 (3-14) | - | - |
| Trastornos renales y urinarios | 3 (1-10) | - | - |
| Trastornos hepatobiliares | 14 (8-24) | 21 (9-47) | 0,7 (0,3-1,8) |
| Trastornos psiquiátricos | - | 7 (2-28) | - |
| Trastornos del aparato reproductor y de la mama | 1 (0-8) | - | - |
| Trastornos del sistema inmunológico | - | - | - |
| Trastornos del metabolismo y de la nutrición | 4 (2-11) | 25 (12-52) | 0,2 (0,1-0,6)** |
| Trastornos endocrinos | - | - | - |
| Trastornos del oído y del laberinto | - | - | - |
| Embarazo, puerperio y enfermedades perinatales | - | - | - |
| Trastornos congénitos, familiares y genéticos | - | - | - |
| Circunstancias sociales | - | - | - |
| Insuficiencia cardiaca | - | - | - |
| Infarto agudo | - | 4 (0-25) | - |
| Tuberculosis | 3 (1-10) | - | - |
| Linfomas | - | - | - |
| Desmielinización | - | - | - |
| Varicela | - | - | - |
| Herpes zoster | 2 (1-9) | - | - |
*p<0,05; **p<0,01;***p<0,001.
Los registros como el presentado en este trabajo permiten monitorizar la seguridad a largo plazo y en algunos casos también la eficacia de los tratamientos (tanto los clásicos como los emergentes) en la práctica habitual con poblaciones no seleccionadas. La utilidad de los registros de seguridad de fármacos biológicos ha quedado establecida tanto por la proliferación de las mismas en Europa, como por los resultados obtenidos en algunas de ellas, de la que BIOBADASER sería un ejemplo consolidado. Este registro, pionero en España, predecesor y ejemplo de BIOBADADERM, permitió detectar una mayor incidencia de infección tuberculosa en los tratamientos biológicos2, lo que motivó un cambio en la práctica clínica. En Europa existen varios registros de fármacos biológicos para psoriasis. Los más importantes, presentes en Italia, Gran Bretaña, Suecia, Israel, Alemania y Holanda están integrados en la red PSONET (http://www.psonet.eu), una iniciativa de la Agencia Italiana del Medicamento para la fusión de datos de los registros. Esta red agrupa en la actualidad 13 registros y un total de unos 15.000 pacientes con psoriasis en tratamiento con biológicos, aunque todavía hay pocos datos publicados3,4. BIOBADADERM está integrada también en la red PSONET, buscando aumentar la eficiencia del estudio y el poder estadístico. El proyecto PSONET ha sido registrado como una red de contacto europea promovido por la EMEA dentro del llamado European Network of Centres of Pharmacovigilance and Pharmacoepidemiology5.
BIOBADADERM se diseñó siguiendo el modelo de BIOBADASER, pero adaptándolo a nuestros enfermos con psoriasis. En la cohorte de expuestos están todos los agentes biológicos aprobados hasta la fecha, y se irán añadiendo nuevos, como ha ocurrido con ustekinumab. En la cohorte control se incluyen pacientes con tratamientos sistémicos clásicos: metotrexato, ciclosporina y acitretino. Se ha excluido la fototerapia, como también en otros registros similares, para intentar que los pacientes de ambas cohortes sean los más homogéneos posible en cuanto a gravedad (PASI), incidencia de artropatía, etc.
Según este primer informe los tratamientos biológicos tienden a asociarse a un mayor número de AA que los controles. Hay que tener en cuenta que las cohortes no son del todo homogéneas, ya que se ha incluido un mayor número de pacientes en el grupo de biológicos que en el de controles. Además, los pacientes con tratamientos biológicos tenían un PASI algo superior y habían recibido un mayor número de tratamientos previos, lo que permite sugerir que se trataba de pacientes con una psoriasis más grave. Esto podría explicar la mayor frecuencia de AA. La inclusión de más pacientes con biológicos que controles se debe a que, en primer lugar, se han incluido pacientes tratados con biológicos de forma retrospectiva desde el 2006, dado que se disponía de todos sus datos, mientras que los controles sólo se han incluido de forma prospectiva. Además, debe tenerse en cuenta que muchos de los investigadores son responsables de unidades de psoriasis donde se atienden fundamentalmente casos graves y moderados, muchos de los cuales requieren tratamiento continuado y son candidatos, por lo tanto, a las nuevas terapias biológicas.
El agente biológico más empleado según este primer informe es etanercept. Esto puede explicarse, al menos en parte, por su aprobación más temprana, lo que repercute en un mejor conocimiento y familiaridad de su uso por parte del dermatólogo y a un mayor periodo histórico de prescripción.
Merece la pena resaltar el gran número de ciclos de tratamientos biológicos que fueron suspendidos (464 de 722 ciclos). La suspensión por efectos adversos es poco frecuente (72 ciclos, 10%). Puede resultar llamativo el porcentaje suspendido por ineficacia o pérdida de eficacia (un 45% del total de las suspensiones de biológicos, 29% de los ciclos iniciados). Para valorar adecuadamente esta cifra conviene tener en cuenta que se clasifican así todos aquellos tratamientos que se suspenden después del periodo máximo de tratamiento que indica la ficha técnica sin haber obtenido la mejoría esperada, y aquellos en los que se opta por cambiar a otro biológico. Probablemente este cambio se realiza ahora con más frecuencia ante las mayores expectativas de los pacientes y de los dermatólogos y la disponibilidad de múltiples fármacos.
Sólo se ha perdido el seguimiento en 9 pacientes (2%). Este hecho, junto con las monitorizaciones de los datos llevadas a cabo por un monitor externo, tanto on line casi a tiempo real como in situ una vez al año, da una idea de la alta calidad en la recogida de la información. Sin embargo, también es cierto que hay cierta discrepancia en el porcentaje de notificación de AA según los centros, con algunos centros donde no se reportó ningún AA. Es muy difícil en la práctica clínica homogeneizar esta notificación de AA, pero creemos que con las monitorizaciones y las diferentes reuniones de los investigadores estas diferencias se irán suavizando.
En cuanto a los AA, como hemos mencionado, su incidencia es mayor en los pacientes tratados con biológicos que con controles, especialmente con respecto a las infecciones e infestaciones. Sin embargo, como hemos comentado, la mayoría son infecciones de vías respiratorias altas que fueron consideradas no graves y se recuperaron sin secuelas. Las diferencias son significativas, y aunque haya muchos factores de confusión, como comentamos a continuación, estos resultados nos deben impulsar a seguir atentos y ver qué nos deparan futuros análisis. Es necesario aclarar que aunque existan diferencias estadísticamente significativas, las cifras de incidencia no son consistentes, puesto que los periodos de seguimiento y el número de individuos aún son relativamente pequeños. También de cara a la interpretación de los riesgos relativos se trata de valores sin ajustar por otros posibles factores de confusión, tales como confusión por indicación, comorbilidad, factores sociodemográficos, tratamientos concomitantes o gravedad de la enfermedad. En próximos análisis sería también interesante poder analizar el tiempo que transcurre entre la aparición del AA y el inicio del tratamiento, para ver si también se cumple lo que en algunos ensayos clínicos, donde hay una mayor notificación al principio6.
Otros factores que deben tenerse en cuenta al valorar los resultados son:
- 1.
El posible sesgo de información: el seguimiento de los pacientes no se realiza a ciegas sobre su exposición y podría llevar a los médicos a ser más celosos en la descripción de los AA en los pacientes expuestos. Para intentar minimizar este sesgo se intentará utilizar definiciones estándar y mediciones objetivas de los efectos adversos7, tratando de alcanzar acuerdos estandarizados de grupos de expertos en la notificación de acontecimientos adversos8. Además, las llamadas de seguimiento (para obtener datos sobre estado vital y hospitalizaciones) se realizarán a ciegas sobre el grupo al que pertenece el paciente. La dirección de este sesgo, de existir, sería favorable a los objetivos de la farmacovigilancia (detección de reacciones adversas).
- 2.
La heterogeneidad de la exposición. Inicialmente estamos considerando en un único grupo todos los agentes biológicos y todos los sistémicos. Es previsible que sus perfiles de toxicidad difieran entre los distintos fármacos. Por otra parte, es probable que muchos pacientes reciban varios de los fármacos de cada grupo. Para poder valorar este entramado de posibles agentes etiológicos será necesario dividir la muestra, bien realmente bien mediante técnicas estadísticas como el análisis multivariante. Para que estos análisis den resultados satisfactorios, en el contexto de reacciones adversas poco frecuentes debe partirse de una muestra muy grande. Estas preguntas probablemente sólo puedan responderse mediante la red PSONET, o uniendo datos de BIOBADASER y BIOBADADERM para fármacos de uso común en Dermatología y Reumatología.
A pesar de las dificultades, estos registros son, hoy por hoy, la mejor manera que tenemos para estudiar la seguridad a medio y largo plazo de nuevos tratamientos. El objetivo de este registro es poner a disposición de los profesionales una información de calidad sobre los efectos adversos de estas nuevas terapéuticas a corto, medio y largo plazo, para poder adoptar decisiones terapéuticas basadas en la evidencia científica y contribuir al mejor manejo de los pacientes con psoriasis grave moderada. No se trata de una guía clínica para el tratamiento de la psoriasis, pues no se analiza en BIOBADADERM eficacia ni coste, y además ya existen buenas guías y directrices tanto españolas como internacionales que recogen opiniones de expertos y análisis de la literatura al respecto9–12. Tampoco es una serie de casos de pacientes psoriásicos tratados con biológicos, como ya publicó otro miembro del grupo de Psoriasis de la AEDV13, que nos aporta también gran información, aunque con los sesgos propios de este tipo de estudios (retrospectivos y sin controles). BIOBADADERM es un proyecto de futuro, diseñado específicamente para la detección de efectos adversos.
Para concluir, presentamos los resultados del primer informe de BIOBADADERM. Debe destacarse la importancia de este proyecto diseñado (estudio prospectivo de cohortes) para la detección de acontecimientos adversos en pacientes con psoriasis en tratamiento con agentes biológicos. En este primer informe, aunque existen ciertas diferencias estadísticamente significativas entre los AA de los pacientes tratados con biológicos frente a los controles, las cifras de incidencia de AA no son consistentes, puesto que el periodo de seguimiento y el número de individuos es aún corto. Los tratamientos biológicos parecen presentar mayor número de acontecimientos adversos que los controles. Entre los biológicos los AA más frecuentes son: infecciones, infestaciones, trastornos de la piel y tejido subcutáneo, de la sangre y del sistema linfático y exploraciones complementarias. Entre los controles los AA más frecuentes son: trastornos del metabolismo, de la nutrición, gastrointestinales y vasculares. La diferencia de porcentajes de AA referidos por los distintos centros pone de manifiesto la dificultad de la recogida de AA en la práctica clínica.
Es de mencionar que el esfuerzo de todos los participantes en BIOBADADERM ha sido y es encomiable. La información que se desprende de este proyecto nos ayudará a mejorar el trato con nuestros pacientes. Dicha información estará disponible para todos los académicos en forma de informes anuales en la página web de la AEDV (http://www.aedv.es).
Conflicto de interesesBIOBADADERM recibe financiación de la Academia Española de Dermatología y Venereología, de la Agencia Española de Medicamentos y Productos Sanitarios y de la industria farmacéutica (Abbott, Merck-Schering Plough, Pfizer-Wyeth). Los laboratorios colaboradores aportan cantidades similares y no participan en el análisis ni en la interpretación de los resultados.
Los autores desean agradecer a la doctora Loreto Carmona y a Miguel Ángel Descalzo su inestimable dedicación y colaboración en la elaboración de este artículo.