El uso de la terapia diana (TD) en el melanoma irresecable tiene un 49% de respuesta patológica completa. Esta se define como la presencia de menos de un 10% de células tumorales viables (CTV) tras la resección1.
Describimos a continuación 4 pacientes con metástasis de melanoma irresecables que, tras el tratamiento con dabrafenib y trametinib (D+T), obtuvieron una buena respuesta clínica y radiológica y fueron sometidos a cirugía de rescate. En todos ellos el estudio histológico mostró un escaso número de células tumorales viables.
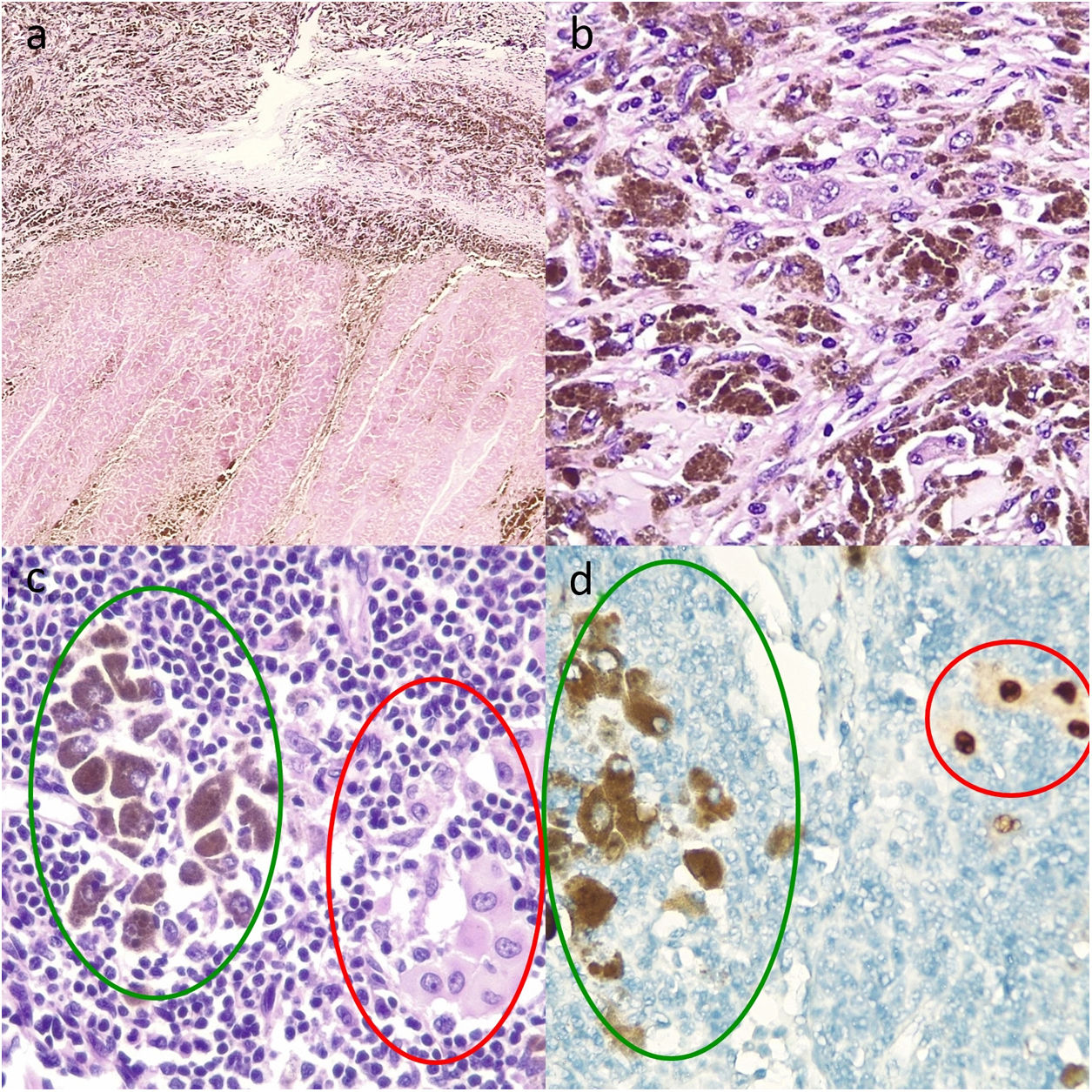
Se estudiaron histológicamente 4 piezas quirúrgicas de metástasis de melanoma, inicialmente irresecables, de pacientes que tras recibir D+T alcanzaron una buena respuesta clínica y radiológica que permitió la cirugía posterior. La respuesta radiológica fue evaluada siguiendo la guía RECIST (versión 1.1)2. La respuesta patológica se evaluó siguiendo las recomendaciones del International Neoadjuvant Melanoma Consortium3. Se estudió la presencia de fibrosis y necrosis y se realizó un estudio por inmunohistoquímica con SOX10 para el estudio de CTV (fig. 1). Se definieron la respuesta patológica completa y parcial como la presencia de <10% y 10-50% de CTV, respectivamente.
Cortes histológicos de ganglio linfático tras terapia diana con dabrafenib y trametinib. A. Múltiples melanófagos sobre un fondo de fibrosis en la parte superior y necrosis intensa en la parte inferior (hematoxilina y eosina, ×10). B. Melanófagos y CTV con mucha melanina intracitoplasmática, haciendo necesario el uso de técnicas adicionales como el marcador nuclear SOX10 para evaluar el porcentaje de CTV y, por tanto, el tipo de respuesta patológica (hematoxilina y eosina, ×20). C. Melanófagos a la izquierda con melanina intracitoplasmática (marcados con verde), y a la derecha CTV aisladas (marcadas con rojo) (hematoxilina y eosina ×100). D. Captación nuclear para las CTV (marcadas con rojo) y captación citoplasmática de los melanófagos sin tinción nuclear (marcados con verde) (inmunohistoquímica para SOX10, ×100).
Todos nuestros pacientes presentaron una buena respuesta clínica tras el tratamiento con TD, con reducción o desaparición de las metástasis (tabla 1). En los 3 pacientes en los que se midió la respuesta radiológica, estos alcanzaron una respuesta RECIST 1.1 parcial. Todos alcanzaron una respuesta patológica tras el uso de D+T, que fue parcial en un paciente y completa en 3 pacientes. Una paciente presentó astenia y pérdida de apetito grado iii durante la TD, que remitió tras una reducción de dosis con aumento progresivo de la misma durante 8 semanas y posterior reintroducción a dosis plenas, con buena tolerancia hasta la actualidad. Todos ellos se mantienen libres de recurrencia.
Casos de pacientes con metástasis de melanoma irresecables tratados con dabrafenib y trametinib
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | |
|---|---|---|---|---|
| Edad | 74años | 50años | 42años | 68años |
| Sexo | Mujer | Hombre | Hombre | Mujer |
| Estadio | IIIC irresecable (T3bN3bM0) | IIIC irresecable (T4aN1aM0) | IIID irresecable (T4bN3cM0) | IIIC irresecable (T2aN3cM0) |
| Tratamiento previo recibido | No | Pembrolizumab (progresión durante la adyuvancia) | No | No |
| Metástasis de melanoma | Adenopatías cervicales, supraclaviculares, axilares y retropectorales derechas | Gran masa adenopática axilar izquierda | Gran masa adenopática axilar izquierda | Cutáneas múltiples en la pierna derecha |
| Terapia sistémica empleada | Dabrafenib y trametinib | Dabrafenib y trametinib | Dabrafenib y trametinib | Dabrafenib y trametinib |
| Semanas de tratamiento | 16 semanas | 8 semanas | 6 semanas | 48 semanas |
| Respuesta clínica | Desaparición de las adenopatías palpables | Disminución del tamaño de las adenopatías | Disminución del tamaño de las adenopatías | Resolución de las lesiones cutáneas |
| Respuesta radiológica | RECIST 1.1. parcial | RECIST 1.1. parcial | RECIST 1.1. parcial | No evaluada |
| Rescate quirúrgico | Linfadenectomía cervical y axilar derecha | Linfadenectomía axilar izquierda | Linfadenectomía axilar izquierda | Extirpación de una lesión pigmentada cutánea residual |
| Respuesta patológica | Completa | Completa | Parcial | Completa |
| Adyuvancia posterior | Pembrolizumab con progresión a metástasis cutáneaCambio a dabrafenib+trametinib | Dabrafenib y trametinib | Pembrolizumab | Dabrafenib y trametinib |
| Toxicidad presentada | Astenia y pérdida de apetito grado iii (resuelta tras un descenso de la dosis) | No | No | No |
| Supervivencia libre de enfermedad | 16 meses | 9 meses | 14 meses | 8 meses |
En los últimos años se ha aprobado el uso de varios agentes terapéuticos en adyuvancia para el tratamiento del melanoma, demostrando un aumento de la supervivencia libre de enfermedad para los pacientes en estadio iii resecado4–6. El éxito de estas terapias ha llevado a su evaluación también en el contexto de la neoadyuvancia, un campo de investigación activo en los últimos años7. El uso de la terapia dirigida o citotóxica neoadyuvante está estandarizada para numerosos tipos de cáncer, donde ha demostrado facilitar la cirugía permitiendo la resección completa del tumor, además de facilitar el desarrollo de biomarcadores de respuesta en las piezas de resección quirúrgica. En un ensayo clínico aleatorizado fase ii reciente se comparó la eficacia y la seguridad de TD con D+T neoadyuvante y adyuvante frente al tratamiento quirúrgico estándar en el melanoma en estadio iii resecable o estadio iv oligometastásico. El 58% de los pacientes en el grupo que recibió neoadyuvancia alcanzó una respuesta patológica completa, siendo el riesgo de recurrencia 60 veces menor en este grupo que en el que recibió tratamiento quirúrgico estándar8. Igualmente, en un ensayo fase ii en pacientes con melanoma estadio iii u oligometastásico, el 49% de los pacientes que recibieron D+T de forma neoadyuvante obtuvieron una respuesta patológica completa1. También se ha observado un 21% de respuestas patológicas completas con el tratamiento en monoterapia con inhibidores de puntos de control inmunológico (anti-PD1)9.
Actualmente, el tratamiento estándar para las metástasis de melanoma en los pacientes en estadio iii y iv resecables es el tratamiento quirúrgico seguido de una adyuvancia posterior con inmunoterapia o terapia dirigida10. No obstante, algunos pacientes con metástasis inicialmente irresecables pueden presentar una respuesta radiológica tras el tratamiento sistémico que permite la cirugía de rescate posterior. Todos nuestros pacientes presentaron una buena respuesta clínica tras el tratamiento con TD, con una reducción o desaparición de las metástasis, alcanzándose una respuesta patológica completa tras D+T en 3 pacientes y parcial en un paciente. Todos ellos se mantienen libres de enfermedad tras una media de 17,5 meses de seguimiento (rango 10-24 meses).
El estudio histológico detallado y estandarizado de las piezas quirúrgicas de resección, con medición de la necrosis, fibrosis, células viables y melanófagos es fundamental para evaluar los tipos de respuesta a la terapia. En ocasiones la presencia de melanina intracitoplasmática puede dificultar diferenciar las CTV de los melanófagos, siendo necesarias técnicas complementarias. Destacamos la importancia de marcadores nucleares como el SOX10 para identificar las CTV y evaluar la respuesta patológica completa.
El uso de TD en pacientes con metástasis de melanoma BRAF mutado irresecables tiene el potencial de reducir de forma rápida el tamaño de estos tumores, permitiendo la cirugía posterior y disminuyendo la morbilidad de la misma. En segundo lugar, nos ofrece una ventana de oportunidad para evaluar la eficacia antitumoral de la TD mediante el examen histológico de la pieza de resección quirúrgica. Mientras que la persistencia tumoral tras la TD puede indicar la necesidad de plantear nuevos tratamientos en el contexto de la adyuvancia posterior, su erradicación puede favorecer la continuación de la terapia actual. Por último, el uso de la TD previa a la cirugía puede potencialmente erradicar enfermedad clínicamente oculta, previniendo o retrasando la recurrencia posterior.