El carcinoma escamoso cutáneo (CEC) es un tumor maligno relativamente indolente comparado con otros tipos de cáncer y que rara vez ocasiona metástasis si se trata con prontitud, siendo la tasa de curación a 5 años superior al 90%1. El tratamiento curativo suele ser la cirugía y más infrecuentemente la radioterapia, de especial interés en pacientes frágiles y/o en tumores de gran tamaño. La cirugía puede ser convencional o micrográfica de Mohs (CMM), que obtiene unas tasas de recurrencia menores: 3,1-8% vs. 0-4%, respectivamente2. Algunos casos responden mal a estos tratamientos o pueden no ser la mejor opción terapéutica por características del paciente o del tumor. Suelen valorarse entonces tratamientos alternativos, principalmente sistémicos o bien paliativos. La inmunoterapia con anti-PD-1ha supuesto una revolución terapéutica en el CEC avanzado y metastásico. Sin embargo, aproximadamente el 50% de los pacientes no responderán a este tratamiento, además de no ser una buena opción en pacientes trasplantados3. Las nuevas terapias intralesionales podrían suponer otra revolución terapéutica que podría dar solución a algunas situaciones que se describirán en este artículo.
Es objetivo del presente artículo, fruto de la reflexión y la práctica clínica habitual, identificar y analizar los distintos escenarios en los que los tratamientos convencionales locales (cirugía y radioterapia) son de difícil aplicación u ofrecen una opción curativa limitada. Estas situaciones no siempre se contemplan de forma óptima en las guías clínicas (National Comprehensive Cancer Network [NCCN] Guidelines4 y European Association of Dermato Oncology [EADO] Guidelines5) y en los sistemas de estadificación (American Joint Committee on Cancer [AJCC] 8th edition6 y Brigham and Women's Hospital [BWH] system7) de uso habitual. Suponen un reto de manejo y tratamiento cuando nos encontramos con ellas y algunas se sobreponen con los conceptos de CEC de alto riesgo, localmente avanzado y metastásico. Estos escenarios son (tabla 1):
Escenarios en los que el carcinoma escamoso cutáneo es difícil de tratar con terapias locales convencionales
| Invasión de estructuras profundas o cavidades |
| Afectación ósea y más allá del hueso |
| Invasión perineural |
| Ubicaciones anatómicas complejas: uña y pene |
| Hidrosadenitis supurativa concomitante u otras enfermedades inflamatorias crónicas |
| Exéresis incompletas o recidivas en colgajos |
| Satelitosis o metástasis en tránsito |
| Múltiples tumores simultáneos |
| Metástasis parotídeas |
| Metástasis ganglionares extensas |
| Pacientes de edad muy avanzada o muy frágiles |
Algunos tumores comprometen estructuras profundas o cavidades como la órbita8 o el oído9. La cirugía en estos casos, más allá de comportar una mayor tasa de recurrencias por su complejidad, puede ser tan mutilante que se contraindique o no sea factible. A veces, no se consiguen unos márgenes quirúrgicos adecuados. La radioterapia está a menudo contraindicada en estos casos. También representan un escenario similar los tumores en extremidades u otras localizaciones, que presenten invasión de estructuras profundas como tendones, y que conllevan cirugías excesivamente mutilantes como la amputación.
La discusión de estos casos con oftalmólogos, otorrinolaringólogos y otros especialistas es básica para ofrecer la mejor opción al paciente. En la decisión deberá tenerse en cuenta pruebas de imagen prequirúrgicas y el estado general del paciente. En caso de decidirse por la cirugía, la CMM debería de considerarse de elección.
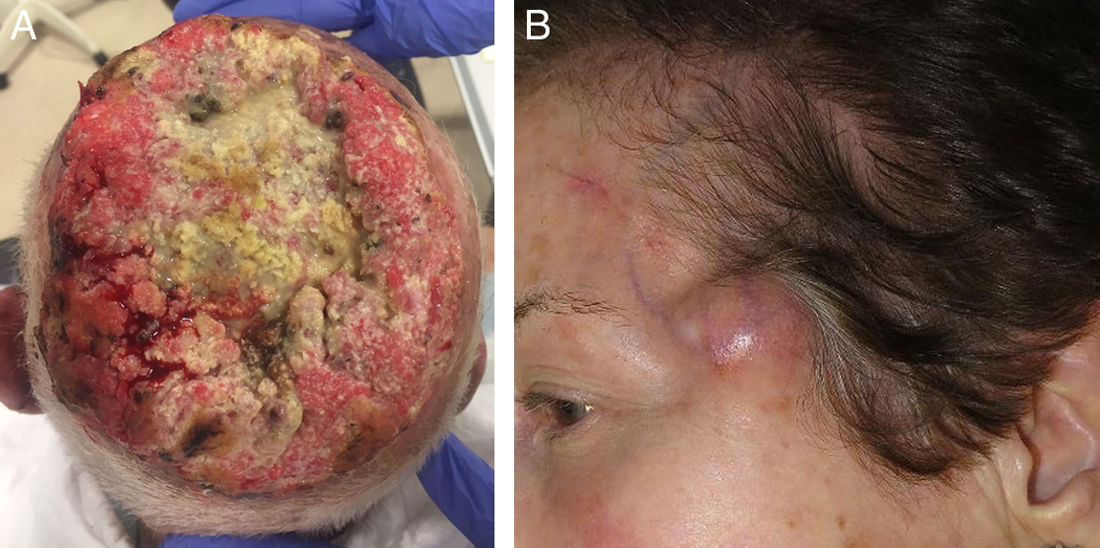
Afectación ósea y más allá del huesoLa afectación ósea es un factor de mal pronóstico reconocido en los principales sistemas de estadificación, por ser un factor de riesgo de recurrencia, de progresión de la enfermedad y de mortalidad, por sí solo supone un estadio T4 en la AJCC6 y un T3 en la BWH7. Pero, más allá de esto, la resección o irradiación del hueso a veces no es posible y en algunos casos, como pasa con los tumores del cuero cabelludo, pueden invadirlo y dar lugar a invasión intracraneal, lo que imposibilita o hace muy difícil el tratamiento quirúrgico o radioterápico curativo10. En estos casos las opciones curativas son muy limitadas y es fundamental el abordaje multidisciplinar (fig. 1a).
a) Varón de 98 años con gran carcinoma escamoso cutáneo, afectando todo el cuero cabelludo con invasión ósea que afecta la totalidad de la calota craneal.
b) Mujer con carcinoma escamoso cutáneo operado en frente izquierda (véase la cicatriz) que a las pocas semanas de la cirugía desarrolló una satelitosis en forma de nódulo tumoral dérmico en sien izquierda.
La invasión perineural es un conocido factor de mal pronóstico de recurrencia y mortalidad, especialmente cuando invade nervios de gran diámetro (>0,1mm) o más profundos que la dermis. La invasión perineural no es un tipo de invasión linfática ni hemática, sino que es una extensión directa del tumor primario. Suele ser subclínica, aunque algunas veces da lugar a síntomas neurológicos (parestesias, dolor, parálisis…), en estos casos se recomienda realizar una resonancia magnética previa a la cirugía. El nervio trigémino, el nervio facial y sus ramas suelen ser los más frecuentemente afectados. A pesar de ser una situación contemplada en los sistemas de estadificación, sigue siendo infradiagnosticada y sigue suponiendo un reto terapéutico. No es infrecuente que debido a la diseminación perineural, la resección sea incompleta por imposibilidad de seguir con la cirugía a cierta profundidad o por posibles diseminaciones no detectadas. Por este motivo se suelen debatir opciones como añadir un margen quirúrgico de seguridad, pese a obtener márgenes negativos en CMM o administrar radioterapia adyuvante11.
Ubicaciones anatómicas complejasLa ubicación anatómica del tumor es un factor de riesgo de recurrencia y metástasis. Se consideran zonas de bajo riesgo las extremidades y el tronco. En cambio, son de alto riesgo la cabeza y el cuello (especialmente zona H de la cara), genitales, mucosas, orejas, localización pretibial, manos y pies4. La CMM puede disminuir la tasa de recurrencia. Sin embargo, existen localizaciones donde sigue siendo complicado alcanzar la curación con un tratamiento quirúrgico único. Un ejemplo de ello es la uña. En esta localización, las tasas de recurrencias descritas, a pesar de ser tratadas con CMM, se describen superiores al 20%12 (mucho más altas que el 0-4% descrito en otras localizaciones). Esta alta tasa de recurrencia podría explicarse por dos hipótesis no excluyentes entre ellas: 1) la dificultad anatómica de esta área concreta, 2) que la etiología detrás de estos tumores fuera la infección por el virus del papiloma humano y que la persistencia de células no tumorales, pero infectadas por este virus causara su recurrencia12. En este sentido son necesarios estudios para confirmar el posible rol del virus del papiloma humano y con ello plantear nuevas estrategias de prevención y tratamiento. El carcinoma escamoso del pene también presenta particularidades etiológicas (fimosis, tabaquismo, virus del papiloma humano, enfermedades inflamatorias crónicas como el liquen escleroso…) que influyen en la recurrencia de este y que condicionan las estrategias terapéuticas y profilácticas. Esta localización tiene una alta tasa de recidiva y progresión regional. La CMM evitaría cirugías mutilantes sin afectar los resultados, sin embargo el abordaje conjunto con urología es fundamental13.
Hidrosadenitis supurativa concomitante u otras enfermedades inflamatorias crónicasLos CEC que se desarrollan en áreas afectas por enfermedades inflamatorias crónicas como la hidrosadenitis supurativa (otros ejemplos serían enfermedades como el liquen plano o tumores que asientan en zonas irradiadas, en las ostomías o en pacientes con epidermólisis ampollosa congénita) suelen suponer un reto terapéutico. En primer lugar, es frecuente que exista un retraso diagnóstico, por lo que no es extraño encontrarse frente a tumores localmente avanzados. En segundo lugar, asientan sobre una piel dañada por la patología de base, lo que implica que las complicaciones posquirúrgicas en la cicatrización como las dehicencias serán más frecuentes. La piel suele ser menos elástica y puede presentar fibrosis que dificulte cierres y colgajos, además, muchas veces la piel no será tributaria de irradiación. Esta piel inflamada ejerce de campo de cancerización, por lo que a veces, a pesar de tratar debidamente el tumor, existan recurrencias. Por último, la hidrosadenitis supurativa causa trayectos fistulosos donde el tumor encuentra un plano de progresión ideal, por lo que frecuentemente el tumor tendrá una extensión local mayor a la imaginada, hecho que dificulta mucho su exéresis. Estas fístulas pueden ser profundas y estar en relación con estructuras proctorrectales y urogenitales, que pueden verse comprometidas por el tumor o la cirugía.
Para abordar este escenario es imprescindible el alto nivel de sospecha en el cribado de estos pacientes para una detección lo más precoz posible, así como optimizar el tratamiento de la enfermedad de base para prevenir la aparición de nuevos tumores. En segundo lugar, una vez nos enfrentemos a un tumor de este tipo, es importantísimo realizar pruebas de imagen para planificar la cirugía y realizar un abordaje quirúrgico conjunto con el especialista en cuestión (cirujano general, urólogo, ginecólogo…)14.
Exéresis incompletas o recidivas en colgajosLa aparición de una recidiva sobre un colgajo o la exéresis con márgenes afectos de un tumor cuyo defecto ha sido reconstruido mediante un colgajo sigue siendo un escenario relativamente frecuente a la vez que difícil de abordar. En primer lugar, la recidiva en sí es un factor de mal pronóstico y la exéresis incompleta puede ser debida a un tumor de difícil delimitación clínica. En segundo lugar, es difícil saber dónde persiste el tumor en caso de márgenes afectos y, en los casos de recidiva, el tumor suele encontrar algún plano de diseminación por las cicatrices del colgajo y/o tener tiempo de progresión largo debido a recidivas en profundidad difíciles de detectar clínicamente. Por último, las reconstrucciones pueden ser dificultosas dado que en ocasiones hemos «gastado» opciones reconstructivas previamente.
Es opinión de los autores, que para prevenir que esto suceda, debería realizarse CMM para analizar el 100% de los márgenes del tumor siempre que se vaya a realizar un colgajo para reconstruir un defecto de exéresis tumoral. Aun así, algunos casos (aunque muchos menos) tratados con CMM presentarán recidivas sobre colgajos. Estos casos, se deberían abordar siempre con otra CMM, preferentemente en diferido.
Satelitosis o metástasis en tránsitoLas satelitosis o metástasis en tránsito representan uno de los grandes escenarios olvidados del CEC. Consisten en lesiones no epidérmicas originadas entre el tumor primario y los primeros ganglios linfáticos que drenan el tumor. Se ha demostrado que las satelitosis son un factor de riesgo independiente de mal pronóstico en CEC y que en términos de recurrencia y supervivencia específica de la enfermedad, los pacientes con satelitosis por CEC tienen resultados clínicos comparables al hecho de tener metástasis ganglionares15. Aunque son infrecuentes, cuando en la práctica clínica se encuentra un paciente con satelitosis, representa un reto diagnóstico y terapéutico dado que se omiten a los principales sistemas de estadificación y guías clínicas de uso habitual4–7. Recientemente se ha demostrado que no todas las satelitosis son iguales y que un tamaño ≥ 2cm y la presencia de> 5 lesiones confieren un riesgo aumentado de recaída tumoral y mortalidad específica16.
Incorporar las satelitosis a los próximos sistemas de estadificación y guías clínicas, tal y como ya sucede con el melanoma y el carcinoma de células de Merkel, sería un primer paso para poder iniciar ensayos clínicos y otros estudios para valorar cuál es la estrategia terapéutica óptima en cada caso (fig. 1b).
Múltiples tumores simultáneosLa presencia de múltiples tumores simultáneos no traduce una enfermedad extendida o metastática como las satelitosis, pero comparte con ellas el hecho de tener múltiples lesiones. En algunos casos, debido al número, tamaño, localización o rápida aparición de nuevos tumores, se dificulta o se imposibilita el tratamiento con terapias convencionales.
Metástasis parotídeasEn países con alta incidencia de cáncer cutáneo como Australia, las metástasis por CEC son la primera causa de malignidad de esta glándula salivar. Sin embargo, esta situación no está contemplada en los principales sistemas de estadificación. Mientras que la afectación de la glándula es posible por invasión local, la mayoría de las veces se ve afectada por metástasis nodales intraparotídeas. En los sistemas de estadificación de uso habitual6,7, se suele equiparar la metástasis parotídea a la ganglionar cervical, a pesar de varios estudios que proponen sistemas de estadificación alternativos que clasifican este escenario aparte, por presentar características pronósticas propias. El más conocido es el estudio de ÓBrien17, que diferencia en su clasificación las metástasis parotídeas de las ganglionares cervicales, además de establecer 3 niveles de gravedad que se correlacionan con el pronóstico. A pesar de algunos resultados controvertidos, esta clasificación se ha corroborado en otros estudios a lo largo de los años. Sin embargo, los sistemas de estadificación actuales siguen sin dar la distinción y particularidad que merece esta situación, conllevando un manejo y tratamiento subóptimo de estos pacientes.
Metástasis ganglionares extensasLos pacientes con metástasis ganglionares presentan por definición una enfermedad extendida. El tratamiento quirúrgico en las metástasis ganglionares puede ser curativo. Frecuentemente falla cuando las metástasis presentan un gran tamaño, un gran número de ganglios involucrados o extensión extracapsular y por eso en estos casos se suele añadir radioterapia6. Las linfadenectomías presentan complicaciones posquirúrgicas en más de un 55% de los casos, como infecciones, seromas, dehicencias o linfedemas. A pesar de recibir cirugía y radioterapia, que es lo que recomiendan las guías, las tasas de recurrencia son en estos casos generalmente entre el 20% y el 35% y la supervivencia libre de enfermedad a 5 años y la supervivencia específica de la enfermedad 59%-83% y el 63%-83%, respectivamente4.
Pacientes de edad muy avanzada o muy frágilesEl CEC aparece preferentemente en pacientes de edad avanzada, por lo que no es infrecuente encontrar en práctica clínica pacientes frágiles o con comorbilidades que contraindican la cirugía y donde la radioterapia se considera paliativa. El envejecimiento se asocia a mayor fragilidad, riesgo de dependencia y menor autonomía. El paciente frágil tiene peor supervivencia y tolera peor los tratamientos estándar. Algunas sociedades de oncología geriátrica recomiendan que los pacientes de edad avanzada con cáncer reciban una evaluación geriátrica para detectar problemas no identificados en la exploración física rutinaria o la historia médica, con el fin de predecir supervivencia y asistir a la toma de decisiones terapéuticas18. La valoración geriátrica es una herramienta multidimensional e interdisciplinar que lleva a identificar factores funcionales, nutricionales, cognitivos, psicológicos, de soporte social y de comorbilidad. La evaluación geriátrica completa puede ser útil en oncología, pero requiere de visitas y test complejos y largos. En este sentido, existen herramientas rápidas de cribado en geriatría más allá del ECOG, tales como el G8 y el Vulnerable Elders Survey-13, que se han mostrado útiles para identificar a pacientes en necesidad de evaluación adicional19. En los casos en los que la puntuación es de fragilidad se recomienda una valoración geriátrica integral, que valore la función física, mental, nutricional, de comorbilidad y función social. Si se confirma fragilidad tras esta valoración integral puede ser recomendable una actuación que permita la reversión a estados no frágiles y considerar tratamientos no quirúrgicos o mínimamente agresivos. Además, el Charlson Comorbidity Index permite predecir la mortalidad a corto o a largo plazo según las comorbilidades del paciente, se han validado sus resultados en algunas poblaciones con cáncer. Se deberían validar sus resultados en pacientes con CEC20.
ConclusionesEl presente artículo identifica y analiza los principales escenarios en los que el CEC es de difícil tratamiento con terapias locales convencionales, y que, por tanto, no existe un claro consenso en su manejo terapéutico. Las pruebas de imagen prequirúrgicas, la CMM, la discusión en comités multidisciplinares y la personalización del tratamiento son elementos comunes para un abordaje óptimo de los distintos escenarios. La comunidad científica debería centrar sus esfuerzos en considerar estos escenarios en las guías clínicas, realizar estudios para optimizar su manejo e incluir estos pacientes en los ensayos clínicos (especialmente ahora que nos encontramos frente la nueva era de terapias intralesionales) para poder ofrecer la mejor opción terapéutica a estos pacientes.