La ecografía cutánea es una técnica dermatológica de diagnóstico por imagen basada en la interacción de los ultrasonidos de alta frecuencia con la piel. Su carácter no invasivo, rápido y accesible hace que sus aplicaciones en la clínica sean cada vez más amplias, tanto en oncología cutánea como en afección inflamatoria o dermatología estética. En este artículo se revisan los principios de la técnica y las aplicaciones en los distintos ámbitos de la dermatología.
The interaction of high-frequency ultrasound waves with the skin provides the basis for noninvasive, fast, and accessible diagnostic imaging. This tool is increasingly used in skin cancer and inflammatory conditions as well as in cosmetic dermatology. This article reviews the basic principles of skin ultrasound and its applications in the different areas of dermatology.
La ecografía cutánea es la técnica diagnóstica de imagen no invasiva que utiliza las propiedades físicas del ultrasonido para el estudio de la piel y los anejos1.
Los ultrasonidos de alta frecuencia (>7MHz) y de muy alta frecuencia (>20MHz) son los apropiados para el diagnóstico detallado de la piel, ya que proporcionan una resolución y profundidad adecuadas para discriminar las estructuras cutáneas con claridad2.
La aplicación del efecto doppler en ecografía cutánea permite el estudio de los fenómenos fisiológicos y patológicos asociados al aumento de flujo local como la inflamación y la neoangiogénesis3.
La introducción de la ecografía cutánea al campo específico de la dermatología es relativamente reciente y, aunque se requieren más estudios para consolidar esta técnica en la práctica clínica habitual, ya existen evidencias sobre su utilidad en las diversas áreas de conocimiento dermatológico4.
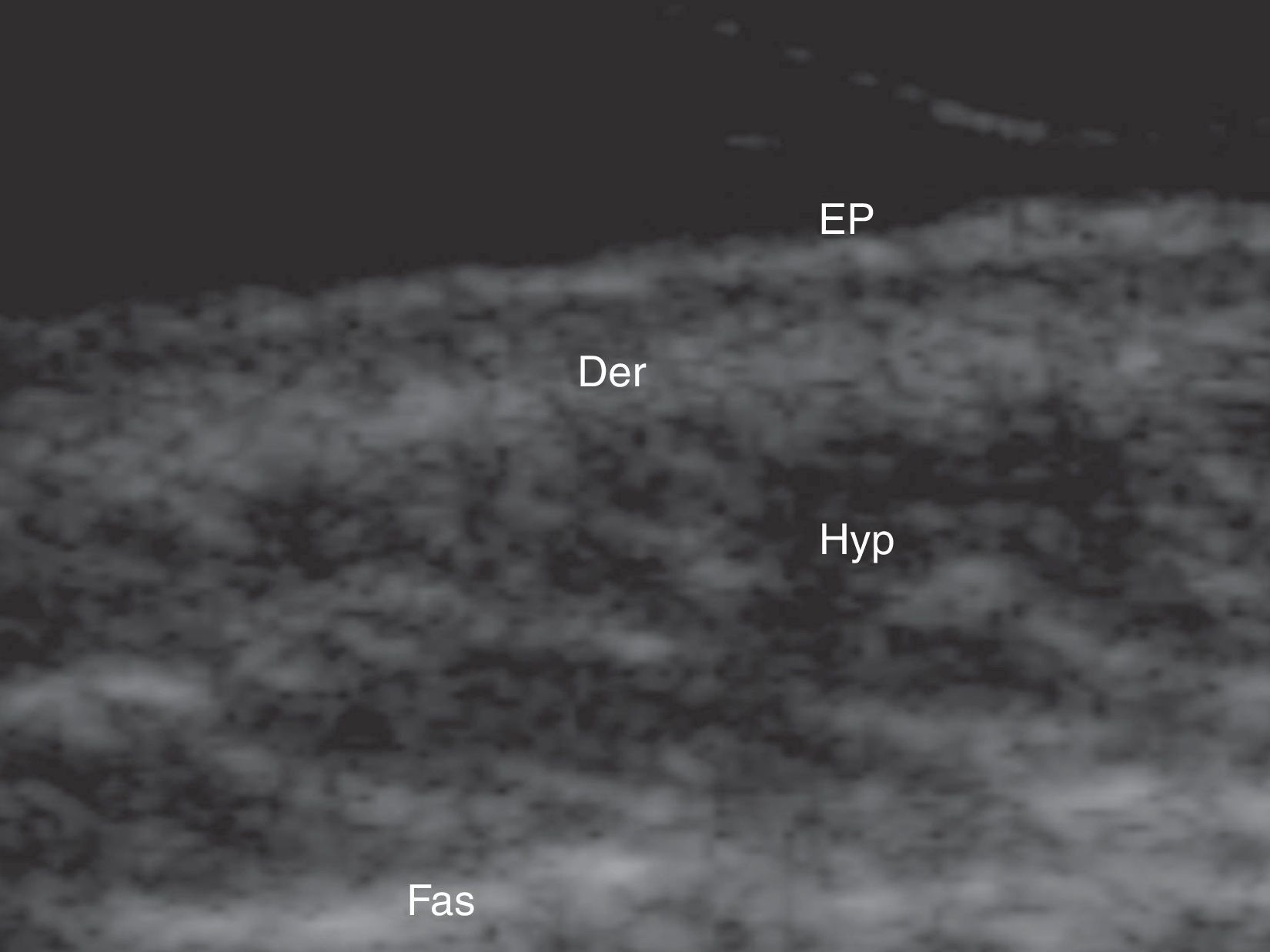
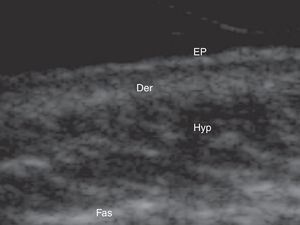
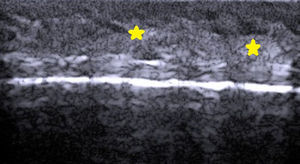
Ecografía cutánea de la piel normal y los anejosLa ecoestructura de la piel está constituida, en modo B (bright) por una serie de líneas y bandas en distintos tonos de gris, negro y blanco, que representan los distintos estratos cutáneos5 (fig. 1).
La epidermis es una línea hiperecoica que, en algunas localizaciones como la piel acral, es doble6.
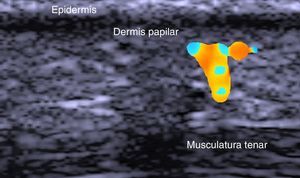
La dermis se identifica como una banda discretamente menos ecogénica que la epidermis. En ocasiones se puede apreciar una zona más hipoecoica superficial que se corresponde con la dermis papilar.
El tejido celular subcutáneo es el área ecográfica que queda bajo la banda dérmica y está constituida por un entramado de líneas hiperecoicas que se corresponden con los septos. En su interior se encuentran áreas hipoecoicas que se corresponden con los lobulillos grasos1.
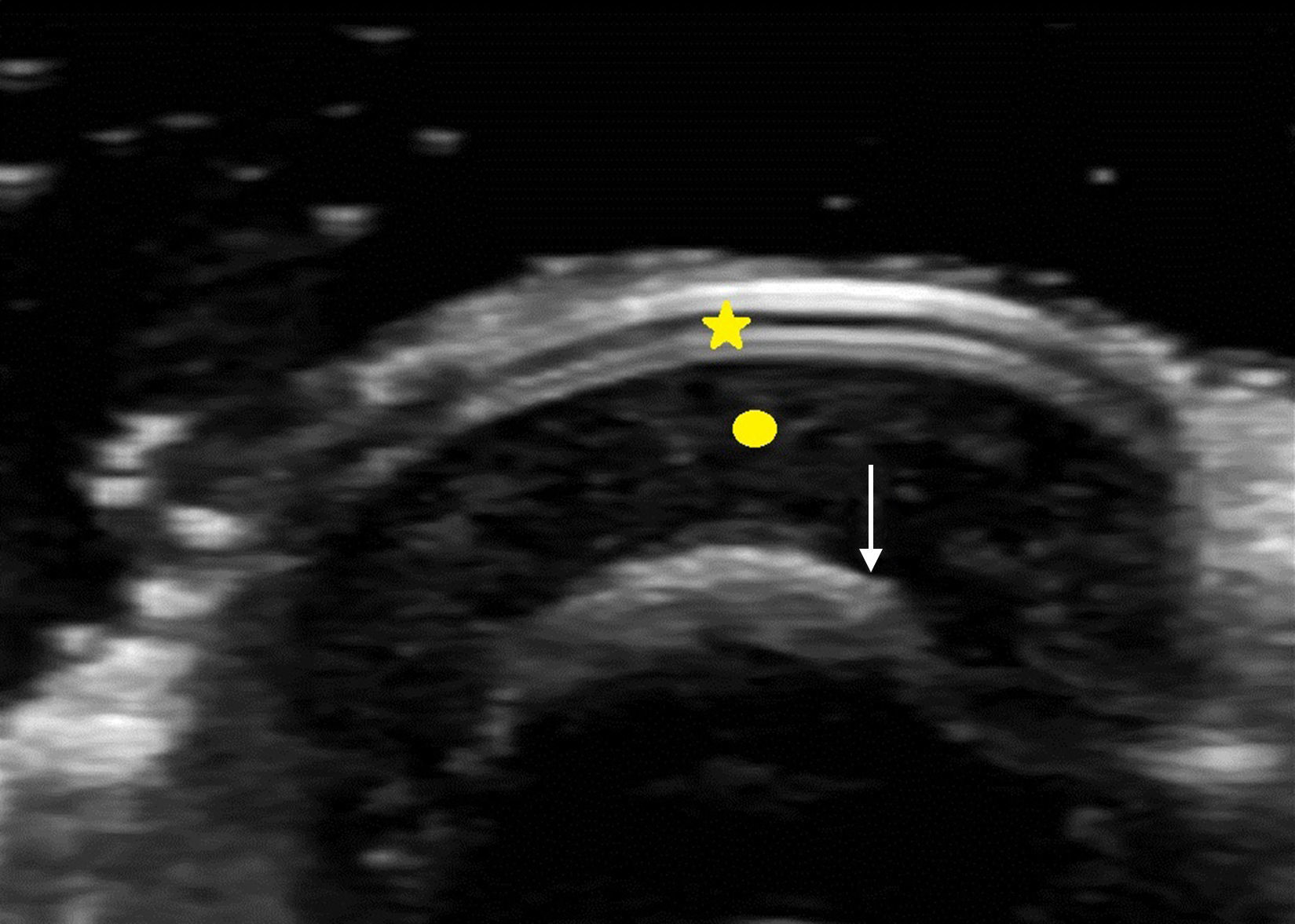
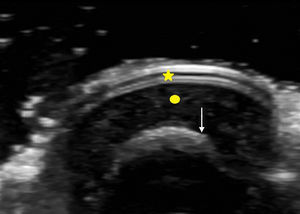
La uña desde el punto de vista ecográfico se identifica por una tabla ungueal hiperecoica y doble que asienta sobre el lecho ungueal hipoecoico. La uña guarda una íntima relación con la falange distal, que se distingue como una línea hiperecoica continua7 (fig. 2).
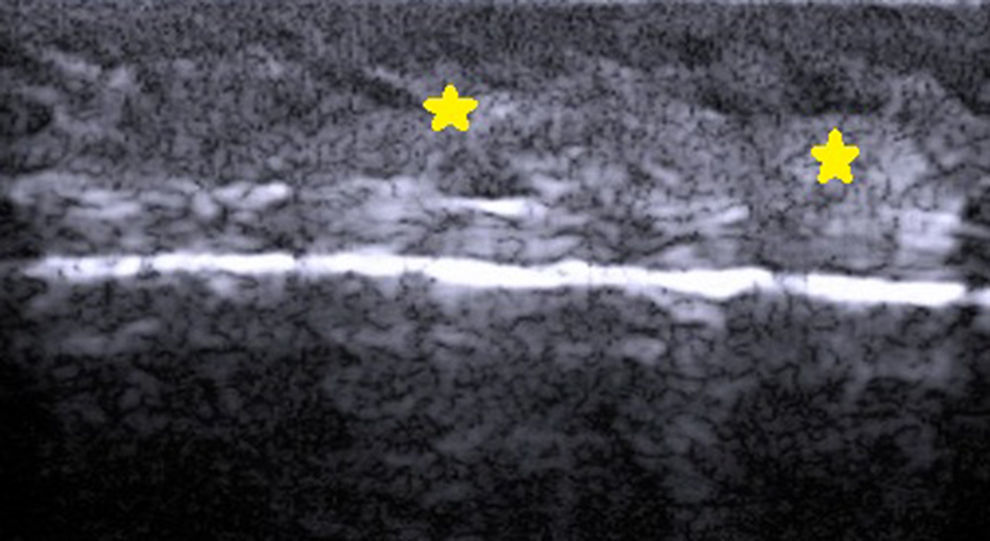
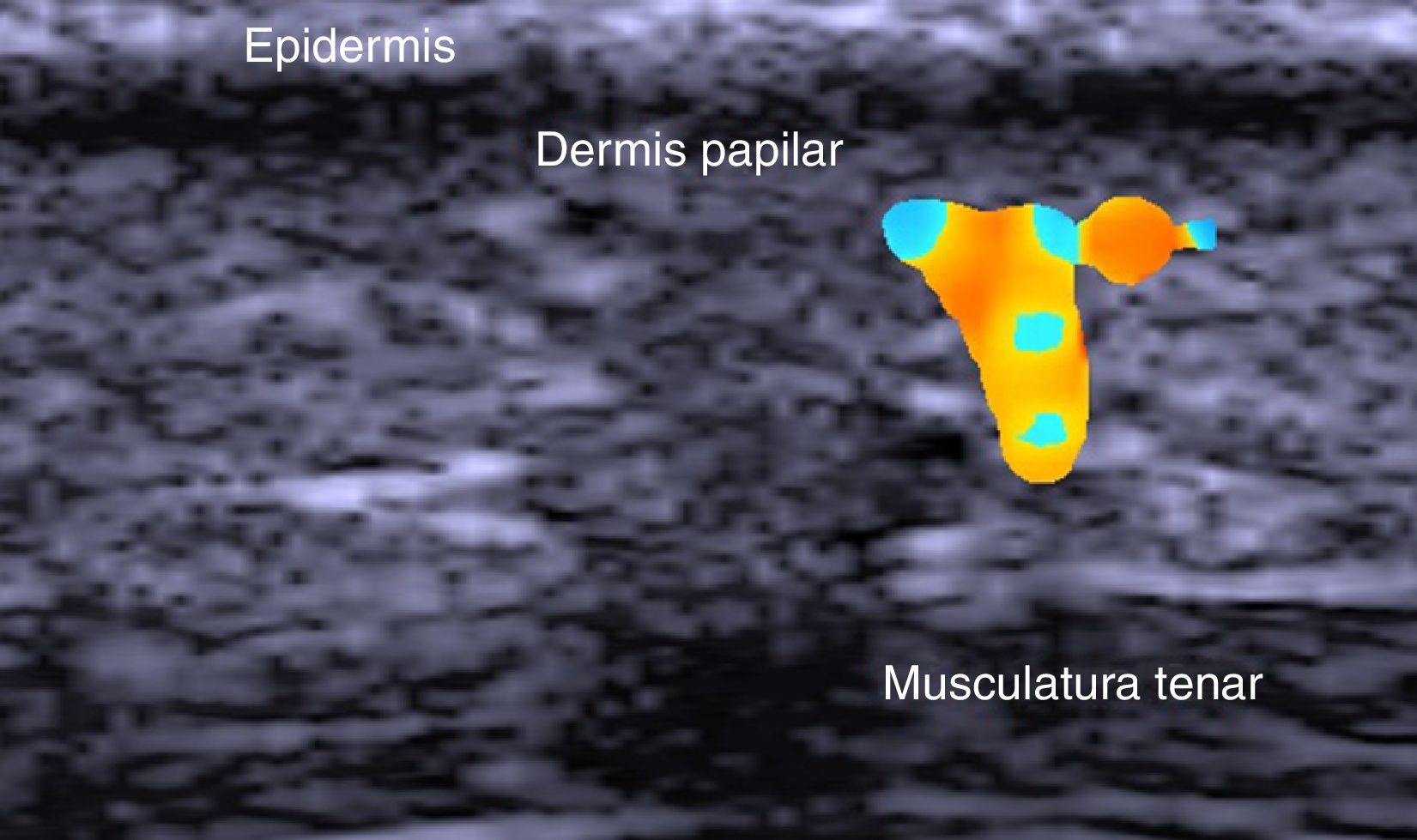
El tallo piloso es una estructura hiperecoica doble, similar a la tabla ungueal, que se introduce de manera oblicua en la epidermis y la dermis. Ya en la dermis se aprecia como líneas hipoecoicas oblicuas y en la unión dermo-subdérmica como áreas ovaladas mal definidas hipoecoicas8 (fig. 3).
Ecografía en oncología cutáneaTumores cutáneos benignosLas tumoraciones subcutáneas suponen en ocasiones un reto desde el punto de vista del diagnóstico. Cabe esperar que la ecografía mejore la exploración clínica (inspección y palpación) al hacer evidentes las estructuras cutáneas profundas.
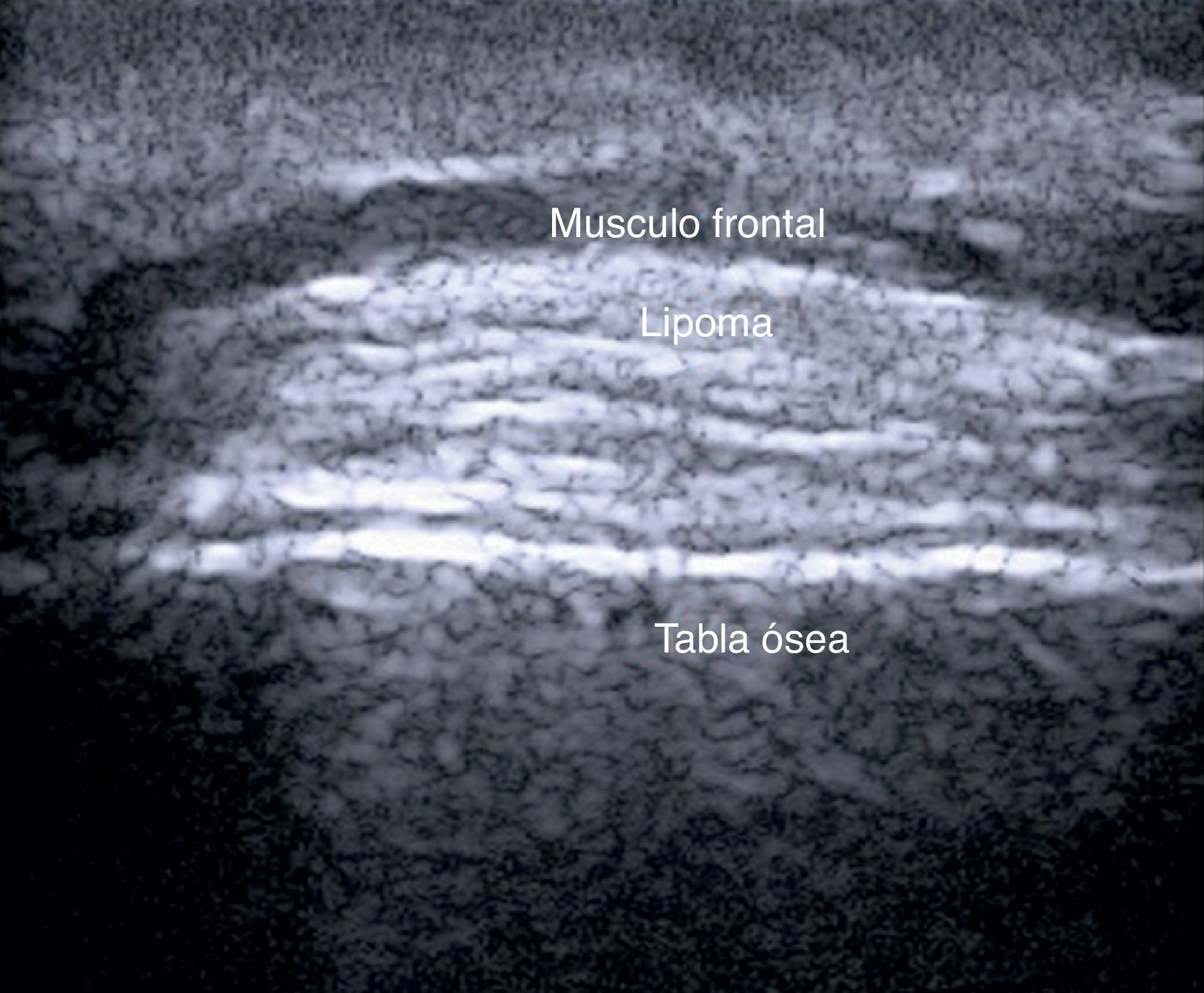
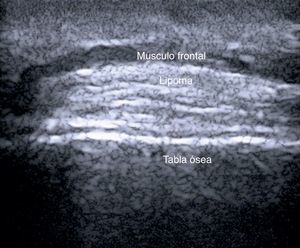
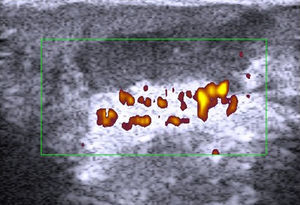
En el estudio de Kuwano et al.9 en 183 lesiones benignas subcutáneas estudiadas con ecografía de manera preoperatoria, la palpación ayudó al diagnóstico del 54% de los lipomas y en el 93,5% de los quistes. La ecografía mejoró la sensibilidad del diagnóstico clínico al 88,1% (p<0,01) y al 99,3% (p<0,05) de los lipomas (fig. 4) y de los quistes respectivamente.
En el estudio de Wortsman et al., con 4.388 lesiones cutáneas estudiadas por ecografía cutánea10, el diagnóstico clínico fue correcto en el 73% de los casos y con el uso de la ecografía cutánea se alcanzó el 97% de diagnósticos correctos (p>0,001)10.
Estos estudios apuntan a que la ecografía cutánea mejora el diagnóstico clínico preoperatorio de las lesiones benignas subcutáneas11,12
Cáncer cutáneo no melanomaEn el cáncer cutáneo no melanoma, en el carcinoma basocelular y en el carcinoma epidermoide el grado de invasión local y de estructuras vecinas es relevante a la hora de plantear un tratamiento adecuado desde el punto de vista oncológico, y para evitar lesionar estructuras adyacentes no afectadas.
La correlación entre la medida de la profundidad del tumor en la pieza histológica y su correlación con el grosor medido en la ecografía ha sido estudiada por varios autores. Crisan et al.13, con un equipo de 20MHz, observan correlaciones cercanas al 94%.
Estos estudios de medición son controvertidos14, ya que si se considera como gold standard la medición histológica, la extirpación y la fijación de las muestras conlleva siempre una retracción que tampoco coincide totalmente con la medida del tumor in vivo15–18.
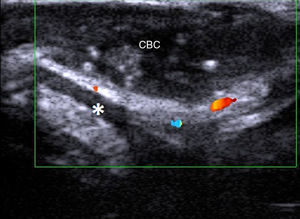
En regiones estéticamente sensibles como la cara, la Dra. Wortsman, en un estudio con 25 pacientes con carcinomas basocelulares en esta región (fig. 5) y utilizando una sonda lineal de 7-15MHz, encuentra una correlación de la profundidad histológica con el grosor tumoral en la ecografía de 0,919. Analiza también los casos en los que hubo una mala correlación y los atribuye a zonas con hiperplasias sebáceas o inflamación peritumoral. En este trabajo también se evalúa de manera secundaria la presencia o no de afectación cartilaginosa. La ecografía la descartó en todos los casos, dato que fue confirmado histológicamente. La misma Dra. Wortsman en un artículo reciente posiciona la ecografía cutánea como técnica de imagen de primera línea en el manejo del carcinoma basocelular facial20.
En cuanto a si la ecografía podría ser de ayuda en la cirugía de Mohs, 2 estudios abordan este tema. Marmur et al.21 realizan en 20 pacientes con carcinoma basocelular y espinocelular, utilizando una sonda de 20MHz, mediciones prequirúrgicas y las comparan con los márgenes quirúrgicos del primer estadio de la cirugía de Mohs. No existieron diferencias entre las medidas obtenidas por el ecografista de manera prequirúrgica y los márgenes clínicos del cirujano, aunque en algún caso se detectaron áreas de carcinoma basocelular satélite no diagnosticadas desde el punto de vista clínico. En otro estudio Jambusaria-Pahjlahani et al.22 recogen 100 pacientes con carcinomas basocelulares y espinocelulares de diversa localización comparando los márgenes del cirujano, los márgenes ecográficos obtenidos por un técnico-ecografista y los márgenes histológicos teñidos por congelación. La correlación ecográfica-histológica a la hora de predecir correctamente los márgenes tuvo una sensibilidad del 32% con una especificidad del 88%. Los autores recomiendan que la técnica ha de ser refinada antes de establecer conclusiones al respecto, así como el diseño del estudio en términos de homogeneidad y criterios ecográficos.
La profundidad de estos tumores, determinada por ecografía, puede ser también de utilidad a la hora de clasificar a los pacientes para tratamientos no quirúrgicos. En un estudio reciente Smucler et al.23 asignan a pacientes con carcinomas basocelulares, en función de su profundidad, diversos tratamientos no quirúrgicos (láser, terapia fotodinámica [TFD], láser+TFD). En los pacientes seleccionados con tumores de más de 3mm de grosor a los que aplicaron láser de CO2 para disminuir su grosor pre TFD consiguen tasas de eliminación del tumor del 100%.
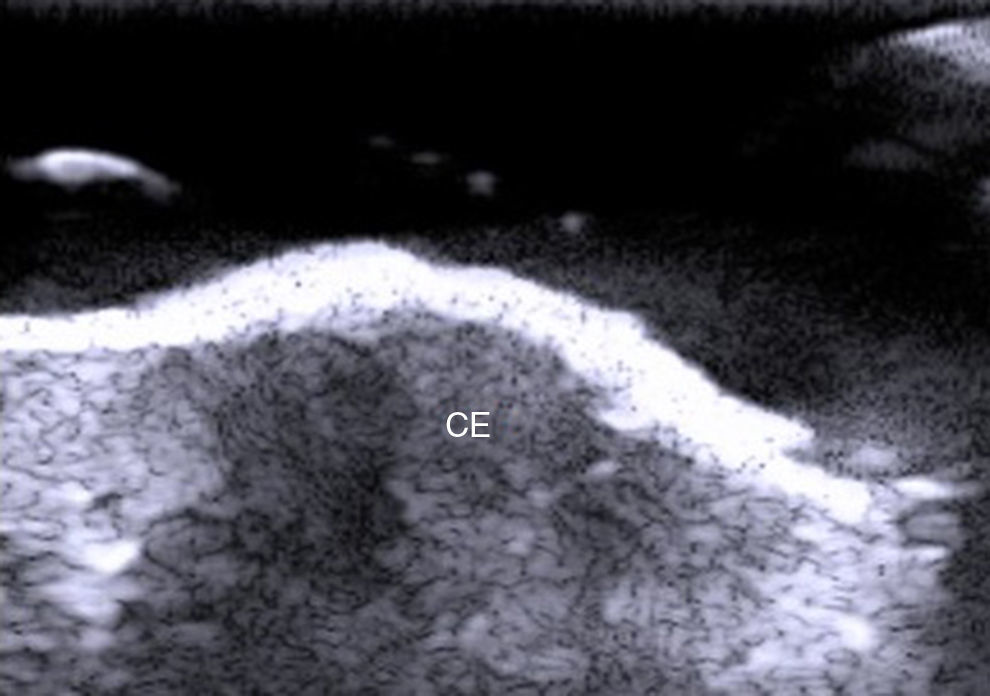
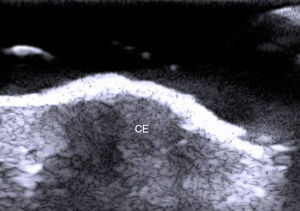
Desde el punto de vista ecográfico el carcinoma epidermoide ha sido menos estudiado de manera aislada debido a que la queratina que produce provoca un artefacto en sombra acústica posterior, y además los bordes de este tumor suelen presentar una morfología más irregular que el carcinoma basocelular2 (fig. 6). Este tumor tiene un potencial metastático y de recidiva, sobre todo en las variantes de alto riesgo24–26.
El estudio de las adenopatías mediante ecografía permite detectar metástasis regionales en el carcinoma epidermoide27. Sin embargo, en los estudios realizados sobre carcinomas epidermoides en el territorio de la cabeza y el cuello los carcinomas epidermoides cutáneos suelen estar junto con otros tumores de mayor agresividad biológica, como los del territorio maxilofacial27. En el único estudio preliminar28 con 47 pacientes con carcinoma epidermoide cutáneo de cabeza y cuello los autores no encuentran utilidad en realizar una ecografía en el postoperatorio a los pacientes con cáncer de piel para establecer un pronóstico en pacientes con grados histológicos Broders 3 y 4. Quizás nuevas técnicas ecográficas, como la elastografía, permitan mejoras a la hora de detectar estadios muy iniciales de afectación adenopática29.
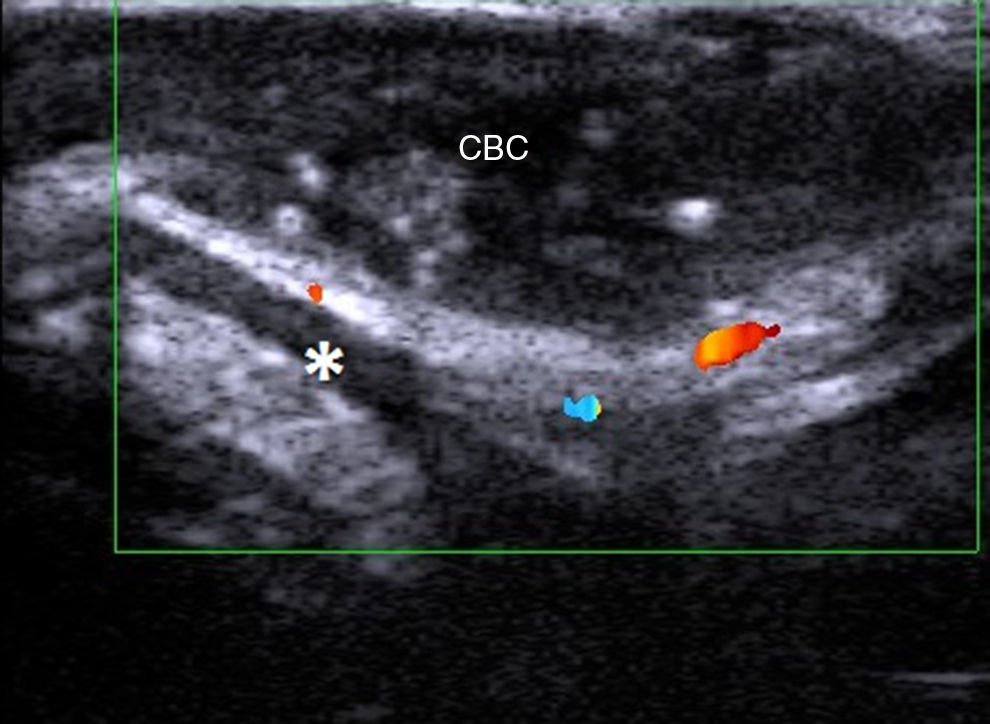
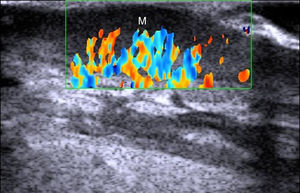
MelanomaEn el melanoma tanto el índice de Breslow como la presencia de metástasis locales o a distancia permiten establecer un pronóstico del paciente y ofrecer el tratamiento más adecuado30 (fig. 7).
En la correlación entre el «Breslow ecográfico» y el Breslow histológico influyen 2 factores fundamentales: en primer lugar el Breslow histológico medio de los melanomas a estudio y en segundo lugar el equipo ecográfico con el que se realice la medición31. Aunque existen numerosos trabajos al respecto la heterogeneidad de equipos y criterios con que se haga la medición son un inconveniente a la hora de extraer conclusiones robustas32–34.
Recientemente, el grupo del Hospital Costa del Sol de Marbella35 ha publicado un trabajo en el que en 79 melanomas cutáneos, utilizando una sonda de 15Mhz, se obtiene un Breslow medio de 0,8mm y se compara con el obtenido en el examen histológico, encontrándose una correlación ecográfico histológica moderada en melanomas finos (menores de 1mm de Breslow) y menor en melanomas gruesos. A la hora de diferenciar los melanomas IB las características de la prueba demostraron una sensibilidad del 82%, una especificidad del 80%, un valor predictivo positivo del 54% y un valor predictivo negativo del 94%.
En el metaanálisis de Machet36, donde se recogen 14 estudios previos de correlación ecográfico-histológica, se obtienen correlaciones de alrededor de 0,9. En 7 estudios (869 pacientes) en los que se encuentran los datos completos de los pacientes se intenta averiguar si los márgenes proporcionados por la ecografía predicen los márgenes quirúrgicos reales en estos pacientes. En el 72% de los casos la valoración ecográfica hubiera llevado a una actuación quirúrgicamente correcta.
En el estudio de Music et al.37, realizado en 70 melanomas, se intenta definir si la ecografía es capaz de distinguir melanomas mayores de 1mm empleando sonda de 12-15MHz. La sensibilidad, especificidad, valor predictivo positivo y negativo fueron respectivamente 92, 92, 95 y 81%, con lo que concluyen que la ecografía cutánea podría distinguir con fiabilidad los melanomas mayores de 1mm de los menores de 1mm.
Las características ecográficas de las adenopatías (ratio longitud/anchura<2, centro hipoecoico, ausencia de vasos en los hilios) permiten diferenciar las adenopatías inflamatorias de las afectadas por los melanomas con una sensibilidad del 100% y una especificidad del 96%38.
El ganglio centinela es una técnica que permite establecer la afectación del lecho ganglionar preferente del melanoma. Es una técnica que requiere inyección de isótopos radioactivos y cirugía para extirpar dicho ganglio. La ecografía no ha demostrado ser superior al ganglio centinela en la evaluación preoperatoria de pacientes con melanoma39. En un estudio del grupo de Catalano40, que intenta comparar ambas técnicas en 623 pacientes, se demuestra que la ecografía tiene una sensibilidad del 15%, una especificidad del 100%, un valor predictivo positivo del 100% y un valor predictivo negativo del 87%.
Sin embargo, en un estudio en 707 pacientes con melanoma, en los que se realizó ecografía preoperatoria, los pacientes que no presentaron adenopatías patológicas desde el punto de vista ecográfico presentaron una menor carga tumoral y una mayor supervivencia en comparación con los pacientes con adenopatías patológicas41.
Comparando la PET y la ecografía para detectar el ganglio centinela, en un estudio limitado a 123 pacientes con melanoma se demostró que la ecografía fue capaz de detectar 2 de los 19 ganglios centinelas positivos, mientras que la PET no detectó ningún ganglio centinela afecto42.
El estudio doppler de los melanomas es relevante. El grupo de Lassau43 demostró que la presencia de neovasos predice la capacidad de metástasis del melanoma. En un reciente estudio realizado por Srivastava44 se demostró, utilizando una sonda de 10MHz, que la presencia de neovasos y un flujo pico elevado son factores predictores de supervivencia a 15 años.
La aplicación de los nuevos contrastes ecográficos45 y la elastografía46 probablemente contribuyan a la mejor caracterización y detección de las adenopatías patológicas. Estas técnicas, en especial la cuantificación del flujo mediante contrastes ecográficos, permite predecir la respuesta a quimioterapia en estadios avanzados47.
Ecografía de otros tumores cutáneosAcerca de la ecografía en otros tumores como el dermatofibrosarcoma protuberans48,49, el carcinoma de Merkel50,51 y el linfoma cutáneo52,53 existen series de casos de carácter fundamentalmente descriptivo.
Ecografía en enfermedad inflamatoria cutáneaLas manifestaciones ecográficas de la inflamación cutánea son2:
- •
Hipoecogenicidad de la dermis en la zona subepidérmica.
- •
Aumento de flujo local evidenciado mediante doppler.
- •
Hipoecogenicidad de los septos si la inflamación afecta al tejido celular subcutáneo.
- •
Hiperecogenicidad de los lobulillos grasos.
Estas características ecográficas nos permiten distinguir el grado y la extensión de cualquier proceso inflamatorio a nivel de la piel, el pelo o las uñas.
Enfermedad infecciosaEn las infecciones por el virus del papiloma humano la ecografía permite valorar la extensión de las verrugas plantares y realizar el seguimiento de su tratamiento54.
Una aplicación que ya es común en los departamentos de urgencias en Estados Unidos es la valoración de abscesos mediante ecografía. En la publicación del Departamento de Urgencias Pediátricas de Michigan55, la ecografía implicó un cambio de actitud (drenaje frente a no drenaje) en el 15% de los casos evaluados exclusivamente mediante clínica. La capacidad de diagnosticar abscesos ecográficamente es posible incluso con un mínimo entrenamiento56,57.
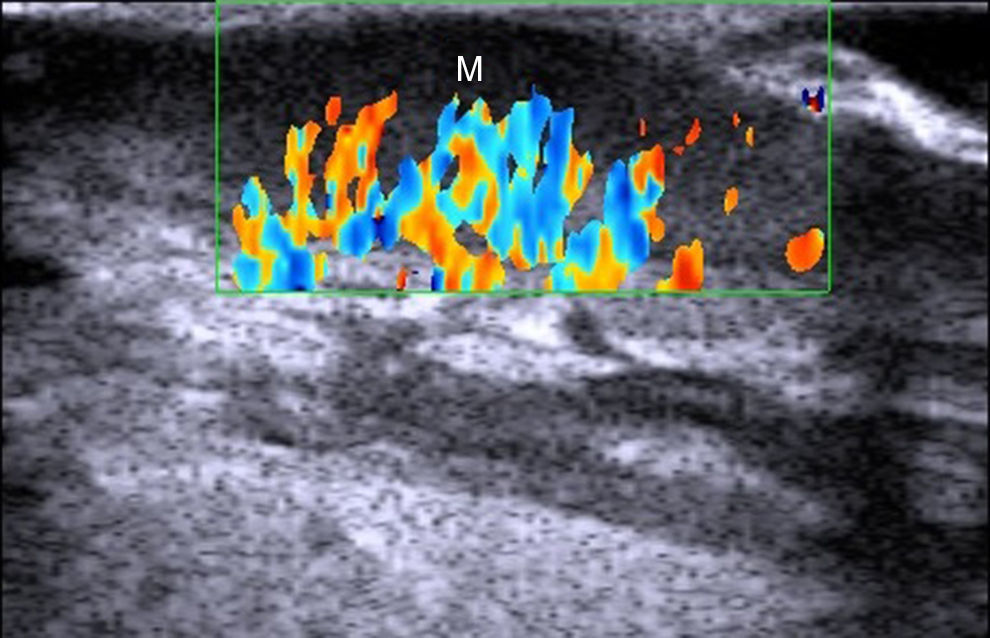
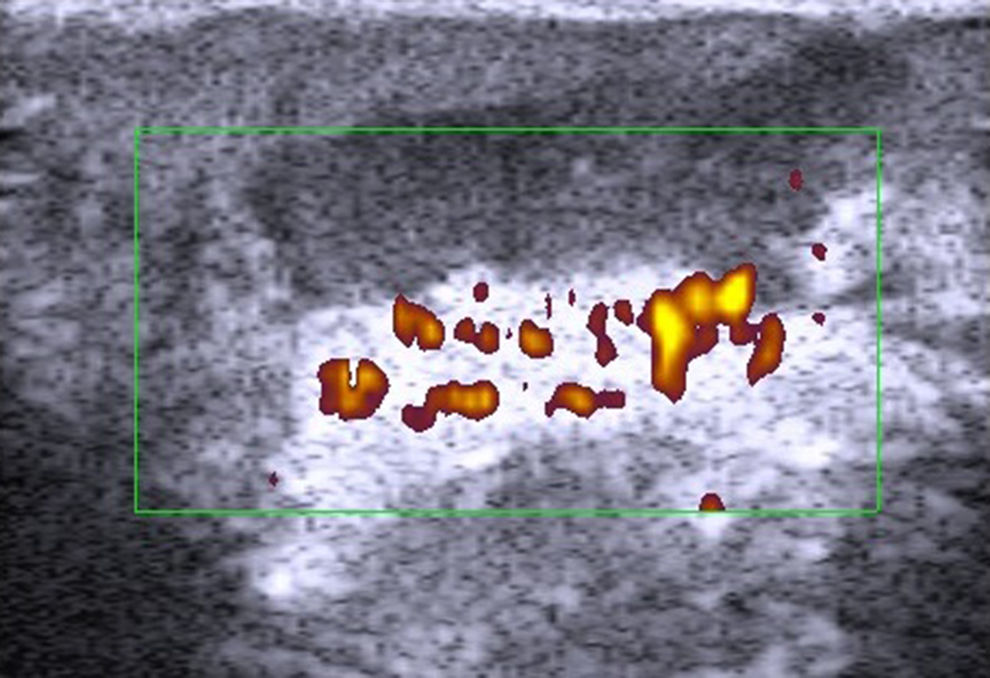
PsoriasisDesde el punto de vista ecográfico en la psoriasis encontramos un engrosamiento de la línea epidérmica, un aumento de la banda dérmica y la aparición de un área hipoecoica subepidérmica con aumento de flujo local (fig. 8)58.
Estos datos ecográficos, sobre todo el grosor de la banda dérmica, se correlacionan con la gravedad de la psoriasis medida con el PASI u otras escalas de valoración de gravedad/extensión59,60.
El efecto de los diversos tratamientos aplicados en la psoriasis, tanto tópicos61 como sistémicos59,62, se va a poder apreciar como variaciones en las características ecográficas previamente descritas.
En un estudio multicéntrico del grupo de ecografía de la Sociedad Española de Reumatología se observó que en pacientes tratados con infliximab hubo una disminución tanto en en el grosor dérmico como en las señales doppler de la dermis62.
En la psoriasis ungueal el grosor de la uña es mayor que en los pacientes sanos o con dermatitis atópica y se correlaciona con el NAPSI63. Esta afectación ungueal se correlaciona con la presencia de entesitis incluso de manera subclínica63.
A la hora de evaluar la inflamación sistémica en los pacientes con psoriasis el grupo de la Universidad de Granada64 demostró, sobre todo en aquellos que tienen afectación ungueal, que presentan un menor flujo en las arteriolas digitales como manifestación de un aumento de resistencias vasculares en comparación con los sujetos sanos. Estos hallazgos sugieren que la psoriasis puede ser un factor de riesgo independiente para daños microvasculares64.
Dentro del concepto de psoriasis como enfermedad inflamatoria sistémica se ha intentado evaluar mediante ecografía el riesgo cardiovascular de estos enfermos mediante el índice íntima-media carotídeo65,66. En un estudio piloto reciente67 en pacientes tratados con anti-TNF este índice íntima-media se incrementó. Las implicaciones de estas valoraciones ecográficas de la afectación inflamatoria sistémica aún deben ser aclaradas.
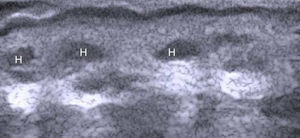
HidrosadenitisLa hidrosadenitis es una inflamación predominantemente subcutánea (fig. 9) que puede ser estudiada con ecografía en toda su extensión68. El grupo de la Dra. Wortsman69 recoge una serie de pacientes con hidrosadenitis y compara con controles sanos el grosor de la epidermis y de la dermis en las zonas afectadas. Se encuentra un aumento en el grosor dermoepidérmico y una menor ecogenicidad en los pacientes con hidrosadenitis. La ecografía permite detectar también lesiones subclínicas y fístulas ocultas69.
ColagenosisLa enfermedad que ha sido más estudiada desde el punto de vista ecográfico es la esclerodermia, ya que los tratamientos difieren en función de la fase evolutiva de la enfermedad (inflamatoria o de esclerosis)70. La publicación de la Dra. Wortsman71, que analiza 104 placas de morfea en 59 pacientes, demuestra que la ecografía tiene una sensibilidad del 100% y una especificidad del 98,4% a la hora de diferenciar la fase inflamatoria de la esclerótica. La ecografía detectó inflamación incluso en 5 pacientes con síndrome de Parry-Romberg71 en los que la inflamación no era clínicamente evidente. Estos mismos resultados se han intentado estandarizar para crear escalas semicuantitativas72 y poder valorar la eficacia de ciertos tratamientos como la fototerapia73.
Otras enfermedades inflamatoriasEn dermatitis atópica, en un estudio reciente de Polanska et al.74, se compara la ecografía cutánea de pacientes con dermatitis atópica con sus muestras histológicas. Los autores encuentran una correlación entre el grosor de la banda hipoecoica subepidérmica con los siguientes parámetros: hiperplasia epidérmica, paraqueratosis, espongiosis e intensidad de infiltrados inflamatorios. De esta manera la medición de la banda hipoecoica subepidérmica podría ser un marcador ecográfico de inflamación cutánea. La inflamación cutánea subclínica podría ser también evidente ecográficamente en áreas sin lesiones visibles75.
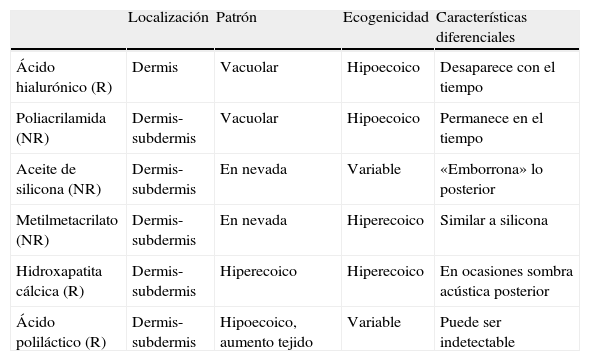
Ecografía en dermatología estéticaLa ecografía ha tomado una gran relevancia recientemente en la valoración de manera no invasiva de los implantes cutáneos y sus posibles complicaciones desde el punto de vista médico y médico-legal76–78 (fig. 10). Los distintos implantes presentan características ecográficas que permiten distinguir su naturaleza (tabla 1), así como las alteraciones y complicaciones (migración, trombosis, etc.)79 que en ocasiones surgen, tras la infiltración de estos materiales de relleno. Desde el punto de vista del envejecimiento cutáneo la ecografía permite, a través de la medición de la banda hipoecoica subcutánea (SLEB) en áreas fotoexpuestas, medir el grado de envejecimiento cutáneo80,81, ya que se corresponde con el grado de elastosis dérmica.
Patrones ecográficos de los rellenos más frecuentes
| Localización | Patrón | Ecogenicidad | Características diferenciales | |
| Ácido hialurónico (R) | Dermis | Vacuolar | Hipoecoico | Desaparece con el tiempo |
| Poliacrilamida (NR) | Dermis-subdermis | Vacuolar | Hipoecoico | Permanece en el tiempo |
| Aceite de silicona (NR) | Dermis-subdermis | En nevada | Variable | «Emborrona» lo posterior |
| Metilmetacrilato (NR) | Dermis-subdermis | En nevada | Hiperecoico | Similar a silicona |
| Hidroxapatita cálcica (R) | Dermis-subdermis | Hiperecoico | Hiperecoico | En ocasiones sombra acústica posterior |
| Ácido poliláctico (R) | Dermis-subdermis | Hipoecoico, aumento tejido | Variable | Puede ser indetectable |
NR: no reabsorbibles; R reabsorbible.
Ya existen estudios que utilizan este parámetro para valorar de manera no invasiva, rápida y reproducible las distintas técnicas de rejuvenecimiento cutáneo como la mesoterapia, los factores de crecimiento82 o los láseres ablativos y fraccionales83.
Futuro de la ecografía cutáneaEl futuro de la técnica comienza en el presente de la misma. Es necesaria una labor de difusión, aprendizaje y experimentación por parte de los dermatólogos. Por otro lado, y al igual que en otras especialidades como la ecografía reumatológica, es necesario un consenso de los médicos que realizamos ecografía cutánea en cuanto a nomenclatura y criterios comunes a la hora de evaluar la enfermedad tanto tumoral como inflamatoria.
Respecto a los avances técnicos la utilidad de la elastografía y el uso de los contrastes ultrasónicos en ecografía cutánea están todavía por definir. La aparición progresiva de equipos apropiados específicos para nuestra especialidad a precios asequibles también colaborará a la generalización de esta técnica complementaria.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Al Dr. Cerezo (presidente de SEECO), a la Dra. Villegas del Hospital Sanitas Moraleja y a los Dres. Roustán y Suárez del Hospital Universitario Puerta de Hierro por su apoyo en los inicios y desarrollo de la ecografía cutánea, así como en la elaboración de este artículo.