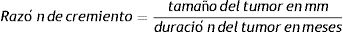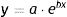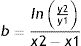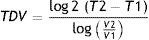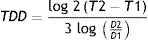El cáncer de piel al igual que otros tumores internos está compuesto por células transformadas de crecimiento incontrolado. El crecimiento tumoral ha sido objeto de estudio desde hace décadas. En este artículo se repasan las distintas formas de medición del crecimiento tumoral cutáneo y se establecen las bases para el desarrollo de una estimación del tiempo de duplicación tumoral que pueda ser útil en el manejo de los pacientes con cáncer de piel.
Skin cancer, like other cancers, is characterized by the uncontrolled growth of transformed cells. Tumor growth has been studied for decades. We review different methods for measuring skin tumor growth and propose a new system for estimating tumor doubling time that could be useful in the management of skin cancer.
El cáncer es una transformación celular que condiciona un crecimiento incontrolado de sus células. Se asume que un tumor comienza como una simple célula transformada y que esta se duplica en 2y estas a su vez en cuatro, y así sucesivamente de forma indefinida. Aun con la pérdida celular que se produce (por apoptosis, necrosis tumoral por falta de vascularización…), se estima que, tras 40 duplicaciones, el tumor alcanza hasta un kilogramo de volumen tumoral. Las duplicaciones posteriores son potencialmente letales para el paciente1. El cálculo de la tasa de crecimiento tumoral ha sido objeto de estudio desde hace 80 años para entender mejor la cinética del tumor y ayudar en el manejo de los pacientes con cáncer. La mayoría de los estudios han asumido que el crecimiento del tumor es exponencial1,2, aunque este no es el único modelo de crecimiento.3
La mayoría de los estudios se han llevado a cabo en tumores internos, sobre todo mediante la medición del tamaño de las metástasis con imágenes radiológicas con las limitaciones que estas conllevan4–6. Este manuscrito revisa la evidencia más importante de la cinética de los tumores cutáneos. Se han revisados los conceptos de tasa de crecimiento tumoral y tiempo de duplicación tumoral. Con respecto a este último, se propone una nueva forma de medición del tiempo de duplicación tumoral en los tumores cutáneos.
La tasa de crecimiento de los tumores cutáneosLos tumores cutáneos, a diferencia de los tumores internos, nos ofrecen una oportunidad de valorar su cinética desde meses o años atrás ya que en la mayoría de las ocasiones el paciente o su entorno recuerda cronológicamente más o menos desde cuando tiene su lesión e incluso aproximadamente cómo era en ese tiempo atrás. De hecho, para la guía de práctica clínica de la National Comprehensive Cancer Network (NCCN) para el carcinoma escamoso cutáneo (CEC) un crecimiento rápido del tumor es un criterio para considerarlo de alto riesgo7. El primer problema evidente que se plantea es qué se considera un CEC de crecimiento rápido. De hecho, no establece ningún método de medida ni, obviamente, punto de corte específico. Ocurre de manera similar con otros tumores.
La primera referencia de la que tenemos constancia es la de Teloh8 en 1953 sobre los carcinomas basocelulares. En este estudio el autor define la tasa de crecimiento de la siguiente forma:
El autor consideró el diámetro de la lesión como la medida del tamaño. En su estudio mostró que una mayor tasa de crecimiento (>0,7mm/mes) se relacionaba con una mayor invasión de los tejidos de estos tumores.
Posteriormente, aparece una referencia concerniente a los CEC de rápido crecimiento por Fitzpatrick y Harwood en 1985 en el que analizaron un subgrupo de CEC de rápido crecimiento a los que denominaron “epiteliomas agudos” que tenían una peor supervivencia a los 3 años con respecto a los CECs que no consideraron de rápido crecimiento. En este trabajo la definición de crecimiento rápido se consideraba desde una evaluación puramente subjetiva sin ningún tipo de medida específica.
En 2002 Grob et al9. intentaron objetivar el crecimiento de los melanomas mediante la tasa de crecimiento, que ellos denominaron Índice cinético del melanoma (ICM), y que expresaron de la siguiente forma:
Donde t1 es el momento en el que el paciente o su familia nota el crecimiento visible del melanoma y tR el momento de la resección. Se mide en mm/mes. Decidieron tomar el grosor tumoral de Breslow como valor indirecto indicativo del volumen, ya que este es más complicado de medir. Observaron que los distintos cuartiles de este valor tenían una diferente supervivencia libre de enfermedad proporcional al valor del ICM. Los autores admiten la “subjetividad” del valor de tiempo pero que “…la subjetividad no significa inexactitud o irrelevancia.”9 De hecho, muchos autores abogan por darle relevancia a la llamada “medicina narrativa” que es lo que se puede extraer de la entrevista médica en contraposición de la “medicina basada en la evidencia”.10 Lin et al.,11 basándose en biopsias sucesivas del mismo melanoma pudieron comprobar que la tasa de crecimiento a través de la historia clínica es un método válido como marcador clínico.
Esta misma idea cinética fue desarrollada por Wendy Liu y su grupo australiano12 en 2006 en un estudio de caracterización de los melanomas. En él, estableció que hasta un tercio de los melanomas pueden ser de rápido crecimiento tomando como valor una tasa de crecimiento mayor de 0,5mm/mes. Estos melanomas pudo caracterizarlos como más gruesos, con más mitosis, en personas mayores de 70 años y más sintomáticos. Posteriormente, el mismo grupo correlacionó la tasa de crecimiento con los índices de proliferación Ki-67 y la fosfohistona H313. Esta caracterización de los melanomas de rápido crecimiento posteriormente fue corroborada por Martorell-Calatayud et al.14 Estos autores sugirieron otra vía patogénica al estar asociados con menos antecedentes de quemaduras solares lo que sugeriría otra vía patogénica.
En 2010, Tejera-Vaquerizo et al.15, relacionó esta tasa de crecimiento con el pronóstico de melanoma como factor pronóstico independiente, al igual que Nagore et al.16. A su vez, la tasa de crecimiento se relacionaba directamente con una mayor presencia de metástasis en el ganglio centinela17.
La tasa de crecimiento en el melanoma, además, se correlaciona con la aparición temporal de las metástasis, apareciendo estas más precozmente cuanto más rápido crece un melanoma18. Incluso fue posible calcular el momento crítico de aparición de las metástasis en el melanoma a partir del cual es posible observar la aparición de eventos fatales y paradójicamente los melanomas más rápidos comienzan a dar metástasis con un grosor mayor que los melanomas finos19.
A pesar de afectar a la proliferación celular, mediada por la afectación de la vía de las cinasas de MAP, las mutaciones en BRAF no se relacionan necesariamente con melanomas de crecimiento más rápido aunque esta mutación sí se relacione con una mayor mortalidad.20 Sin embargo, su combinación con las mutaciones en el promotor de TERT sí que se asociaba con los melanomas de rápido crecimiento21. Más recientemente, estos melanomas se han relacionado con una mutación en el receptor del factor de crecimiento fibroblástico 2 lo que podría ser un marcador de este tipo de melanomas22.
La evidencia disponible para la tasa de crecimiento en otros tumores cutáneos es bastante más limitada. En el caso de los CEC, Cañueto et al.23 calculó la tasa de crecimiento como el cociente entre el diámetro de la lesión en mm y el tiempo de evolución. En su estudio, realizaron particiones mediante técnicas de regresión para determinar que el punto de corte de 4mm/mes era el más adecuado para considerar a un CEC como de rápido crecimiento. Relacionándolo con una mayor propensión a las recidivas linfáticas regionales y una aparición precoz de las mismas. La subjetividad, tal como ocurre en otros tumores, supone una limitación en la determinación de la velocidad de crecimiento del CEC. No obstante, mientras en los CBCs el tumor aumenta de tamaño con el tiempo de manera estable, esto no es tan evidente en el CEC,24 de modo que el tamaño del CEC depende más de la velocidad con la que este crece que del tiempo que la lesión permanece sin tratamiento. Por otra parte, en los tumores de crecimiento rápido el sesgo de tiempo es menor, o dicho de otra manera se tienden a diagnosticar antes porque el paciente se da cuenta de ellos de manera más clara. Además, la diferencia de tamaño en el tiempo transcurrido entre el diagnóstico inicial y el tratamiento definitivo puede ser fácilmente medible y ser de utilidad para un cálculo fiable. La posibilidad de añadir medida de profundidad con técnicas de imagen, como la ecografía, podría permitir un cálculo volumétrico y añadir un elemento más de precisión en la medida del crecimiento.
Por otro lado, para el carcinoma de células basales, aparte del estudio inicial de Teloh mencionado más arriba, existe un estudio descriptivo por parte de Betti et al.25 que analiza la tasa de crecimiento del carcinoma tanto la calculada por la extensión en profundidad (Breslow) como la calculada según la extensión lateral de la medición de la pieza quirúrgica. Sugieren estos autores que la tasa de crecimiento teniendo en cuenta el grosor tumoral tiene más valor en las formas nodulares y la tasa de crecimiento tumoral teniendo en cuenta la extensión lateral tiene más valor en las formas tumorales superficiales. Otro estudio neozelandés de Sykes et al.,26 a través del calculo de la tasa de crecimiento axial y longitudinal, además del área en mm2/mes, corroboró que el carcinoma de células basales es un tumor lento y que la tasa de crecimiento no tiene mucha repercusión una demora en el manejo de estos pacientes.
Tiempo de duplicación tumoral como medida más adecuadaLa evidencia disponible hasta ahora en los tumores cutáneos de la cinética tumoral se basa en la tasa de crecimiento, medida en mm/mes. Esta medida, como se ha explicado, se basa en el grosor o el diámetro de la lesión, que se toma como un sucedáneo del volumen tumoral, que sería lo ideal.
Con el diámetro se podría estimar el crecimiento del tumor teniendo en cuenta un modelo de crecimiento exponencial como fue publicado por Tejera-Vaquerizo et al.27 para la estimación de lo que crecerían los carcinomas y los melanomas en el confinamiento durante la pandemia por la COVID19. Donde la variable dependiente (y=tamaño de la lesión) y la variable independiente (x=tiempo) se relacionan como sigue,
Donde a y b son 2parámetros ajustables. Siendo a el tamaño del tumor inicial y b el coeficiente que determina el crecimiento del tumor, cuanto mayor es b, más rápido crece el tumor. Para el cálculo de la función exponencial del crecimiento tumoral de cada caso se requieren 2puntos en 2momentos diferentes en los que se conozca los valores de×(tiempo) e y (tamaño). Para completar la ecuación y1 es el tamaño de la primera observación cuadno el paciente o su familiar vio el tumor por primera vez mientras que y2 es el tamaño en el segundo momento, cuando es intervenido. Igual con el tiempo (x1 y x2) que hace referencia a la primera observación vs. el momento de la cirugía.
Con esta función podríamos calcular el tamaño conociendo el diámetro de la lesión en 2momentos diferentes. Sin embargo, sería más útil el cálculo del tiempo de duplicación tumoral como medida más fiable de la cinética tumoral.
Estos cálculos fueron revisados por Schwartz2 asumiendo un crecimiento exponencial y con el valor del volumen tumoral en 2momentos diferentes. De esta forma el cálculo del tiempo de duplicación tumoral basado en el volumen (TDV) es como sigue:
Donde T es el tiempo y V el volumen en 2momentos diferentes.
De una forma más simple y probablemente más práctica y aplicable en lo que nos concierne sería el cálculo del tiempo de duplicación basado en el diámetro tumoral (TDD) que sería como sigue2:
Donde T es el tiempo y D el diámetro de la lesión en 2momentos diferentes.
A continuación se presentan 2ejemplos de CEC en cuero cabelludo:
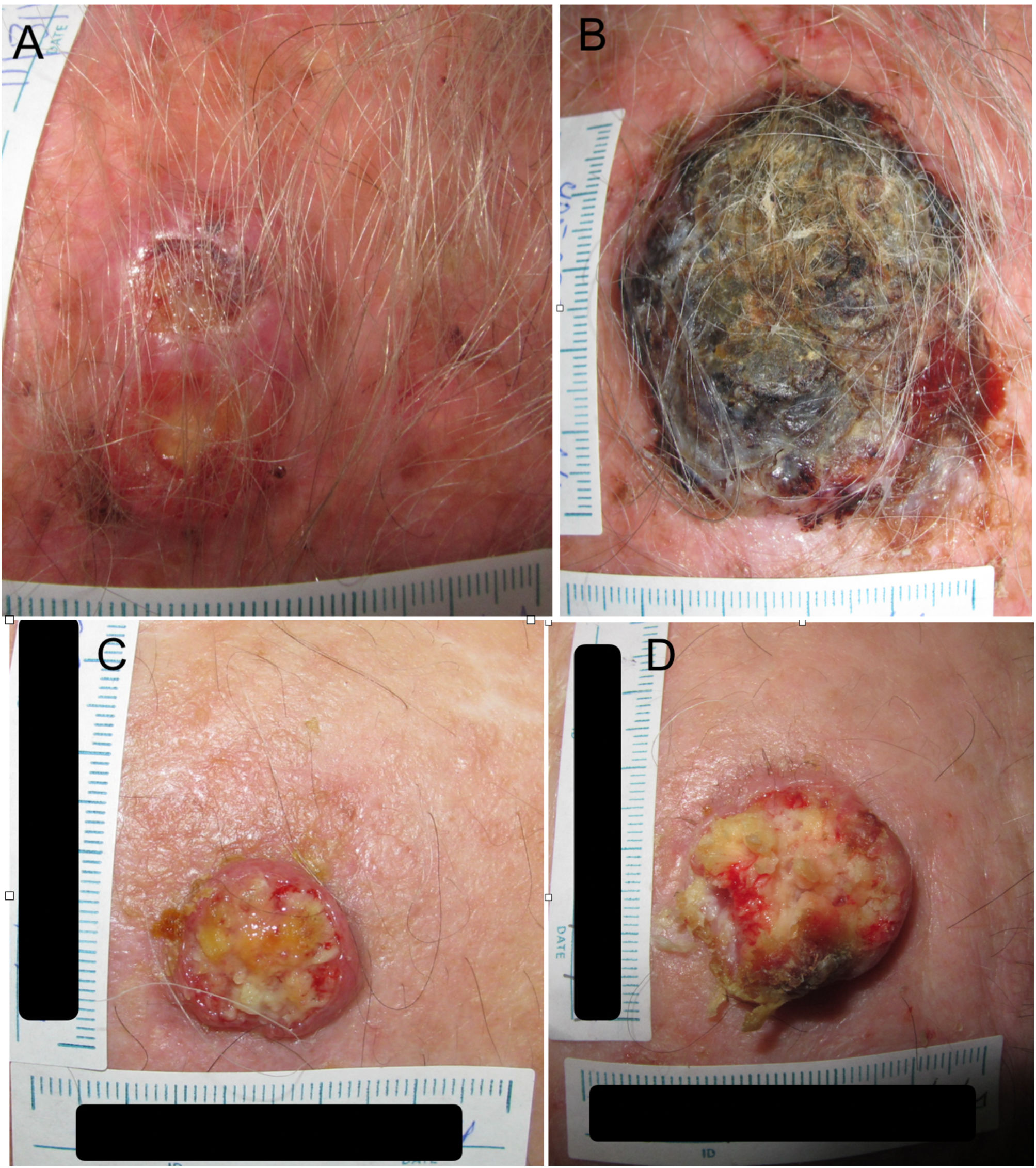
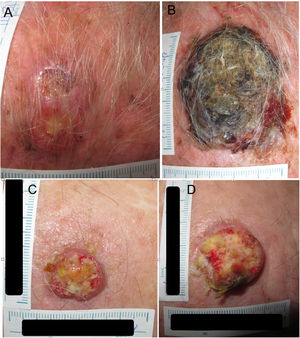
Ejemplo 1 (fig. 1A y 1B). Un CEC localizado en el cuero cabelludo con un D1 de 27mm y un D2 de 53mm con una diferencia T2-T1 de 84 días. El TDD calculado es de 7,3 días.
(1A) Carcinoma epidermoide de cuero cabelludo con un diámetro de 27mm en el tiempo 1 (T1) y un diámetro de 53mm a los 84 días (T2) (1B). (1C) Carcinoma epidermoide de cuero cabelludo con un diámetro de 20mm en el tiempo 1 (T1) y un diámetro de 28mm (1D) a los 133 días, tiempo 2 (T2).
Ejemplo 2 (fig. 1C y 1D). Otro CEC, localizado también en el cuero cabelludo, con un D1 de 20mm y un D2 de 28mm con una diferencia de T2-T1 de 133 días. El TDD calculado es de 16,1 días.
Aunque son lesiones similares en el inicio, un TDD más corto finalmente resulta en un CEC de más alto riesgo, aun con un tiempo de demora más corto.
Sin embargo, en la gran mayoría de los tumores que nos encontramos en la práctica clínica diaria, solo tenemos el tamaño en ese momento, por lo que el cálculo de la TDD no puede ser aplicable.
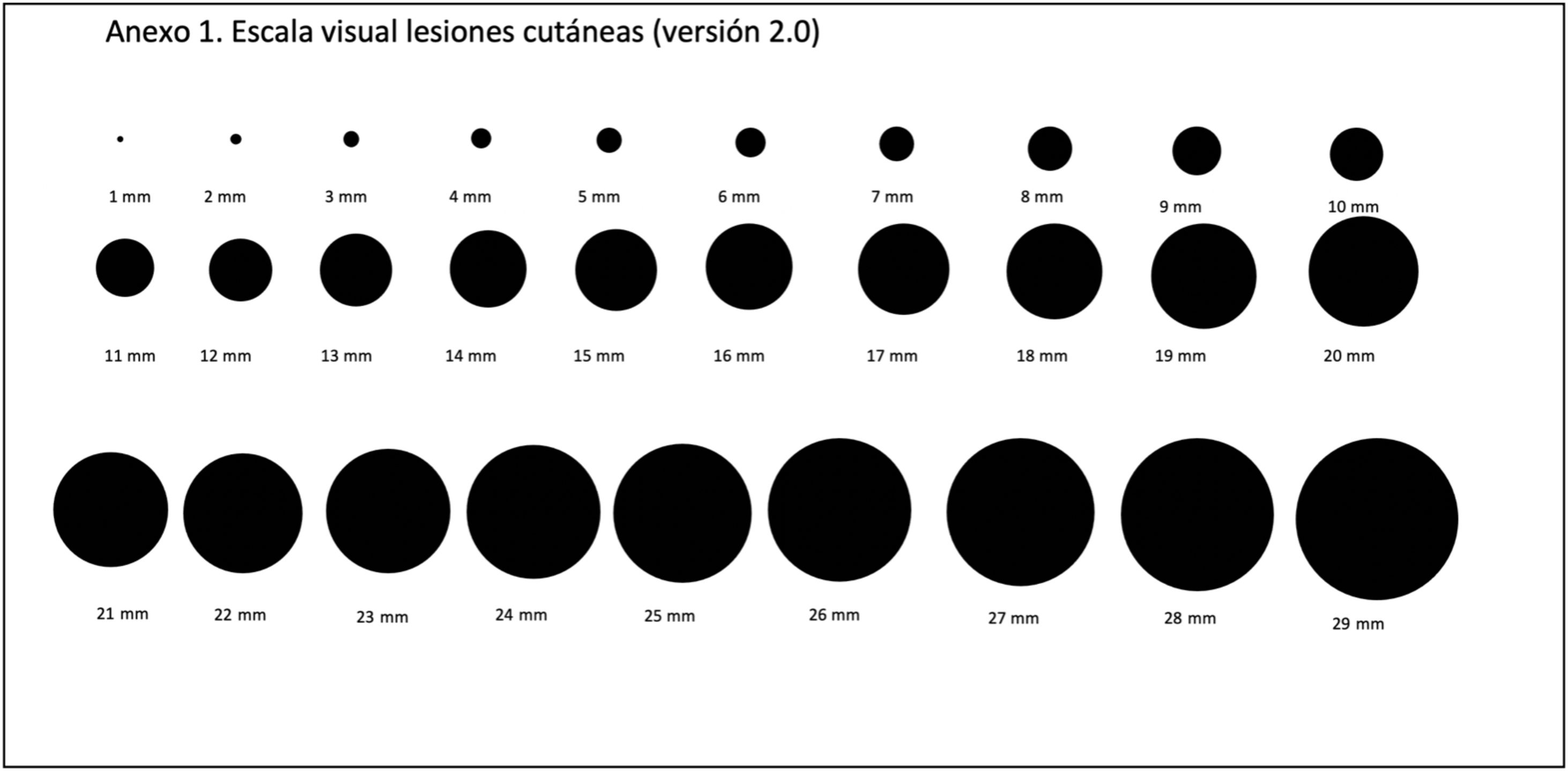
En este sentido, nosotros proponemos la opción de realizar una estimación del TDD (eTDD) basado en una escala visual (fig. 2) (Tabla 1 suplementaria) de círculos entre 1 y 29mm. De igual forma que los pacientes recuerdan el tiempo de evolución desde cuando tienen la lesión, pueden recordar aproximadamente el tamaño que presentaba la lesión cuando se la notó por primera vez. Pensamos que este valor está sometido a la misma incertidumbre que ya ha sido descrito para la evolución de la lesión.
Para intentar responder a la potencial aplicabilidad del eTDD y su aplicabilidad en el cáncer de piel disponemos de un estudio en marcha. Durante la pandemia por COVID19 se llevó a cabo un estudio multicéntrico sobre el impacto del confinamiento en el tamaño y grosor de los melanomas y CEC en nuestro país28. En dicho estudio se le pidió a los investigadores ofrecer la escala visual (fig. 2) a los pacientes de melanoma y CEC en la entrevista inicial para que valoraran el tamaño de la lesión que recordaban la primera vez que la vieron, pregunta a la que respondieron más del 90% de los participantes (datos no publicados). En los próximos meses dispondremos de datos para intentar caracterizar y relacionar el eTDD con las diferentes características clínicas y patológicas de los tumores incluidos.
Al igual que Liu et al.12 caracterizó la tasa de crecimiento determinando que hasta un tercio de los pacientes con melanoma tienen un melanoma de rápido crecimiento, sería posible mediante percentiles determinar con base en la eTDD qué CEC, melanoma u otro tipo de tumor cutáneo es de rápido o de lento crecimiento. Esta medida podría ayudar en la toma de decisiones tanto terapéuticas como para el seguimiento posterior.
Para nosotros se trata de una nueva propuesta de herramienta fácil de calcular y que merece la pena ser analizada.