Los agentes biológicos anti-TNF usados para el tratamiento de la psoriasis moderada y grave pueden incrementar el riesgo de desarrollar tuberculosis activa en pacientes con infección tuberculosa latente. El objetivo principal de este estudio fue estimar la prevalencia de infección tuberculosa latente en pacientes con psoriasis en placas moderada y grave en consultas de dermatología en España.
Material y métodoEstudio epidemiológico, no intervencionista, de corte transversal y ámbito nacional, realizado en España en 2011-2012. Se incluyeron pacientes con psoriasis en placas moderada y grave, a los que se les había realizado en los 2 años previos a su inclusión en el estudio al menos una prueba de tuberculina y/o una prueba de liberación de IFN-γ mediante la técnica de ELISA QuantiFERON®-TB gold In Tube.
ResultadosSe incluyeron 440 pacientes evaluables. Se había realizado una prueba de tuberculina al 97,7% de los pacientes, resultando positiva en el 23%. En 238 pacientes con una primera prueba negativa se realizó un booster, que fue positivo en el 5%. Se realizó la determinación del QuantiFERON®-TB al 16,8% de los pacientes, resultando positivo en el 20,5%; en 2 de estos pacientes la prueba de la tuberculina había sido negativa. En el total de la muestra, la prevalencia de infección tuberculosa latente fue del 26,6%. El grado de concordancia entre la prueba de tuberculina y el QuantiFERON®-TB fue medio (índice Kappa=0,516; p<0,001).
ConclusionesLa prevalencia de infección tuberculosa latente estimada en este estudio fue similar a la comunicada previamente en España.
Anti-tumor necrosis factor therapy for moderate to severe psoriasis can increase the risk of active tuberculosis in patients who have latent tuberculosis infection (LTBI). The main objective of this study was to estimate the prevalence of LTBI in patients with moderate to severe plaque psoriasis being treated in dermatology clinics in Spain.
Material and methodNon-interventional, cross-sectional, national epidemiological study conducted in Spain in 2011-2012. Patients with moderate to severe plaque psoriasis were included if they had undergone at least one tuberculin skin test (TST) and/or been evaluated with an interferon-γ release assay (IGRA) based on enzyme-linked immunosorbent assay (QuantiFERON® TB Gold In-Tube) in the 2 years preceding the study.
ResultsData for 440 patients were valid for analysis. In total, 97.7% of the patients had undergone a TST, with a positive result in 23%. Of the 238 patients in whom the initial result was negative, 5% converted to positive on re-testing for a booster effect. IGRA results were available for 16.8%, 20.5% of them positive. Two of the patients with positive IGRA results had a negative TST. The prevalence of LTBI in the whole sample was 26.6%. The degree of concordance between the TST and the IGRA was moderate (κ=0.516; P<.001).
ConclusionsThe prevalence of LTBI in this study was similar to previous estimates for Spain.
En España, la implementación de las recomendaciones de la Sociedad Española de Reumatología en febrero de 2002 para el manejo de la infección tuberculosa latente (ITL) en pacientes con enfermedades reumatológicas en tratamiento con fármacos inhibidores del factor de necrosis tumoral (anti-TNF) se asoció, conforme a datos del registro BIOBADASER1, con un descenso del 78% en la tasa de tuberculosis activa (TBA) con respecto al periodo previo a la recomendación. En este registro se detectaron un total de 34 casos de TBA, todos ellos en pacientes con artritis reumatoide tratados con infliximab, de los cuales solo 2 habían empezado el tratamiento biológico una vez puesta en marcha la recomendación1. En dermatología, el uso de las terapias biológicas anti-TNF para el tratamiento de la psoriasis moderada y grave se inició en 2004, por lo que las guías ya incluían estas recomendaciones2,3. A pesar de la eficacia de estas recomendaciones, publicaciones recientes evidencian que el riesgo de desarrollar TBA en estas poblaciones sigue siendo superior al observado en grupos poblacionales controles y en pacientes naïves a anti-TNF, enfatizando la necesidad de desarrollar estrategias más efectivas en la detección de ITL en nuestro medio4-6.
La tasa de TBA en 2012 en España fue de 13,0 casos por 100.000 habitantes/años7, superior a la observada en otros países de nuestro entorno7,8. Por otra parte, hallazgos recientes sugieren que la psoriasis podría representar en sí misma un factor de riesgo independiente en el desarrollo de TBA9,10; conforme a datos españoles, los pacientes con psoriasis parecen tener un riesgo entre 7-10 veces superior de desarrollar TBA, al compararlo con el de la población general5. El objetivo principal de este estudio es aportar evidencia científica adicional sobre la prevalencia en España de ITL en pacientes con psoriasis en placa moderada y grave susceptibles de iniciar terapia con anti-TNF, mediante la utilización de la prueba de la tuberculina (PT) y técnicas de detección de liberación de IFN-γ, también denominadas interferon gamma release assays (IGRA).
Material y métodosPoblación en estudioEstudio epidemiológico, no intervencionista, de corte transversal, realizado en 94 consultas de dermatología en España en 2011-2012. Se incluyeron pacientes de edad mayor o igual a 18años con diagnóstico de psoriasis en placas de moderada y grave, a los que se les había realizado una PT (primera determinación y booster) mediante la intradermorreacción de Mantoux y/o una técnica de IGRA en los 2años previos a su inclusión en el estudio. No se contemplaron criterios adicionales de exclusión en la selección de los pacientes. El estudio fue aprobado por un Comité Ético de Investigación Clínica (CEIC) de referencia de ámbito nacional y los pacientes firmaron su consentimiento informado para participar en el mismo.
Variables analizadas e instrumentos de medidaLas variables sociodemográficas recogidas fueron la edad, el género, el peso, la raza y procedencia (si inmigrante), el lugar de residencia, la actividad laboral y extralaboral, los hábitos tóxicos (alcohol y tabaco), las enfermedades concomitantes, los antecedentes personales y familiares de enfermedad tuberculosa, y los antecedentes personales de vacunación con el bacilo de Calmette-Guérin (BCG). Las variables clínicas recogidas fueron la fecha de diagnóstico de la psoriasis, la forma clínica de presentación, los antecedentes familiares de psoriasis y los parámetros de actividad de la enfermedad; puntuaciones Actividad de la Psoriasis e Índice de Gravedad (PASI), Área Corporal Afectada (BSA) y Evaluación Global de la Psoriasis (PGA). Como pruebas de detección específica de ITL se recogieron los resultados de las siguientes pruebas: a)determinaciones de la PT mediante la intradermorreacción de Mantoux11. Se consideró una PT positiva12 a una induración ≥5mm, independientemente de que los pacientes estuviesen o no vacunados con el BCG. Se recogieron los resultados de una segunda determinación (booster) en los pacientes con una primera prueba leída como negativa y en los que se repitió el test a los 7-10días, considerándose como definitivo el resultado de la segunda lectura, y b)técnica de ELISA de detección de liberación de IFN-γ frente a antígenos de M.tuberculosis (IGRA), mediante la prueba de QuantiFERON®-TB Gold In Tube (QFN-G-IT) (Cellestis Limited, Carnegie, Victoria, Australia). Se recogieron adicionalmente los hallazgos radiográficos en aquellos pacientes a los que, conforme a criterio del investigador, se les realizó radiografía de tórax posteroanterior y lateral; conforme al protocolo del estudio, no se recogió información sobre la toma de muestras de esputo. Se consideró que un paciente presentaba ITL tras descartar una TB activa o residual, si cumplía alguno de los siguientes supuestos: a)pacientes con induración ≥5mm de diámetro, en la primera o segunda PT, y/o b)pacientes con una prueba de QFN-G-IT positiva. Adicionalmente, se determinó la prevalencia de ITL por comunidades autónomas y se analizaron los factores de riesgo posiblemente relacionados con la presencia de ITL.
Análisis estadísticoSe realizó un análisis descriptivo de todas las variables cualitativas y cuantitativas. Para estudiar las diferencias estadísticamente significativas en variables cuantitativas se utilizaron el test t de Student y el test U de Mann-Withney. En variables cualitativas se utilizaron el test Chi-cuadrado de Pearson o test exacto de Fisher para tablas (2×2) y el test razón de verosimilitud para tablas (mXn). El grado de concordancia existente entre variables cualitativas se evaluó utilizando el coeficiente de concordancia Kappa. A fin de determinar factores asociados a la presencia de ITL se realizó un análisis de regresión logística multivariante donde la variable dependiente fue el diagnóstico de ITL. Las estimaciones se realizaron con un nivel de confianza del 95%, utilizando el paquete estadístico SPSS V17.0.
ResultadosSe incluyeron 440 pacientes evaluables; de ellos, el 67,4% (293/435) fueron varones. La edad media fue de 46,6±13,3años, y el peso medio, de 80,5±16,3kg; el 95,9% (418/436) eran de raza caucásica. El 50,8% (223/439) presentaban psoriasis moderada y el 36,4% (160/439) grave en el momento de la visita, con un tiempo medio de evolución de la enfermedad de 18,9±11,0 años. La forma clínica predominante fue la psoriasis en placas en el 90,7% (399/440) de los casos. Los valores medios del PASI, BSA y PGA fueron de 13,3±10,1, 25,3±22,0% y 3,8±1,6, respectivamente. En el momento de realizar las pruebas de detección de ITL, el 59,5% (262/440) estaban en situación laboral activa, el 5,0% (22/440) eran emigrantes y el 59,9% (263/439) vivían en ámbito urbano o metropolitano. Adicionalmente, el 43,4% (191/440) de los pacientes presentaban al menos una enfermedad concomitante, el 32,4% (188/435) eran fumadores activos y el 33,0% (142/430) presentaban hábito alcohólico.
El 56,0% (235/420) de los pacientes presentaban antecedentes familiares de psoriasis (padres en el 45,1%; 106/235) y el 1,1% (5/439) antecedentes personales de TB. Un 1,3% (5/396) presentaban TBA; de ellos, el 20% (1/5) con localización pulmonar y el 40% (2/5) con localización pleural, en el momento del cribado. El 16,5% (57/288) de los pacientes refirieron haber sido vacunados previamente con BCG, con una media de 36,9±10,1años trascurridos desde la vacunación. En el año previo a la realización de las pruebas de detección de ITL el 14,8% (65/440) de los pacientes habían realizado al menos un viaje al extranjero, 8/434 (1,8%) pacientes habían convivido en el entorno familiar o laboral con personas con TB activa (bacilíferos) y 14/403 (3,5%) habían tenido contacto con personas con posible enfermedad tuberculosa. La radiografía de tórax se había realizado al 88,0% (387/440) de los pacientes, resultando patológica con signos radiográficos sugestivos de antigua enfermedad tuberculosa en 8/386 (2,1%) pacientes; los hallazgos observados con mayor frecuencia fueron las adenopatías hiliares calcificadas (37,5%; 3/8 pacientes) y los engrosamientos pleurales con o sin calcificación (25%; 2/8 pacientes).
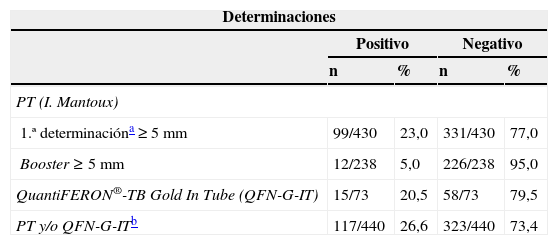
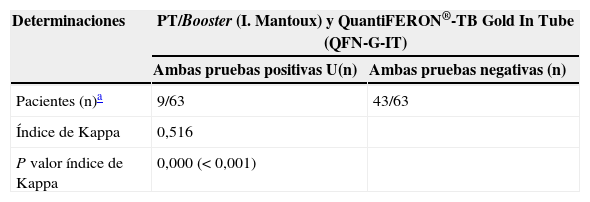
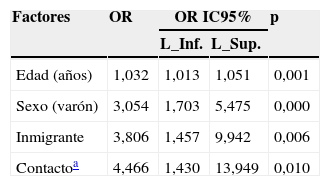
La prevalencia de la ITL se realizó mediante la PT (primera prueba) en el 97,7% (430/440) de los pacientes. En el 23% (99/430) de los casos la PT resultó positiva (induración ≥5mm). El booster se realizó al 71,9% (238/331) de los pacientes con una primera PT negativa, resultando positivo en el 5% (12/238) de los pacientes (tabla 1). Adicionalmente, se realizó la determinación del QFN-G-IT al 16,8% (73/440) de los pacientes, resultando positiva en el 20,5% (15/73) de los casos; de ellos, 2 pacientes con determinación de IGRA positiva habían presentado una PT negativa, y en 4 pacientes con determinación IGRA positiva no se les había realizado la PT (tabla 1). El grado de concordancia entre los resultados de la PT y QFN-G-IT resultó medio (índice Kappa=0,516; p<0,001) (tabla 2). La prevalencia de ITL resultó significativamente superior al comparar varones frente a mujeres (31,7% [93/293] y 15,5% [22/142]), respectivamente; p<0,001), así como en aquellos pacientes con antecedentes de vacunación con BCG al comparar con los no vacunados (35,1% [20/57] y 21,5% [62/288], respectivamente; p<0,05); estos porcentajes fueron 29,6 y 16,6% (PT primera prueba), 8,8 y 2,5% (booster) y 25 y 14,9%, IGRA (p=0,100, p=0,076 y p=0,358, respectivamente). El grado de concordancia entre los resultados de la PT y QFN-G-IT no varió significativamente al observado en la población global del estudio al analizar de manera independiente la población de pacientes con antecedentes de vacunación con BCG (índice Kappa=0,409; p<0,067) y aquellos no vacunados (índice Kappa=0,599; p<0,0001). En el total de nuestra muestra la prevalencia de ITL, considerando los pacientes con resultado positivo en la PT y/o QFN-G-IT, fue del 26,6% (117/440). Los factores estadísticamente significativos relacionados con la presencia de ITL en el análisis de regresión multivariante se resumen en la tabla 3. La tabla 4 muestra la prevalencia de ITL en las comunidades autónomas en las que se incluyó un número ≥20 pacientes en el estudio.
Prevalencia estimada de infección tuberculosa latente (ITL) con los distintos métodos de detección
| Determinaciones | ||||
|---|---|---|---|---|
| Positivo | Negativo | |||
| n | % | n | % | |
| PT (I. Mantoux) | ||||
| 1.ª determinacióna ≥5mm | 99/430 | 23,0 | 331/430 | 77,0 |
| Booster ≥5mm | 12/238 | 5,0 | 226/238 | 95,0 |
| QuantiFERON®-TB Gold In Tube (QFN-G-IT) | 15/73 | 20,5 | 58/73 | 79,5 |
| PT y/o QFN-G-ITb | 117/440 | 26,6 | 323/440 | 73,4 |
I. Mantoux: intradermorreacción de Mantoux; PT: prueba de la tuberculina.
Detección de infección tuberculosa latente (ITL). Grado de concordancia entre las pruebas de Mantoux y QuantiFERON®-TB
| Determinaciones | PT/Booster (I. Mantoux) y QuantiFERON®-TB Gold In Tube (QFN-G-IT) | |
|---|---|---|
| Ambas pruebas positivas U(n) | Ambas pruebas negativas (n) | |
| Pacientes (n)a | 9/63 | 43/63 |
| Índice de Kappa | 0,516 | |
| P valor índice de Kappa | 0,000 (<0,001) | |
I. Mantoux: intradermorreacción de Mantoux; PT: prueba de la tuberculina.
Factores asociados positivamente con la presencia de infección tuberculosa latente (ITL) en el análisis de regresión multivariante
| Factores | OR | OR IC95% | p | |
|---|---|---|---|---|
| L_Inf. | L_Sup. | |||
| Edad (años) | 1,032 | 1,013 | 1,051 | 0,001 |
| Sexo (varón) | 3,054 | 1,703 | 5,475 | 0,000 |
| Inmigrante | 3,806 | 1,457 | 9,942 | 0,006 |
| Contactoa | 4,466 | 1,430 | 13,949 | 0,010 |
IC95%: intervalo de confianza al 95%; L. Inf: límite inferior; L. Sup: límite superior; OR: odds ratio.
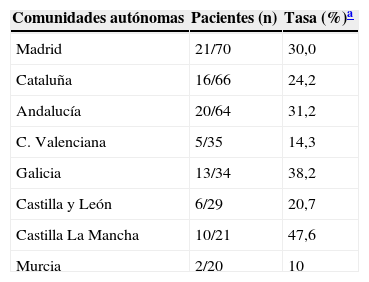
Prevalencia de la infección tuberculosa latente (ITL) por comunidades autónomas
| Comunidades autónomas | Pacientes (n) | Tasa (%)a |
|---|---|---|
| Madrid | 21/70 | 30,0 |
| Cataluña | 16/66 | 24,2 |
| Andalucía | 20/64 | 31,2 |
| C. Valenciana | 5/35 | 14,3 |
| Galicia | 13/34 | 38,2 |
| Castilla y León | 6/29 | 20,7 |
| Castilla La Mancha | 10/21 | 47,6 |
| Murcia | 2/20 | 10 |
Las tasas de ITL reportadas para estas comunidades autónomas en España en 2012 fueron: Madrid (12,2%), Cataluña (16,8%), Andalucía (10,7%), C. Valenciana (10,1%), Galicia (24,6%), Castilla y León (14,3%), Castilla-La Mancha (8,4%) y Murcia (10,1%)7.
En nuestro estudio hemos estimado una prevalencia de ITL del 26,6%, confirmando los resultados publicados previamente en España5,13. En el registro BIOBADADERM5, la prevalencia de ITL fue del 20%; de ellos, al 17% de los pacientes expuestos no se les había realizado ninguna prueba de detección de ITL, siendo la ausencia de booster (43,3%) la causa principal de incumplimiento. En nuestro estudio, la realización del booster resultó en un incremento de la prevalencia de ITL en un 5%. En el estudio de Sánchez-Moya y Dauden13 el cumplimiento más estricto de estas recomendaciones podría explicar la mayor prevalencia de ITL encontrada, de hasta un 29%, acercándose probablemente más a la realidad de nuestras consultas de dermatología. Nuestro trabajo es el primer estudio multicéntrico realizado en España en el que se ha determinado la prevalencia de ITL a partir de los resultados obtenidos mediante la PT e IGRA (QFN-G-IT). Un reciente estudio realizado en un solo centro de nuestro país testó la ITL en 103 pacientes con psoriasis moderada-grave que seguían o iban a iniciar tratamiento sistémico inmunosupresor. Para ello usaron T-SPOT.TB, QFN-G-IT y PT; las tasas de ITL fueron del 16,5, del 17,5 y del 8,7%, y cuando se combinaron las pruebas, la tasa de ITL fue del 24,3%14, similar a las observadas previamente y a las que nosotros hemos detectado. La prevalencia que nosotros hemos observado es superior a la comunicada en otros países de nuestro entorno utilizando técnicas IGRA15,16. Sin embargo, hay que tener en cuenta que es difícil comparar estas prevalencias dada la heterogeneidad entre los estudios, las técnicas de detección empleadas y la variabilidad geográfica de las muestras poblacionales.
Uno de los mayores inconvenientes de la PT radica en su baja especificidad, al poder resultar positiva en individuos vacunados con BCG o sensibilizados por exposición previa a micobacterias no tuberculosas, así como su menor sensibilidad en pacientes con alteraciones de la inmunidad celular17. Un inconveniente añadido es la alta intervariabilidad en la interpretación de los resultados. Por el contrario, las técnicas IGRA de liberación de IFN-γ no interfieren con la BCG y la mayoría de las micobacterias ambientales, no estando sujetas a variabilidad en su interpretación18. Al contrario que la PT, un test IGRA parece presentar una mayor sensibilidad que la PT, particularmente en poblaciones inmunocomprometidas o con alta prevalencia de vacunación con BCG19. En nuestro estudio, la técnica del QFN-G-IT se realizó al 16,8% de los pacientes, resultado en una prevalencia de ITL del 20,5%; en 2 pacientes con IGRA positivo la PT había resultado negativa. La concordancia entre las 2 pruebas de detección de ITL resultó moderada (κ=0,516; p<0,001), ligeramente inferior a la observada en el estudio de Prignano et al.20 en una población de 267 pacientes dermatológicos (κ=0,69; p<0,0001), aunque superior a la reportada por Gisondi et al.21 (κ=0,15). En nuestra opinión, y en concordancia con la mayoría de los artículos revisados, el test IGRA podría considerarse como de primera elección para la detección de ITL en estos pacientes. No obstante, y en base a la superior prevalencia de ITL encontrada en nuestra población de pacientes con antecedentes de vacunación con BCG y a la moderada concordancia que hemos encontrado entre estas pruebas, tanto en la población global del estudio como al analizar independientemente las poblaciones con/sin antecedentes de vacunación con BCG, nos parece aconsejable recomendar, tal como viene recogido en diversas publicaciones21,22, la combinación de la PT con técnicas IGRA en pacientes con psoriasis que vayan a iniciar terapia con anti-TNF. En nuestro estudio, el análisis de regresión multivariante mostró como factores estadísticamente asociados a la presencia de ITL el ser inmigrante y el contacto con personas con posible TBA en el año previo a la realización de las pruebas de detección de ITL, enfatizando la necesidad de recoger estos datos en la historia clínica de los pacientes. Solamente hemos incluido en el análisis de ITL los datos de 8 comunidades autónomas, de las que disponíamos de información de al menos 20 pacientes; aun así, el bajo tamaño muestral de las comunidades autónomas analizadas no nos permite establecer comparaciones con los datos reportados para 2012 por el Centro Nacional de Epidemiología en su informe de 20137.
Al analizar los datos del estudio hay que tener en cuenta las limitaciones derivadas de su diseño. El hecho de no recoger información sobre el seguimiento de los pacientes una vez iniciada la terapia con anti-TNF es sin duda una de sus principales limitaciones, al no conocer el tipo de tratamiento profiláctico realizado, ni permitirnos evaluar la incidencia de TBA en los años siguientes al inicio de la terapia. El elevado número de centros incluidos también representa una limitación a la hora de la evaluación de los resultados de la PT, dada la elevada variabilidad intercentros en su interpretación, no disponiendo tampoco de la información sobre cuándo se realizó la lectura ni el tipo de preparado comercial utilizado en cada centro. Tampoco se ha recogido información sobre la metodología utilizada en cada centro para la determinación del IGRA, ni se dispone de datos sobre la secuencia de realización de la determinación del PT e IGRA en aquellos pacientes a los que se les realizaron ambas determinaciones, sobre el estado de inmunocompetencia de los pacientes o sobre la posible administración de inmunosupresores en el momento de realización de las pruebas. Sin duda, disponer de esta información nos permitiría explicar, al menos en parte, el grado medio de concordancia que hemos observado entre ambas determinaciones.
En conclusión, y teniendo en cuenta las limitaciones ya comentadas, a partir de los resultados de las determinaciones de la PT y QFN-G-IT hemos estimado en nuestro estudio una prevalencia de ITL del 26,6%, tras analizar una amplia muestra de 440 de pacientes con psoriasis moderada a grave candidatos a terapia biológica, confirmando los resultados comunicados previamente en España.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEl estudio ha sido promovido por Pfizer España.
Conflicto de interesesMiquel Ribera declara que ha recibido ayudas y pagos relacionados con la investigación, la asesoría y la formación de las siguientes compañías: Abbott, Janssen, Leo Pharma, MSD, Novartis y Pfizer. Ander Zulaica declara haber recibido honorarios por participación en ensayos clínicos, ponencias y asesoramiento para las siguientes compañías: Abbvie, Pfizer, Janssen, MSD y Novartis. Conrad Pujol declara haber recibido honorarios por participación en ensayos clínicos, ponencias y asesorías para las siguientes compañías: Abbvie, Pfizer, Janssen, MSD y Novartis. Maria Luisa Alonso declara haber recibido financiación por asesoramiento como experto, participación en ensayos clínicos o conferencias de la compañía Pfizer. Isabel Maria Rodríguez declara haber recibido honorarios por participación en ensayos clínicos, ponencias y asesoramiento para las siguientes compañías: Abbvie, Pfizer, Janssen y MSD. Carmen García-Calvo trabaja como Medical Advisor en el departamento médico de Pfizer España.
El soporte para el análisis estadístico ha sido proporcionado por Maria Luz Samaniego, de Trial Form Support, Madrid, España.