El diagnóstico de las enfermedades del cabello y del cuero cabelludo se basa, en la mayoría de las ocasiones, en el reconocimiento de signos clínicos; sin embargo, dichos signos no siempre son característicos y, en ocasiones, tenemos que recurrir a técnicas más invasivas como la realización de una biopsia. En este artículo se revisa de forma detallada las principales formas de alopecia desde un punto de vista histopatológico, y para ello se utiliza la clasificación tradicional de las alopecias que las divide en 2 grandes grupos: las alopecias cicatriciales y las no cicatriciales. Las alopecias cicatriciales son aquellas en las cuales el folículo piloso es sustituido por tejido fibroso cicatricial, causando una pérdida permanente del cabello. En las alopecias no cicatriciales el folículo permanece intacto y puede retomar su actividad cuando cesa el estímulo desencadenante. La primera parte de este artículo revisa las principales formas de alopecia no cicatricial desde un punto de vista histopatológico. Dado que una buena correlación clínico-patológica es fundamental para realizar el correcto diagnóstico histopatológico de las alopecias, en este artículo se incluye también una breve descripción de las características clínicas de las principales formas de alopecia.
The diagnosis of disorders of the hair and scalp can generally be made on clinical grounds, but clinical signs are not always diagnostic and in some cases more invasive techniques, such as a biopsy, may be necessary. This 2-part article is a detailed review of the histologic features of the main types of alopecia based on the traditional classification of these disorders into 2 major groups: scarring and nonscarring alopecias. Scarring alopecias are disorders in which the hair follicle is replaced by fibrous scar tissue, a process that leads to permanent hair loss. In nonscarring alopecias, the follicles are preserved and hair growth can resume when the cause of the problem is eliminated. In the first part of this review, we describe the histologic features of the main forms of nonscarring alopecia. Since a close clinical-pathological correlation is essential for making a correct histologic diagnosis of alopecia, we also include a brief description of the clinical features of the principal forms of this disorder.
En la práctica clínica diaria los dermatólogos nos encontramos con bastante frecuencia ante pacientes que consultan por alopecia. En muchos casos el diagnóstico correcto de estos cuadros se puede establecer directamente por la presentación y evolución del proceso. Sin embargo, en ocasiones, es necesaria la realización de una biopsia para poder establecer un diagnóstico definitivo. La primera parte de este artículo revisa de forma detallada las principales formas de alopecia no cicatricial desde un punto de vista histopatológico, y para ello utilizamos la clasificación tradicional dividiendo las alopecias en 2 grandes grupos: alopecias cicatriciales (AC) y alopecias no cicatriciales (ANC)1. Las primeras son aquellas en las que el folículo piloso es reemplazado por tejido fibroso cicatricial, y las segundas son aquellas en las que cuando el proceso inflamatorio que afecta al folículo se resuelve, este puede recuperar su actividad2.
Ciclo folicularPara poder describir la histopatología de las alopecias resulta primordial comprender el ciclo folicular y los cambios morfológicos que sufre el folículo piloso en cada una de sus fases. Las alopecias afectan con mayor frecuencia a una determinada fase del ciclo folicular, siendo el anagen, la fase activa del crecimiento (con síntesis de ADN y melanogénesis), la más vulnerable3–9. Cuando el folículo piloso en anagen es sometido a una agresión reversible, este acorta su fase de crecimiento dando lugar a un catagen y telogen precoz. Esta conversión de una fase metabólicamente muy activa a una casi inerte es lo que trata de evitar que el daño sobre el folículo piloso sea irreparable, permitiendo el crecimiento de nuevos tallos pilosos cuando cesa la agresión10–12. Del total de los 100.000 folículos pilosos existentes en el cuero cabelludo humano normal, aproximadamente el 85% se encuentra en fase de anagen, con una duración media de 2 a 7 años. En el anagen tardío el segmento inferior de los folículos pilosos se encuentra en la dermis profunda o en la hipodermis, y presenta una morfología característica en tenaza3, con la papila rodeada por células germinativas que irán queratinizando según asciendan. Tras el anagen el folículo piloso entra en fase de catagen, la más corta del ciclo, con una duración de 2 a 3 semanas. La fase de catagen se caracteriza por la retracción del segmento inferior del folículo piloso, que se sitúa más superficial, lo que provoca un arrugamiento de la vaina radicular externa que adquiere aspecto ondulado, con células apoptóticas dispersas, especialmente en la porción inferior13. En el cuero cabelludo normal solo el 1-2% de los folículos pilosos se encuentran en catagen, siendo normal no observar ninguno en una biopsia sin alteraciones. Sin embargo, su número puede aumentar de forma significativa en determinadas alopecias como la tricotilomanía1. El telogen es la última fase del ciclo folicular, con una duración media de 3 meses. En esta fase la síntesis de ADN ha cesado por completo y la melanogénesis está interrumpida. Al final de la fase de telogen el tallo piloso se desprende, comenzando un nuevo ciclo folicular. Los folículos en telogen muestran su segmento inferior retraído y abultado (maza en telogen) en la dermis media y superior, y aparecen compuestos mayoritariamente por la porción permanente del folículo piloso (infundíbulo e istmo). Presentan, por tanto, una morfología en maza y están rodeados por vainas de tejido conectivo perifolicular retraído. Además, es característico de esta fase la presencia de una estela angiofibrótica que se extiende desde el istmo hasta el tejido celular subcutáneo y deja patente la localización inicial del segmento inferior de ese folículo2. Las células madre del folículo piloso se encuentran en un ensanchamiento de la vaina radicular externa que coincide con la inserción del músculo erector del pelo, estructura conocida como protuberancia (o bulge). Recientemente se han identificado marcadores inmunohistoquímicos relativamente específicos de estas células madre foliculares, como el PHLDA114,15. En cada ciclo folicular la activación de estas células dará lugar a la reaparición de la porción transitoria del folículo piloso, y por tanto, a un nuevo ciclo folicular. El daño permanente de estas células madre es el denominador común en la fisiopatología de las AC16,17.
Alopecias no cicatricialesEn la exploración física de las ANC es posible observar la persistencia de los orificios foliculares, lo que representa una clave diagnóstica importante para diferenciarlas de las AC, en las que los orificios foliculares aparecen obliterados. Esto se correlaciona histopatológicamente con la presencia de unidades foliculares con capacidad de sintetizar tallos pilosos, y es la razón por la que esas áreas de alopecia se repueblan al cesar el estímulo desencadenante. Para el estudio de las ANC es de gran utilidad evaluar la densidad folicular y la dinámica del ciclo folicular (fase del ciclo en la que se encuentran los folículos pilosos que observamos histopatológicamente). Para ello es preferible que las biopsias sean cortadas transversalmente, ya que así es posible observar múltiples folículos pilosos en diferentes estadios simultáneamente. Además, para que la biopsia sea rentable es importante tomarla de una región activa de la lesión. En las alopecias con morfología parcheada es preferible el borde de la lesión, mientras que en las alopecias difusas será preferible tomar la biopsia de una zona que presente pilotracción positiva. Es también de utilidad, siempre que sea posible, obtener la biopsia de la región occipital, ya que así disminuirá la posibilidad de que los efectos que los andrógenos ejercen sobre el folículo piloso puedan alterar la representatividad de la muestra. Por último, cuando evaluemos una muestra obtenida de un paciente con ANC es importante recordar que se trata de un proceso dinámico, y que por tanto los hallazgos histopatológicos varían con el estadio evolutivo en el que se encuentra el proceso en el momento de la biopsia18. Las principales claves histopatológicas que son útiles en el diagnóstico de las ANC se encuentran resumidas en la tabla 1.
Claves histopatológicas de las alopecias no cicatriciales
| Tipo de alopecia | Claves histopatológicas |
|---|---|
| Alopecia androgenética | Miniaturización folículos pilosos |
| Pseudohiperplasia sebácea | |
| Efluvio telógeno | Predominio de folículos pilosos en telogen |
| Ausencia de cambios histopatológicos significativos | |
| Alopecia areata | Infiltrado linfocitario peri e intra-bulbar («panal de abejas») |
| Varios folículos de la biopsia en la misma fase evolutiva | |
| Inversión de la relación anagen:telogen | |
| Alopecia sifilítica | Abundancia de células plasmáticas en el infiltrado inflamatorio |
| Presencia de Treponema pallidum con tinciones inmunohistoquímicas | |
| Tricotilomanía | Ausencia de infiltrado inflamatorio peribulbar |
| Tricomalacia | |
| Incontinencia pigmentaria | |
| Hemorragias intra y perifoliculares | |
| Alopecia por tracción | Similares a tricotilomanía |
| Disminución de folículos pilosos terminales |
La alopecia androgenética (AAG), o calvicie común, se considera como la progresión normal y fisiológica de los folículos pilosos del cuero cabelludo, más que una enfermedad en sí misma. La causa subyacente en la AAG es un aumento de la sensibilidad de los folículos pilosos a los andrógenos. Está determinada genéticamente y varía según la zona del cuero cabelludo, siendo los folículos de la zona occipital los menos afectados19. Se ha demostrado que tanto hombres como mujeres con AAG presentan niveles más elevados de actividad de la enzima 5α-reductasa en los folículos de la región frontal de cuero cabelludo, cuando se compara con los folículos de la región occipital de ese mismo paciente20, lo que puede explicar la diferente sensibilidad a los andrógenos en determinadas zonas del cuero cabelludo. El patrón de AAG en hombres y mujeres es diferente. Mientras que en los hombres suele comenzar como una regresión bitemporal de la linea de implantación capilar y posteriormente una afectación de la zona frontotemporal y del vertex, en las mujeres comienza como una pérdida difusa del cabello, que afecta especialmente a la zona central del cuero cabelludo21–23.
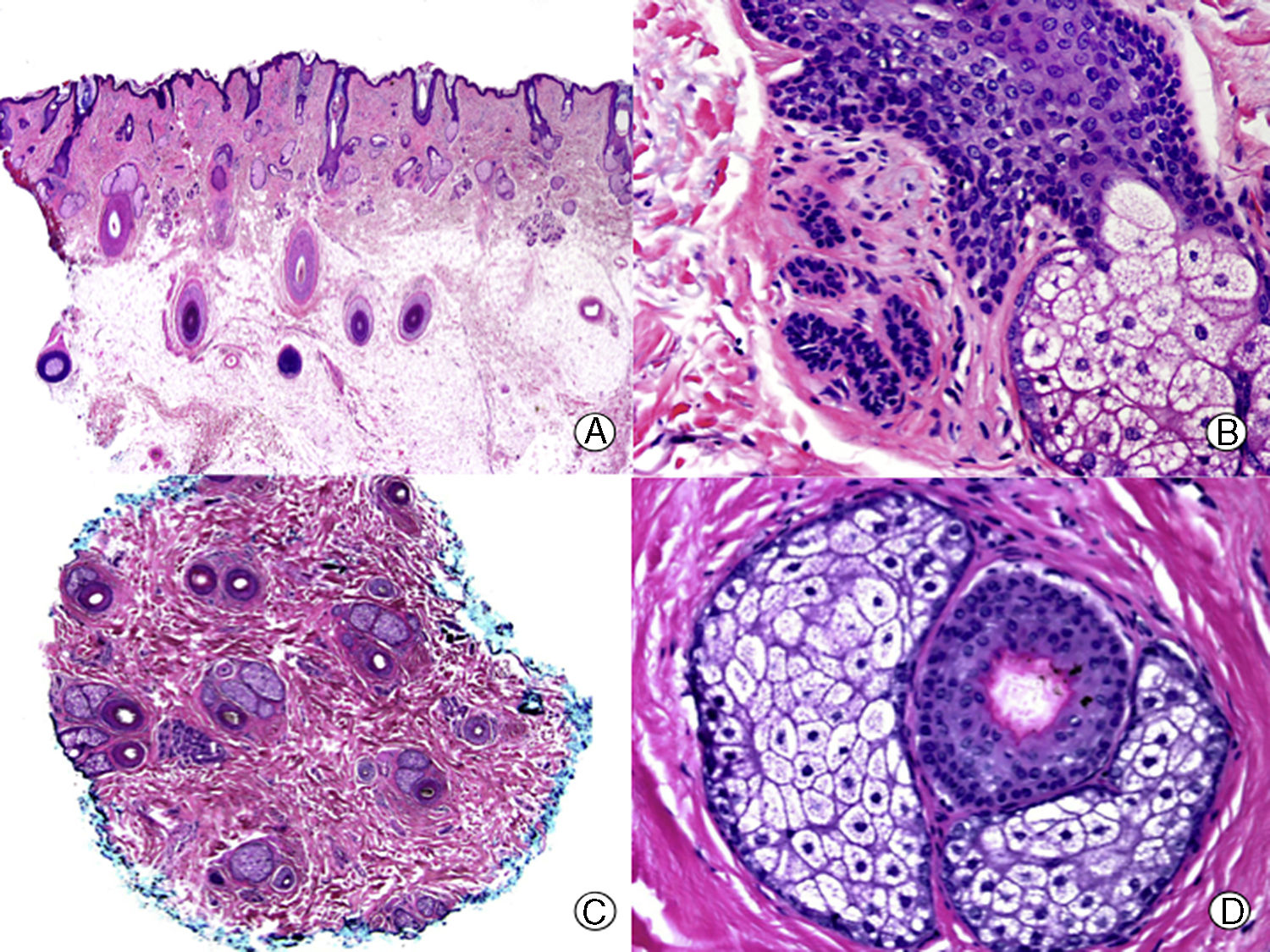
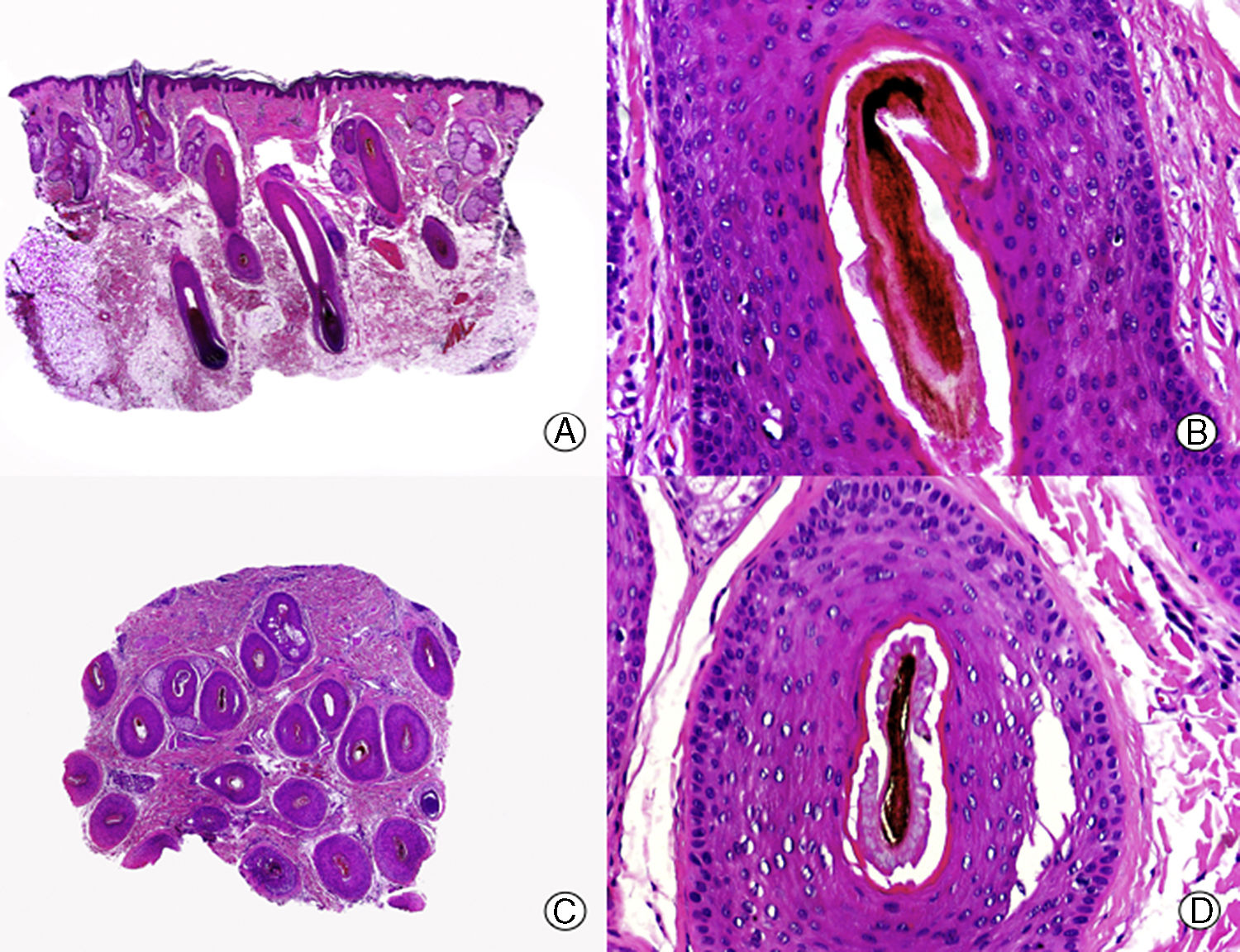
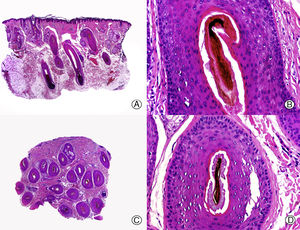
La clave histopatológica principal en la AAG es la miniaturización progresiva de los folículos pilosos terminales24–29, llegando algunos a transformarse en folículos vellosos (fig. 1). Sin embargo, el número total de folículos permanece estable, observándose una reducción de su tamaño, profundidad y diámetro del tallo piloso30,31. El cambio más precoz que puede observarse en las biopsias de AAG es la degeneración basófila focal de la membrana vítrea de los folículos en anagen32. Además, con la miniaturización se produce un ascenso del segmento inferior de los folículos pilosos hacia la dermis superficial que se acompaña de un aumento en el número de tractos fibrosos. De esta forma aumenta el número de folículos en telogen y disminuye la proporción normal anagen:telogen de 7:1 a 2:133. También es característico de la AAG observar glándulas sebáceas aparentemente más grandes al compararlas con el tamaño de los folículos pilosos miniaturizados. Pero esta imagen es en realidad una «pseudohiperplasia sebácea», ya que las glándulas sebáceas presentan un tamaño y morfología normales34, y simplemente parecen más grandes al compararlas con los folículos pilosos miniaturizados.
Alopecia androgenética. A. En cortes longitudinales se observa miniaturización de folículos terminales que se transforman en vellosos (HE x20). B. Folículos pilosos miniaturizados y glándulas sebáceas aparentemente hipertróficas (HE x200). C. El mismo caso estudiado en cortes transversales observándose varias unidades pilosas de tamaño menor de lo habitual en el cuero cabelludo (HE x20). D. Detalle de la anterior en la que se aprecian glándulas sebáceas proporcionalmente más voluminosas respecto al tamaño del folículo piloso (HE x200).
La presencia y significado del infiltrado inflamatorio en la AAG es controvertido. Tradicionalmente se consideraba que la presencia de infiltrado inflamatorio iba en contra de un diagnóstico histopatológico de AAG35, pero diversos autores30,31,36–38 han descrito un infiltrado inflamatorio en hasta un 75% de los pacientes con AAG, sin que se observen signos clínicos de inflamación en la exploración física. Este infiltrado, mayoritariamente constituido por linfocitos, se dispone habitualmente rodeando el infundíbulo, pero también se ha observado alrededor de las estelas fibrosas.
Con tinciones para fibras elásticas las biopsias de AAG muestran los cuerpos de Arao-Perkins, que consisten en pequeños agregados de fibras elásticas, en las estelas fibrosas39. Su aparición se debe a la aglomeración del tejido elástico que rodea el cuello de la papila follicular durante el catagen, y deja patente la localización inicial de la papila folicular en el ciclo previo. En la AAG evolucionada se aprecian múltiples cuerpos de Arao-Perkins en las estelas fibrosas, que presentan una localización cada vez más superficial40. Según Pinkus estos hallazgos son diagnósticos de AAG8.
Efluvio telógenoEl efluvio telógeno (ET) es una alteración del ciclo folicular en la que uno o varios agentes etiológicos de diversa índole dan lugar a una finalización precipitada de la fase de anagen. La causa subyacente de este cuadro es una alteración del reloj biológico del ciclo de crecimiento del folículo piloso, con una conversión prematura de los folículos en fase de anagen a telogen41–43. Las causas que pueden dar lugar a esta conversión son numerosas y variadas e incluyen cirugía, infecciones, anestesia general, estrés quirúrgico y diversas enfermedades sistémicas intercurrentes. Estos procesos suelen ocurrir 2-3 meses antes del comienzo del efluvio (tiempo equivalente a la fase de telogen). Los pacientes refieren una caída de cabello de patrón difuso, y si observamos los cabellos desprendidos al microscopio estos muestran la típica morfología en maza característica de la fase de telogen9.
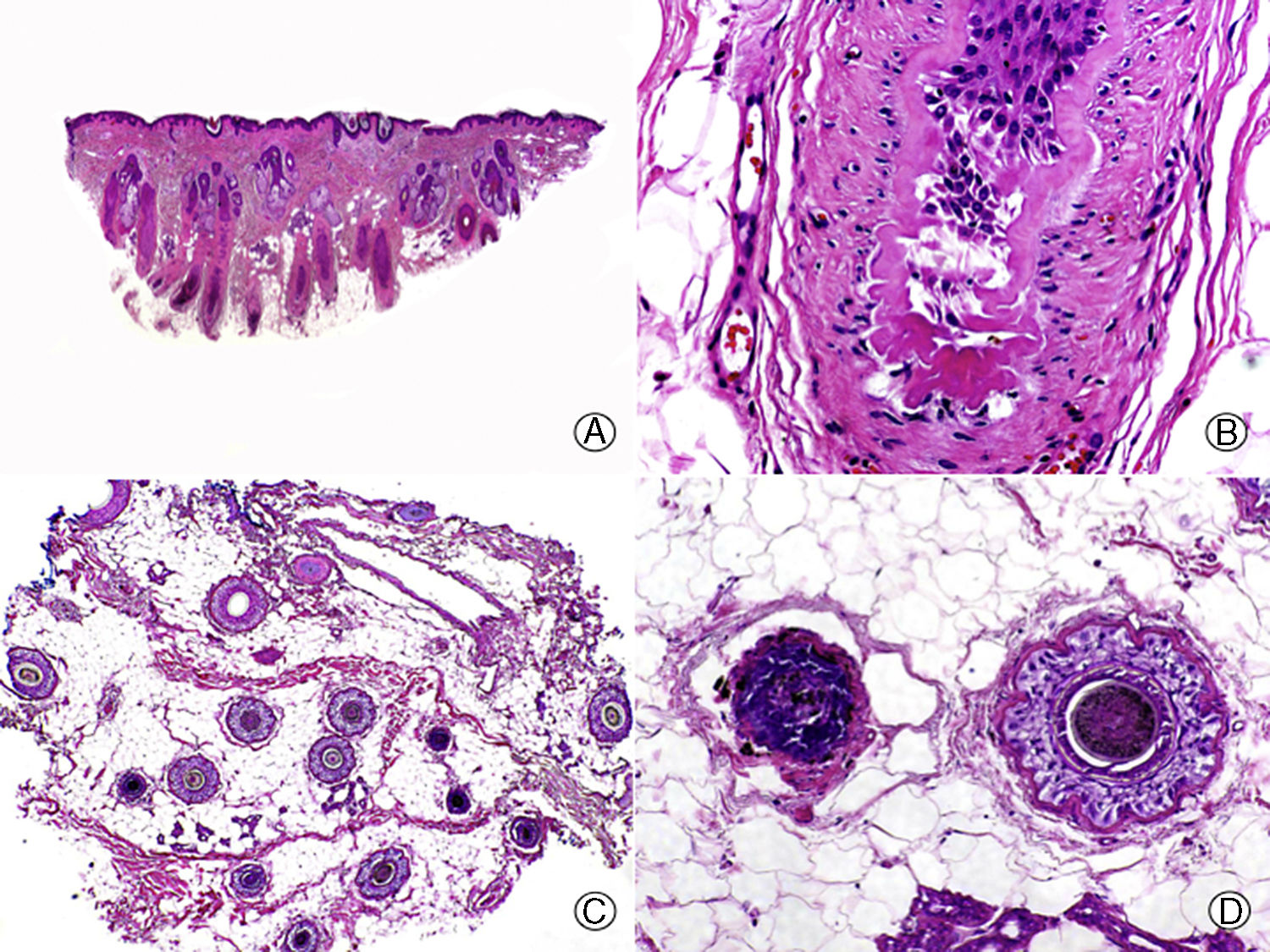
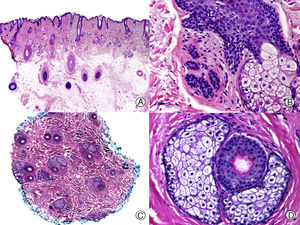
En todas las ANC es importante conocer en que estadio del proceso se encuentra el paciente, ya que las características histopatológicas varían en función de la evolución de la enfermedad. Esto es especialmente importante en el ET, en el que una causa desencadenante produce una conversión precipitada de los folículos de la fase de anagen a la de telogen (fig. 2), pero posteriormente se reinicia un nuevo ciclo folicular de forma normal. Por ello, la biopsia de un paciente con ET evolucionado suele ser normal. De esta forma, si sospechamos un ET y realizamos una biopsia en la que no se aprecian alteraciones estaríamos ante un caso típico de ET, ya que los pacientes no suelen acudir al dermatólogo hasta que notan la caída del cabello, que suele ser en una fase avanzada de la enfermedad44,45. Solo si tomamos la biopsia en una fase inicial de un paciente con ET podremos encontrar una disminución de la proporción anagen: telogen, con un porcentaje de folículos en telogen mayor del 25%46. Además, en las biopsias de ET no se observan anomalías en el folículo piloso47, ni infiltrado inflamatorio, ni aumento de estelas fibrosas y el número de folículos es normal48. Es importante tener en cuenta que algunos pacientes, especialmente los varones, pueden presentar una AAG concomitante al ET, por lo que es importante que la biopsia se realice en la zona occipital del cuero cabelludo.
Efluvio telógeno por quimioterapia. A. Corte longitudinal donde se observan varios folículos pilosos en telogen rodeados por gruesas vainas conectivas perifoliculares (HE x10). B. Detalle de la anterior mostrando una membrana vítrea gruesa y arrugada alrededor de la maza en telogen (HE x200). C. El mismo caso estudiado en cortes transversales, donde se observan varias unidades foliculares (HE x20). D. Detalle de la anterior en la que se aprecia una vaina radicular externa arrugada rodeada de una gruesa membrana vítrea (HE x200).
El ET crónico se describe como la pérdida difusa de cabello durante más de 6 meses. Se diferencia del ET agudo porque es más frecuente en mujeres (especialmente durante la menopausia) y su etiología no está tan clara. Suele tener un inicio más brusco y una progresión fluctuante pero autolimitada, y suele presentarse como una regresión bitemporal de la línea de implantación capilar49,50. Se ha postulado que el proceso se debe a una reducción en la duración de la fase de anagen, lo que impide el crecimiento de cabellos largos45,51. La biopsia muestra un cuero cabelludo con escasa o ninguna diferencia respecto al normal, pudiendo observarse un ligero aumento del porcentaje de folículos en telogen, si la biopsia se realiza en las fases más activas. Según Whitting52 una pérdida de cabello con ausencia de alteraciones histopatológicas es característica de esta condición. Para diferenciarlo de la AAG de patrón femenino, cuyas características clínicas son muy similares, es útil determinar la proporción de folículos pilosos telogen:anagen en la biopsia. En la AAG de patrón femenino este suele estar aumentado, pero no suele superar una relación de 4:1, mientras que si esta relación es mayor de 8:1 es indicativo de un ET crónico53.
Alopecia areataLa alopecia areata (AA) es una causa relativamente frecuente de alopecia cuya patogenia más probable es una alteración autoinmune genéticamente determinada, mediada por linfocitos T contra HLA-DR aberrantes expresados por los queratinocitos de los folículos pilosos54,55. Afecta con mayor frecuencia a niños y adultos jóvenes, pudiendo aparecer a cualquier edad. Se manifiesta clínicamente como uno o varios parches ovalados o redondos de alopecia, sin pérdida de los ostia foliculares. El proceso puede afectar a cualquier zona pilosa del cuerpo. Es característico de la AA observar cabellos en forma de «signo de admiración», especialmente en los márgenes de las lesiones. Estos corresponden a pequeños cabellos rotos, con un bulbo cónico y atenuado y un segmento inferior distal más ancho56,57.
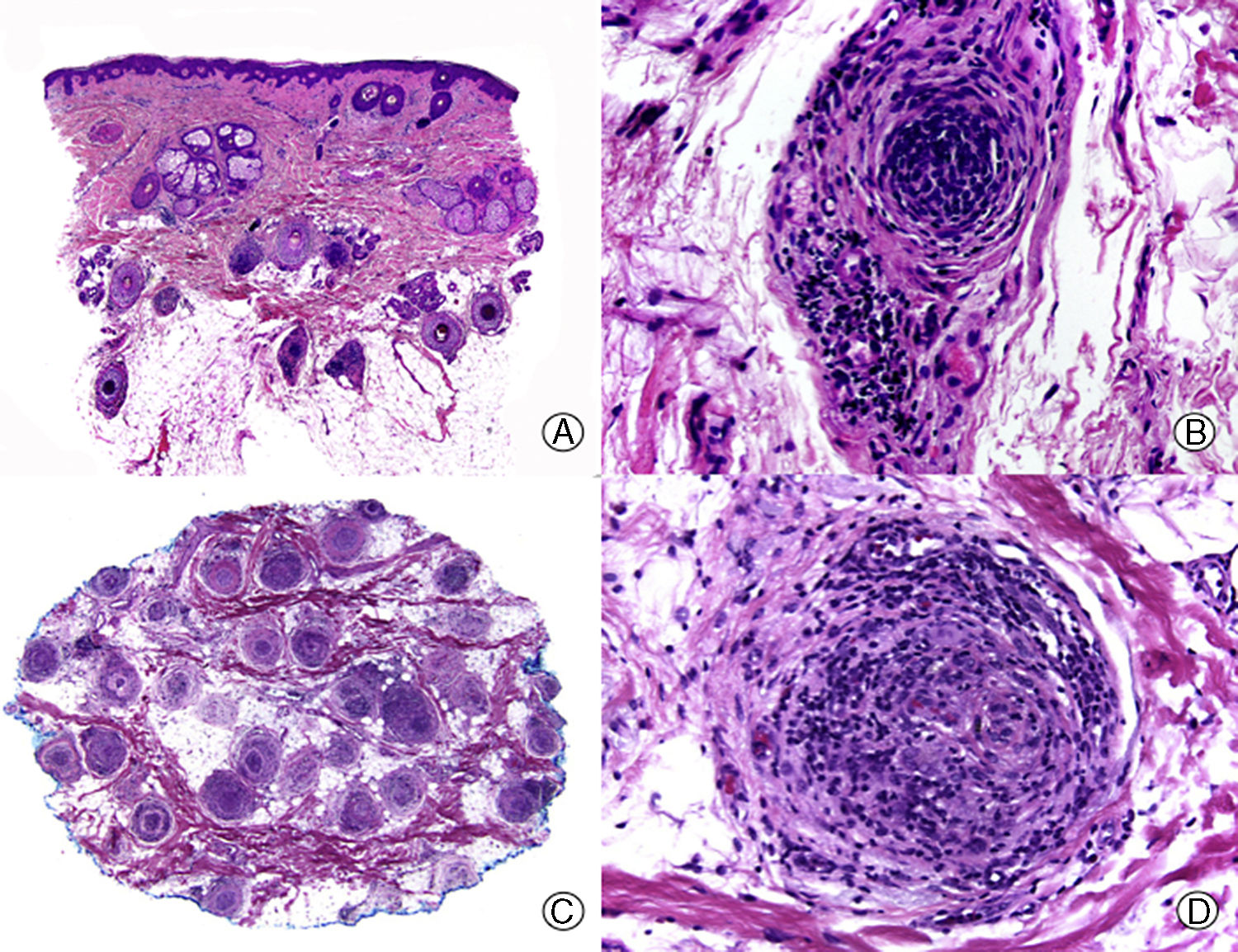
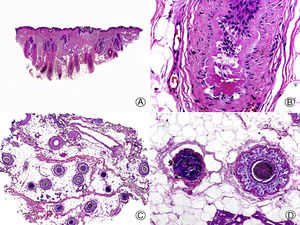
Desde un punto de vista histopatológico la AA se caracteriza por la presencia de un infiltrado inflamatorio de linfocitos pequeños que rodean el bulbo de los folículos en anagen (fig. 3), lo que determina una conversión precoz a las fases de catagen y telogen. El infiltrado adopta una distribución peri e intrabulbar, dando una imagen que recuerda a un panal de abejas, y se compone mayoritariamente de linfocitos T CD4+ y células de Langerhans, pudiendo observarse también algún histiocito, célula plasmática, mastocito y esosinófilo58–63. Los linfocitos T inducen la apoptosis de las células matriciales del bulbo, comenzando por las periféricas, que son las encargadas de la formación de la vaina radicular interna y de la corteza del tallo piloso62. Esto da lugar al adelgazamiento del tallo piloso, que se traduce clínicamente por la aparición de cabellos «en signo de admiración». También inducen una transición precoz a catagen y telogen, que ocasiona la inversión de la relación anagen:telogen, típico de la AA. Por tanto, en las biopsias de este proceso se observa un número aumentado de folículos en catagen y telogen con una estela fibrosa acompañante, y esta abundancia de folículos pilosos, todos ellos en la misma fase evolutiva del ciclo, constituye una clave del diagnóstico histopatológico de la AA64. No obstante, el característico infiltrado inflamatorio que normalmente se observa en los cuadros de AA puede estar ausente en algunas ocasiones, especialmente en casos de larga evolución. En estos casos puede ser útil buscar otras características histopatológicas sugestivas de AA, como la presencia de eosinófilos, linfocitos y melanina en las estelas fibrosas. Otras características menos específicas de AA, pero que también pueden ayudar al diagnóstico, son el aumento de folículos en catagen y telogen, la incontinencia pigmentaria (tanto peribulbar como en la estela fibrosa) y la tricomalacia. En la AA, pero también en otros cuadros de alopecia, se puede observar una proliferación de ductos simulando siringoma, pero que carece del estroma esclerótico característico de este tumor. Por lo tanto se considera que se trata de una hiperplasia ductal reactiva65. Además, en la AA de larga evolución tiene lugar una miniaturización de los folículos pilosos observándose una ausencia casi completa de folículos terminales.
Alopecia areata. A. En cortes longitudinales se observa un infiltrado inflamatorio rodeando los bulbos de los folículos pilosos terminales (HE x10). B. Detalle de la anterior donde se observa que el infiltrado inflamatorio está compuesto mayoritariamente por linfocitos (HE x200). C. Cortes transversales del mismo caso mostrando un infiltrado inflamatorio alrededor del segmento inferior de varios de los folículos pilosos (HE x10). D. Detalle de la anterior que muestra un intenso infiltrado linfocitario (HE x200).
A diferencia de las alopecias cicatriciales en la AA el infiltrado inflamatorio no afecta a las células madre, y de esta forma, el folículo piloso mantiene su capacidad de regenerarse tras una agresión. Si cuando el folículo inicia un nuevo ciclo de crecimiento se ha resuelto la inflamación, la zona afectada repoblará de forma progresiva. Si por el contrario el folículo en anagen vuelve a verse afectado por el infiltrado inflamatorio se producirá una nueva interrupción del ciclo folicular en la fase de anagen precoz, produciendo un catagen y telogen prematuros66 y una persistencia de la enfermedad. De todas formas, aunque la AA es una alopecia no cicatricial, en formas crónicas y resistentes al tratamiento de AA las biopsias muestran ausencia de folículos pilosos que aparecen reemplazados por nódulos de fibroplasia y tejido colágeno dispuesto en hojas de cebolla. Estos hallazgos son ya indicativos de una AA que no se repoblará67.
Alopecia sifilíticaLa alopecia sifilítica (AS) es una de las manifestaciones de la sífilis secundaria y su etiopatogenia se debe a la inflamación causada por la agresión local que el Treponema pallidum ejerce sobre los folículos pilosos. Es muy infrecuente que la AS aparezca de forma aislada, pero cuando lo hace, bien en su forma clínica parcheada (alopecia apolillada) bien en su forma difusa, puede generar gran dificultad diagnóstica, ya que requiere una alta sospecha clínica y en la mayoría de ocasiones será necesario solicitar una serología luética para establecer el diagnóstico.
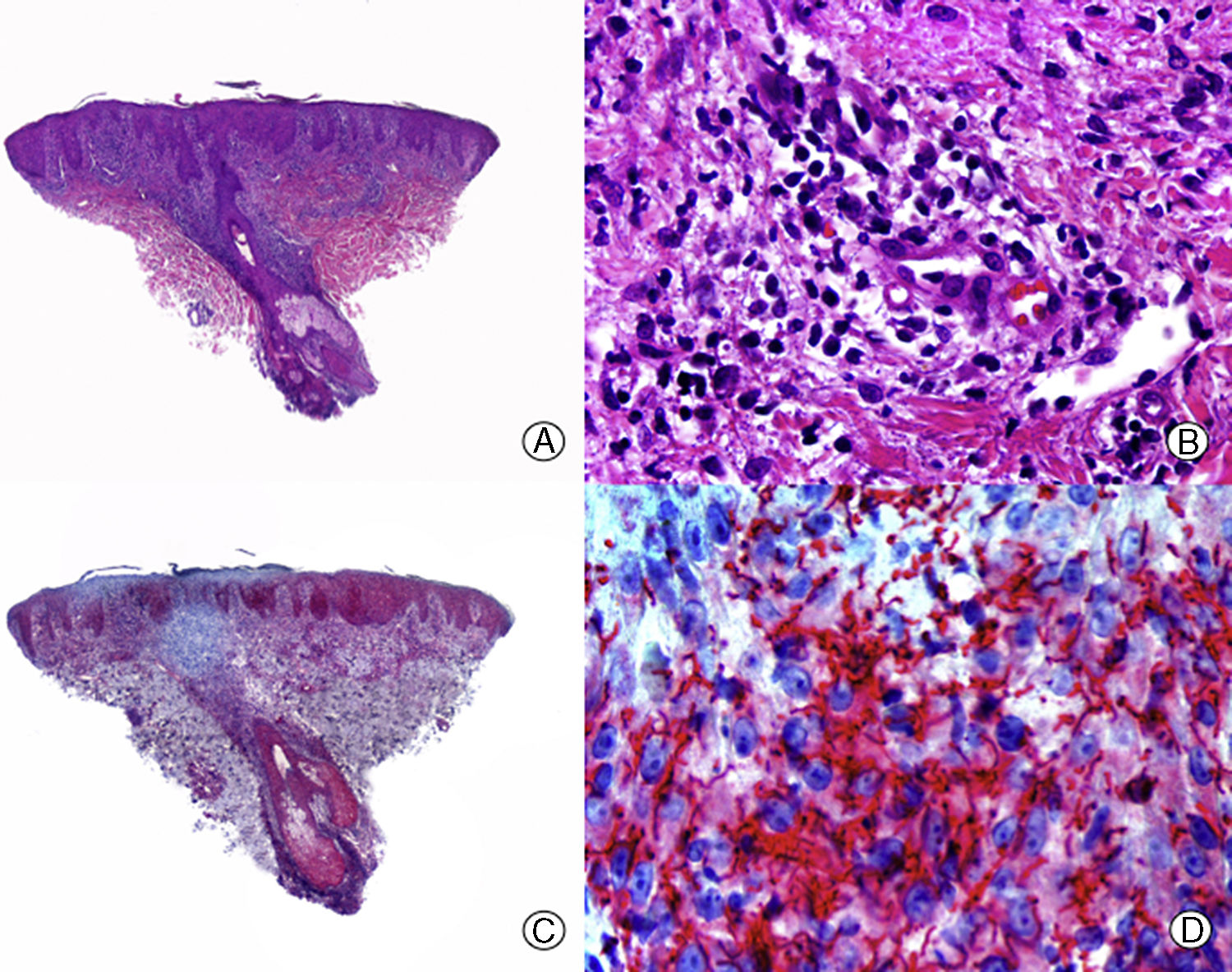
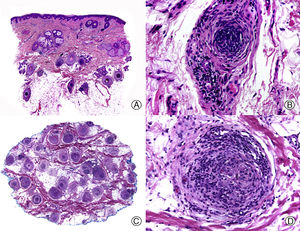
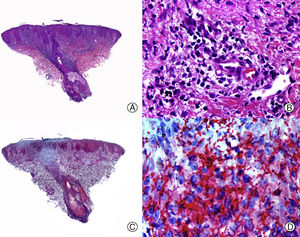
Desde el punto de vista histopatológico es importante tratar de detectar las espiroquetas entre el infiltrado inflamatorio mediante estudios inmunohistoquímicos, que constituyen la técnica más sensible en el momento actual68 (fig. 4). La AS presenta un infiltrado inflamatorio linfohistiocitario con un componente de células plasmáticas llamativo, que rodea las estelas fibrosas y el bulbo. Además, en las biopsias de AS se puede observar un aumento del número de folículos en fase de telogen y catagen. Esto último es importante en el diagnóstico diferencial con la AA, que presenta similitudes clínicas e histopatológicas con la AS. Diversos autores han tratado de encontrar otros hallazgos histopatológicos que ayuden en el diagnóstico diferencial entre AS y AA, siendo la presencia o no de eosinófilos una de las propuestas. Algunos estudios, como el de Jordaan y Louw69, describen la presencia de eosinófilos en las biopsias de AS, mientras que otros autores como Lee y Hsu70 describen su ausencia y lo consideran un criterio útil para el diagnóstico diferencial con la AA.
Alopecia sifilítica. A. Se observa infiltrado liquenoide en la unión dermo-epidérmica y un denso infiltrado perifolicular (HE x10). B. A mayor aumento se observa que el infiltrado está mayoritariamente constituido por linfocitos y células plasmáticas (HE x400). C. Inmunohistoquímica del mismo caso para Treponema pallidum (x10). D. Numerosos treponemas entre el epitelio de la vaina radicular externa del folículo (x400).
La tricotilomanía es un proceso patológico autoinflingido, bien consciente bien inconscientemente, en la cual los pacientes sufren la compulsión de retorcerse y/o tirarse del pelo y a través de ello obtienen placer o alivio71. Estos pacientes suelen presentar un patrón clínico de alopecia aberrante, que afecta con mayor frecuencia al cuero cabelludo, pero que puede afectar a cualquier zona pilosa del cuerpo72. Las áreas alopécicas presentan forma parcheada y límites irregulares. Característicamente se observan cabellos de diferente longitud y con extremos de aspecto roto o desflecado, debido al arrancamiento y rotura de los mismos a lo largo del tiempo. A diferencia de la AA los parches no suelen presentar una pérdida completa del pelo, ya que el ciclo folicular se desarrolla de forma adecuada a pesar de las continuas agresiones72.
Histopatológicamente se observan las consecuencias de la lesión de los folículos pilosos debido a los traumatismos de repetición. De esta forma es frecuente apreciar en la misma biopsia la alternancia de folículos dañados con otros intactos, incluso muy próximos entre sí73–75, y este hallazgo se correlaciona con la observación clínica de pérdida incompleta del cabello en los parches de alopecia. Existe, además, una ausencia de infiltrado inflamatorio perifolicular76, aunque en ocasiones se observa inflamación perivascular en la dermis superficial. Como evidencia del trauma los folículos individuales dañados presentan tricomalacia, incontinencia pigmentaria, así como hemorragia intra y perifolicular76. La tricomalacia es el hallazgo histopatológico más característico de este cuadro, y hace referencia a la distorsión del tallo piloso (fig. 5), aunque en ocasiones puede no estar presente75–77. El daño de los melanocitos del bulbo da lugar a incontinencia pigmentaria, que se observa en forma de masas pigmentadas irregulares localizadas en la porción permanente del folículo, tanto en el infundíbulo como en el istmo, ocupando la vaina radicular externa ya ondulada y arrugada75. En individuos de cabello rubio o pelirrojo es infrecuente encontrar estas acumulaciones de pigmento18. Las hemorragias foliculares aparecen en las fases precoces del proceso y no son un hallazgo constante, pero cuando se observan constituyen un hallazgo prácticamente diagnóstico de tricotilomanía44. A veces es posible observar una reacción granulomatosa rodeando los folículos de los cabellos que han sido arrancados, probablemente como respuesta a tallos pilosos rotos en contacto directo con la dermis sin la protección que supone las vainas radiculares del folículo3,10. La presencia de canales foliculares vacíos76 es también un hallazgo frecuente en este proceso, pero desgraciadamente no ayuda al diagnóstico, ya que se trata de un hallazgo frecuente en muchas de las biopsias de cuero cabelludo debido a la acción del microtomo. Si se consigue realizar una biopsia en la que se conserven los tallos pilosos es posible apreciar un signo muy característico: el «signo de la hamburguesa» ocasionado por la fractura del tallo piloso en dirección longitudinal con un cúmulo de material proteináceo y de eritrocitos en el espacio intermedio generado78.
Tricotilomanía. A. Cortes longitudinales donde se observan foliculos pilosos normales alternando con otros afectados (HE x10). B. Tricomalacia mostrando tallos pilosos pigmentados y arrugados en el canal folicular (HE x200). C. El mismo caso estudiado en cortes transversales (HE x10). D. Detalle de la anterior donde se observa un tallo piloso roto y con abundante pigmento (HE x200).
En cortes transversales se observa un aumento de folículos en catagen en los estadios más incipientes36,75–77. Al igual que en la AA, es la lesión sobre los folículos en anagen la que acelera su conversión a catagen y telogen. Según Whitting12 la alopecia en la que más folículos en catagen se pueden encontrar es la tricotilomanía, no variando, sin embargo, el número total de folículos, ni la relación entre folículos terminales y vellos. El principal criterio histopatológico para establecer el diagnóstico diferencial con la AA es la ausencia de infiltrado inflamatorio peribulbar en la tricotilomanía.
Alopecia por tracciónLa alopecia por tracción (AT) se incluye, junto a la tricotilomanía, en el grupo de las alopecias inducidas mecánicamente. La forma crónica se presenta en la práctica clínica diaria con cierta frecuencia. En general se debe a técnicas de peinado inadecuadas, como recogidos tensos o uso de cintas elásticas para el pelo79. En esta entidad se produce una pérdida de cabello en las zonas donde este se encuentra a mayor tensión, ocasionando con el tiempo una retracción de la línea frontal de implantación capilar o un ensanchamiento de las líneas de separación del cabello, asociado a una progresiva pérdida centrífuga del cabello80.
La AT está muy bien caracterizada desde el punto de vista clínico, sin embargo sus características histopatológicas no son tan conocidas. A grandes rasgos, los hallazgos histológicos de la AT son muy similares a los observados en la tricotilomanía, sin embargo con el paso de los años puede dar lugar a una alopecia cicatricial, situación conocida como síndrome de degeneración folicular81. En estadios precoces, cuando la alopecia aún es reversible, se pueden observar cambios superponibles a los descritos en la tricotilomanía, como presencia de tricomalacia e incontinencia pigmentaria, aunque de forma más leve y con un menor número de folículos pilosos afectos48. En estadios avanzados, cuando la alopecia ya es irreversible, se pueden observar zonas de fibrosis en los lugares donde se encontraban previamente los folículos pilosos terminales48. Un hallazgo característico de la AT es la disminución del número de folículos pilosos terminales, con un número normal de folículos vellosos. Caracteríticamente, en ningún momento de la evolución de la AT se suele observar infiltrado inflamatorio1.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.