Se ha descrito la inducción de anticuerpos antinucleares (ANA) y el desarrollo de enfermedades autoinmunes tras el tratamiento con fármacos anti-TNFα, aunque existe controversia sobre su significado.
ObjetivosDeterminar la aparición de enfermedades autoinmunes y de autoanticuerpos en pacientes psoriásicos tratados con fármacos anti-TNFα subcutáneos (adalimumab y etanercept). Relacionar su desarrollo con la efectividad del tratamiento, posibles efectos adversos y con el orden de administración del fármaco anti-TNFα. Evaluar los factores predictores de aparición de ANA y de enfermedades autoinmunes.
MétodosEstudio retrospectivo sobre una cohorte de 121 pacientes seguidos en un período de 11 años. Se determinaron los ANA (si fueran positivos), también se investigaron los anticuerpos anti-ADN de doble cadena y los anticuerpos extraíbles del núcleo basales a los 3, 6, 12 meses (admitiendo en el estudio a aquellos pacientes con una determinación basal y otra durante el primer año) y posteriormente cada año. En cada consulta se calculó el Psoriasis area and severity index y se recogieron los posibles efectos adversos.
ResultadosDurante el tratamiento de la psoriasis moderada-grave con adalimumab y etanercept se produce un aumento significativo en la positivización de los ANA, no acompañada del desarrollo de enfermedades autoinmunes. No se observa correlación con la efectividad del tratamiento, el orden cronológico de utilización de los fármacos anti-TNFα ni, aparentemente, con la aparición de efectos adversos. No se demuestran factores predictores del desarrollo de ANA excepto el índice de masa corporal.
ConclusiónRecomendamos la determinación de ANA y el despistaje de enfermedades autoinumnes previos al tratamiento con fármacos anti-TNFα, pero no una determinación seriada y rutinaria durante el seguimiento, excepto en aquellos casos en los que existan signos o síntomas de sospecha de enfermedad autoinmune.
The induction of antinuclear antibodies (ANA) and the onset of autoimmune diseases have been reported after treatment with tumor necrosis factor (TNF) inhibitors, though controversy persists.
ObjectivesTo determine the frequency of onset of autoimmune diseases and of the appearance of autoantibodies in psoriasis patients administered TNF inhibitors (adalimumab and etanercept) subcutaneously and to correlate this with the effectiveness of treatment, adverse effects, and the order of use of TNF inhibitors. We also tried to identify any factors that might predict the appearance of ANA and autimmune diseases.
MethodsWe performed a retrospective study of a cohort of 121 patients monitored over an 11-year period. ANA were measured at baseline and at 3, 6, and 12 months; positive results were followed up by study of antibodies to double-stranded DNA. Extractable nuclear antigen (ENA) antibodies were also studied at baseline and at 3, 6, and 12 months. Patients with a baseline assay of ANA and ENA at least one more assay during the first year were included in the study, and these antibodies were measured annually thereafter. Psoriasis area severity index was calculated and adverse effects were recorded at each visit.
ResultsA significant increase in ANA positivity was observed during treatment of moderate-to-severe psoriasis with adalimumab and etanercept, but this was not associated with the onset of autoimmune diseases. No correlation was observed with treatment efficacy, the order of use of TNF inhibitors, or the appearance of adverse effects. No predictive factors for the appearance of ANA were identified, except for the body mass index.
ConclusionsWe recommend ANA measurement and screening for autoimmune diseases prior to treatment with TNF inhibitors, but not routine serial measurements of ANA during follow-up except in patients with signs or symptoms suggestive of autoimmune disease.
Los fármacos anti-TNFα han demostrado ser eficaces en el tratamiento de la psoriasis y presentan, además, un buen perfil de seguridad. Sin embargo, se ha descrito la positivización de anticuerpos antinucleares (ANA) y la aparición de enfermedades autoinmunes durante el tratamiento. Estos fenómenos se han descrito especialmente en la literatura reumatológica y, en menos ocasiones, en la dermatológica1–10. Además, generalmente se han llevado a cabo en estudios con un número reducido de pacientes y durante cortos periodos de seguimiento. Su significado permanece incierto y está sujeto a controversia. Podría deberse a un efecto adverso de los fármacos, pero no puede descartarse la existencia de una enfermedad de base latente en el momento de la administración de estos fármacos.
Por todo ello, se decidió iniciar un estudio cuyo objetivo primario era evaluar la aparición de enfermedades autoinmunes, ANA, anticuerpos antiantígenos extraíbles del núcleo (ENA) y anticuerpos antiácido desoxirribonucleico de doble cadena (dcADN) de doble cadena (dcADN) en pacientes psoriásicos tratados con fármacos anti-TNFα subcutáneos (adalimumab [ADA] y etanercept [ETN]). Como objetivos secundarios se planteó: 1) Comprobar si existe relación entre la aparición de anticuerpos o el desarrollo de autoinmunidad con la efectividad del tratamiento, con posibles efectos adversos y con el orden de administración del fármaco anti-TNF y 2) evaluar los factores predictores de aparición de ANA y enfermedades autoinmunes.
Material y métodosSe trata de un estudio de cohorte, unicéntrico y retrospectivo, en el que se incluyó a pacientes del Servicio de Dermatología del Hospital Universitario de la Princesa (de febrero de 2004 a marzo de 2016). Este trabajo fue aprobado por el Comité Ético de Investigación Clínica (registro n.° 27989) del hospital.
Criterios de inclusión al estudio- -
Pacientes adultos mayores de 18 años con psoriasis moderada-grave (definida con base en el documento de consenso de 2016 del Grupo Español de Psoriasis de la Academia Española de Dermatología y Venereología11)
- -
Haber recibido tratamiento continuo con fármacos anti-TNFα (ADA y ETN) durante al menos 3 meses. En la visita basal era necesario un periodo de lavado de al menos un mes tras el uso de fármacos sistémicos convencionales, ETN y ADA, y de al menos 2 meses con infliximab.
- -
Pacientes con determinación de ANA basales y al menos otra determinación a los 3, 6 o 12 meses de iniciar el tratamiento.
A partir de las historias clínicas, se recogieron las siguientes variables:
- -
Demográficas, relacionadas con la psoriasis como enfermedad, tratamientos realizados anteriormente para la psoriasis y presencia de enfermedades autoinmunes.
- -
Screening previo al tratamiento con agentes anti-TNFα (hemograma, bioquímica sanguínea, serología para los virus de hepatitis B, C y VIH, prueba de tuberculina y booster, y radiografía de tórax)
- -
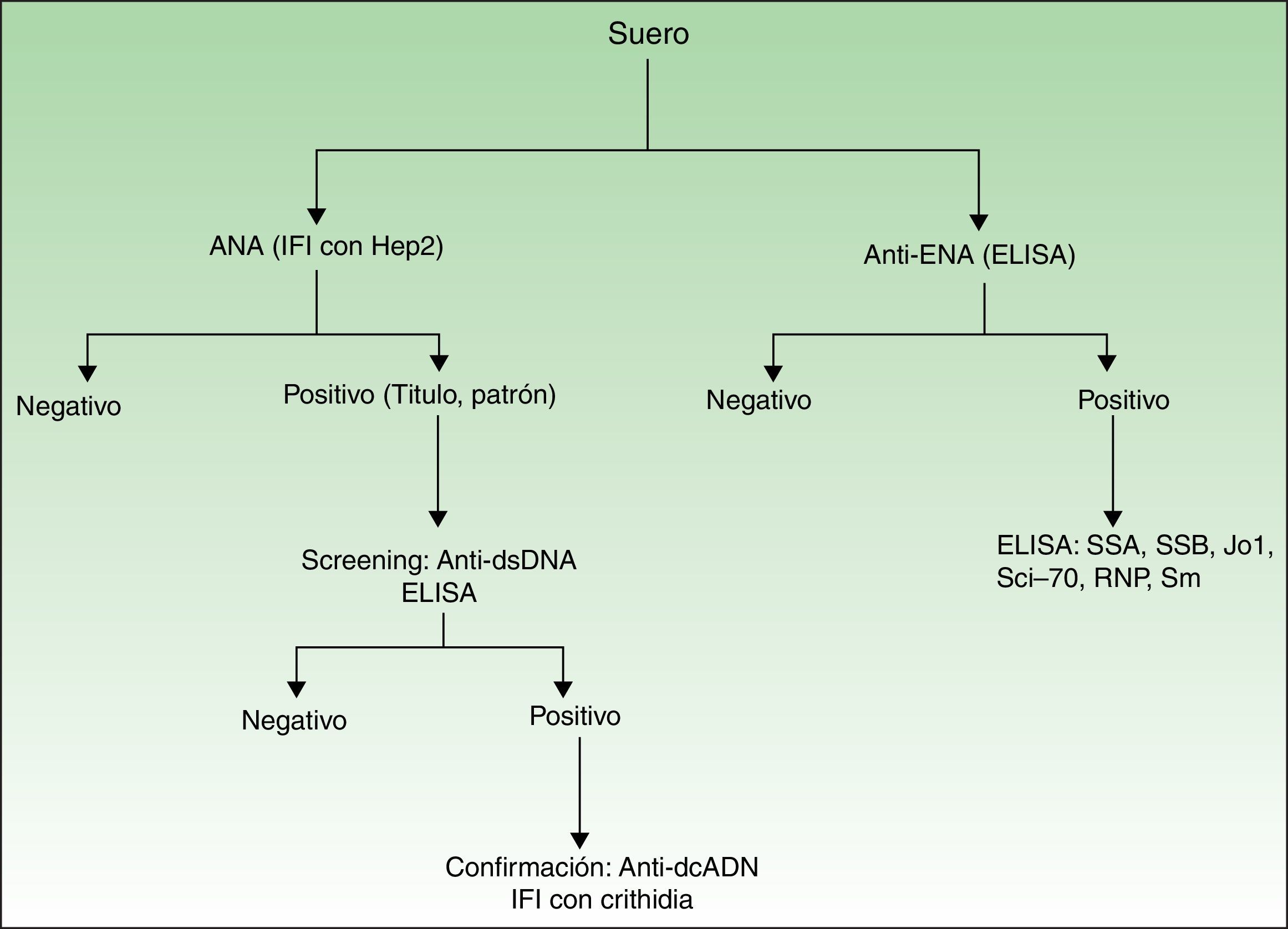
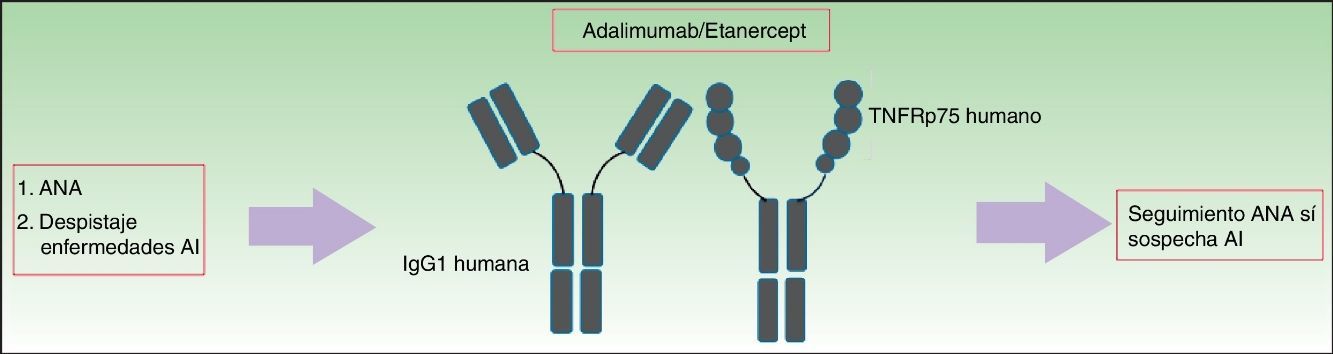
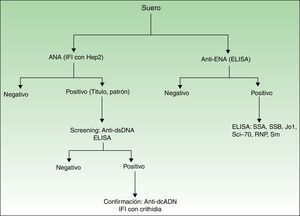
Presencia, título y patrón de ANA. El análisis de los ANA se realizó mediante inmunofluorescencia indirecta (usando células epiteliales humanas, HEp2). En caso de ser positivos (≥1/160), se determinaban los anticuerpos anti-dcADN por ELISA (alta sensibilidad, menor especificidad). Si estos eran positivos, se confirmaba el resultado por inmunofluorescencia indirecta usando Crithidia luciliae (alta especificidad, menor sensibilidad)12 (fig. 1).
- -
Presencia de anticuerpos anti-ENA (por ELISA). Si la prueba resultaba positiva, se realizaba un nuevo ELISA específico para los siguientes antígenos (SSA, SSB, Jo1, Scl-70, RNP, Sm) (fig. 1).
En cada visita se recogieron datos sobre:
- -
Eficacia del tratamiento mediante la valoración del Psoriasis area and severity index (PASI)
- -
Tipo de tratamiento administrado, dosis e intervalo de administración del fármaco.
- -
Seguridad. Efectos adversos durante el tratamiento, con especial atención al desarrollo de enfermedades autoinmunes.
- -
En aquellas visitas en las cuales se realizaron pruebas complementarias, se recogió información sobre las siguientes determinaciones: hemograma y bioquímica sanguínea, así como ANA, anticuerpos anti-dcADN y anticuerpos anti-ENA con las mismas técnicas descritas en la visita basal. En el caso de que los anticuerpos fueran positivos, se realizó una anamnesis específica y dirigida para descartar afectación clínica de conectivopatía.
Los resultados se presentan como media, desviación estándar, mínimo y máximo para las variables cuantitativas, y como frecuencias absolutas y porcentajes para las variables cualitativas. La comparación entre grupos se ha realizado por medio de la prueba t de Student para muestras independientes o la prueba de Mann-Whitney, dependiendo del cumplimiento del supuesto de normalidad, en el caso de variables cuantitativas, y con la prueba exacta de Fisher en tablas de 2X2 o con la ji cuadrado en tablas de mayores dimensiones, para variables cualitativas.
Se ha desarrollado un modelo logístico multivariado con variable dependiente de ANA (negativo/positivo), utilizando como variables independientes edad, sexo, índice de masa corporal (IMC), tiempo de evolución de la enfermedad, artritis psoriásica (no/sí), tratamiento previo (naïve/1-2 anti-TNF previos), PASI basal, anti-TNF actual (ADA/ETN). Se han utilizado métodos de introducción forzada de variables y selección por pasos hacia atrás.
Para poner a prueba la independencia condicional del desarrollo de ANA frente al anti-TNF actual, controlando el efecto del tratamiento previo, se ha utilizado la prueba de Mantel-Haenszel.
Se han considerado significativos valores p<0,05. El análisis estadístico se ha realizado con el programa IBM SPSS 21.0.
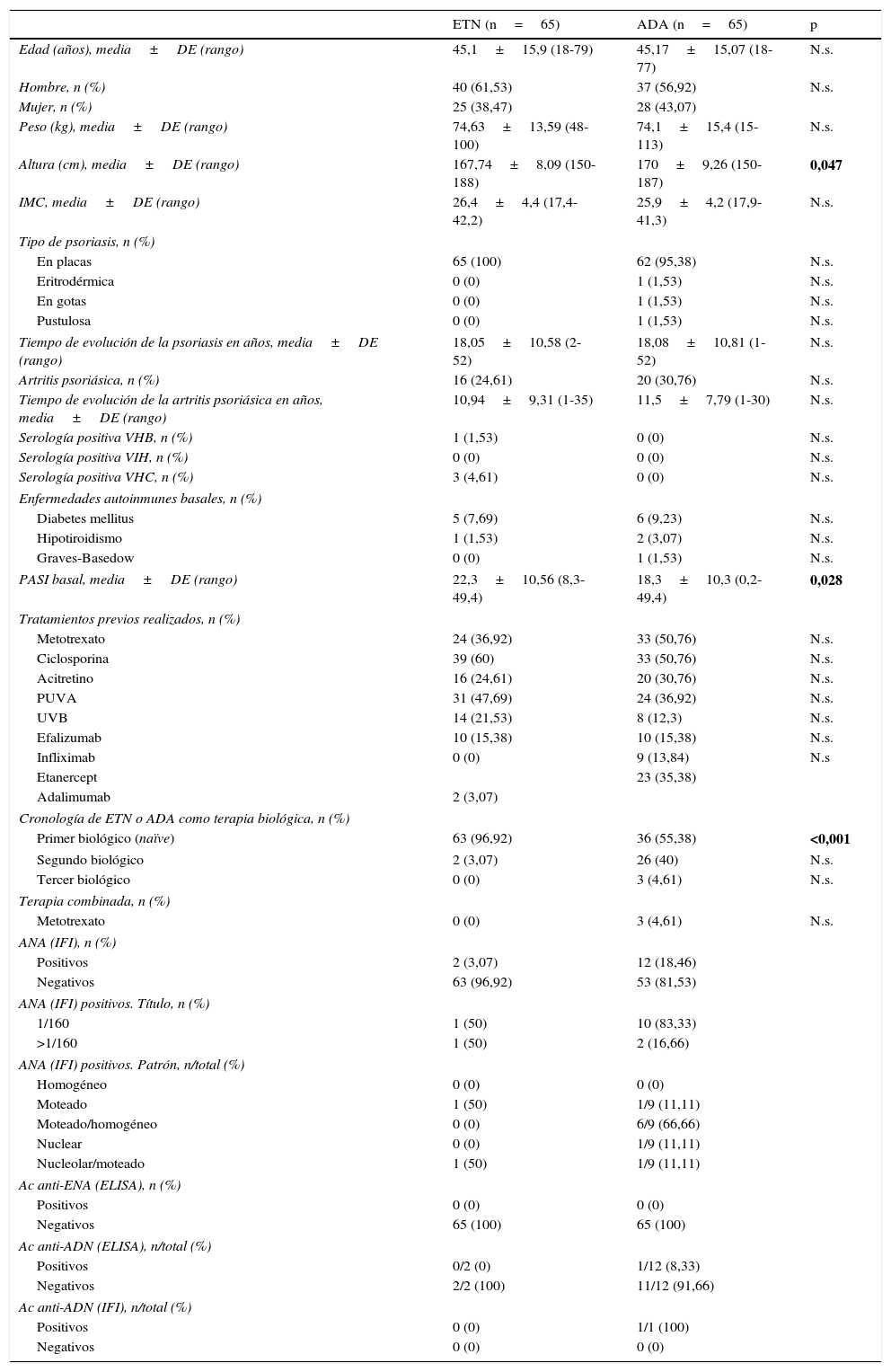
ResultadosEl estudio incluye un total de 121 pacientes: 9 tratados con ETN y ADA, 56 tratados solo con ETN y 56 tratados solo con ADA, de modo que ADA se utilizó en 65 pacientes y ETN en otros 65 (77 hombres y 53 mujeres). La tabla 1 resume sus principales características basales. Los pacientes del grupo ADA presentaron una mayor estatura media y un PASI basal significativamente inferior que los pacientes con ETN. El número de pacientes naïve era claramente superior en el grupo ETN, lo cual podría explicar las diferencias en el PASI basal entre ambos grupos.
Análisis de las principales características basales de los pacientes incluidos en el estudio
| ETN (n=65) | ADA (n=65) | p | |
|---|---|---|---|
| Edad (años), media±DE (rango) | 45,1±15,9 (18-79) | 45,17±15,07 (18-77) | N.s. |
| Hombre, n (%) | 40 (61,53) | 37 (56,92) | N.s. |
| Mujer, n (%) | 25 (38,47) | 28 (43,07) | |
| Peso (kg), media±DE (rango) | 74,63±13,59 (48-100) | 74,1±15,4 (15-113) | N.s. |
| Altura (cm), media±DE (rango) | 167,74±8,09 (150-188) | 170±9,26 (150-187) | 0,047 |
| IMC, media±DE (rango) | 26,4±4,4 (17,4-42,2) | 25,9±4,2 (17,9-41,3) | N.s. |
| Tipo de psoriasis, n (%) | |||
| En placas | 65 (100) | 62 (95,38) | N.s. |
| Eritrodérmica | 0 (0) | 1 (1,53) | N.s. |
| En gotas | 0 (0) | 1 (1,53) | N.s. |
| Pustulosa | 0 (0) | 1 (1,53) | N.s. |
| Tiempo de evolución de la psoriasis en años, media±DE (rango) | 18,05±10,58 (2-52) | 18,08±10,81 (1-52) | N.s. |
| Artritis psoriásica, n (%) | 16 (24,61) | 20 (30,76) | N.s. |
| Tiempo de evolución de la artritis psoriásica en años, media±DE (rango) | 10,94±9,31 (1-35) | 11,5±7,79 (1-30) | N.s. |
| Serología positiva VHB, n (%) | 1 (1,53) | 0 (0) | N.s. |
| Serología positiva VIH, n (%) | 0 (0) | 0 (0) | N.s. |
| Serología positiva VHC, n (%) | 3 (4,61) | 0 (0) | N.s. |
| Enfermedades autoinmunes basales, n (%) | |||
| Diabetes mellitus | 5 (7,69) | 6 (9,23) | N.s. |
| Hipotiroidismo | 1 (1,53) | 2 (3,07) | N.s. |
| Graves-Basedow | 0 (0) | 1 (1,53) | N.s. |
| PASI basal, media±DE (rango) | 22,3±10,56 (8,3-49,4) | 18,3±10,3 (0,2-49,4) | 0,028 |
| Tratamientos previos realizados, n (%) | |||
| Metotrexato | 24 (36,92) | 33 (50,76) | N.s. |
| Ciclosporina | 39 (60) | 33 (50,76) | N.s. |
| Acitretino | 16 (24,61) | 20 (30,76) | N.s. |
| PUVA | 31 (47,69) | 24 (36,92) | N.s. |
| UVB | 14 (21,53) | 8 (12,3) | N.s. |
| Efalizumab | 10 (15,38) | 10 (15,38) | N.s. |
| Infliximab | 0 (0) | 9 (13,84) | N.s |
| Etanercept | 23 (35,38) | ||
| Adalimumab | 2 (3,07) | ||
| Cronología de ETN o ADA como terapia biológica, n (%) | |||
| Primer biológico (naïve) | 63 (96,92) | 36 (55,38) | <0,001 |
| Segundo biológico | 2 (3,07) | 26 (40) | N.s. |
| Tercer biológico | 0 (0) | 3 (4,61) | N.s. |
| Terapia combinada, n (%) | |||
| Metotrexato | 0 (0) | 3 (4,61) | N.s. |
| ANA (IFI), n (%) | |||
| Positivos | 2 (3,07) | 12 (18,46) | |
| Negativos | 63 (96,92) | 53 (81,53) | |
| ANA (IFI) positivos. Título, n (%) | |||
| 1/160 | 1 (50) | 10 (83,33) | |
| >1/160 | 1 (50) | 2 (16,66) | |
| ANA (IFI) positivos. Patrón, n/total (%) | |||
| Homogéneo | 0 (0) | 0 (0) | |
| Moteado | 1 (50) | 1/9 (11,11) | |
| Moteado/homogéneo | 0 (0) | 6/9 (66,66) | |
| Nuclear | 0 (0) | 1/9 (11,11) | |
| Nucleolar/moteado | 1 (50) | 1/9 (11,11) | |
| Ac anti-ENA (ELISA), n (%) | |||
| Positivos | 0 (0) | 0 (0) | |
| Negativos | 65 (100) | 65 (100) | |
| Ac anti-ADN (ELISA), n/total (%) | |||
| Positivos | 0/2 (0) | 1/12 (8,33) | |
| Negativos | 2/2 (100) | 11/12 (91,66) | |
| Ac anti-ADN (IFI), n/total (%) | |||
| Positivos | 0 (0) | 1/1 (100) | |
| Negativos | 0 (0) | 0 (0) | |
ADN: ácido desoxirribonucleico; ANA: anticuerpos antinucleares; DE: desviación estándar; ENA: antígenos extraíbles del núcleo; IFI: inmunofluorescencia indirecta; IMC: índice de masa corporal; N.s.: no significativo; PASI: Psoriasis area and severity index; VHB: virus de la hepatitis B; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
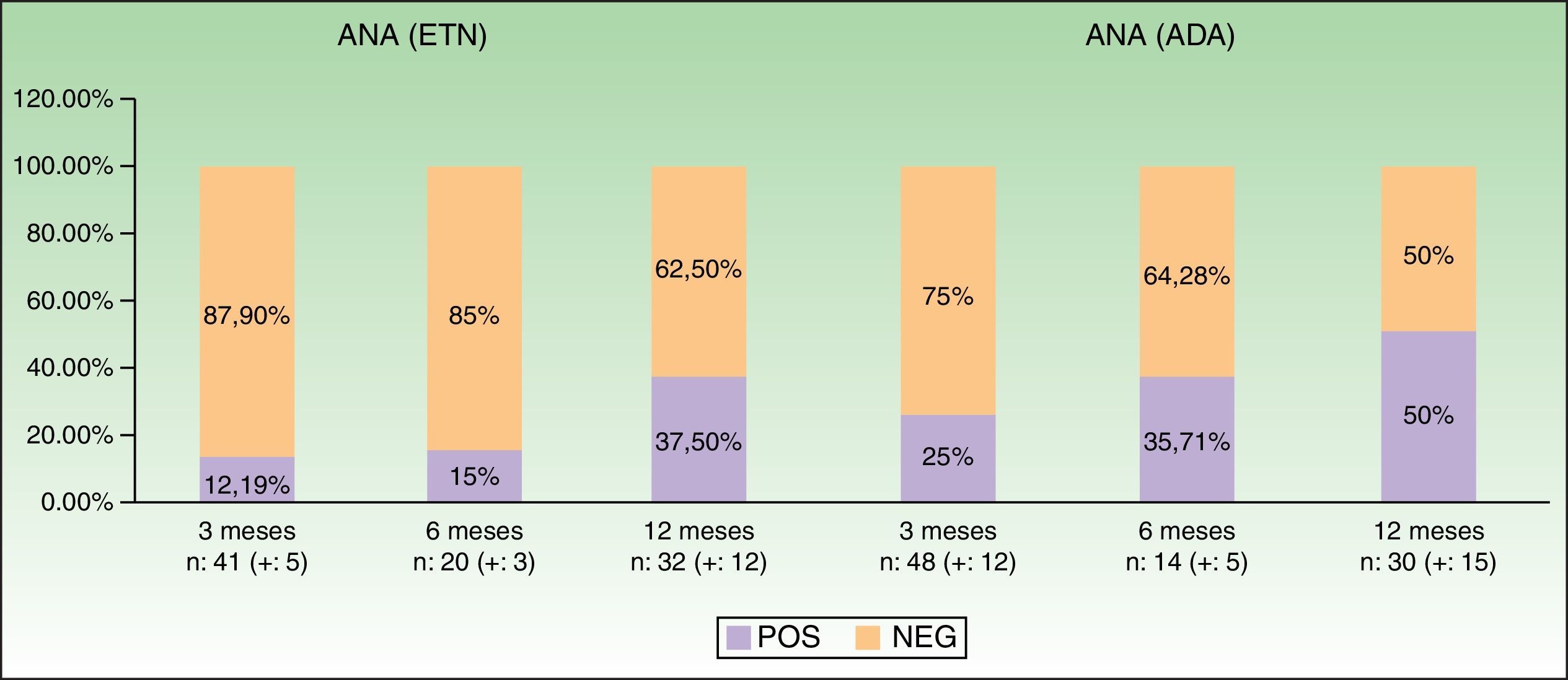
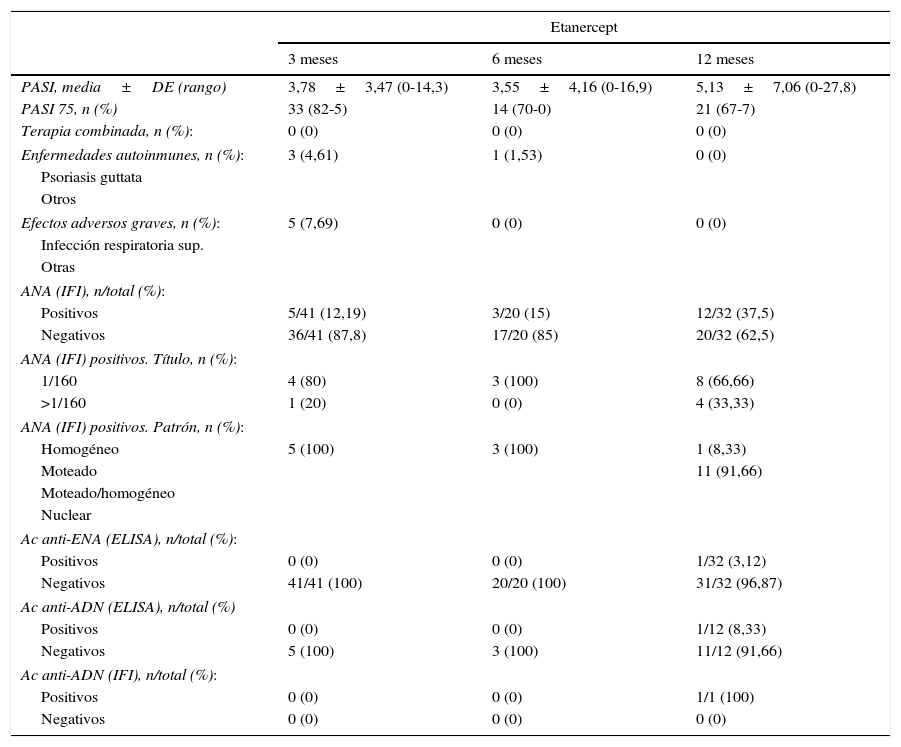
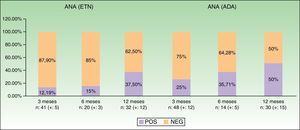
La tabla 2 y la figura 2 muestran datos obtenidos a lo largo del primer año de seguimiento, especialmente la positividad de anticuerpos y desarrollo de enfermedades autoinmunes. Podemos observar cómo hay una tendencia al alza en la positividad de ANA a medida que aumenta el tiempo de tratamiento: pasa del 12,19% a nivel basal al 37,5% a los 12 meses con ETN, y del 25 al 50% con ADA. En el caso de ADA, los patrones de ANA con inmunofluorescencia indirecta (IFI) mostraron una amplia variabilidad. No se observó la aparición de conectivopatías autoinmunes a lo largo del seguimiento.
Evolución de los ANA durante el primer año de seguimiento
| Etanercept | |||
|---|---|---|---|
| 3 meses | 6 meses | 12 meses | |
| PASI, media±DE (rango) | 3,78±3,47 (0-14,3) | 3,55±4,16 (0-16,9) | 5,13±7,06 (0-27,8) |
| PASI 75, n (%) | 33 (82-5) | 14 (70-0) | 21 (67-7) |
| Terapia combinada, n (%): | 0 (0) | 0 (0) | 0 (0) |
| Enfermedades autoinmunes, n (%): | 3 (4,61) | 1 (1,53) | 0 (0) |
| Psoriasis guttata | |||
| Otros | |||
| Efectos adversos graves, n (%): | 5 (7,69) | 0 (0) | 0 (0) |
| Infección respiratoria sup. | |||
| Otras | |||
| ANA (IFI), n/total (%): | |||
| Positivos | 5/41 (12,19) | 3/20 (15) | 12/32 (37,5) |
| Negativos | 36/41 (87,8) | 17/20 (85) | 20/32 (62,5) |
| ANA (IFI) positivos. Título, n (%): | |||
| 1/160 | 4 (80) | 3 (100) | 8 (66,66) |
| >1/160 | 1 (20) | 0 (0) | 4 (33,33) |
| ANA (IFI) positivos. Patrón, n (%): | |||
| Homogéneo | 5 (100) | 3 (100) | 1 (8,33) |
| Moteado | 11 (91,66) | ||
| Moteado/homogéneo | |||
| Nuclear | |||
| Ac anti-ENA (ELISA), n/total (%): | |||
| Positivos | 0 (0) | 0 (0) | 1/32 (3,12) |
| Negativos | 41/41 (100) | 20/20 (100) | 31/32 (96,87) |
| Ac anti-ADN (ELISA), n/total (%) | |||
| Positivos | 0 (0) | 0 (0) | 1/12 (8,33) |
| Negativos | 5 (100) | 3 (100) | 11/12 (91,66) |
| Ac anti-ADN (IFI), n/total (%): | |||
| Positivos | 0 (0) | 0 (0) | 1/1 (100) |
| Negativos | 0 (0) | 0 (0) | 0 (0) |
| Adalimumab | |||
|---|---|---|---|
| 3 meses | 6 meses | 12 meses | |
| PASI, media (rango) | 2,6±4 (0, 19) | 1,9±4,1 (0, 26.6) | 1,6±3,4 (0, 15) |
| PASI 75, n (%) | 28 (75,7) | 9 (81,8) | 17(94,4) |
| Terapia combinada, n (%): | 3 (4,61) | 3 (4,61) | 1 (1,53) |
| Metotrexato | ACI: 1 (1,53) | EVBBE: 1 (1,53) | |
| Otros: acitretino, UVBbe | ACI: 1 (1,53) | ||
| Enfermedades autoinmunes, n (%): | 0 (0) | ||
| Psoriasis gutatta | 2 (3,07) | 1 (1,53) | |
| Alopecia areata | 1 (1,53) | ||
| Efectos adversos graves, n (%): | 0 (0) | 0 (0) | |
| Infección respiratoria sup. | 3 (4,61) | ||
| Infección urinaria | 1 (1,53) | ||
| Doble bypass | 1 (1,53) | ||
| ANA (IFI), n/total (%): | |||
| Positivos | 12/48 (25) | 5/14 (35,71) | 15/30 (50) |
| Negativos | 36/48 (75) | 9/14 (64,28) | 15/30 (50) |
| ANA (IFI) positivos. Título, n (%): | |||
| 1/160 | 9/12 (75) | 1/5 (20) | 7/15 (46,66) |
| >1/160 | 3/12 (25) | 4/5 (80) | 8/15 (53,33) |
| ANA (IFI) positivos. Patrón, n (%): | |||
| Homogéneo | 1 (8,33) | 1/4 (25) | 4 (26,66) |
| Moteado | 7 (58,33) | 3/4 (75) | 10 (66,66) |
| Moteado/homogéneo | 1 (8,33) | ||
| Nuclear | 2 (16,66) | 1 (6,66) | |
| Homogéneo/nuclear | 1 (8,33) | ||
| Ac anti-ENA (ELISA), n/total (%): | |||
| Positivos | 1 (Scl 70) -> 2,08% | ||
| Negativos | 47/48 (97,91) | 14/14 (100) | 30 (100) |
| Ac anti-ADN (ELISA), n/total (%) | |||
| Positivos | 0 (0) | 0 (0) | 1 (6,66) |
| Negativos | 12/12 (100) | 5/5 (100) | 14 (93,33) |
| Ac anti-ADN (IFI), n/total (%): | |||
| Positivos | 0 (0) | 0 (0) | 0 (0) |
| Negativos | 0 (0) | 0 (0) | 1 (100) |
ANA: anticuerpos antinucleares; IFI: inmunofluorescencia indirecta; ENA: antígenos extraíbles del núcleo; PASI: Psoriasis area and severity index; UVBbe: ultravioleta B de banda estrecha.
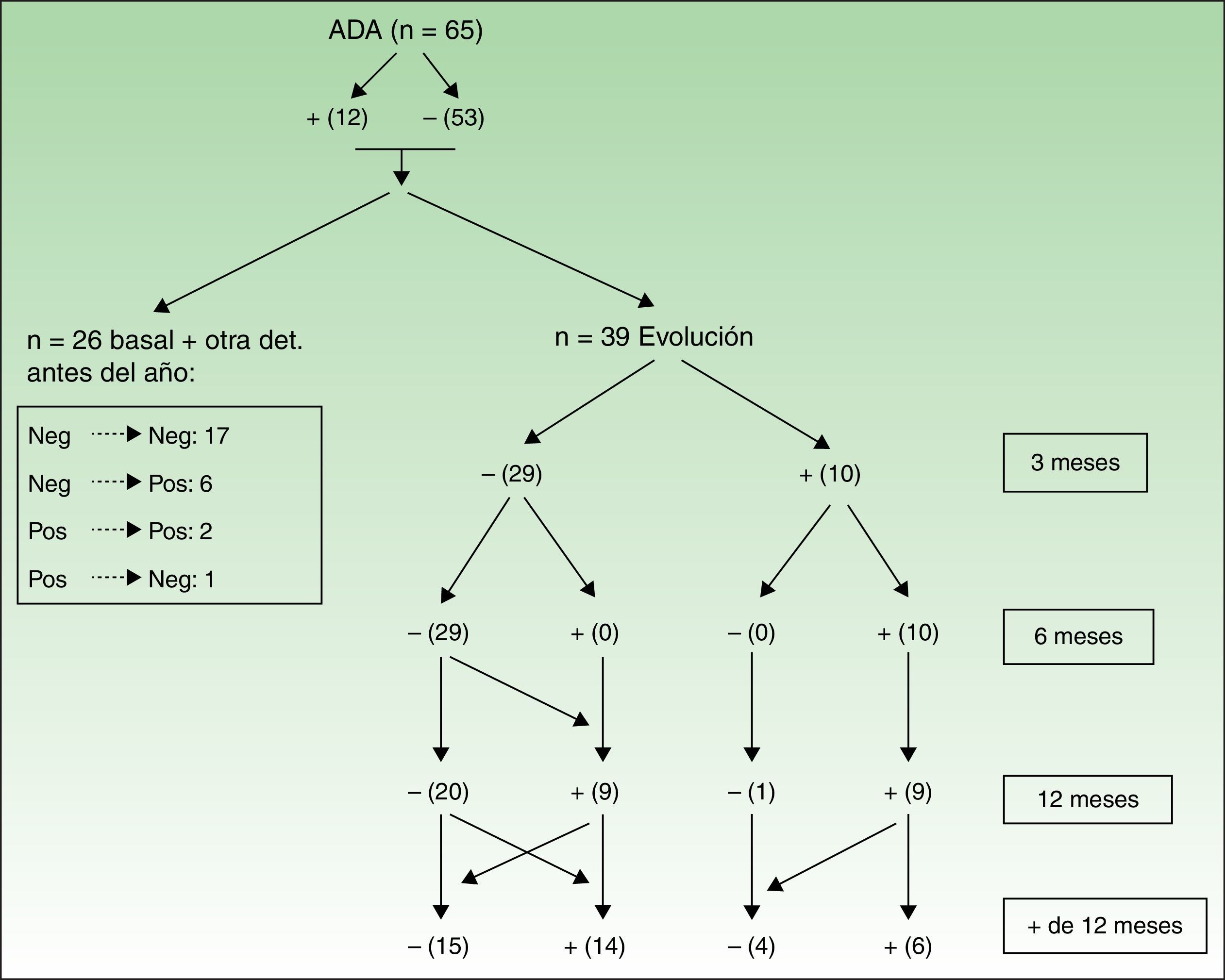
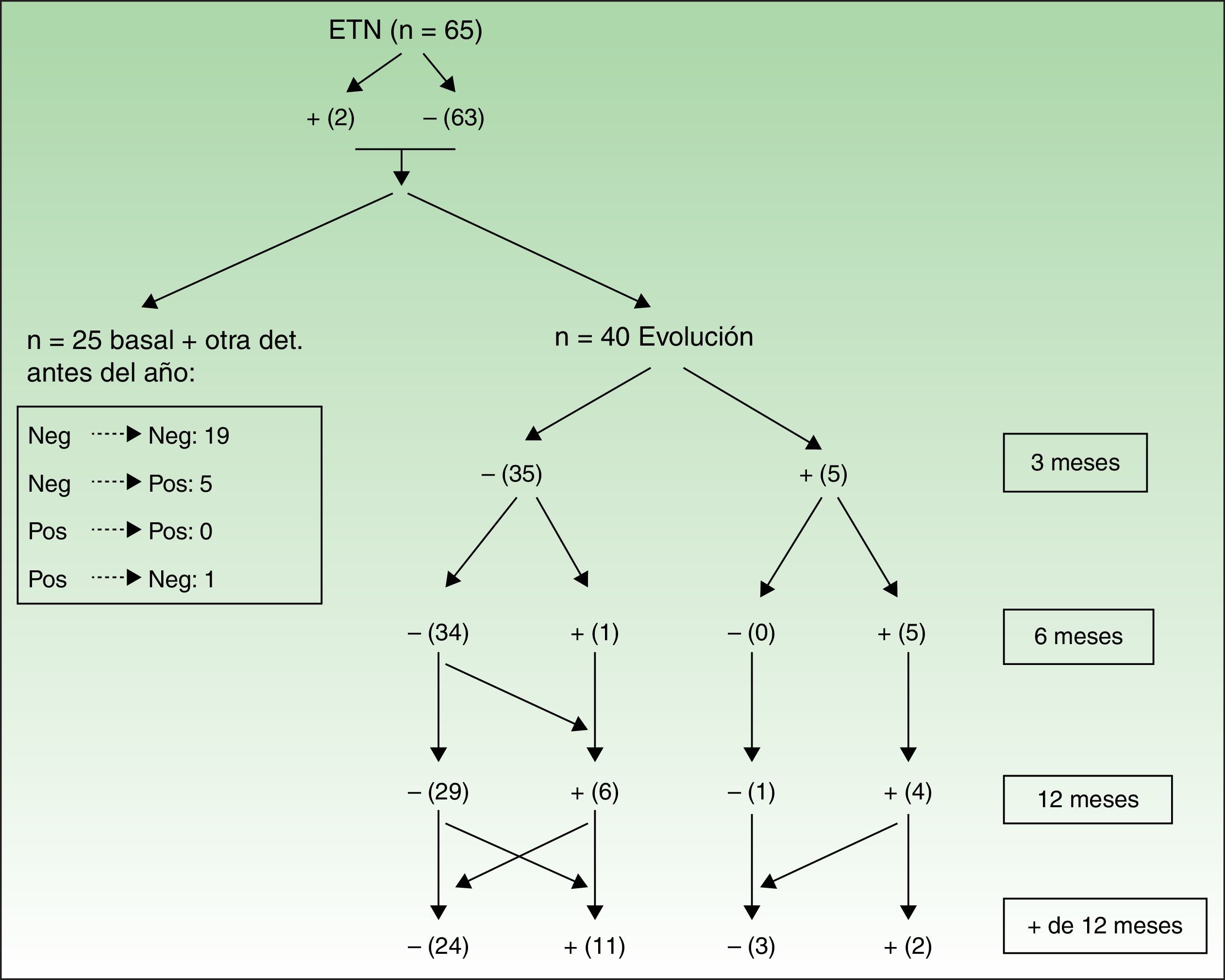
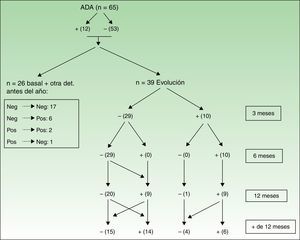
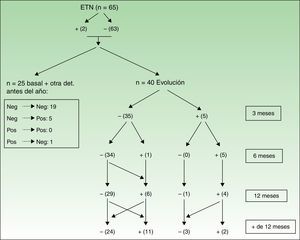
Las figuras 3 y 4 muestran las modificaciones que han sufrido los ANA durante el periodo de evaluación.
Evolución de los ANA tras tratamiento con adalimumab. Los valores en el recuadro de la izquierda son de aquellos pacientes que solo tenían la determinación basal y otra en menos de un año, lo que permitía que entraran en el estudio, pero no hacerles un seguimiento en el tiempo. En la parte de la derecha (evolución) se muestra la determinación de ANA en aquellos pacientes a los que sí se les pudo realizar ese seguimiento. Para construir la tabla se ha considerado que todos los pacientes en evolución tenían una determinación de ANA en todos los meses del seguimiento.
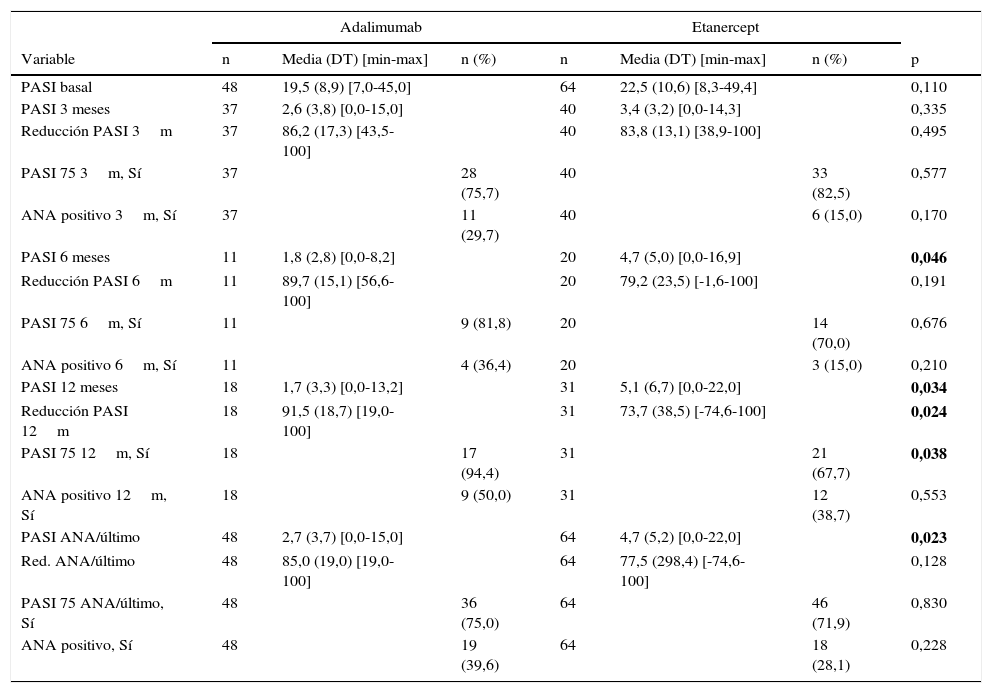
En el análisis de efectividad, se encuentran algunas diferencias a favor de ADA sobre ETN, al alcanzar un PASI medio absoluto menor a los 6 y 12 meses, y también globalmente (tabla 3). Sin embargo, este valor no es fiable debido a que el grupo de ADA partía de valores de PASI basales inferiores de forma estadísticamente significativa. En ningún momento del estudio se encontró una asociación entre presentar ANA positivo y alcanzar una mejoría del PASI del 75% (PASI 75) (tabla 4). Cuando se controla el efecto del tratamiento por medio de la prueba de Mantel-Haenszel, no se encontró que el tratamiento modificara significativamente la pauta de asociación entre PASI 75 y el desarrollo de ANA a los 3, 6, 12 meses ni globalmente.
Evolución del PASI y tiempo en el que se alcanza PASI 75 (Prueba de Mann-Whitney)
| Adalimumab | Etanercept | ||||||
|---|---|---|---|---|---|---|---|
| Variable | n | Media (DT) [min-max] | n (%) | n | Media (DT) [min-max] | n (%) | p |
| PASI basal | 48 | 19,5 (8,9) [7,0-45,0] | 64 | 22,5 (10,6) [8,3-49,4] | 0,110 | ||
| PASI 3 meses | 37 | 2,6 (3,8) [0,0-15,0] | 40 | 3,4 (3,2) [0,0-14,3] | 0,335 | ||
| Reducción PASI 3m | 37 | 86,2 (17,3) [43,5-100] | 40 | 83,8 (13,1) [38,9-100] | 0,495 | ||
| PASI 75 3m, Sí | 37 | 28 (75,7) | 40 | 33 (82,5) | 0,577 | ||
| ANA positivo 3m, Sí | 37 | 11 (29,7) | 40 | 6 (15,0) | 0,170 | ||
| PASI 6 meses | 11 | 1,8 (2,8) [0,0-8,2] | 20 | 4,7 (5,0) [0,0-16,9] | 0,046 | ||
| Reducción PASI 6m | 11 | 89,7 (15,1) [56,6-100] | 20 | 79,2 (23,5) [-1,6-100] | 0,191 | ||
| PASI 75 6m, Sí | 11 | 9 (81,8) | 20 | 14 (70,0) | 0,676 | ||
| ANA positivo 6m, Sí | 11 | 4 (36,4) | 20 | 3 (15,0) | 0,210 | ||
| PASI 12 meses | 18 | 1,7 (3,3) [0,0-13,2] | 31 | 5,1 (6,7) [0,0-22,0] | 0,034 | ||
| Reducción PASI 12m | 18 | 91,5 (18,7) [19,0-100] | 31 | 73,7 (38,5) [-74,6-100] | 0,024 | ||
| PASI 75 12m, Sí | 18 | 17 (94,4) | 31 | 21 (67,7) | 0,038 | ||
| ANA positivo 12m, Sí | 18 | 9 (50,0) | 31 | 12 (38,7) | 0,553 | ||
| PASI ANA/último | 48 | 2,7 (3,7) [0,0-15,0] | 64 | 4,7 (5,2) [0,0-22,0] | 0,023 | ||
| Red. ANA/último | 48 | 85,0 (19,0) [19,0-100] | 64 | 77,5 (298,4) [-74,6-100] | 0,128 | ||
| PASI 75 ANA/último, Sí | 48 | 36 (75,0) | 64 | 46 (71,9) | 0,830 | ||
| ANA positivo, Sí | 48 | 19 (39,6) | 64 | 18 (28,1) | 0,228 | ||
Se ha excluido a 5pacientes que presentaban un PASI inicial <5 debido a que se trataba de pacientes que procedían de otro tratamiento previo interrumpido por efectos adversos y que se sustituyó inmediatamente por el tratamiento estudiado.
ANA: anticuerpos antinucleares; DT: desviación típica; PASI: Psoriasis area and severity index.
En negrita se señala la p de las variables que alcanzaron significación estadística (p < 0,05).
Asociación entre la presencia de ANA+ y el PASI 75
| ANA mes 3 | Fisher | |||||||
|---|---|---|---|---|---|---|---|---|
| Negativo | Positivo | Total | p | |||||
| PASI 75 mes 3 | No | 11 | 18,3% | 5 | 29,4% | 16 | 20,8% | |
| Sí | 49 | 81,7% | 12 | 70,6% | 61 | 79,2% | 0,327 | |
| Total | 60 | 100,0% | 17 | 100,0% | 77 | 100,0% | ||
| ANA mes 6 | ||||||||
|---|---|---|---|---|---|---|---|---|
| Negativo | Positivo | Total | ||||||
| PASI 75 mes 6 | No | 7 | 29,2% | 1 | 14,3% | 8 | 25,8% | |
| Sí | 17 | 70,8% | 6 | 85,7% | 23 | 74,2% | 0,400 | |
| Total | 24 | 100,0% | 7 | 100,0% | 31 | 100,0% | ||
| ANA mes 12 | ||||||||
|---|---|---|---|---|---|---|---|---|
| Negativo | Positivo | Total | ||||||
| PASI 75 mes 12 | No | 6 | 21,4% | 5 | 23,8% | 11 | 22,4% | |
| Sí | 22 | 78,6% | 16 | 76,2% | 38 | 77,6% | 1,000 | |
| Total | 28 | 100,0% | 21 | 100,0% | 49 | 100,0% | ||
| ANA global | ||||||||
|---|---|---|---|---|---|---|---|---|
| Negativo | Positivo | Total | ||||||
| PASI 75 último | No | 18 | 24,0% | 12 | 32,4% | 30 | 26,8% | |
| Sí | 57 | 76,0% | 25 | 67,6% | 82 | 73,2% | 0,370 | |
| Total | 75 | 100,0% | 37 | 100,0% | 112 | 100,0% | ||
Cuando se controla el efecto del tratamiento por medio de la prueba de independencia condicional Mantel-Haenszel no se encontró que el tratamiento modificase significativamente la pauta de asociación entre PASI 75 y el desarrollo de ANA a los 3, 6, 12 meses y globalmente (p=0,603; p=0,898; p=0,926; p=0,444, respectivamente).
ANA: anticuerpos antinucleares, PASI: Psoriasis area and severity index.
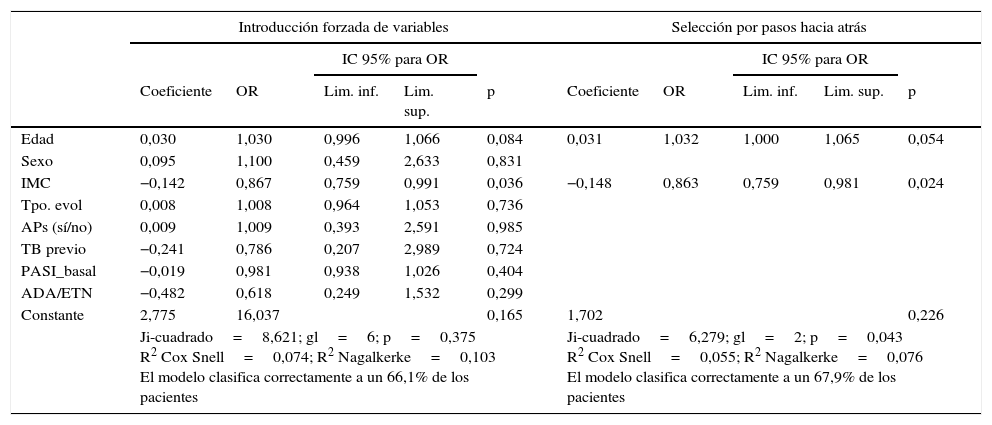
En cuanto a las variables relacionadas con el desarrollo de ANA, la única que se asoció significativamente fue el IMC (p=0,024) (tabla 5). El riesgo de desarrollo de ANA se reduce según aumenta el IMC, con una OR de 0,867 (IC 95%: 0,759-0,991), lo que indica que en el rango entre 20 y 30 el riesgo disminuye al aumentar el IMC. La variable edad no llega a alcanzar significación estadística (p=0,054). Aunque el ajuste global es significativo (p=0,043), la capacidad de las variables independientes para explicar la dependiente es muy pequeña (R2 de Cox y snell=0,055; R2 de Nagalkerke=0,076). Ninguna de las variables estudiadas se correlacionó con la capacidad de alcanzar una respuesta PASI 75.
Análisis de los factores relacionados con el desarrollo de ANA
| Introducción forzada de variables | Selección por pasos hacia atrás | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| IC 95% para OR | IC 95% para OR | |||||||||
| Coeficiente | OR | Lim. inf. | Lim. sup. | p | Coeficiente | OR | Lim. inf. | Lim. sup. | p | |
| Edad | 0,030 | 1,030 | 0,996 | 1,066 | 0,084 | 0,031 | 1,032 | 1,000 | 1,065 | 0,054 |
| Sexo | 0,095 | 1,100 | 0,459 | 2,633 | 0,831 | |||||
| IMC | −0,142 | 0,867 | 0,759 | 0,991 | 0,036 | −0,148 | 0,863 | 0,759 | 0,981 | 0,024 |
| Tpo. evol | 0,008 | 1,008 | 0,964 | 1,053 | 0,736 | |||||
| APs (sí/no) | 0,009 | 1,009 | 0,393 | 2,591 | 0,985 | |||||
| TB previo | −0,241 | 0,786 | 0,207 | 2,989 | 0,724 | |||||
| PASI_basal | −0,019 | 0,981 | 0,938 | 1,026 | 0,404 | |||||
| ADA/ETN | −0,482 | 0,618 | 0,249 | 1,532 | 0,299 | |||||
| Constante | 2,775 | 16,037 | 0,165 | 1,702 | 0,226 | |||||
| Ji-cuadrado=8,621; gl=6; p=0,375 R2 Cox Snell=0,074; R2 Nagalkerke=0,103 El modelo clasifica correctamente a un 66,1% de los pacientes | Ji-cuadrado=6,279; gl=2; p=0,043 R2 Cox Snell=0,055; R2 Nagalkerke=0,076 El modelo clasifica correctamente a un 67,9% de los pacientes | |||||||||
ADA: adalimumab; ANA: anticuerpos antinucleares; APs: artritis psoriásica; ETN: etanercept; IMC: índice de masa corporal; PASI: Psoriasis area and severity index; TB: tratamiento biológico; Tpo. evol: tiempo de evolución de la psoriasis.
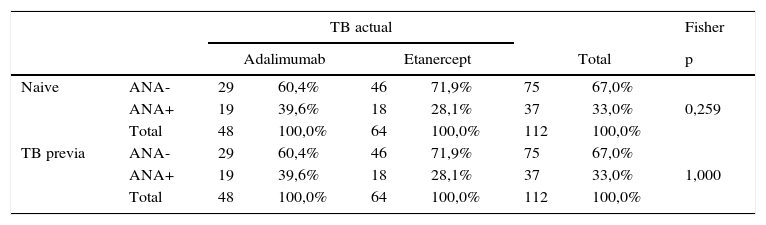
Ante la posibilidad de que el uso de un fármaco anti-TNF previo pudiera condicionar la aparición de ANA durante el tratamiento con un segundo anti-TNF, se analizó el orden de empleo de ADA (elevado porcentaje de segundos tratamientos) y ETN (elevado porcentaje de pacientes naïve de biológico). Sin embargo, no se observaron diferencias significativas entre la inducción de ANA y el haber empleado tratamiento biológico previo (naïve vs. 2.° o 3.er anti-TNFα) (tabla 6). La estimación de la OR común de Mantel-Haenszel fue de 0,544 (IC 95%: 0,229-1,292), lo que indica que no había indicios para rechazar la independencia entre las variables consideradas.
Presencia de ANA y empleo previo de tratamiento biológico previo (naïve vs. 2.° o 3.er anti-TNFα)
| TB actual | Fisher | |||||||
|---|---|---|---|---|---|---|---|---|
| Adalimumab | Etanercept | Total | p | |||||
| Naive | ANA- | 29 | 60,4% | 46 | 71,9% | 75 | 67,0% | |
| ANA+ | 19 | 39,6% | 18 | 28,1% | 37 | 33,0% | 0,259 | |
| Total | 48 | 100,0% | 64 | 100,0% | 112 | 100,0% | ||
| TB previa | ANA- | 29 | 60,4% | 46 | 71,9% | 75 | 67,0% | |
| ANA+ | 19 | 39,6% | 18 | 28,1% | 37 | 33,0% | 1,000 | |
| Total | 48 | 100,0% | 64 | 100,0% | 112 | 100,0% | ||
ANA: anticuerpos antinucleares; TB: terapia biológica.
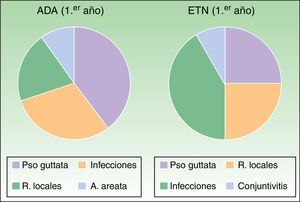
En el análisis de efectos adversos se pudo comprobar que durante el primer año de seguimiento en el grupo de ADA se describieron 4 casos que podrían considerarse como desarrollados por un posible mecanismo autoinmunitario (un caso de reacción psoriasiforme paradójica guttata, 2reacciones locales en la zona de administración del fármaco y un paciente con alopecia areata, fig. 5).
Posteriormente, a los 2 y 3 años se produjeron 2nuevos casos de reacciones psoriasiformes en gota, y a los 5 años un caso de urticaria. Entre los efectos adversos graves que aparecieron en algunos pacientes se incluyeron el de un paciente con hernia cervical y lumbar y el de otro con fractura de húmero, que requirieron hospitalización, un adenocarcinoma de cabeza de páncreas, un carcinoma papilar renal de tipo I y, finalmente, un paciente que desarrolló enfermedad de Alzheimer.
En el grupo de ETN, durante el primer año, tan solo se describieron 4casos de psoriasis paradójica guttata y 3 reacciones locales (fig. 5) como eventos de posible origen autoinmune. En el seguimiento posterior, solo se describieron infecciones del tracto respiratorio leves, un aborto, un deterioro cognitivo de tipo Alzheimer, EPOC, 2operaciones de cataratas, 2herniorrafias y un caso de lumbociatalgia. No se ha descrito la aparición de caso alguno de lupus eritematoso, otra conectivopatía o vasculitis. Los potenciales casos de posible origen autoinmune descritos previamente no se correlacionan con el desarrollo de ANA en nuestros pacientes.
DiscusiónLos anti-TNFα proporcionan un gran beneficio en aquellos pacientes con psoriasis moderada-grave que ya han sido tratados inefectivamente con otras opciones terapéuticas. Sin embargo, la positivización de autoanticuerpos y reacciones adversas derivadas han obligado a emplearlos con cuidado en pacientes con algún tipo de enfermedad autoinmune5,7,9. Viana et al. consideran que tener un patrón de ANA homogéneo basal y anticuerpos anti-dcADN suponen un factor de riesgo más elevado a la hora de predisponer al desarrollo de enfermedades autoinmunes, como el lupus eritematoso13.
En la revisión de la literatura, existe controversia sobre la posible predisposición que el uso previo de un fármaco anti-TNFα puede tener sobre la eficacia, el desarrollo de ANA o de enfermedades autoinmunes durante el tratamiento con un 2.° o 3.er anti-TNF6,14. En nuestro estudio no hemos observado asociación alguna entre dichas variables y el tratamiento previo con biológicos, lo cual puede indicar que su aparición podría estar ligada con la susceptibilidad genética. Dado el posible aumento transitorio de anticuerpos secundario a infección estreptocócica explicado por la similitud estructural entre la proteína M estreptocócica y la queratina 12, algunos autores recomiendan comprobar si los pacientes tuvieron una infección en el momento de la medición de los ANA1.
En este trabajo, además del tratamiento previo, analizamos otras variables potencialmente predictoras del desarrollo de ANA, como la asociación de artritis psoriásica, sexo o PASI basal. No obstante, no se demostró una asociación estadísticamente significativa. «Aunque próxima, la variable edad no llega a alcanzar significación estadística (p=0,054). No hemos encontrado referencia en la bibliografía que asocie la variable edad con la aparición de ANA en pacientes tratados con terapia biológica». El IMC fue el único parámetro asociado, pero como variable protectora, sin que sepamos dar una explicación razonable al respecto o haya sido referido previamente en la literatura.
Estudios recientes han propuesto que el desarrollo de anticuerpos podría deberse a la disminución de algunas citocinas que participan en el aclaramiento del material nuclear en la apoptosis (como sería el caso de la proteína C reactiva) lo que daría lugar a una mayor predisposición a la formación de anticuerpos contra el material nuclear y el desarrollo de autoinmunidad. También se ha descrito la posibilidad de que se deba a alteraciones de la apoptosis celular, que podrían provocar la liberación de antígenos del nucleosoma y la formación de anticuerpos anti-dcADN en individuos predispuestos. Bardazzi et al. comentan que mientras ADA e infliximab inhiben la fracción transmembrana y soluble del TNFα, ETN inhibiría solo la soluble, lo que podría dar lugar a una menor apoptosis celular y menor desarrollo de autoanticuerpos (si bien no explicaría el hecho de que ADA tenga menos desarrollo de ANA que infliximab)1. No obstante, estas hipótesis no han sido confirmadas, y dependerían en gran medida de la susceptibilidad de cada individuo al fármaco3,7,10,15.
Aunque el desarrollo de ANA con la administración de estos fármacos parece ser bastante común (33,3-77% según las series)1,4,13, el desarrollo de enfermedades autoinmunes es bastante infrecuente en la psoriasis (<1%), hecho que también se muestra en nuestro estudio, dado que a lo largo de todo el seguimiento solo aparecieron un caso de alopecia areata y varias reacciones psoriasiformes paradójicas como situaciones de potencial origen autoinmune. Podría deberse a los isotipos de anticuerpos anti-dcADN inducidos por los fármacos: mientras que en otras enfermedades autoinmunes las formas IgG son las que participan en la patogenia de la enfermedad, los fármacos anti-TNF desarrollan anticuerpos anti-dcADN IgM e IgA2–4.
Por otra parte, es bien conocido que algunos pacientes desarrollan resistencia al uso de los agentes anti-TNFα, motivo de fracasos secundarios de eficacia. Aunque se desconoce el mecanismo que provoca esta situación, Pink et al. han propuesto que la positividad de los ANA durante el tratamiento podría predisponer a un fallo en la respuesta al fármaco7. Por el contrario, en otros estudios no se ha observado relación alguna entre el desarrollo de anticuerpos y la pérdida de respuesta al tratamiento1,8. Incluso Lora et al. han mostrado una tendencia que implica una mejor respuesta al fármaco con el desarrollo más rápido de ANA15. En nuestro caso, la prueba exacta de Fisher no demostró una correlación entre la aparición de ANA y la respuesta clínica al fármaco (PASI 75).
Entre las limitaciones del estudio se debe tener en cuenta: 1) su diseño retrospectivo, con cierta pérdida de información, dado que no todos los datos se recogieron en todas las visitas; 2) el número de pacientes limitado, cierta variabilidad entre ellos, además de un periodo de seguimiento variable; 3) las limitaciones de las técnicas utilizadas para la detección de los ANA y otros autoanticuerpos, que pueden presentar falsos positivos y negativos.
Conclusiones- •
Durante el tratamiento de la psoriasis moderada-grave con ADA y ETN se produce un aumento significativo en la positivización de los ANA, no acompañada del desarrollo de enfermedades autoinmunes. Por el contario, no se observa una positivización significativa de los anticuerpos anti-dcADN o anti-ENA.
- •
No se observa correlación entre la aparición de los ANA y la efectividad del tratamiento, el orden cronológico de utilización de los fármacos anti-TNF ni la aparición de efectos adversos. Tampoco se demuestran factores predictores del desarrollo de ANA excepto el IMC (inversamente proporcional).
- •
Recomendamos la determinación de ANA y despistaje de enfermedades autoinmunes previamente al tratamiento con fármacos anti-TNF, pero no una determinación seriada y rutinaria durante el seguimiento, excepto en aquellos casos en los que existan signos o síntomas de sospecha de enfermedad autoinmune.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a Cristina Carazo por su colaboración en la recogida de información y trabajo con la base de datos, y a Jesús Garrido por el análisis estadístico.