En ocasiones el carcinoma epidermoide cutáneo se caracteriza por tener un mayor riesgo de desarrollar recurrencia locorregional y ocasionalmente metástasis a distancia. Existen diversos factores clínico-patológicos de reconocido valor pronóstico, entre ellos la presencia de infiltración perineural. Esta consiste en la diseminación de células tumorales a través de los nervios, siendo en la mayoría de los casos un hallazgo incidental. Cuando aparecen síntomas y/o evidencia radiológica de la extensión de la infiltración perineural, se clasifica como infiltración perineural clínica y se asocia a un mayor riesgo de recurrencia local y de mortalidad.
Cutaneous squamous cell carcinoma is sometimes characterized by an increased risk of locoregional recurrence and occasionally distant metastasis. Several clinical and pathological factors, including perineural invasion, have been shown to have prognostic value in this setting. Perineural invasion, that is, the spread of tumor cells into the space surrounding a nerve, is usually an incidental finding. In the presence of symptoms or radiographic evidence of perineural spread, the diagnosis is clinical perineural invasion, which is associated with an increased risk of local recurrence and mortality.
La infiltración perineural (IPN) fue descrita por primera vez por Cruveilhier2 en 1835, en un caso de afectación del nervio facial por un carcinoma mamario. Se define como la infiltración de células tumorales a través de los nervios, que se extienden por el espacio perineural1 mostrando poca tendencia a invadir el nervio en profundidad. Por tanto, la IPN no es una variedad de diseminación linfática ni hemática, sino que representa una extensión directa del tumor primario3,4.
EpidemiologíaLa IPN en los tumores cutáneos está infravalorada, y con frecuencia pasa desapercibida tanto clínica como radiográficamente. La incidencia en carcinoma epidermoide cutáneo (CEC) es del 2,4 al 14%5–7, asciende al 24% en los CEC recurrentes8, y si nos referimos exclusivamente a los CEC de mucosas de cabeza y cuello9, es del 29%.
También varía según el tamaño tumoral, estando presente en el 64% de los tumores mayores de 2,5cm y en el 11% de los tumores menores de 2,5cm10, y el subtipo histológico, siendo más frecuente en los CEC pobremente diferenciados9.
La edad media11 de los pacientes se sitúa en los 64 años, con un claro predominio por el sexo masculino (77%).
PatogénesisInicialmente, se creía que consistía en una propagación linfática del tumor a los nervios. Posteriormente se consideró a la vaina del nervio como una vía de baja resistencia para la diseminación del tumor10, teoría que ha quedado refutada al demostrar con microscopía electrónica la elevada selectividad de la barrera hematoneural4,12,13.
En la actualidad se considera que la IPN se produce por invasión, como resultado de la interacción recíproca y dinámica entre el tumor y las terminaciones nerviosas4,14. Se han identificado varios agentes neurotrópicos implicados: el factor de crecimiento neural15, la molécula de adhesión neural celular16,17, el factor neurotrófico derivado del cerebro, la neurotrofina 34.
En un estudio reciente, Binmadi et al. muestran que plexin-B1 (un subtipo de proteínas que interviene en la adhesión de las células nerviosas y la migración de los axones durante el desarrollo18) se sobreexpresa en tejidos y líneas celulares de neoplasias neurotrópicas y promueve que los nervios expresen su ligando, semaforina 4D, a través de la vía Rho/Rho quinasa-dependiente19. Los tumores atraen a los nervios a través de este mismo sistema de proteínas, lo que sugiere que tanto la plexina B1 como la semaforina 4D son importantes en la promoción de la PNI.
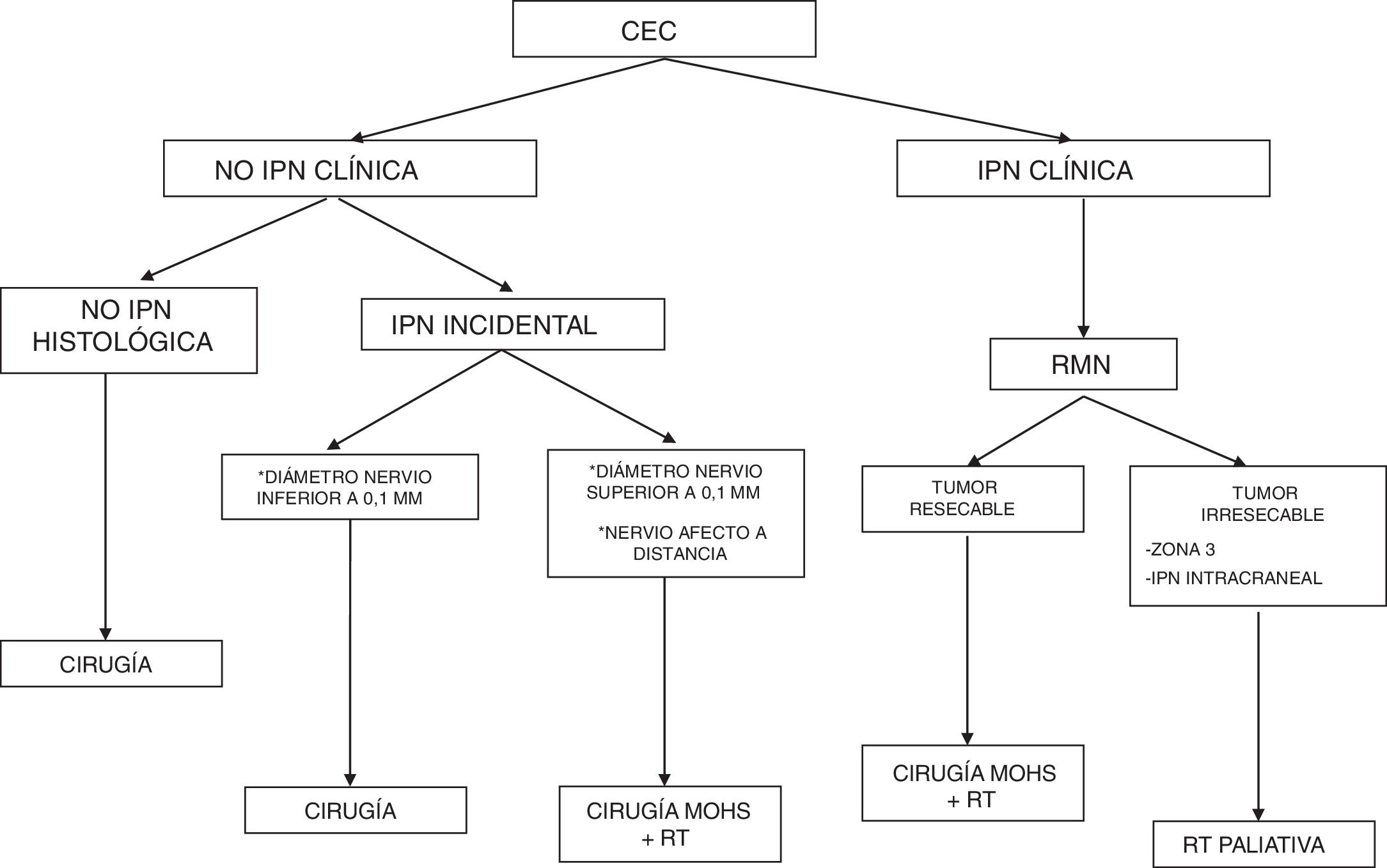
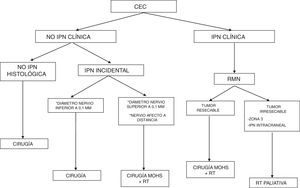
DiagnósticoClasificación de la infiltración perineuralEn el 60-70% de los pacientes con CEC e IPN esta se presenta como un hallazgo incidental, es decir, se identifica en el estudio histológico del tumor tras la cirugía, sin sintomatología ni evidencia radiológica, denominándose IPN incidental o microscópica20,21.
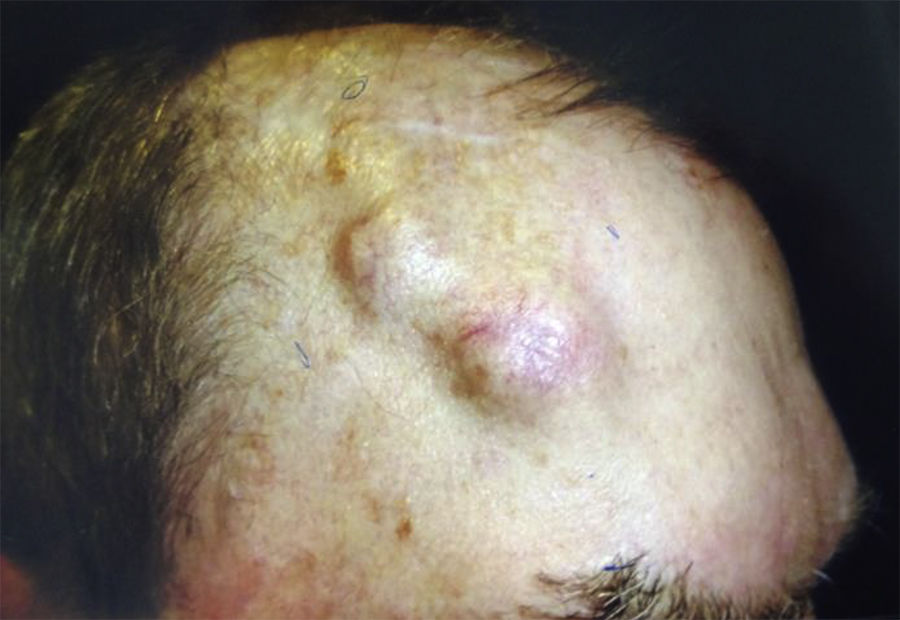
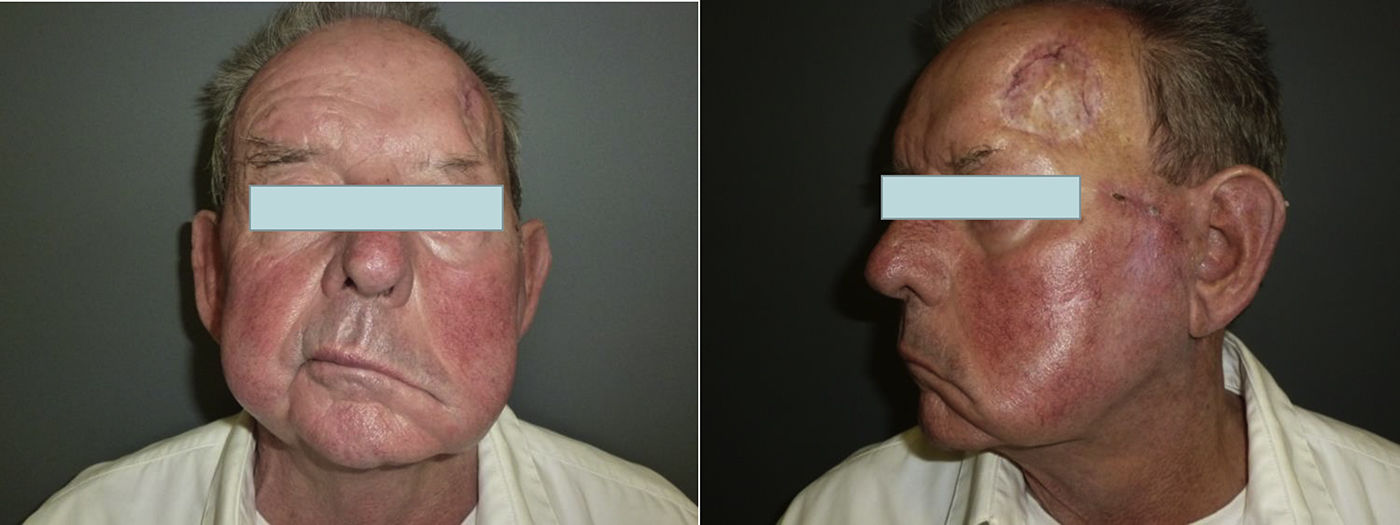
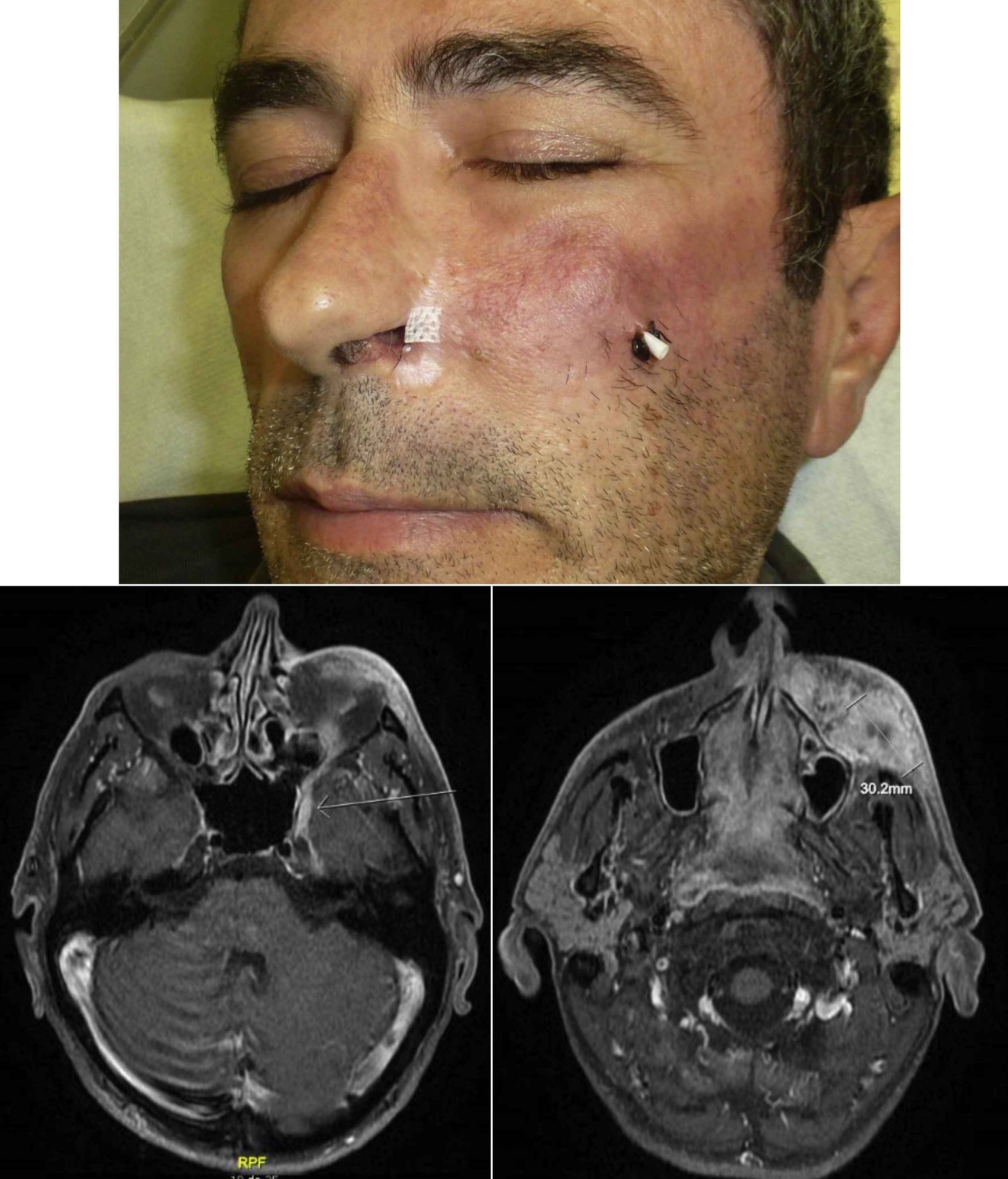
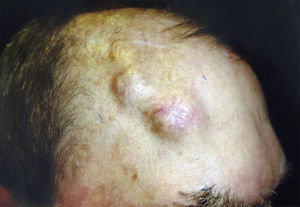
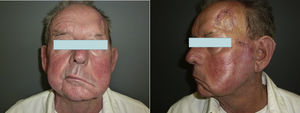
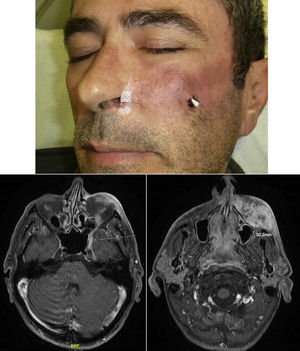
Cuando aparecen síntomas como dolor, parestesias, disestesias, anestesia o parálisis y/o evidencia radiológica de la extensión de la IPN, se clasifica como IPN clínica22,23 (fig. 1). Los primeros síntomas suelen ser muy sutiles, sensación de hormigueo o entumecimiento, pudiendo pasar desapercibidos salvo que se tenga un alto índice de sospecha de IPN24. El hecho de que en ocasiones en las pruebas de imagen de pacientes con IPN clínica no se observan alteraciones, aún dificulta más su manejo25,26. En casos más avanzados puede aparecer dolor o déficit motor (fig. 2).
De esta forma puede diagnosticarse erróneamente de parálisis de Bell, neuralgia del trigémino o accidente cerebrovascular, demorando el diagnóstico y con ello empeorando el pronóstico de estos pacientes27.
Anatomía de los nervios de la región facialEl nervio facial y el trigémino son los nervios que con mayor frecuencia se ven afectados, especialmente la rama maxilar28,29, habiéndose descrito casos aislados de CEC fuera de cabeza y cuello con IPN clínica30,31.
Es fundamental conocer su distribución anatómica para entender la IPN, así como su abordaje terapéutico32–34.
Nervio trigéminoEs el nervio craneal más vulnerable para la IPN de cáncer cutáneo, debido a la rica inervación cutánea en la mayoría de las regiones expuestas a los rayos UV de la cabeza y el cuello. Emerge de la protuberancia, con una raíz sensitiva y una raíz motora. Su ganglio sensitivo (semilunar) asienta en la caverna trigeminal, en el suelo de la fosa craneal media. Desde la porción distal del ganglio, se divide en tres ramas:
-V1: la rama oftálmica entra en la órbita a través de la fisura orbitaria superior. Antes de entrar en ella da sus tres ramas principales: lacrimal, frontal y nasociliar. La rama terminal es el nervio supraorbitario.
-V2: la rama maxilar es un nervio sensitivo que sale por el agujero redondo mayor, atraviesa la fosa pterigomaxilar y el suelo de la órbita. Al llegar al agujero infraorbitario, ingresa en la región geniana, donde pasa a llamarse nervio infraorbitario.
-V3: la rama mandibular nace del ganglio de Gasser como un nervio sensitivo; se dirige hacia el agujero oval, por el que ingresa en la fosa cigomática. Durante su paso por este agujero, la raíz motora del trigémino se funde a él, convirtiéndolo así en nervio mixto.
Su raíz sensitiva se divide en tres ramas: el nervio auriculotemporal, que se dirige a la glándula parótida donde se anastomosa con ramas del nervio facial; el nervio lingual; y nervio alveolar inferior, que sale por el agujero mentoniano como nervio mentoniano.
La raíz motora se divide en los nervios masticador y milohioideo.
Nervio facialEs junto con el trigémino, el que más frecuentemente se encuentra implicado, especialmente en casos de CEC que metastatizan en la glándula parótida.
Emerge del surco bulboprotuberancial, alcanza la cisterna del ángulo pontocerebeloso, y se introduce en el conducto auditivo interno, en el que se diferencian tres segmentos: laberíntico, timpánico y mastoideo. Posteriormente, el nervio facial sale del cráneo por el agujero estilomastoideo y se introduce en la glándula parótida donde se divide en dos troncos mayores: cervicofacial, que a su vez se divide en maxilar, mandibular y cervical; y temporofacial, que se divide en dos, rama temporal y rama cigomática.
HistologíaLos nervios periféricos están formados por haces de fibras nerviosas, envueltas por tres capas denominadas epineuro, perineuro y endoneuro. El endoneuro es tejido conectivo laxo que rodea cada fibra nerviosa individual; el perineuro es tejido conectivo especializado que rodea cada fascículo de fibras nerviosas; y el epineuro es tejido conectivo denso no modelado que rodea todo un nervio periférico y llena los espacios entre los fascículos nerviosos. El perineuro es el componente principal de la barrera hematoneural y tiene una permeabilidad altamente selectiva.
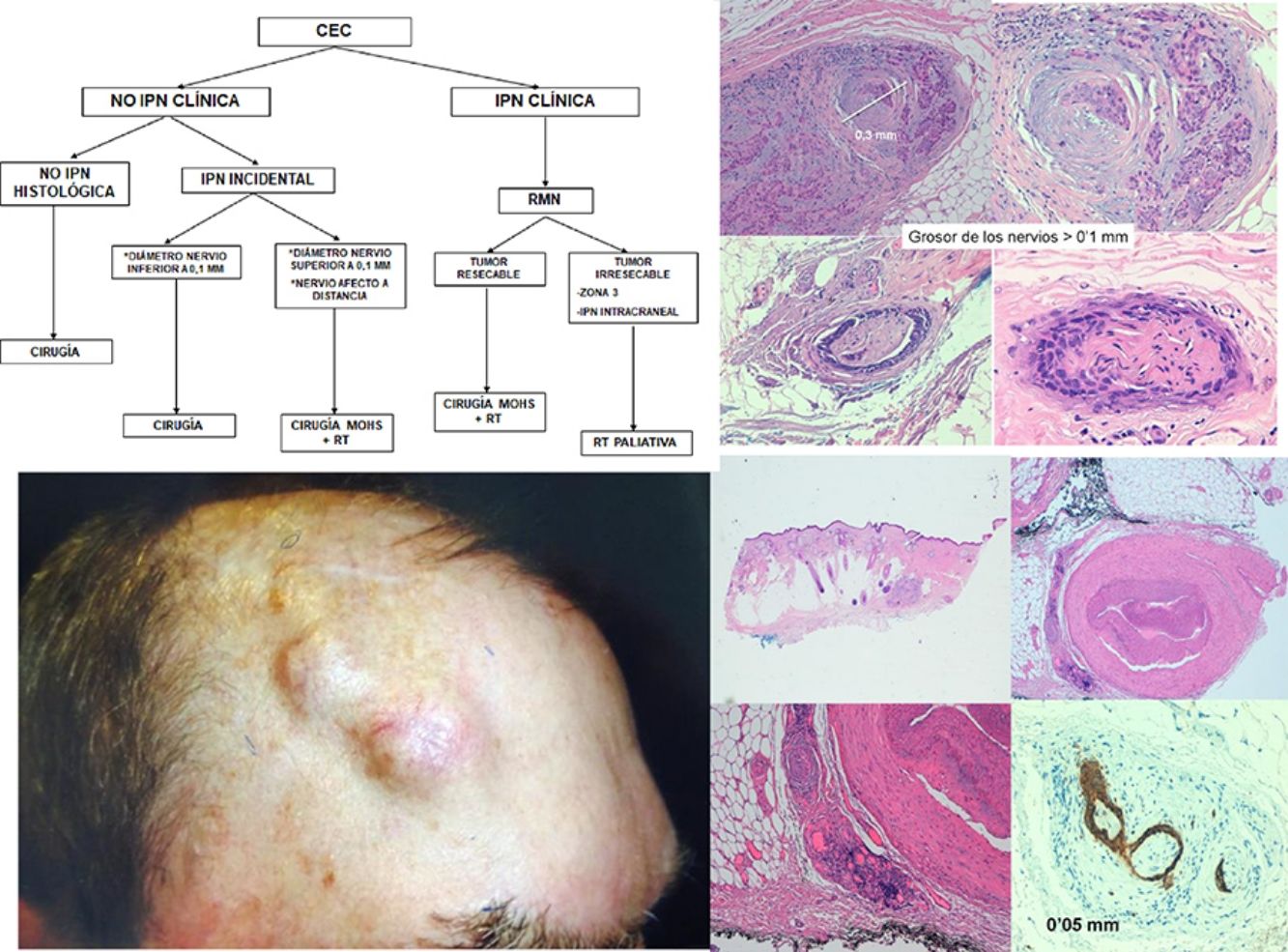
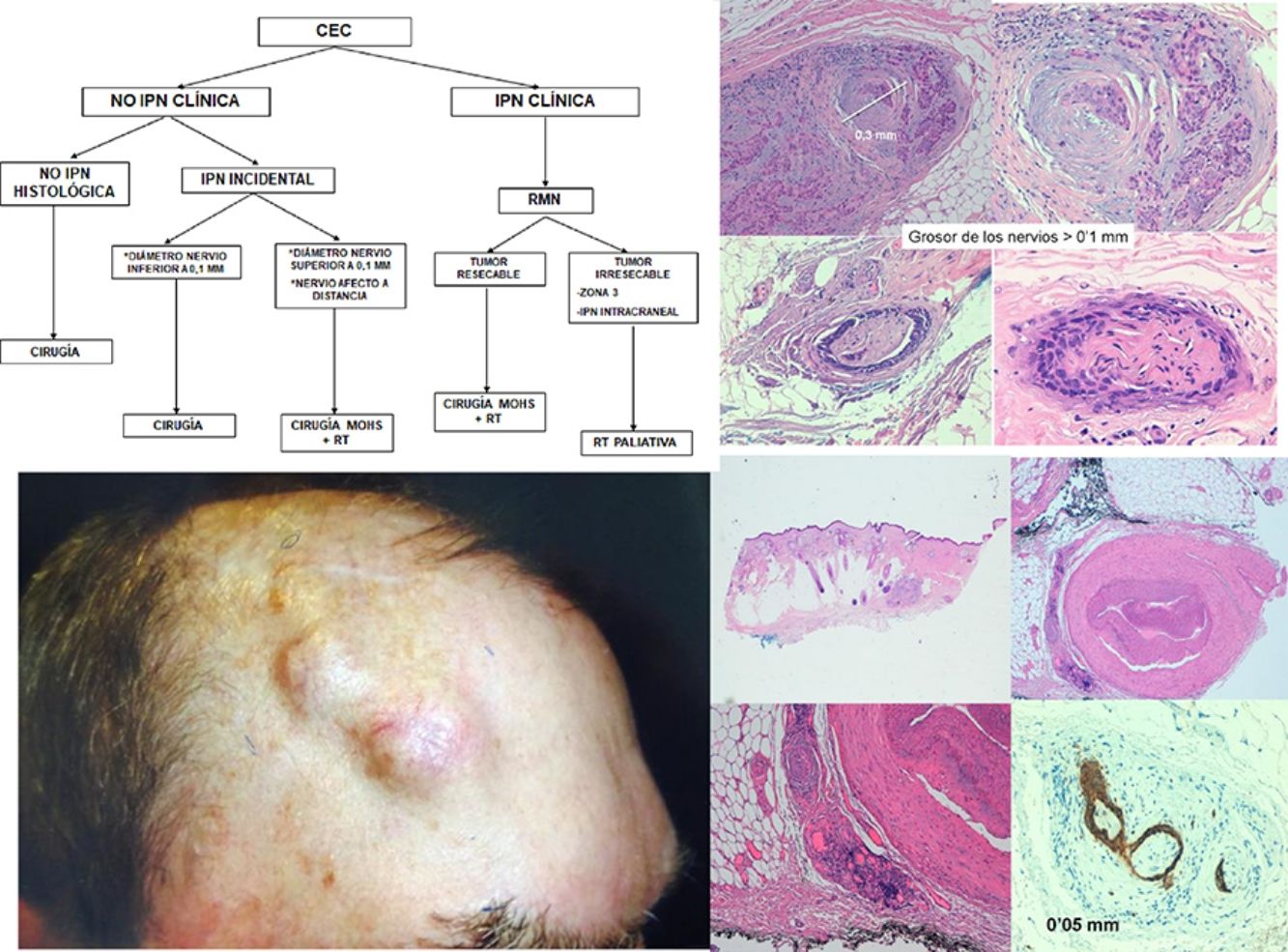
En la actualidad no existe una definición unificada de IPN, al existir controversia para establecer los criterios histológicos. Dunn et al.1 proponen los siguientes hallazgos diagnósticos: en presencia de una neoplasia maligna, la IPN puede diagnosticarse con la observación de células citológicamente malignas en el espacio perineural de los nervios. En casos ambiguos, es útil la afectación circunferencial total o casi total, así como la presencia de un seguimiento perineural en las secciones tangenciales y la afectación intraneural.
Por el contrario, Liebig et al.4 afirman que encontrar células tumorales dentro de cualquiera de las 3 capas de la cubierta del nervio o focos tumorales fuera del nervio con la participación del 33% de la circunferencia del nervio son características suficientes para definir la IPN.
Es importante tener presente que existen simuladores de IPN42–44: la fibrosis peritumoral, la inflamación perineural, la presencia de epitelio escamoso en áreas de exéresis previas o el neuroma de las vainas epiteliales. Para establecer el diagnóstico definitivo son muy útiles las técnicas de inmunohistoquímica.
RadiologíaLa resonancia magnética es la técnica de imagen más sensible para diagnosticar la IPN32,45–47. Al estudiar el trayecto neural en su totalidad, permite evaluar la presencia, así como la extensión de la IPN en aquellos pacientes que presenten signos o síntomas de afectación neurológica y con ello, planificar la actitud terapéutica. Los hallazgos primarios48 son: la captación de toda la circunferencia del nervio en las secuencias T1 con gadolinio, el aumento del calibre normal del nervio y la obliteración de planos grasos yuxtaforaminales (fig. 3).
Se ha descrito como signo indirecto49,50 de IPN, la atrofia por denervación cuando existe afectación de una rama motora. Esto se ve en resonancia magnética como hiperintensidad de señal en imágenes T2 con realce en las fases agudas (edema por denervación) y menor volumen muscular e infiltración grasa en las fases tardías.
Estos signos radiológicos pueden persistir indefinidamente a pesar de la mejoría clínica, por tanto, se sospechará recidiva cuando la lesión crezca o progresen los síntomas.
El TAC45,47 es menos sensible, sin embargo es muy útil para valorar los cambios óseos: alteraciones en la cortical, forma y tamaño de los forámenes nerviosos, así como la dilatación foraminal y la erosión ósea en los casos más avanzados.
El PET51 es de gran utilidad en los cánceres de cabeza y cuello, detecta la invasión linfática, la presencia de metástasis y de tumor residual o recurrente, pero hasta el momento no existen análisis de su sensibilidad para identificar IPN, posiblemente tenga una sensibilidad muy baja, ya que solo detecta recidivas o metástasis a partir de un determinado tamaño (lesiones mayores de 1,5-2cm en la mayoría de los casos).
Si las pruebas de imagen demuestran IPN intracraneal o diseminación perineural, la lesión se puede considerar irresecable.
PronósticoEn ausencia de otros factores de riesgo, si el calibre de los nervios afectos es inferior a 0,1mm y no se encuentra en proximidad al tumor primario, la presencia de IPN no augura un peor pronóstico, por ello no se considera necesaria la terapia adyuvante en estos casos35,36.
Campoli9 revela que aunque la IPN incidental es un hallazgo infrecuente en el CEC, está asociada con marcadores previos de mal pronóstico: el tamaño del tumor, la profundidad de este, factores de riesgo clínico y la extensión subclínica significativa. Sugiere que la IPN incidental puede servir como marcador para mejorar la precisión en la evaluación pronóstica de estos pacientes.
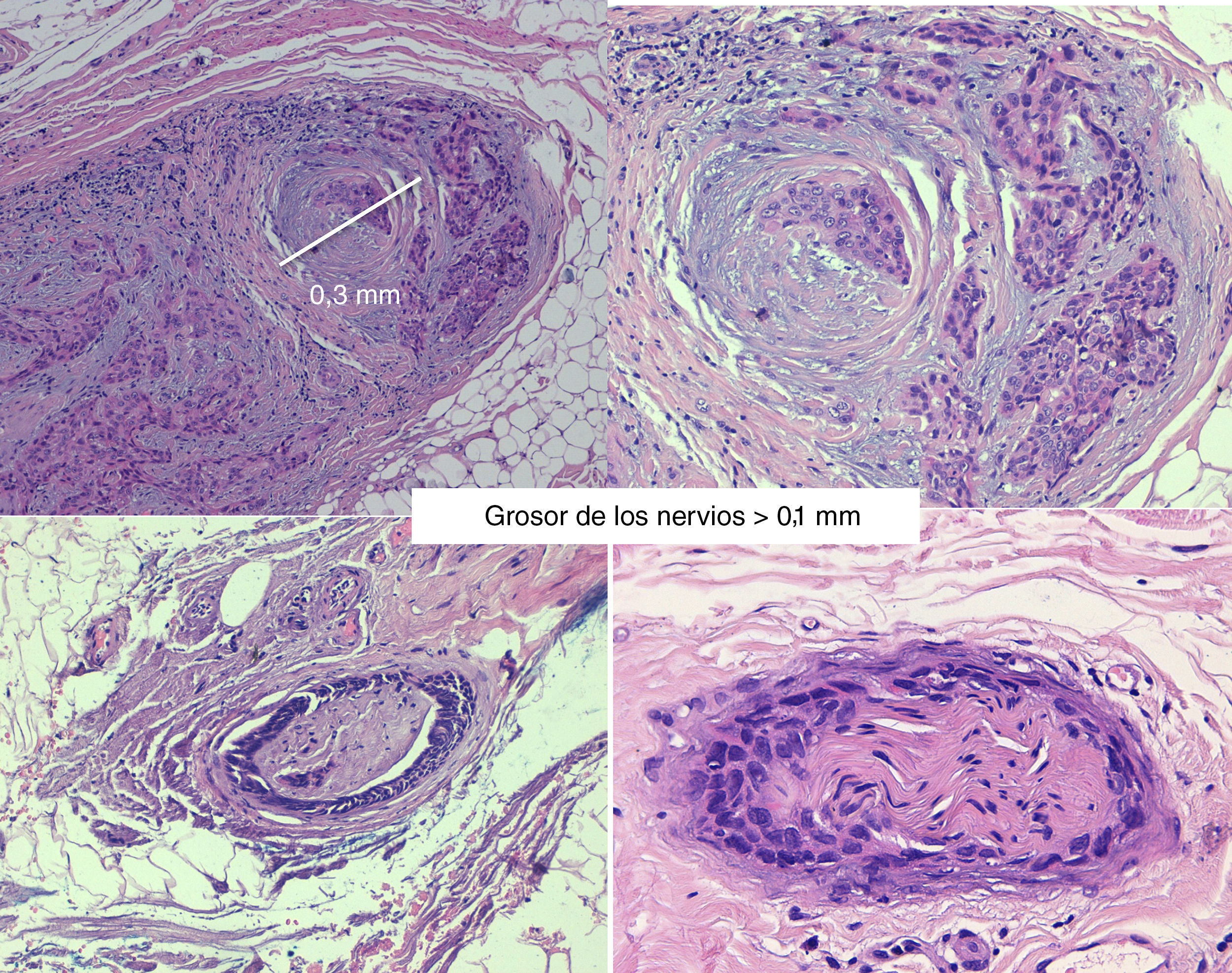
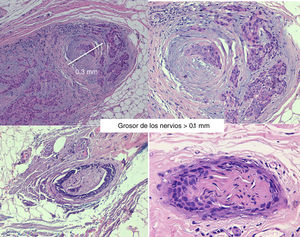
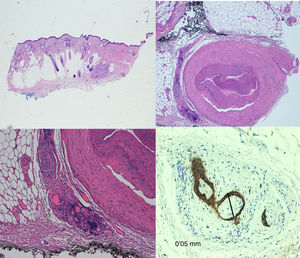
La invasión de nervios más gruesos o a distancia del foco principal del tumor35 independientemente de su diámetro (figs. 4 y 5), implica un peor pronóstico. Clayman et al. objetivaron una supervivencia específica de la enfermedad a 3 años del 64% en pacientes con CEC con IPN, frente al 91% para CEC sin IPN40.
En una revisión sistémica realizada recientemente a partir de 12 estudios recogiendo 640 CEC con IPN, se determina que no existen diferencias en el riesgo de metástasis ganglionares o a distancia entre pacientes con IPN microscópica y pacientes con IPN clínica, sin embargo, estos últimos tienen mayor riesgo de recurrencia local y un riesgo de muerte del 30%37–39,41.
Clasificación zonalWilliams et al.47 describieron la clasificación zonal para determinar la extensión de la IPN a lo largo de los nervios facial y trigémino en la RMN y con ello la posibilidad de resección quirúrgica. Se distinguen tres zonas: distal (zona 1), base del cráneo (zona 2), cisternal (zona 3) (tabla 1).
Clasificación zonal para IPN en tumores de cabeza y cuello
| Zona 1 |
| V1: hasta la fisura orbitaria superior |
| V2: hasta la apertura externa del foramen redondo mayor |
| V3: hasta la apertura externa del foramen oval |
| VII: hasta la apertura externa del forman estilomastoideo |
| Zona 2 |
| V1, V2 y V3: desde la zona 1 al ganglio de Gasser |
| VII: desde la zona 1 al extremo lateral del CAI |
| Zona 3 |
| Todo el nervio desde el ganglio de Gasser o CAI hasta las cisternas o tronco del encéfalo |
Esta clasificación ha demostrado ser también un importante predictor de evolución adversa52, con tasas de supervivencia a los 5 años del 85,7% para la zona 1, del 64,4% para la zona 2 y del 20% para la zona 3.
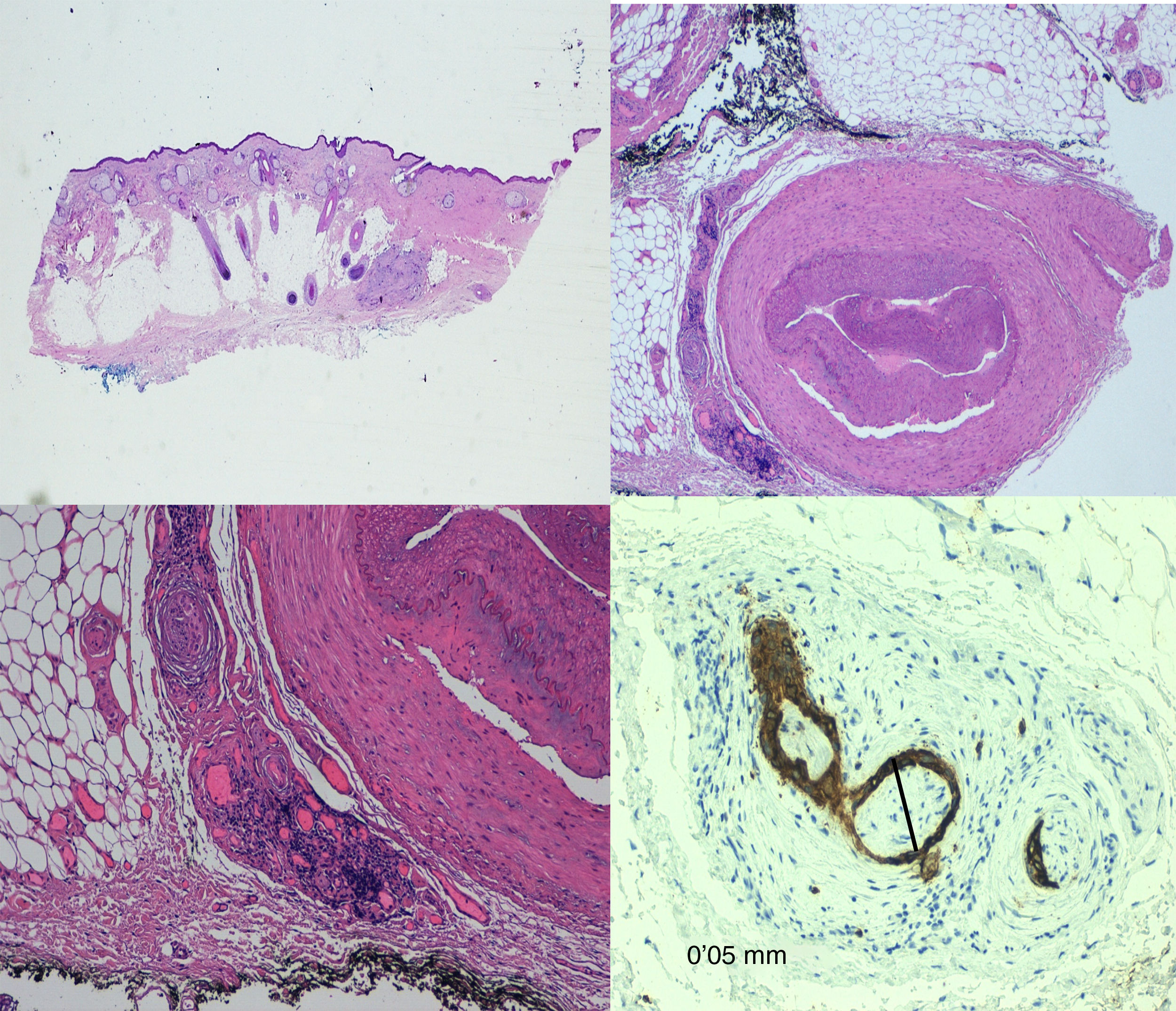
TratamientoLa cirugía de Mohs53,54 se considera la técnica de elección para el tratamiento del CECAR, al lograr tasas de recurrencia inferiores, así como una mayor sensibilidad para la detección de la IPN que la cirugía estándar, ya que permite examinar los márgenes laterales y profundos en su totalidad, proporcionando la mejor semejanza de extirpación tumoral completa. Posiblemente la técnica más empleada es la variante diferida con pieza fijada en formol (fig. 6).
Rowe et al.55 demostraron tasas de recurrencia local del 47% para la cirugía convencional y del 0% para la cirugía de Mohs. Cottel5 a partir de 17 casos de CEC con IPN tratados con cirugía de Mohs con un periodo de seguimiento de 42 meses, no recoge ningún caso de recidiva local y uno de metástasis (5,9%). En un estudio retrospectivo con 70 pacientes tratados con cirugía de Mohs, Leibovitch et al.11 demostraron una tasa de recurrencia del 8% en 5 años.
La presencia de infiltrado inflamatorio entorno a un nervio, al considerarse marcador de IPN, indica la necesidad de continuar estudiando el nervio hasta encontrar células tumorales o hasta que dicha inflamación desaparece. Incluso, sin que el infiltrado inflamatorio esté presente, se han objetivado en etapas sucesivas, lesiones a distancia, de hasta 14cm más allá del sitio inicial del tumor, lo que se conoce como «skip lesions56». Estas podrían ser una explicación para la tasa relativamente más alta de recidiva posquirúrgica de CEC con IPN en comparación con lesiones sin IPN.
Por ello, algunos investigadores consideran que se debería tomar un margen de seguridad adicional con cirugía de Mohs, incluso después de obtener un margen histológico negativo en los casos con IPN11. Por el contrario, otros no lo recomiendan, al considerar, que la presencia y localización de las «skip lesions» son impredecibles y deciden tratar a estos paciente con radioterapia adyuvante, preservando al máximo el tejido sano54.
Generalmente, la IPN es un hallazgo histológico incidental tras la extirpación completa del tumor primario. En los pacientes con márgenes quirúrgicos negativos e IPN en pequeños nervios cutáneos (diámetro menor de 0,1mm), se aconseja realizar seguimiento clínico exclusivamente. Ante invasión perineural significativa (diámetro superior a 0,1mm) incluso cuando han sido extirpados con márgenes quirúrgicos libres, está indicada la radioterapia adyuvante57.
En aquellos pacientes con IPN clínica es fundamental realizar una evaluación exhaustiva de los signos y síntomas de IPN durante el examen clínico pretratamiento, así como un abordaje terapéutico agresivo, para minimizar el riesgo de recidiva tumoral y metástasis.
Si mediante las pruebas de imagen se considera posible la resecabilidad del tumor primario se aboga por la resección quirúrgica agresiva seguida de radioterapia. La red nacional de estudio del cáncer (NCCN) recomienda en su última actualización del año 2017 la radioterapia adyuvante en aquellos CEC con invasión perineural extensa.
En los casos en los que no sea posible: enfermedad en la zona 3, IPN cerca o dentro de la cavidad craneal o aquellos tumores que extienden a lo largo de un nervio craneal a la base del cráneo, la radioterapia está indicada, con intención paliativa, reduciéndose considerablemente las posibilidades de curar a estos pacientes.
Actualmente, no hay estudios prospectivos que confirmen la eficacia de agregar quimioterapia en pacientes con CEC con IPN29. Se están realizando ensayos clínicos con un anticuerpo monoclonal anti-PD1 en pacientes con CEC metastásicos o localmente avanzados, sería interesante evaluar su utilidad como terapia adyuvante en pacientes con IPN para minimizar el riesgo de recurrencia local y metástasis58–61.
SeguimientoDebido a la alta agresividad y a las altas tasas de recurrencias, es fundamental realizar un control estricto en aquellos pacientes con IPN significativa, siendo los primeros 24 meses, el período de mayor riesgo de recurrencia local, realizando rutinariamente una exploración minuciosa del nervio trigémino y facial, así como de la movilidad ocular62. Además, se aconseja la realización de RMN semestrales. Si bien es cierto que la utilidad de la vigilancia radiológica no ha sido bien cuantificada, la detección precoz y con ella el retratamiento, permiten aumentar la supervivencia en estos pacientes.
ConclusionesDebido a la implicación pronóstica de la IPN en el CEC, resulta fundamental su detección precoz, por ello, realizar una exploración clínica minuciosa, un estudio histológico y radiológico exhaustivo, así como protocolos de seguimiento, es esencial para optimizar el manejo terapéutico de estos pacientes.
Financiación(2017-172-001) Universidad Católica de Valencia, ayudas internas investigación UCV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.