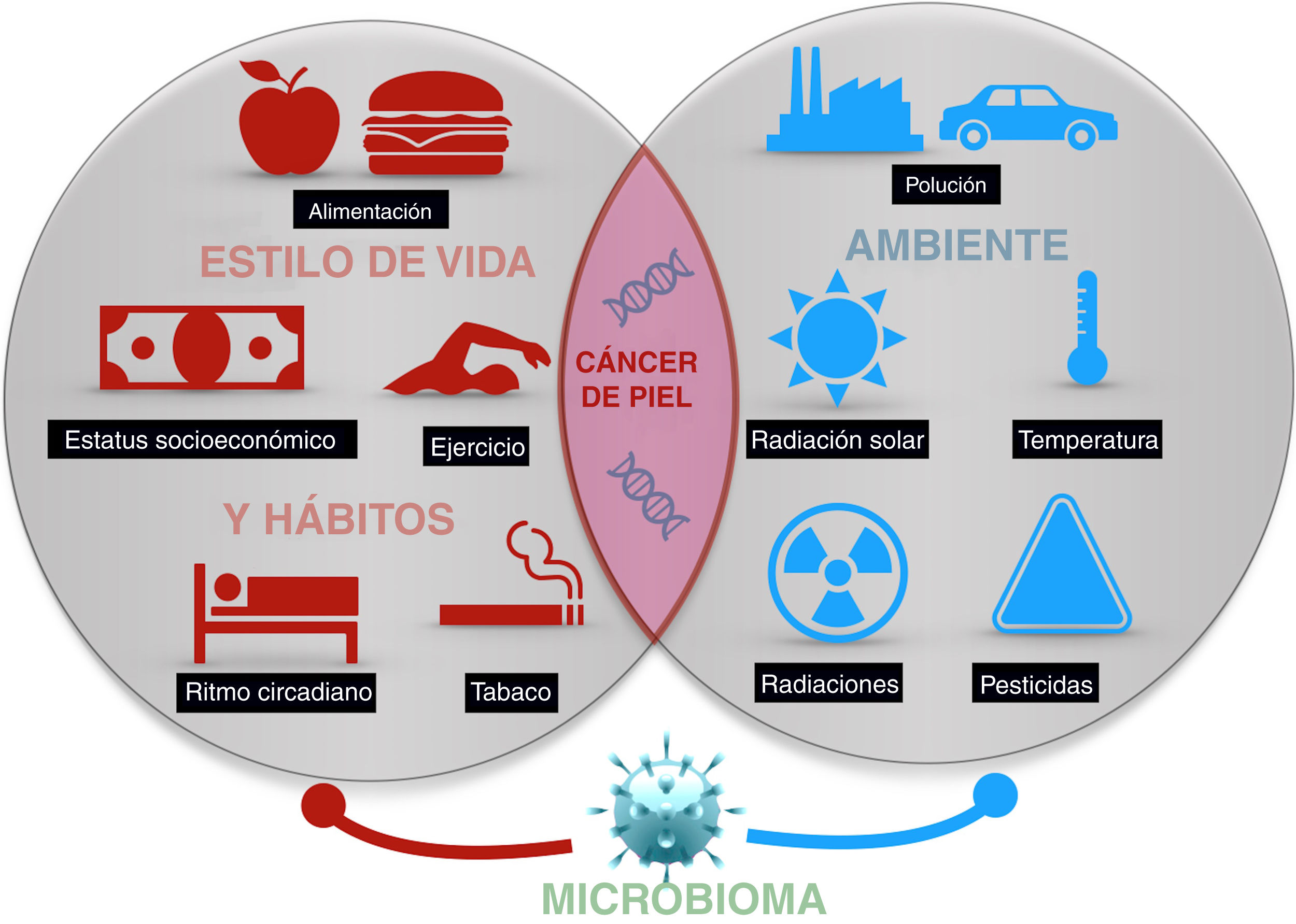
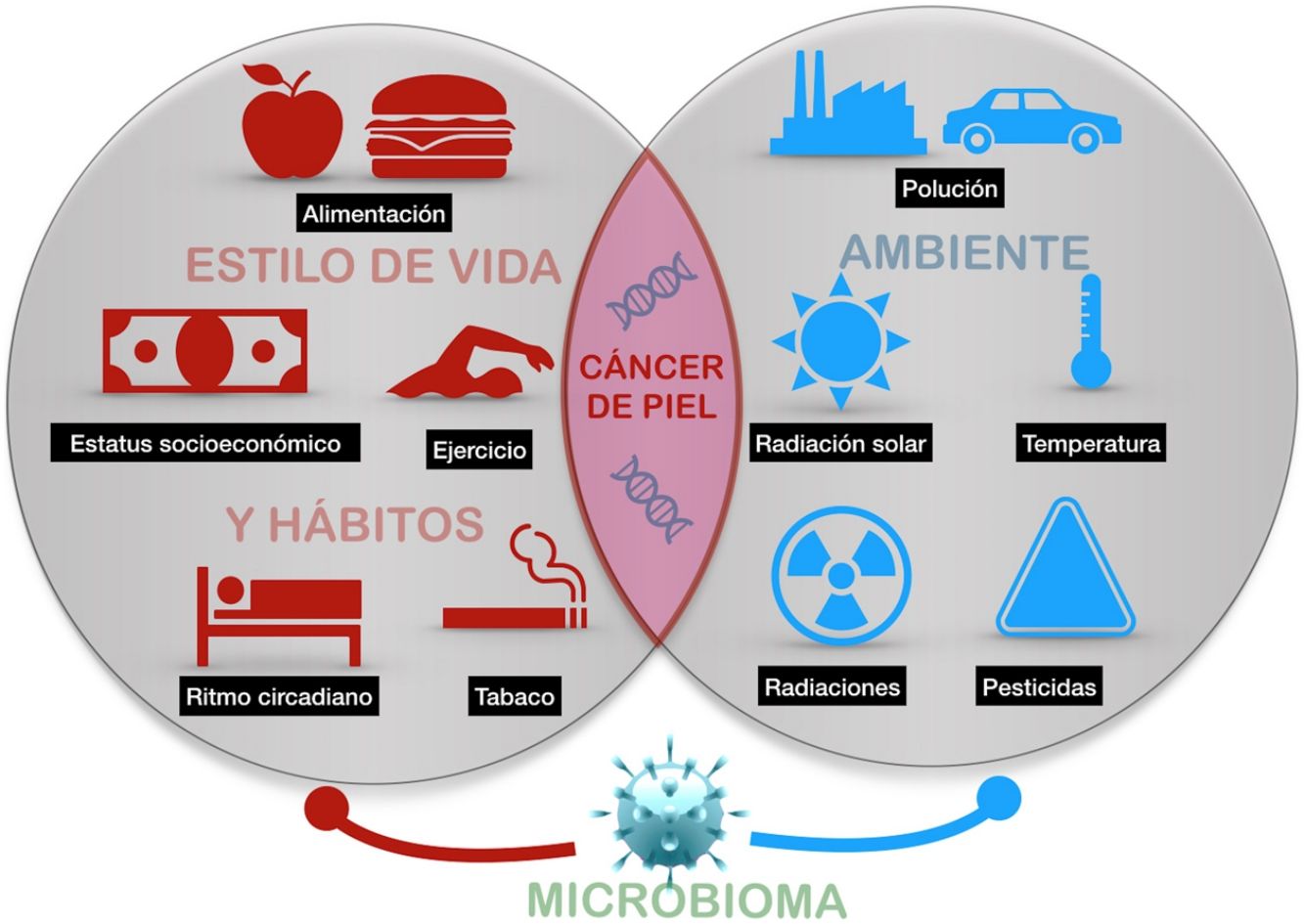
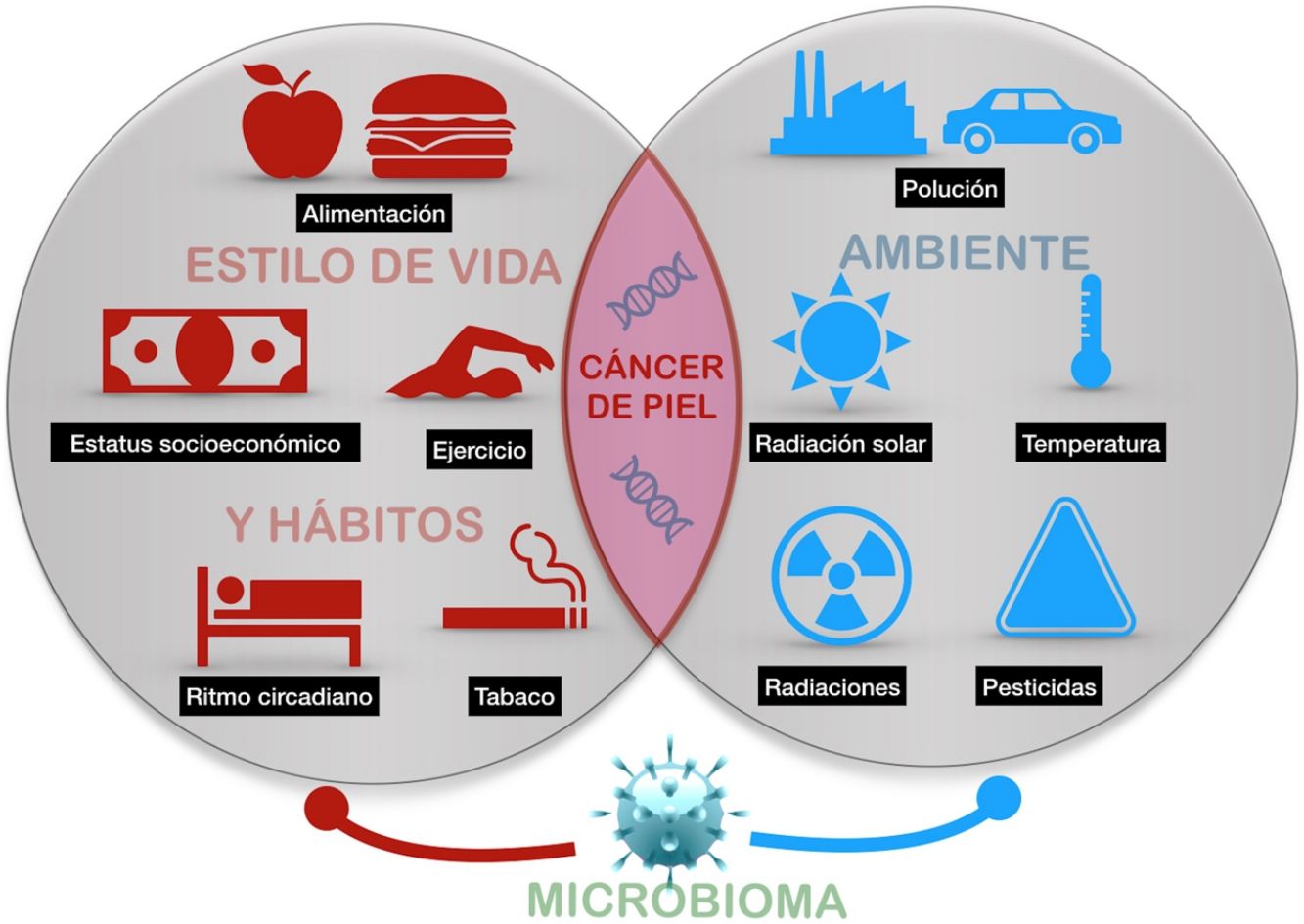
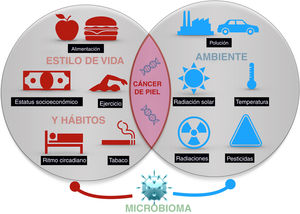
El cáncer de piel es el más frecuente del ser humano. Aunque la exposición a la radiación solar constituye el factor causal más conocido y relevante, existe una variación en el riesgo individual no explicada completamente. Diferentes estudios epidemiológicos muestran la influencia de otras radiaciones, como las ionizantes, los pesticidas, las partículas de la polución, o los tóxicos contenidos en el agua o algunos alimentos como el arsénico, en el riesgo del cáncer de piel. Además, algunos agentes vivos como los poliomavirus o el VPH son agentes etiológicos de algunos tipos concretos de cáncer cutáneo. Por último, algunos factores asociados al estilo de vida, como el estrés, el sueño, o el ejercicio podrían influir, aunque son muy escasos los estudios que aporten luz en estas áreas. Todo ello constituye el exposoma del cáncer cutáneo, el conjunto de exposiciones ambientales de un ser humano a lo largo de la vida que, combinados con el genoma y el microbioma, determinan la aparición del mismo.
Skin cancer is the most frequent type of cancer in humans. While exposure to solar radiation is the most widely known and relevant causal factor, the different degrees of individual risk have not been fully elucidated. Epidemiological studies show how the risk of skin cancer is affected by other types of radiation (eg, ionizing radiation), pesticides, particulate matter in air pollution, toxins (eg, arsenic) in water and some foods. Some living entities, such as polyomavirus and human papillomavirus, can also cause specific types of cancer. Lastly, lifestyle factors such as stress, sleep, and exercise may play a role, although only a few studies shed light on these factors. The abovementioned factors make up the exposome of skin cancer, that is, the set of environmental exposures that, together with the genome and microbiome, determine the onset of disease.
El concepto de exposoma hace referencia a la totalidad de las exposiciones ambientales de un ser humano a lo largo de la vida y constituye una nueva aproximación al estudio del papel del ambiente en la salud humana1. Ligado con ello, el proyecto EXPOsOMICS tiene como objetivo evaluar las exposiciones ambientales, principalmente la polución ambiental y los contaminantes del agua, usando técnicas «omic» que puedan asociar datos de exposición con cambios bioquímicos y moleculares. Los resultados ayudarán a entender mejor cómo los contaminantes influyen en el riesgo de desarrollar tanto enfermedades crónicas como distintos tipos de cáncer2.
El cáncer de piel es el más frecuente en el ser humano. Al ser la piel nuestro órgano más externo y que, por tanto, está más en contacto con el ambiente, sin duda es el más expuesto a la acción de todo lo que ocurre a nuestro alrededor. De todos ellos, la radiación ultravioleta (RUV) de la radiación solar ha sido reconocida como el principal agente etiológico del cáncer cutáneo3. No obstante, en los últimos años existen cada vez más evidencias de que la polución ambiental y los contaminantes del agua, los alimentos o el estilo de vida pueden influir. Por otro lado, en un concepto holístico de salud, y teniendo en cuenta la interacción entre psique, sistema nervioso, endocrino e inmunológico, es cada vez más necesario considerar la influencia del estrés o el sueño en la aparición del cáncer.
El presente artículo pretende revisar las evidencias disponibles de aquellos agentes externos relacionados con la aparición del cáncer cutáneo en cualquiera de sus tipos (fig. 1).
Las radiacionesLa RUV, especialmente en las personas de piel clara, es la principal causa del cáncer cutáneo, especialmente el cáncer cutáneo queratinocitario y el melanoma.
Tanto la RUV de tipo B (RUVB) como la A (RUVA) se consideran carcinógenos humanos3. Se sabe que la RUV interviene en su iniciación, ya que la RUVB induce un daño directo en el ADN que da lugar a la formación de dímeros de timina; también la RUVA induce un daño directo e indirecto en el ADN a través de la producción de especies reactivas del oxígeno (ERO), produciéndo roturas simples o de doble cadena, entrecruzamiento del ADN con proteínas y a través de la oxidación formando 8-oxo-guanosina4. Estos daños en el ADN inducen la activación de p53 que puede activar la reparación celular mediante el mecanismo de escisión de nucleótidos o conducir a la célula hacia la apoptosis5. Si el propio gen p53 está mutado por acción de la RUV este proceso no se producirá dando lugar a la expansión clonal de los queratinocitos y melanocitos con el ADN dañado y a la carcinogénesis cutánea. A esto se une que la RUV induce una depleción de células de Langerhans en la epidermis y, por lo tanto, una disminución de la inmunovigilancia de la piel y la producción de citoquinas inflamatorias, condiciones que favorecen el desarrollo de un cáncer cutáneo6.
Desde el punto de vista epidemiológico, vivir en áreas geográficas con niveles altos de RUV se asocia a un aumento del riesgo de cáncer cutáneo7; mientras que el carcinoma escamoso cutáneo (CEC) se relaciona más con una exposición a RUV acumulada u ocupacional, el carcinoma basocelular (CBC) y el melanoma parecen más relacionados con exposiciones intensas esporádicas y la historia de quemaduras solares8.
El uso de lámparas de bronceado artificial incrementa de una forma dosis dependiente el riesgo tanto de padecer un CBC, en el caso de haberlo realizado durante la adolescencia, como de un CEC9. El uso de estas lámparas también se ha asociado a un incremento del riesgo de desarrollar un melanoma, relacionado con el número de sesiones recibidas y el inicio de su uso a una edad temprana (<35 años)10.
Las radiaciones ionizantes también se han establecido como causa de cáncer cutáneo no melanoma (CCNM). Así, la exposición ocupacional en los técnicos de radiología a unas dosis de bajas a moderadas de radiación puede incrementar el riesgo de CBC, especialmente en personas con los ojos y el pelo claro11. También este aumento del riesgo se observa en personas sometidas a radioterapia12.
Las radiaciones cósmicas se han propuesto como posibles agentes inductores de melanoma y CBC en los pilotos y la tripulación de los aviones. Este grupo de población tienen una incidencia duplicada de melanoma comparado con la población general y esto guarda relación con el número de h y años de vuelo, así como con la radiación acumulada recibida13. No obstante, existe la duda de si también el estilo de vida de este grupo profesional puede influir14.
Por otro lado, entre 1950 y 2011 se detectó un aumento del 13% de la radiación eritemática, debido al descenso del ozono, en nueve ciudades españolas15. El protocolo de Montreal de 1987, al prohibir la emisión de clorofluorocarbonos, ha dado lugar a una disminución de los niveles de clorofluorocarbonos en la Antártida junto a una reducción del 20% en la depleción del ozono secundario16. Este hecho sin duda puede tener una repercusión en la cantidad de RUVB que recibimos, disminuyéndola y resultando, quizás en el futuro, en una disminución de la incidencia del cáncer de piel.
TemperaturaEl calor puede ser también un factor de riesgo de carcinogénesis cutánea. Tanto en cultivos celulares como en animales de experimentación, la administración de dosis repetidas de UVB y calor (39°C), reduce la apoptosis inactivando la respuesta al estrés mediada por p53 e induciendo la expresión de sirtuina 1 (SIRT1). Por tanto, ambos actúan sinérgicamente para permitir la supervivencia de células con el ADN dañado17.
Sin embargo, esta interacción no está tan clara, ya que un trabajo reciente demuestra que, si se somete a ratones sin pelo a calor primero y posteriormente a RUVB muestran un retraso en la aparición de tumores y, además, los tumores que se desarrollaron fueron más pequeños que en los ratones tratados solo con UVB o UVB seguido de calor18.
PoluciónSe estima que la polución del aire causa alrededor de 7 millones de muertes en el mundo19. Su asociación con el cáncer de pulmón es clara, sin embargo, su asociación con otros cánceres, como el de piel, no está establecida.
Los principales contaminantes del aire son los hidrocarburos aromáticos policíclicos (HAP) (incluyen los benzopirenos), cuya fuente principal son las combustiones de los automóviles y la combustion de materiales orgánicos, incluidos los cigarillos. Los HAP son los agentes causales del cáncer de escroto20. A nivel cutáneo se ha demostrado que aplicando una mezcla de HAP de forma crónica en la piel de ratones sin pelo se induce la formación de papilomas y carcinoma escamoso21, mientras que el 7,12-dimetibenzo antraceno es capaz de inducir un linfoma en hámsteres22.
Las partículas de materia (PM) suspendidas en el aire, formadas por una mezcla compleja de gotas de sólidos y líquidos, son de gran importancia como agentes lesivos para la piel. Estas son capaces de introducirse a través de los folículos o de forma transdérmica23. Las PM estimulan la producción de ERO, como el anión superóxido y el radical hidroxilo, y favorecen la secreción de citoquinas proinflamatorias como el TNF-α, IL-1a e IL-8. Además, aumentan las metaloproteinasas (MMP) (MMP-1, MMP-2 y MMP-9) induciendo la degradación del colágeno y, en consecuencia, el fotoenvejecimiento24.
Las párticulas ultrafinas son aquellas que miden menos de 100nm de diámetro y tienen más potencial de producir daño en la salud que las PM. Estas incluyen el carbón negro y los HAP, ambos asociados al cáncer de piel25. Se ha evidenciado un aumento en la incidencia de melanoma, pero no de CCNM, en trabajadores expuestos al carbón negro26.
No obstante, la polución también puede ayudar a reducir la cantidad de radiación UV que llega a la superficie terrestre. Así, la RUV principalmente B se reduce un 50% en días de altos niveles de polución. Sin embargo, la RUVA no se ve modificada por la polución, por lo que se podría alterar la proporción de UVB/UVA que alcanza la superficie terrestre, cuyos efectos son por ahora desconocidos19.
Además, todos los agentes a los que estamos expuestos pueden interaccionar teniendo efectos sinérgicos o antagónicos. La RUV en combinación con los HAP aumentan el fotodaño de la piel27, y la RUVA aumenta la acción carcinogénica de los benzopirenos28. También, la microbiota de la piel, especialmente los micrococos, pueden degradar los benzopirenos, por lo que constituirían un mecanismo innato de defensa frente a los HAP29.
El estudio epidemiológico más relevante para estudiar la relación entre la polución y el cáncer de piel se llevó a cabo en Sajonia, valorando la incidencia de cáncer entre 2010-2014 en aproximadamente dos millones de personas y viendo su relación con la polución existente30. Los autores encontraron una asociación entre las PM10 (10ug/m3) y el NO2 y un incremento en el riesgo relativo de CCNM del 52% y el 7-24%, respectivamente. En contraposición, en este estudio se observó un efecto protector de las zonas verdes, ya que un incremento del 10% de las mismas reducía el riesgo relativo de CCNM en un 16%. Una limitación de este estudio es que el nivel socioeconómico o el tabaquismo no fueron valorados30.
PesticidasSe ha demostrado que la exposición a pesticidas incrementa el riesgo de desarrollar un melanoma (OR 2,1; IC95%: 1-6,9), especialmente cuando esta exposición es ocupacional (OR 4,23; IC95%: 1,94-6,31)31.
El estudio AGRICAN Cohort, realizado en una cohorte de 11.000 agricultores franceses seguidos durante un máximo de 6 años, descubrió una incidencia significativamente mayor de mieloma múltiple en los varones y de melanoma en las mujeres que habían estado expuestos a pesticidas32.
Además, se ha demostrado el efecto sinérgico que tiene la exposición a pesticidas y a RUV, aumentando el riesgo de melanoma con una OR de 2,6 (IC95%: 1,2-5,6) a 4,7 (IC95% 1,3-17)33.
La genética ejerce un efecto modulador de estos factores de riesgo. Determinados polimorfismos en el gen de la glutatión S-transferasa (GST), junto a la exposición a pesticidas, se han asociado a un mayor riesgo de melanoma cutáneo. Así, el genotipo no mutado GSTM1 es un modificador de riesgo para el melanoma cutáneo en pacientes expuestos a pesticidas con una OR 2,8 (IC95%: 1,1-7,1)34.
TabacoLos estudios epidemiológicos publicados sobre el riesgo de cáncer cutáneo en fumadores tienen resultados contradictorios (tabla 1)35–40.
Estudios epidemiológicos sobre la asociación entre cáncer cutáneo y tabaquismo
| Referencia | Tipo de estudio | Número de individuos | Resultados de asociación con el tabaco |
|---|---|---|---|
| Thompson et al.35 | Metanálisis (6 estudios cohortes y 8 casos controles) | 738.661 | Aumento del riesgo de melanoma de cabeza y cuello |
| Song et al.36 | Metanálisis y estudio de cohortes | 145.709 | No encontraron una asociación con el riesgo de CECSe observó una relación inversa con la aparición de melanoma y CBC |
| Jones et al.37 | Estudio de cohortes | 4.231 | Correlación con la aparición de metástasis linfáticas, independiente de su correlación con el grosor del tumor y la ulceración |
| Dusingize et al.38 | Estudio de cohortes | 38.697 | Menor riesgo de melanoma en los exfumadores frente a no fumadores o fumadores actuales |
| Nagore et al.39 | Estudio de casos controles | 160 pacientes con melanomas mayores de 60 años318 controles | El consumo de tabaco es un factor de riesgo independiente en mayores de 60 años |
| Espinosa et al.40 | Estudio de cohortes | 1.200 pacientes con melanoma | No se encontró una asociación entre fumar >20 paquetes-año como factor de riesgo de desarrollar un CCNM en pacientes con antecedente de melanoma |
En cuanto a la genética, algunos polimorfismos en un solo nucleótido del gen CHRNA5-A3-B4 se relacionan con el hábito de fumar y desempeñan un papel en el desarrollo del melanoma41. También, dos polimorfismos del gen del receptor de la vitamina D (BsmI-rs1544410 y FokI-rs2228570) se relacionan con la susceptibilidad para padecer obesidad, la duración del tabaquismo y la gravedad de melanoma42.
En estudios de experimentación animal, se ha comprobado que la exposición a RUV y al humo de cigarrillo tienen un efecto sinérgico para la inducción de CEC en ratones43.
La etiopatogenia se establece porque el humo del tabaco aumenta la proliferación epidérmica e induce ERO que oxidan el ADN de los fibroblastos. Por otro lado, los fibroblastos afectados inducen la secreción de IL1α, IL-6, IL-8, factor básico de crecimiento de fibroblastos (FGF), proteína quimiotáctica de monocitos (MCP-1) y el factor de crecimiento insulínico tipo 4 (IGFBP4), que estimulan la proliferación de queratinocitos, lo que favorece la carcinogénesis en la piel a través de su regulación de la proliferación celular. El estrés oxidativo agudo compromete los sistemas reparativos del ADN, alargando los intervalos de reparación e incrementando el daño en el ADN en el grupo de fumadores44,45.
Por último, se ha observado que el tabaco es un factor de riesgo modificable de aparición de otras neoplasias extracutáneas en pacientes con una historia personal de CCNM o melanoma46.
AlimentaciónEl efecto de la dieta en diferentes dermatosis y neoplasias es controvertido47,48.
En cuanto al consumo de vitaminas, hay estudios que encuentran una relación inversa entre los niveles séricos de vitamina A (retinol) y su derivado β-caroteno y la presencia de un CCNM49,50, mientras que otros encuentran lo contrario51,52. Existen ensayos clínicos que han evaluado el efecto de la suplementación oral con retinol en la prevención frente al cáncer cutáneo y, aunque la mayoría no encuentran un efecto preventivo53–55, parece que en pacientes con un riesgo moderado se reduce el riesgo de aparición de un CEC56.
La pérdida del receptor de vitamina D (VD) aumenta la susceptibilidad a la tumorigénesis cutánea inducida por UV en ratones57. Sin embargo, los estudios en humanos apoyan una relación inversa entre los niveles de VD y el riesgo de CCNM58. Un factor confusor es la exposición solar, que se correlaciona positivamente tanto con los niveles de VD sérica como con el cáncer cutáneo. El papel de la VD en los estudios epidemiológicos no es claro, aunque varios estudios clinicopatológicos y moleculares han demostrado una correlación entre el déficit de VD y la progresión y el pronóstico del melanoma59. Recientemente, en un estudio en 204 melanomas invasivos se evaluó el papel de la VD, encontrando una asociación significativa entre los niveles de VD en el diagnóstico y la ubicación, la tasa mitótica del tumor y la ulceración; y una asociación límite con el grosor de Breslow y el IMC, sugiriendo el papel de los niveles de la VD en la agresividad del melanoma60.
El selenio, un micromineral antioxidante, se postuló como un suplemento que podría disminuir los efectos de la RUVB en el ADN; sin embargo, en un ensayo clínico en el que administraban un suplemento oral diario de selenio (200μg) a pacientes con un antecedente de dos o más CBC o uno o más CEC, paradójicamente, aumentó el riesgo de CEC61.
En un estudio de cohortes, la ingesta de ácido fólico en la dieta se asoció con un aumento moderado del riesgo de melanoma cutáneo62. No obstante, la evidencia científica es todavía insuficiente y hay que considerar otros factores relacionados con la ingesta de ácido fólico en la dieta que podrían explicar esta asociación62.
Por otro lado, la contaminación alimenticia es un problema grave, fundamentalmente cuando afecta al agua. Así, se ha demostrado que ciertos contaminantes de la misma pueden ocasionar un cáncer de piel, como el arsénico y los bifenilos policlorados. La OMS establece que existe un riesgo de cáncer de piel cuando la concentración de arsénico en el agua es superior a 10μg/l63. Este problema está en relación con un riesgo para el desarrollo de tumores queratinocíticos en consumidores de arroz 1,5 veces superior (IC95% 1,1-2,0) respecto a los que no lo consumen64. La razón del contenido de arsénico en el arroz es porque es un cultivo que requiere mucha agua la cual, según el área geográfica, puede contener cantidades importantes de arsénico. Así, se ha documentado una clara asociación del CBC y el CEC con concentraciones de arsénico<100ug/l en el Sur de Asia, China, Taiwan, Méjico, Europa del Este y EE. UU.63.
Además, el efecto del arsénico se ve modificado por la susceptibilidad genética, como ocurre con polimorfismos en el gen de la enzima arsénico metiltransferasa que disminuyen la capacidad para metabolizar el arsénico65.
Los bifenilos policlorados (BPC) se encuentran ampliamente difundidos en el medio ambiente, ya sea por el vertido directo a partir de industrias que los utilizan o por la combustión y el vertido a ríos y aguas marinas de desechos contaminados. Los pescados grasos pueden contener unas cantidades significativas de bifenoles policlorados los cuales afectan a la melanogénesis promoviendo la progresión del melanoma. En contrapartida, estos pescados también son ricos en ácidos grasos poliinsaturados σ-3 que tienen una acción antineoplásica frente a melanoma. Un estudio de cohortes encontró un HR de 4 (IC95% 1,2-1,3, p=0,02) asociado al consumo de BPC, mientras que en relación con el consumo de EPA-DHA el HR fue de 0,2 (IC95% 0,1-0,8, p=0,003). Por lo tanto, se necesitan más trabajos que realmente prueben si el consumo de este pescado tiene un efecto protector o propiciador del melanoma66.
También se ha estudiado la asociación de la dieta mediterránea con el cáncer de piel. En mujeres francesas, la mayor adherencia a esta dieta se asoció a una reducción en el riesgo global de padecer un cáncer de piel, principalmente por una asociación inversa con la incidencia de CBC y una disminución del riesgo de melanoma. Estos resultados deberían de estudiarse también en hombres y valorar los posibles sesgos, pero sus resultados son tan prometedores que promover la dieta mediterránea entre nuestros pacientes es un beneficio añadido67.
El consumo de café con cafeína se asocia inversa y proporcionalmente al riesgo de melanoma en varios estudios. En concreto, el consumo de una taza de café al día redujo en un 3% el riesgo de melanoma68. En contraposición, un metanálisis encontró una relación dosis-respuesta entre el consumo de café cafeinado y la incidencia de CBC69.
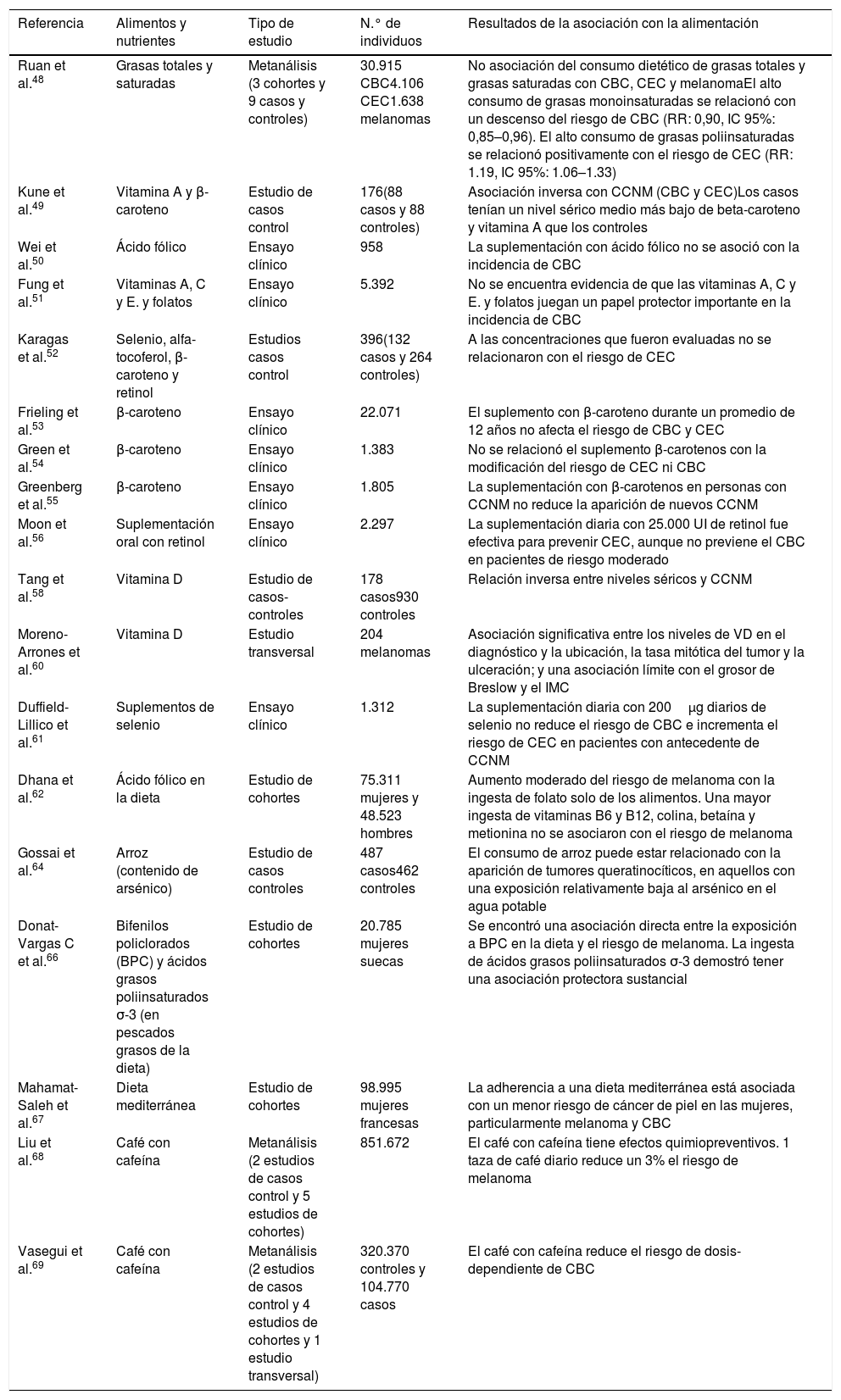
Por último, la restricción alimentaria altera tanto la sensibilidad diurna al daño del ADN inducido por la RUVB como la expresión en el gen XPA, fundamental en la reparación del ADN demostrando un vínculo entre el ritmo circadiano, la ingesta de alimentos y la salud de la piel70. Todos los estudios realizados en humanos que relacionan la dieta con el riesgo o no de desarrollar cáncer de piel están resumidos en la tabla 248,58,60–64,66–69.
Estudios epidemiológicos sobre la asociación entre cáncer cutáneo y alimentación y nutrientes
| Referencia | Alimentos y nutrientes | Tipo de estudio | N.° de individuos | Resultados de la asociación con la alimentación |
|---|---|---|---|---|
| Ruan et al.48 | Grasas totales y saturadas | Metanálisis (3 cohortes y 9 casos y controles) | 30.915 CBC4.106 CEC1.638 melanomas | No asociación del consumo dietético de grasas totales y grasas saturadas con CBC, CEC y melanomaEl alto consumo de grasas monoinsaturadas se relacionó con un descenso del riesgo de CBC (RR: 0,90, IC 95%: 0,85–0,96). El alto consumo de grasas poliinsaturadas se relacionó positivamente con el riesgo de CEC (RR: 1.19, IC 95%: 1.06–1.33) |
| Kune et al.49 | Vitamina A y β-caroteno | Estudio de casos control | 176(88 casos y 88 controles) | Asociación inversa con CCNM (CBC y CEC)Los casos tenían un nivel sérico medio más bajo de beta-caroteno y vitamina A que los controles |
| Wei et al.50 | Ácido fólico | Ensayo clínico | 958 | La suplementación con ácido fólico no se asoció con la incidencia de CBC |
| Fung et al.51 | Vitaminas A, C y E. y folatos | Ensayo clínico | 5.392 | No se encuentra evidencia de que las vitaminas A, C y E. y folatos juegan un papel protector importante en la incidencia de CBC |
| Karagas et al.52 | Selenio, alfa-tocoferol, β-caroteno y retinol | Estudios casos control | 396(132 casos y 264 controles) | A las concentraciones que fueron evaluadas no se relacionaron con el riesgo de CEC |
| Frieling et al.53 | β-caroteno | Ensayo clínico | 22.071 | El suplemento con β-caroteno durante un promedio de 12 años no afecta el riesgo de CBC y CEC |
| Green et al.54 | β-caroteno | Ensayo clínico | 1.383 | No se relacionó el suplemento β-carotenos con la modificación del riesgo de CEC ni CBC |
| Greenberg et al.55 | β-caroteno | Ensayo clínico | 1.805 | La suplementación con β-carotenos en personas con CCNM no reduce la aparición de nuevos CCNM |
| Moon et al.56 | Suplementación oral con retinol | Ensayo clínico | 2.297 | La suplementación diaria con 25.000 UI de retinol fue efectiva para prevenir CEC, aunque no previene el CBC en pacientes de riesgo moderado |
| Tang et al.58 | Vitamina D | Estudio de casos- controles | 178 casos930 controles | Relación inversa entre niveles séricos y CCNM |
| Moreno-Arrones et al.60 | Vitamina D | Estudio transversal | 204 melanomas | Asociación significativa entre los niveles de VD en el diagnóstico y la ubicación, la tasa mitótica del tumor y la ulceración; y una asociación límite con el grosor de Breslow y el IMC |
| Duffield-Lillico et al.61 | Suplementos de selenio | Ensayo clínico | 1.312 | La suplementación diaria con 200μg diarios de selenio no reduce el riesgo de CBC e incrementa el riesgo de CEC en pacientes con antecedente de CCNM |
| Dhana et al.62 | Ácido fólico en la dieta | Estudio de cohortes | 75.311 mujeres y 48.523 hombres | Aumento moderado del riesgo de melanoma con la ingesta de folato solo de los alimentos. Una mayor ingesta de vitaminas B6 y B12, colina, betaína y metionina no se asociaron con el riesgo de melanoma |
| Gossai et al.64 | Arroz (contenido de arsénico) | Estudio de casos controles | 487 casos462 controles | El consumo de arroz puede estar relacionado con la aparición de tumores queratinocíticos, en aquellos con una exposición relativamente baja al arsénico en el agua potable |
| Donat-Vargas C et al.66 | Bifenilos policlorados (BPC) y ácidos grasos poliinsaturados σ-3 (en pescados grasos de la dieta) | Estudio de cohortes | 20.785 mujeres suecas | Se encontró una asociación directa entre la exposición a BPC en la dieta y el riesgo de melanoma. La ingesta de ácidos grasos poliinsaturados σ-3 demostró tener una asociación protectora sustancial |
| Mahamat-Saleh et al.67 | Dieta mediterránea | Estudio de cohortes | 98.995 mujeres francesas | La adherencia a una dieta mediterránea está asociada con un menor riesgo de cáncer de piel en las mujeres, particularmente melanoma y CBC |
| Liu et al.68 | Café con cafeína | Metanálisis (2 estudios de casos control y 5 estudios de cohortes) | 851.672 | El café con cafeína tiene efectos quimiopreventivos. 1 taza de café diario reduce un 3% el riesgo de melanoma |
| Vasegui et al.69 | Café con cafeína | Metanálisis (2 estudios de casos control y 4 estudios de cohortes y 1 estudio transversal) | 320.370 controles y 104.770 casos | El café con cafeína reduce el riesgo de dosis-dependiente de CBC |
Numerosos estudios epidemiológicos han examinado la relación de actividad física con el riesgo de CCNM y melanoma. Los atletas que practican deportes al aire libre reciben unas dosis considerables de RUV debido a los horarios de entrenamiento y la competición con una alta exposición al sol, un efecto que aumenta en los deportes alpinos debido al aumento de la RUV por la altitud y la reflexión de las superficies cubiertas de nieve y hielo71. Así, la exposición extrema a la RUV en deportes al aire libre como el esquí, el alpinismo, el ciclismo o el triatlón se ha documentado en una serie de estudios dosimétricos72–75.
Estudios epidemiológicos amplios mostraron que las actividades recreativas como la exposición al sol en la playa o durante los deportes acuáticos se asocian con un mayor riesgo de CBC, mientras que el esquí ha demostrado tener un mayor riesgo de CEC76–78. La incidencia de CBC y CEC se ha calculado en distintos grupos de deportistas, encontrando un mayor riesgo de ambos tumores en corredores de maratón, un aumento de incidencia de CBC en surferos y un incremento de la prevalencia de queratosis actínicas en escaladores. No obstante, los estudios son escasos, con una muestra pequeña y no incluyen exdeportistas o atletas jubilados76,77.
Un metanálisis en el que se incluyeron 13.949 pacientes que habían sido recientemente diagnosticados de melanoma, encontró que en los estudios de cohorte se demostraba un riesgo mayor de melanoma en los pacientes que realizaban una actividad física alta (RR=1,3; IC del 95%=1,2-1,4); sin embargo, esta relación no se demostró en los estudios de casos y controles, probablemente debido a factores de confusión como la cantidad de exposición solar y el fototipo79.
Por otro lado, algunos factores de riesgo de melanoma cutáneo, como el número de nevos melanocíticos y de lentigos solares, son más frecuentes en los sujetos que practican deportes al aire libre. Además de la importante exposición al sol, la inmunosupresión inducida por el ejercicio podría aumentar el riesgo de cáncer de piel no melanoma y de melanoma cutáneo en los atletas78,80.
Sin embargo, estudios experimentales apoyan que el ejercicio tiene efectos protectores sobre el cáncer cutáneo. En ratones con déficit de PTEN, el ejercicio previene el hepatocarcinoma y el cáncer cutáneo en un modelo animal experimental inducido por tetradecanoylphorbol-13-acetate (TPA)81. El ejercicio estimula la secreción de factor circulante de crecimiento insulínico (IGF-1) y la señal dependiente del mismo en ratones TPA reduciendo el riesgo de cáncer de piel. Además, el ejercicio activa p53, lo que aumenta p21, IGFBP-3 y PTEN que puede inducir una regulación negativa de la vía IGF-1 lo que contribuye a la prevención del cáncer de piel82–84.
En resumen, el ejercicio podría tener un efecto protector sobre el cáncer de piel, pero no lo suficiente como para compensar el riesgo inducido por la excesiva RUV recibida en la práctica deportiva al aire libre; probablemente en esta balanza está pesando negativamente unos hábitos inadecuados de fotoprotección. Por ello, deberían promoverse medidas protectoras en los deportistas al aire libre como evitar el entrenamiento en las h de mayor riesgo, elegir una ropa adecuada y aplicar un fotoprotector resistente al agua y al sudor85.
Ritmo circadianoLa disrupción circadiana ha sido clasificada por la Agencia Internacional de Investigación del cáncer como uno de los carcinógenos más probables basado en la evidencia de estudios en humanos y animales86.
Existe un aumento en la razón de incidencia estandarizada de melanoma en los pilotos (2,2 [IC 95%: 1,7-2,9]) comparado con el personal de la tripulación de los aviones de 2,1 [IC 95% 1,7-2,9]). La penetración de la radiación UVA a través de las ventanillas es un factor plausible para los pilotos, pero no para el resto de la tripulación. Si la causa que subyace a este hecho es la radiación cósmica, el estilo de vida con más vacaciones expuestas al sol o la disrupción del ritmo circadiano es un asunto por resolver87,88.
Otro grupo poblacional que trabaja en turnos y presenta una mayor incidencia de melanoma son los bomberos, en ellos los resultados han sido variables y se estima un riesgo de melanoma de 1,3 (IC 95%: 1,1-1,6)89. No obstante, hay que considerar que están expuestos a compuestos potencialmente cancerígenos generados en los incendios, como los HAP, relacionados con el CCNM21.
En otros trabajadores a turnos como las enfermeras, aquellas que trabajan en turno de noche de forma habitual tienen una incidencia de cáncer cutáneo 14% menor que aquellas que lo habían hecho durante menos tiempo o nunca90.
La influencia de la alteración del ritmo circadiano en la carcinogénesis se atribuye a diferentes posibles mecanismos. Por un lado, la secreción menor de melatonina disminuiría sus actividades anticarcinógenas y antioxidantes91; por otro lado, existe una regulación circadiana inducida por la RUV de ciertos mecanismos reparadores del daño en el ADN, así como de los mecanismos antioxidantes cutáneos92. Sin embargo, la asociación con una mayor o menor incidencia del cáncer cutáneo no está clara debido a factores de confusión, como la disminución de la exposición a RUV debida al trabajo en turnos nocturnos.
Estatus socioeconómicoLa posición social y económica ha sido un tema de estudio en relación con la supervivencia en cáncer. Las desigualdades económicas en países con sistemas sanitarios de limitada accesibilidad condiciona un peor pronóstico en el melanoma debido a que se diagnostican en estadios más avanzados93. Así, se ha demostrado una fuerte correlación inversa entre el gasto sanitario total per cápita de cada país y la razón entre la incidencia y la mortalidad de melanoma (r=-0,76, p<0,05)94.
En Alemania se llevó a cabo un estudio en 70 millones de habitantes encontrando una correlación directa entre tener mayores ingresos y un mejor nivel educativo con una mayor prevalencia de melanoma y CCNM95.
Un estudio multicéntrico en 5 países europeos (Francia, Alemania, Portugal, Italia y Suecia) encontró que hay un cierto incremento del riesgo de cáncer cutáneo asociado con un mayor nivel socioeconómico en los pacientes de mediana edad, sin encontrarse diferencias en los de edad más avanzada96.
Microorganismos y microbiotaEs conocido el papel de determinados microorganismos en algunos cánceres de piel, especialmente el poliomavirus del carcinoma de células de Merkel y el VPH97. En el caso del poliomavirus del carcinoma de células de Merkel, en un estudio de análisis de aguas de países del área Mediterránea se encontró en el 75% de las aguas residuales y en el 29% y 18% de muestras de agua de río y mar, respectivamente. El artículo afirma que el tratamiento de aguas y la RUV eliminan entre 2,22 y 4,52 log10 de las concentraciones virales, pero que el calentamiento climático y la escasez de precipitaciones podría incrementar la presencia de este y otros virus en las aguas98.
Se sabe que Propionibacterium acnes, una de las bacterias de nuestra microbiota cutánea, disminuye la síntesis de porfirinas cuando se expone a la RUVB99. La RUV inhibe el crecimiento de Malassezia furfur, una levadura de la microbiota cutánea que sintetiza pitiriacitrin, con un efecto fotoprotector100. Además, se ha comunicado una relación entre el desarrollo de un melanoma y los géneros Fusobacterium y Trueperella101. Por otro lado, la colonización cutánea de ratones sin pelo con una cepa de la microbiota cutánea humana de Staphylococcus epidermidis que sintetiza 6-N-hidroxiaminopurina ejerció un papel preventivo de desarrollo de tumores cutáneos en un modelo de fotocarcinogénesis con UVB; mientras que la colonización por el mismo germen pero una cepa no productora de 6-N-hidroziaminopurina no ejercía ningún efecto preventivo29. Esto podría indicar que determinadas bacterias de la microbiota podrían condicionar un efecto protector o inductor de cáncer cuando se combinan con la radiación UV/solar.
Pero no solo la microbiota cutánea puede tener relación con el cáncer de piel. Se ha observado que cambios en la microbiota intestinal se relacionan con diferentes respuestas a la inmunoterapia, de forma que una mayor diversidad en la microbiota intestinal y un mayor crecimiento de la familia Ruminococcaceae favorece la respuesta a la inmunoterapia con fármacos anti-PD-1102,103.
ConclusiónEsta revisión de la literatura demuestra que no solo las ya conocidas radiaciones UV y electromagnéticas, sino que también la contaminación ambiental, incluido el aire, el tabaquismo y el agua, parecen tener un impacto en la salud de la piel y en la génesis del cáncer. Algunos datos son controvertidos o no concluyentes y, además, hay que considerar la susceptibilidad individual, determinada por el genoma propio y, quizás, por los otros genes que conviven con nosotros, el microbioma.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.