El linfangioma progresivo adquirido es una neoplasia vascular poco frecuente, de comportamiento localmente agresivo. Histológicamente se caracteriza por la proliferación de múltiples vasos dilatados de paredes finas, revestidos con un endotelio plano sin atipias y que aparentemente disecan las fibras de colágeno. Esta entidad suele debutar de forma asintomática como una placa marrón-eritematosa que presenta un crecimiento gradual. Se presenta un caso de linfangioma progresivo adquirido en un varón de 32 años. La tumoración se localizaba en el hipogastrio sobre una lesión vascular congénita diagnosticada previamente de angiomatosis cutánea multifocal. Clínicamente cursaba con intenso dolor e imposibilidad para la deambulación por lo que fue resecada. El linfangioma progresivo adquirido debe ser considerado por dermatólogos y patólogos dado que su tratamiento quirúrgico precoz, cuando la lesión tiene un tamaño limitado, es siempre curativo y evita posteriores complicaciones derivadas de su crecimiento.
Acquired progressive lymphangioma is a rare vascular tumor with a locally aggressive behavior. Histologically it is characterized by a proliferation of numerous, dilated, thin-walled vessels lined by flat endothelial cells with no nuclear atypia. The vessels appear to dissect between the collagen fibers. It usually presents as an asymptomatic, slow-growing, reddish-brown plaque. We present the case of a 32-year-old man with acquired progressive lymphangioma. The tumor was in the hypogastric region and had arisen on a congenital vascular lesion previously diagnosed as multifocal cutaneous angiomatosis. It was very painful and impeded walking, for which reason it was decided to perform excision. Dermatologists and pathologists must be aware of acquired progressive lymphangioma as early surgical treatment, while the lesion is still small, is curative and prevents subsequent complications due to growth.
El linfangioma progresivo adquirido (LPA) es una rara proliferación vascular localmente agresiva descrita inicialmente por Wilson Jones1 en 1964 y Gold2 en 1970. Posteriormente, en 1990, Wilson Jones se refiere a esta entidad como linfangioendotelioma benigno, término que también han empleado otros autores3. El número de casos de LPA publicados es escaso, menos de cuarenta4. El LPA supone un reto diagnóstico dadas las similitudes histológicas que presenta con neoplasias vasculares malignas tales como el angiosarcoma de bajo grado, el sarcoma de Kaposi (SK) o el angioendotelioma bien diferenciado. Clínicamente puede ser confundido con lesiones proliferativas como el SK o procesos inflamatorios tales como la morfea, especialmente en su variedad profunda4,5. Se comenta un caso de LPA y se revisan los descritos anteriormente comparando sus características clínico-patológicas.
Caso clínicoVarón de 32 años de edad que consultó por una lesión hipogástrica, de dos años de evolución, que presentaba un crecimiento lentamente progresivo, cursando con molestias locales inespecíficase intenso dolor, acompañado de un ligero edema del escroto y la raíz del miembro inferior derecho que dificultaba la deambulación. El paciente presentó desde el nacimiento una lesión vascular localizada en hemiabdomen inferior derecho que fue biopsiada en 1975 y diagnosticada de angiomatosis cutánea multifocal. No recibió posterior seguimiento por ningún especialista, permaneciendo estable como una placa eritematosa de 6×4cm clínicamente compatible con un linfangioma circunscrito. Dos años antes de acudir a nuestra consulta el paciente refiere el inicio de su crecimiento acompañado de intenso dolor. No existían otros antecedentes médico-quirúrgicos de interés.
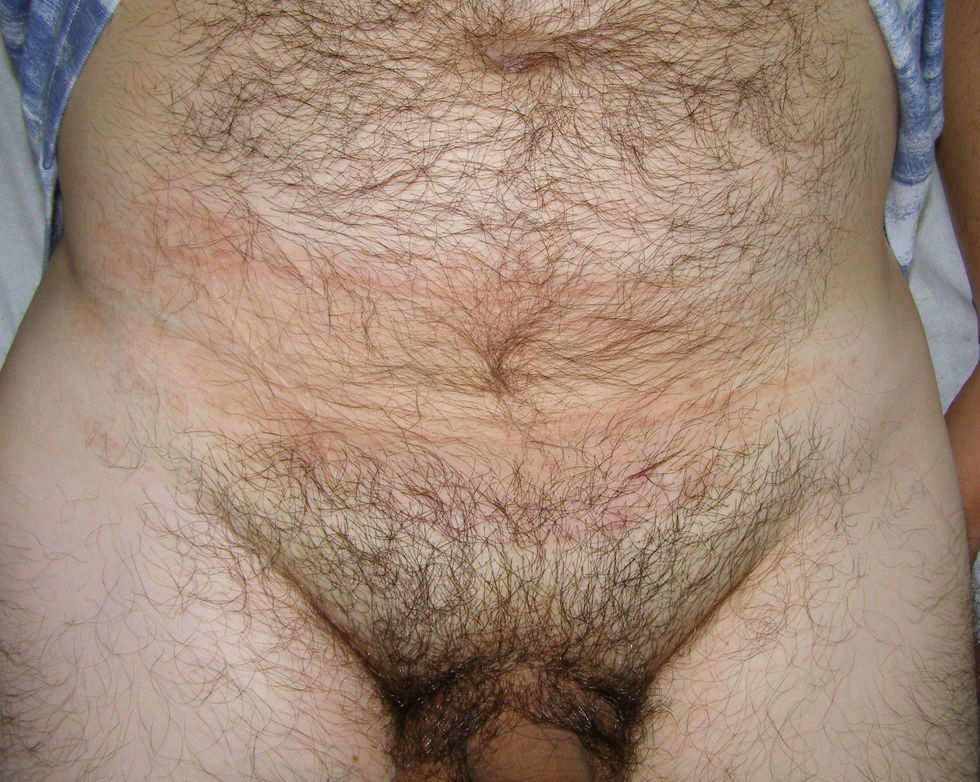
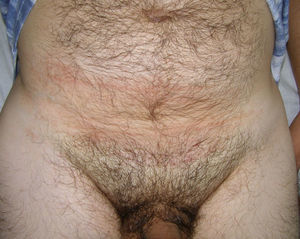
A la exploración se objetivó en hipogastrio una mácula marrón-eritematosa, mal delimitada, que se extendía horizontalmente por ambos flancos y tenía un diámetro vertical mayor de 15cm (fig. 1). A la palpación se apreció debajo de la mácula una masa de consistencia gomosa, discretamente dolorosa y no adherida a planos profundos.
Se realizó un estudio analítico completo; incluyendo hemograma, bioquímica y serología (ANA, ENA, anti-DNA, serología de Borrelia y Scl-70). Todos los resultados estaban dentro de los límites de la normalidad. La resonancia magnética con contraste de pared abdominal reveló en la zona correspondiente a la mácula hipogástrica, un área de engrosamiento cutáneo que alcanzaba un espesor aproximado de 0,7–0,9mm con edema subcutáneo de toda la región. No se apreciaba afectación de la musculatura subyacente ni lesiones intra o retroperitoneales.
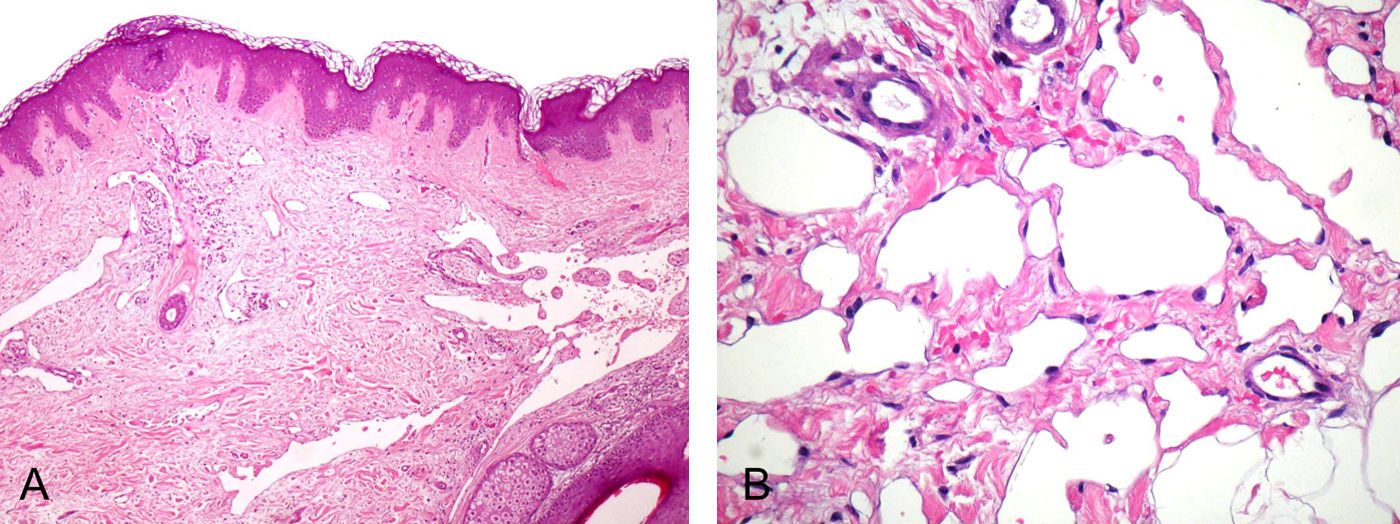
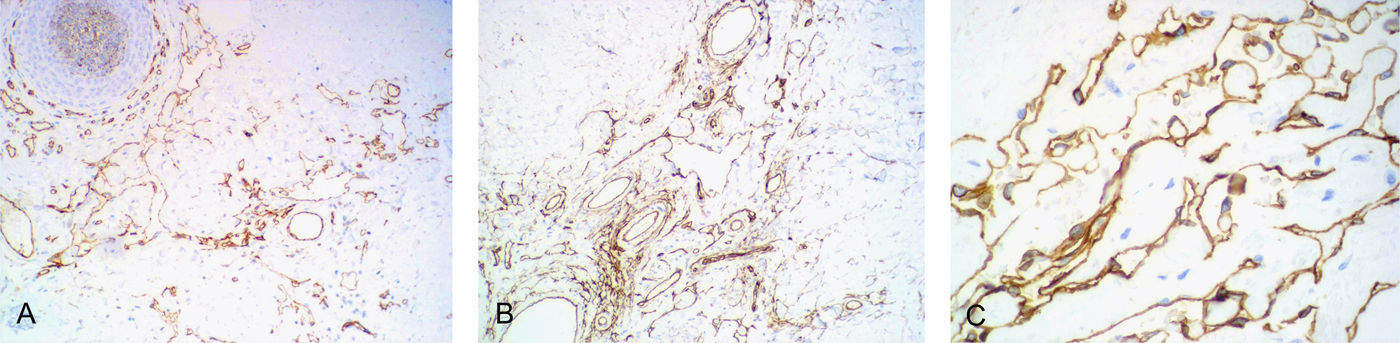
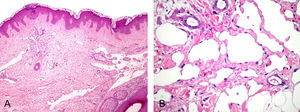
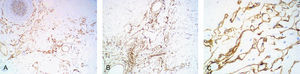
El estudio histopatológico mostró una epidermis conservada, destacando una proliferación de espacios vasculares irregulares en la dermis papilar y reticular (fig. 2A). Los vasos superficiales estaban angulosos y dilatados. A medida que la lesión profundizaba en la dermis las luces vasculares se hacían más estrechas y los vasos se disponían entre las fibras de colágeno, disecándolas aparentemente y adquiriendo un patrón pseudomaligno. A mayor detalle (fig. 2B) se observaban las finas paredes vasculares recubiertas por una capa simple de células endoteliales aplanadas. No se apreciaron atipias en el endotelio. Mediante tinciones inmunohistoquímicas se comprobó que la proliferación tumoral era positiva para los marcadores endoteliales CD 31 y CD 34 y para el marcador linfático D2-40 (fig. 3).
A) Proliferación vascular dérmica, los canales tienden a horizontalizarse y estrecharse en profundidad adoptando un aspecto de «disección de colágeno» (hematoxilina-eosina ×100). B) Paredes vasculares finas con una capa simple de células endoteliales planas, sin atipias ni mitosis (hematoxilina-eosina ×250).
Se diagnosticó este caso como un LPA y se realizó la escisión completa de la lesión incluyendo como margen un cm de piel sana. Se reconstruyó el defecto mediante un colgajo de fascia lata del muslo derecho. Tras 18 meses de seguimiento no se han apreciado signos de recidiva.
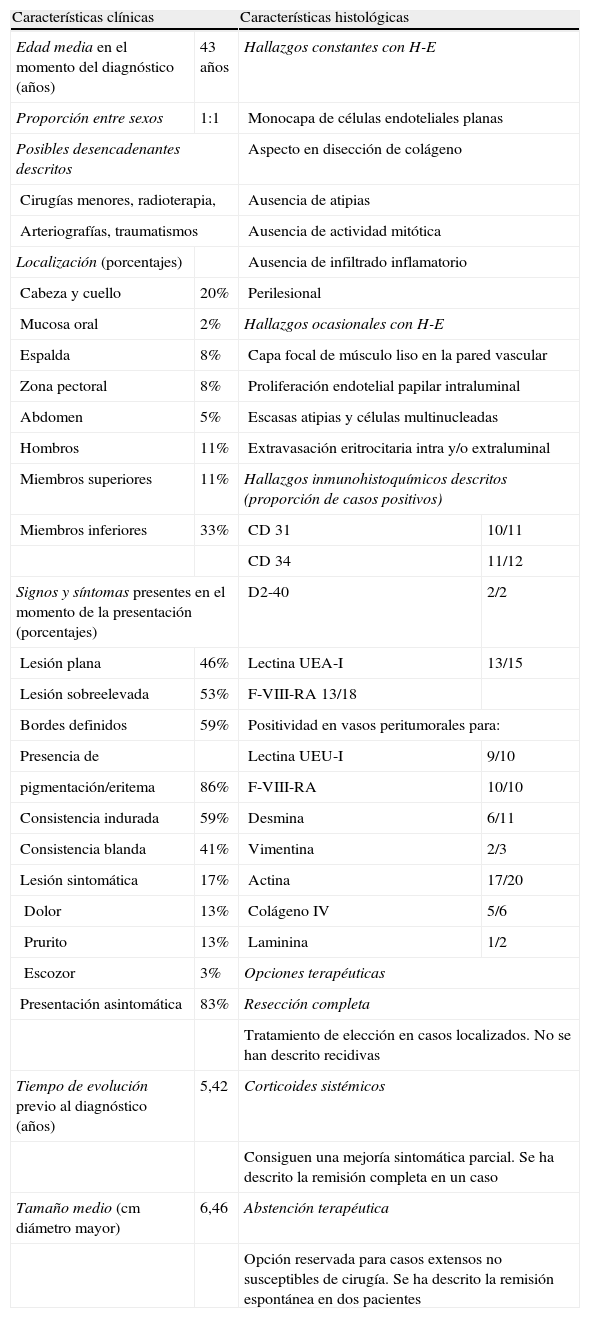
DiscusiónEl LPA, también denominado linfangioendotelioma benigno, es una proliferación vascular con hallazgos de diferenciación linfática y sanguínea. Se trata de una entidad rara de la que solo hay descritos 39 casos. En la tabla 1 se analizan las principales características clínico-patológicas de 37 casos.
Resumen de las características del LPA en 37 casos descritos en la literatura
| Características clínicas | Características histológicas | ||
| Edad media en el momento del diagnóstico (años) | 43 años | Hallazgos constantes con H-E | |
| Proporción entre sexos | 1:1 | Monocapa de células endoteliales planas | |
| Posibles desencadenantes descritos | Aspecto en disección de colágeno | ||
| Cirugías menores, radioterapia, | Ausencia de atipias | ||
| Arteriografías, traumatismos | Ausencia de actividad mitótica | ||
| Localización (porcentajes) | Ausencia de infiltrado inflamatorio | ||
| Cabeza y cuello | 20% | Perilesional | |
| Mucosa oral | 2% | Hallazgos ocasionales con H-E | |
| Espalda | 8% | Capa focal de músculo liso en la pared vascular | |
| Zona pectoral | 8% | Proliferación endotelial papilar intraluminal | |
| Abdomen | 5% | Escasas atipias y células multinucleadas | |
| Hombros | 11% | Extravasación eritrocitaria intra y/o extraluminal | |
| Miembros superiores | 11% | Hallazgos inmunohistoquímicos descritos (proporción de casos positivos) | |
| Miembros inferiores | 33% | CD 31 | 10/11 |
| CD 34 | 11/12 | ||
| Signos y síntomas presentes en el momento de la presentación (porcentajes) | D2-40 | 2/2 | |
| Lesión plana | 46% | Lectina UEA-I | 13/15 |
| Lesión sobreelevada | 53% | F-VIII-RA 13/18 | |
| Bordes definidos | 59% | Positividad en vasos peritumorales para: | |
| Presencia de | Lectina UEU-I | 9/10 | |
| pigmentación/eritema | 86% | F-VIII-RA | 10/10 |
| Consistencia indurada | 59% | Desmina | 6/11 |
| Consistencia blanda | 41% | Vimentina | 2/3 |
| Lesión sintomática | 17% | Actina | 17/20 |
| Dolor | 13% | Colágeno IV | 5/6 |
| Prurito | 13% | Laminina | 1/2 |
| Escozor | 3% | Opciones terapéuticas | |
| Presentación asintomática | 83% | Resección completa | |
| Tratamiento de elección en casos localizados. No se han descrito recidivas | |||
| Tiempo de evolución previo al diagnóstico (años) | 5,42 | Corticoides sistémicos | |
| Consiguen una mejoría sintomática parcial. Se ha descrito la remisión completa en un caso | |||
| Tamaño medio (cm diámetro mayor) | 6,46 | Abstención terapéutica | |
| Opción reservada para casos extensos no susceptibles de cirugía. Se ha descrito la remisión espontánea en dos pacientes | |||
F-VIII-RA: Factor VIII-related antigen; H-E: hematoxilina-eosina; LPA: linfangioma progresivo adquirido; UEA-I: Ulex europaeus agglutinin I.
Resumen de las características del LPA en 37 casos descritos en la literatura.
La etiopatogenia del LPA no está clara. La descripción de traumatismos como un posible desencadenante, unida a la mejoría con corticoides orales aportada por Watanabe et al en un caso, ha llevado a sugerir que se trate de una respuesta a estímulos inflamatorios en lugar de una verdadera neoplasia6. Otros autores consideran que dicho caso pudo más bien tratarse de una linfangiomatosis que de un LPA, dado que tuvo lugar en dos localizaciones distintas y sus canales vasculares presentaban una proliferación más difusa y con mayor dilatación de sus luces que en el resto de descripciones de LPA7. El resto de pacientes tratados con corticoides sistémicos mostraron una leve mejoría con posterior progresión de las lesiones8,9.
Se han descrito otros desencadenantes (radioterapia10, arteriografía, picadura de garrapata7, inflamación de la cadera11) y su aparición sobre lesiones vasculares congénitas, como en nuestro caso8,12.
Tadaki et al13 postuló la existencia de un posible estímulo hormonal como explicación a los numerosos LPA hallados en la pubertad y prepubertad y la fase de crecimiento rápido que se observó en algunos de ellos.
También se sugiere que el LPA puede tratarse de un hamartoma complejo compuesto por músculo liso y vasos en un estadio de diferenciación intermedia entre sanguínea y linfática14. Esta hipótesis se sustenta por el hallazgo de desmina y colágeno iv rodeando los vasos anómalos7,11,12,14. Sin embargo, el característico crecimiento progresivo del LPA va en contra de su posible naturaleza hamartomatosa. En nuestra opinión la diferenciación intermedia sanguínea y linfática del LPA parece demostrada dada por un lado su positividad para distintos marcadores endoteliales típicamente sanguíneos como son F-VIII-RA8,10–12,15,16 y CD 348,12,15, y por otro la expresión del marcador endotelial linfático específico D2-404,5.
Clínicamente se suele presentar como una mácula o una placa ligeramente elevada, de color marrón, violácea o eritematosa, de bordes bien definidos y superficie rugosa. Su textura a la palpación puede ser blanda o ligeramente indurada con hipersensibilidad al tacto. Revisando los casos descritos solo un 17% de los mismos eran sintomáticos en el momento del diagnóstico (tabla 1). El LPA puede presentarse en cualquier punto de la superficie corporal (tabla 1), siendo sus localizaciones más frecuentes los miembros inferiores seguidos de la cabeza y el cuello. Su crecimiento tiene lugar de forma lenta durante un curso que suele ser de varios años de evolución, hecho que condiciona un gran diámetro de la lesión en el momento del diagnóstico (tabla 1). No se ha descrito la diseminación linfática o hemática en ningún caso siendo considerado clásicamente como una patología benigna con un pronóstico favorable. No obstante, dado que su crecimiento progresivo puede conducir a una manifiesta incapacidad del paciente, como sucedía en nuestro caso, parece más adecuado el uso del término localmente agresivo (en lugar de benigno) para caracterizar el comportamiento del LPA8,9,14.
Aunque el LPA fue descrito como una entidad propia de individuos jóvenes6, se han descrito casos en todas las edades; mostrando su presentación un patrón bimodal con mayor incidencia en dos franjas etarias: de 5 a 15 años y de 45 a 55 años. En estas dos décadas se agrupan el 46% de los casos. La proporción de casos entre hombres y mujeres es de 1/1.
Histológicamente el hallazgo más significativo es la presencia de espacios vasculares de pared fina distribuidos desde la dermis subpapilar hasta el tejido celular subcutáneo. Estos canales recubiertos de endotelio tienen una distribución que tiende a ser horizontal, sobretodo en la dermis superficial. La epidermis que los recubre suele estar respetada pudiendo existir zonas ligeramente acantósicas o atróficas. Las luces vasculares tienden a ser angulosas e irregulares con un aspecto dilatado en la dermis superficial. A medida que la lesión se hace más profunda dichas luces tienden a estrecharse y a distribuirse entre los haces de colágeno dando un patrón en disección de colágeno similar al que se puede encontrar en el angiosarcoma. El interior de los espacios vasculares suele estar vacío, pudiendo contener en algunos casos un material proteínico espumoso o colecciones hemáticas. También se ha descrito en algunos casos la existencia de un leve infiltrado inflamatorio mononuclear3. El endotelio vascular es plano, formado por una capa simple de células sin atipias ni mitosis, con un único núcleo ovoide hipercromático. También es frecuente encontrar focos de proliferación endotelial formando papilas que protruyen en el interior luminal.
El análisis de los estudios inmunohistoquímicos realizados en 37 casos revela la poca especificidad respecto a otras proliferaciones vasculares de los distintos marcadores descritos (tablas 2 y 3).
Diagnóstico diferencial del linfangioma progresivo adquirido (LPA)
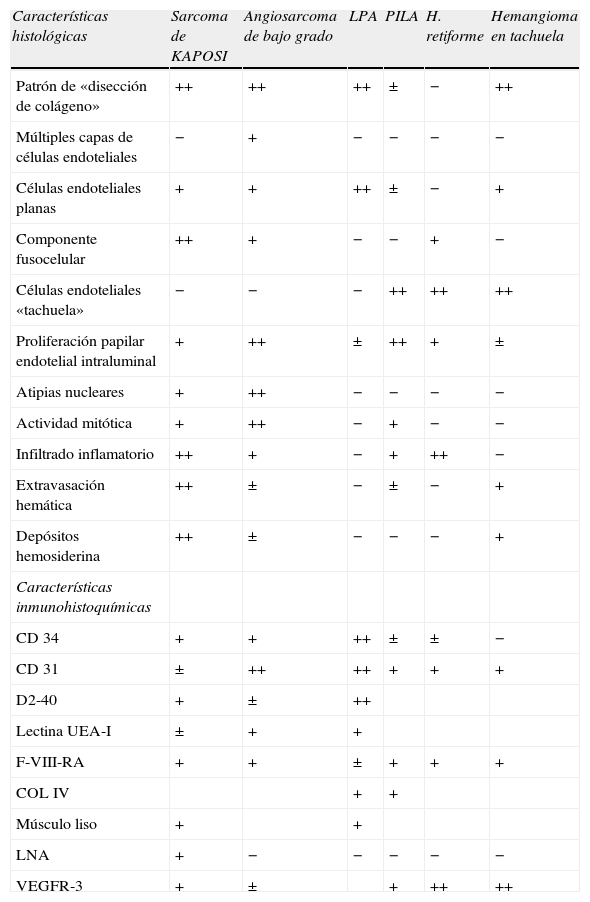
| Características histológicas | Sarcoma de KAPOSI | Angiosarcoma de bajo grado | LPA | PILA | H. retiforme | Hemangioma en tachuela |
| Patrón de «disección de colágeno» | ++ | ++ | ++ | ± | − | ++ |
| Múltiples capas de células endoteliales | − | + | − | − | − | − |
| Células endoteliales planas | + | + | ++ | ± | − | + |
| Componente fusocelular | ++ | + | − | − | + | − |
| Células endoteliales «tachuela» | − | − | − | ++ | ++ | ++ |
| Proliferación papilar endotelial intraluminal | + | ++ | ± | ++ | + | ± |
| Atipias nucleares | + | ++ | − | − | − | − |
| Actividad mitótica | + | ++ | − | + | − | − |
| Infiltrado inflamatorio | ++ | + | − | + | ++ | − |
| Extravasación hemática | ++ | ± | − | ± | − | + |
| Depósitos hemosiderina | ++ | ± | − | − | − | + |
| Características inmunohistoquímicas | ||||||
| CD 34 | + | + | ++ | ± | ± | − |
| CD 31 | ± | ++ | ++ | + | + | + |
| D2-40 | + | ± | ++ | |||
| Lectina UEA-I | ± | + | + | |||
| F-VIII-RA | + | + | ± | + | + | + |
| COL IV | + | + | ||||
| Músculo liso | + | + | ||||
| LNA | + | − | − | − | − | − |
| VEGFR-3 | + | ± | + | ++ | ++ |
++: característico/ constante; +: habitual/leve; ±: hallazgo ocasional/variable según series; −: ausente; H. retiforme: hemangioendotelioma retiforme o hemangioendotelioma en tachuela (hobnail); LNA: antígeno nuclear latente del VHH-8; PILA: angioendotelioma papilar intralinfático o tumor de Dabska.
Tinciones inmunohistoquímicas empleadas en neoplasias vasculares
| Lectina UEA-I (Ulex europaeus agglutinin i) | Marcador de endotelios linfáticos y sanguíneos con baja especificidad |
| CD 31 | Tiñe células hematopoyéticas, plaquetas y endotelios, tanto linfáticos como sanguíneos |
| F-VIII-RA o vWF (antígeno asociado al factor viii, también conocido como factor von Willebrand) | Marcador de endotelios sanguíneos con baja sensibilidad |
| CD 34 | Tiñe células hematopoyéticas y endotelios exclusivamente sanguíneos. Especificidad limitada, positivo en otros tejidos y tumores no vasculares |
| D2-40 (podoplanina) y VEGFR-3 (receptor 3 del factor de crecimiento endotelial vascular) | Marcadores muy específicos y sensibles de endotelios linfáticos |
| Colágeno tipo iv | Componente de las membranas basales. Está presente en vasos y capilares sanguíneos. Los vasos linfáticos suelen carecer de él |
| LNA (antígeno nuclear latente del VHH-8) | Positivo en el sarcoma de Kaposi, sobre todo en las formas asociadas a VIH. Negativo en otras proliferaciones vasculares |
Wilson Jones et al3 aporta en su serie la positividad de los vasos tumorales y no tumorales para lectina UEA-I, mientras que solo los vasos sanguíneos normales se marcaron con F-VIII-RA. Otros autores han descrito casos de LPA positivos para F-VIII-RA4,5,7,8,10–12,16 y negativos para UEA-I10,13. Revisando los LPA publicados (tabla 1) un 87% de los mismos mostró expresión de UEA-I y un 72% fue positivo para F-VIII-RA. Otros marcadores vasculares como el CD 314,5,7,8,15, CD 344,8,12,15, y D2-404,5 resultaron positivos en la práctica totalidad de los casos en que se aplicaron, incluyendo el nuestro.
El diagnóstico diferencial del LPA deberá realizarse con neoplasias vasculares malignas tales como el angiosarcoma de bajo grado o el SK (tabla 2). Histológicamente, la existencia en el angiosarcoma de bajo grado de cordones de células con mínimas atipias proyectándose en la luz es el único hallazgo constante que permite distinguirlo del LPA.
El SK, sobretodo en su estadio inicial (mácula/placa), puede confundirse clínica e histológicamente con el LPA. Sin embargo a diferencia del SK, el LPA se caracteriza por la ausencia de atipias y carece de un componente fusocelular.
Los marcadores inmunohistoquímicos resultan de escasa utilidad en el diagnóstico diferencial entre el angiosarcoma, el SK y el LPA. Cabe destacar la utilidad del antígeno nuclear latente (LNA-1) del VHH-8, cuya positividad se ha observado tanto en el SK asociado a VIH como en el resto de sus variedades. El LNA-1 es característicamente negativo en el resto de proliferaciones vasculares entre las que se plantea el diagnóstico diferencial con el SK (tabla 2). Serían necesarias series en las que se caracterizase la expresión de D2-40 en el subtipo de los angiosarcomas de bajo grado para establecer si este marcador puede contribuir al diagnóstico diferencial con el LPA.
La escisión quirúrgica completa parece el tratamiento de elección, no existiendo recidivas durante el seguimiento de aquellos casos tratados mediante escisiones con control de márgenes o cirugías amplias3,4,8,10,13,15. Watanabe et al describió la resolución completa de las lesiones en un LPA que recibió corticoides sistémicos4. Otros casos tratados con corticoides no mostraron ninguna mejoría o esta fue leve y transitoria8,9. También hay descripciones de pacientes que mejoraron tras recibir tratamiento antibiótico sistémico11,14.
Algunos autores prefieren la abstención terapéutica3,11,16 habiéndose observado la regresión espontánea parcial o total en dos ocasiones11,16. El resto de casos no tratados mostró un crecimiento lento e ininterrumpido llegando a abarcar extensas zonas corporales9. El crecimiento en extensión se acompañó de un incremento en la sintomatología referida por el paciente que comprendía desde molestias locales e hiperestesia a un dolor importante con incapacidad funcional8,9,14.
Según nos consta, se aporta el tercer caso de LPA en el que se describe la expresión de D2-40. Este hallazgo afianza la hipótesis de una diferenciación linfática en el LPA. El resto de hallazgos histológicos de nuestro caso se correspondían con los descritos previamente en la literatura.
Se quiere destacar con este paciente presentado el carácter localmente agresivo del LPA, una entidad considerada clásicamente como benigna que puede cursar de forma sintomática llegando a condicionar la vida del paciente. Estimamos que el LPA debe ser valorado por dermatólogos y patólogos, propiciando un diagnóstico precoz que permita su resección y evite posteriores complicaciones derivadas de su crecimiento. La escisión con control de márgenes parece el tratamiento de elección, obteniendo la curación sin posteriores recidivas en todos los casos descritos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.