Cuarenta años después de la publicación de la primera edición de la estadificación del American Joint Committee on Cancer, la octava edición se publica con cambios relevantes en el cáncer de piel. En el cáncer cutáneo no melanoma el American Joint Committee on Cancer mantiene un enfoque específico para el carcinoma de células de Merkel y tiene en cuenta algunos trabajos publicados recientemente sobre el pronóstico del carcinoma epidermoide cutáneo en la definición de una categoría T completamente nueva para este tumor. Por otra parte, la estadificación se contempla para el carcinoma epidermoide cutáneo de cabeza y cuello (excluyendo el párpado) y en otras localizaciones; únicamente ofrece soluciones para la estratificación de tumores de vulva, pene y región perineal. En relación con el melanoma, el valor del índice mitótico desaparece y el pronóstico del tumor primario se define basándose en el espesor de Breslow y la ulceración. Además, el espesor pasa a registrarse con una precisión de 0,1mm y aparece el concepto de T0 para los melanomas metastásicos en los que el primario ha regresado completamente. Existen diferencias en la categoría N de todos los sistemas de estadificación de cáncer cutáneo en esta nueva edición, y en relación con la categoría M, en el melanoma aparece la categoría M1d para hacer referencia a la afectación metastásica del SNC, que hasta el momento se incluía dentro de la categoría M1c. Será necesario validar este nuevo sistema con series de pacientes para valorar si efectivamente cumple con el objetivo de estratificar por riesgo los tumores de una manera adecuada.
The eighth edition of the staging manual of the American Joint Committee on Cancer incorporates important changes in the classification of skin cancers. Coming 40 years after the first edition, the latest manual preserves its specific system for Merkel cell carcinoma and takes into account recent publications on the prognosis of squamous cell carcinoma by defining a completely new T category for this neoplasm. Staging for squamous cell carcinoma considers head and neck tumors (excluding the eyelid) and does not offer solutions for other sites except the vulva, penis, and perianal region. Regarding melanoma, use of the mitotic index has been eliminated and the prognosis of the primary tumor is based on Breslow thickness and ulceration. In addition, thickness is now recorded to an accuracy of 0.1mm, and the T0 concept has been introduced to define those metastatic melanomas in which the primary tumor has regressed completely. In this new edition, changes have also been made to the N category of all the skin cancer staging systems, and M1d has been added to the M category for melanoma to refer to metastatic involvement of the central nervous system, which, up to now, had been included in the M1c category. This new system will need to be validated with patient series to determine if it adequately satisfies the objective of tumor risk stratification.
Cuarenta años después de que viera la luz la primera edición del TNM del American Joint Committee on Cancer (AJCC)1 se publica su octava edición con importantes novedades en el cáncer cutáneo2. En el cáncer cutáneo no melanoma (CCNM) el nuevo sistema de estadificación mantiene uno específico para el carcinoma de células de Merkel (CCM) y tiene en cuenta algunos trabajos sobre el pronóstico del carcinoma epidermoide cutáneo (CEC) publicados en los últimos años, aunque persiste únicamente un sistema común para el CEC y el resto de las formas de CCNM (excluyendo el CCM), es decir, que el CEC y el carcinoma basocelular se estadifican de la misma manera. En el melanoma se prescinde del índice mitótico como factor modificador del estadio T y la categoría T se basa exclusivamente en el espesor de Breslow y la presencia de ulceración.
Cáncer cutáneo no melanomaDesde aquella primera edición de 19771 se han producido enormes avances en la evaluación del pronóstico del cáncer cutáneo no melanoma, lo que ha supuesto cambios progresivos en las sucesivas ediciones hasta la versión actual, publicada este año 20172 y que se espera sea implementada en práctica desde el 1 de enero del 2018. En realidad, hasta la sexta edición de la estadificación del AJCC3, y a pesar de algunos relevantes trabajos de la década de los 904–10, los cambios que se habían ido produciendo en la clasificación de la categoría T del CCNM habían sido muy sutiles. Con pequeñas diferencias entre algunos de los sistemas, básicamente un tumor se consideraba T1 si medía menos de 2cm, T2 si tenía un diámetro mayor entre 2 y 5cm, T3 si medía más de 5cm y T4 si invadía el hueso, el músculo o el cartílago1,11–14. Se fueron publicando trabajos en los que se reconocía la influencia de diversos factores en el pronóstico del CEC15–23, algunos de los cuales ponían explícitamente de manifiesto la necesidad de mejorar dicho sistema de estadificación18,21.
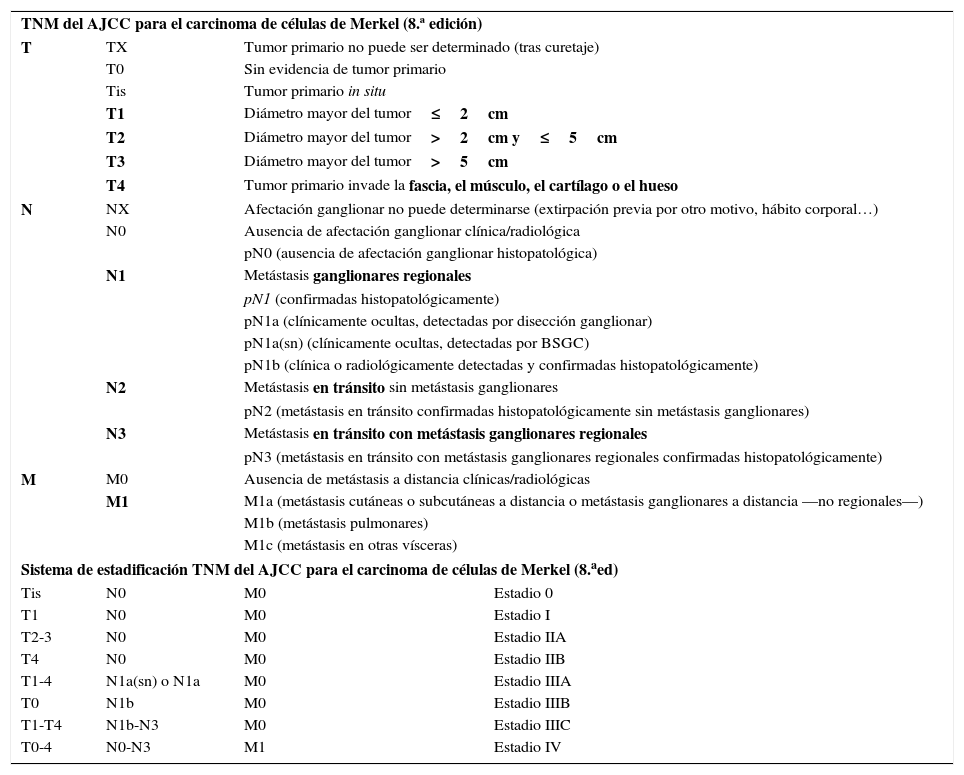
Carcinoma de células de MerkelEn el año 2010 la séptima edición del AJCC incorporó novedades significativas en la clasificación del CCNM24. Por primera vez se creaba una guía de estadificación separada para el carcinoma de células de Merkel (CCM), que hasta ese momento se clasificaba en función del mismo sistema de estadificación que el resto de las formas de CCNM. Desde otro punto de vista, todas las formas de CCNM distintas del CCM se debían clasificar con arreglo a los criterios del carcinoma epidermoide cutáneo. El TNM para el CCM se ha modificado en la última edición2 en función de un estudio que evaluaba la evolución clínica de una gran serie de pacientes25. En realidad, la clasificación del estadio T no sufre modificaciones, pero existen cambios relevantes para la categoría N y para la estratificación de los estadios i-iv2,25. Por otra parte, se separa una estadificación clínica y otro histopatológica en esta octava edición del TNM2,25. En lo que respecta a la categoría T, un CCM se considera T1 si mide 2cm o menos de diámetro mayor, T2 si mide entre 2 y 5cm de diámetro mayor, T3 si mide más de 5cm y T4 si invade estructuras profundas (hueso, músculo, fascia o cartílago)2,25.
Sobre la categoría N se establece el tumor como N1 si exhibe metástasis en los ganglios linfáticos regionales, N2 si presenta metástasis en tránsito sin metástasis en los ganglios regionales y N3 si presenta tanto metástasis en tránsito como en los ganglios. En relación con el estadiaje patológico de la categoría N se diferencia, dentro de la categoría N1 los subtipos N1a (clínicamente oculta, detectada por disección ganglionar), N1a(sn) (clínicamente oculta, detectada por biopsia selectiva de ganglio centinela) y N1b (si es clínica o radiológicamente detectada y confirmada patológicamente). En relación con la categoría M se establece la categoría M1a para la afectación cutánea o subcutánea distante (no en tránsito, que entraría dentro de la categoría N) o afectación de ganglios linfáticos distantes (no regionales); la categoría M1b hace referencia a la afectación pulmonar y M1c a la afectación de vísceras diferentes al riñón. Si existe confirmación microscópica el tumor se considera estadio pM1, con su correspondiente subclasificación. En la tabla 1 se resume el sistema de estadificación actual para el carcinoma de células de Merkel.
Octava edición de la clasificación TNM y la estadificación del AJCC para el carcinoma de células de Merkel
| TNM del AJCC para el carcinoma de células de Merkel (8.ª edición) | |||
| T | TX | Tumor primario no puede ser determinado (tras curetaje) | |
| T0 | Sin evidencia de tumor primario | ||
| Tis | Tumor primario in situ | ||
| T1 | Diámetro mayor del tumor≤2cm | ||
| T2 | Diámetro mayor del tumor>2cm y≤5cm | ||
| T3 | Diámetro mayor del tumor>5cm | ||
| T4 | Tumor primario invade la fascia, el músculo, el cartílago o el hueso | ||
| N | NX | Afectación ganglionar no puede determinarse (extirpación previa por otro motivo, hábito corporal…) | |
| N0 | Ausencia de afectación ganglionar clínica/radiológica | ||
| pN0 (ausencia de afectación ganglionar histopatológica) | |||
| N1 | Metástasis ganglionares regionales | ||
| pN1 (confirmadas histopatológicamente) | |||
| pN1a (clínicamente ocultas, detectadas por disección ganglionar) | |||
| pN1a(sn) (clínicamente ocultas, detectadas por BSGC) | |||
| pN1b (clínica o radiológicamente detectadas y confirmadas histopatológicamente) | |||
| N2 | Metástasis en tránsito sin metástasis ganglionares | ||
| pN2 (metástasis en tránsito confirmadas histopatológicamente sin metástasis ganglionares) | |||
| N3 | Metástasis en tránsito con metástasis ganglionares regionales | ||
| pN3 (metástasis en tránsito con metástasis ganglionares regionales confirmadas histopatológicamente) | |||
| M | M0 | Ausencia de metástasis a distancia clínicas/radiológicas | |
| M1 | M1a (metástasis cutáneas o subcutáneas a distancia o metástasis ganglionares a distancia —no regionales—) | ||
| M1b (metástasis pulmonares) | |||
| M1c (metástasis en otras vísceras) | |||
| Sistema de estadificación TNM del AJCC para el carcinoma de células de Merkel (8.aed) | |||
| Tis | N0 | M0 | Estadio 0 |
| T1 | N0 | M0 | Estadio I |
| T2-3 | N0 | M0 | Estadio IIA |
| T4 | N0 | M0 | Estadio IIB |
| T1-4 | N1a(sn) o N1a | M0 | Estadio IIIA |
| T0 | N1b | M0 | Estadio IIIB |
| T1-T4 | N1b-N3 | M0 | Estadio IIIC |
| T0-4 | N0-N3 | M1 | Estadio IV |
Hemos tenido en cuenta la estadificación patológica. En negrita, los aspectos más relevantes de la estadificación.
BSGC: biopsia selectiva de ganglio centinela.
En relación con las guías de estadificación del CEC, la séptima edición incluía una serie de factores de alto riesgo que permitían modificar la categoría T de un tumor primario independientemente del tamaño horizontal (lo cual representaba un avance importante frente a las ediciones previas) (tabla 2)24. Concretamente reconocía el pobre grado de diferenciación histológica, la infiltración perineural, el espesor vertical de más de 2mm, los niveles iv y v de Clark y la localización en la oreja o en el labio inferior, junto con el tamaño horizontal del tumor como factores de riesgo (FR) a considerar para definir la categoría T del tumor primario: a) si el tumor medía <2cm y tenía <2FR se consideraba T1; b) si medía >2cm o si medía <2cm y exhibía 2 o más FR se consideraba T2; c) para considerarlo T3 o T4 era necesario que invadiera el hueso: un T3 se consideraba si presentaba la invasión de hueso maxilar, mandibular, orbitaria o del hueso temporal y un T4 si presentaba invasión de otros huesos o infiltración perineural de la base del cráneo24. No obstante, no se incluían todos los factores de riesgo, y a medida que se fue sometiendo a su validación se observaron deficiencias. La mayor crítica se centraba en que dentro del estadio T2 existía un abanico de pacientes con una gran heterogeneidad en términos de riesgo y pronóstico26–31. De alguna manera, esta edición de la estadificación concentraba el mal pronóstico del CEC en los tumores T232,33. De hecho, en una cohorte de 1.818 pacientes se comprobaron únicamente 6 casos T3-T4 y el grueso de eventos adversos sucedió en tumores clasificados como T2 (el 72% de las recidivas locales, el 82% de las metástasis ganglionares y el 67% de las muertes específicas por enfermedad)32.
Comparación de la 7.a y 8.a ediciones de estadificación del American Joint Committee on Cancer (AJCC) para el carcinoma epidermoide cutáneo y cáncer cutáneo no melanoma (CCNM) distinto del carcinoma de células de Merkel. Diferencias en las 4 categorías del estadio T
| Categoría T para el carcinoma epidermoide cutáneo y CCNM no Merkel | |||
| T | 7.aedición del AJCC | 8.aedición del AJCC | |
| T1 | Hasta 2cm de diámetro mayor y<de 2 factores de alto riesgo | Hasta 2cm de diámetro mayor | |
| T2 | >2cm de diámetro mayor o 2 o más factores de alto riesgoa | Tumor>2cm pero<de 4cm de diámetro mayor | |
| T3 | Invade hueso maxilar, órbita, mandíbula, hueso temporal | Tumor≥4cm de diámetro mayor o mínima erosión del hueso o invasión perineural o invasión profundab | |
| T4 | Otros huesos (incluyendo esqueleto axial), infiltración perineural de la base del cráneo | Tumor con afectación ósea extensa cortical o medular (T4a), invasión de la base del cráneo o invasión a través del foramen de la base del cráneo(T4b) | |
Espesor mayor de 2mm, pobre grado de diferenciación, infiltración perineural, afectación de oreja o labio inferior, nivel iv-v de invasión de Clark.
Invasión profunda que se define como espesor mayor de 6mm o invasión más allá de la grasa subcutánea. La invasión perineural para clasificar un tumor como T3 debe ser de nervios mayores de 0,1mm, más profundos que la dermis, o afectación clínica o radiológica de nervios «nominados» sin afectación o invasión de la base del cráneo.
La octava edición del AJCC2 parece haber tenido en cuenta algunos trabajos que se habían centrado, por un lado, en la evaluación de la influencia del espesor sobre el pronóstico21 y por otro en la influencia del grosor del filete nervioso afectado que infiltra el tumor y en la profundidad de invasión del CEC32 para clasificar la T (tabla 2). En relación con la estratificación de la categoría N, esta se basa en el esquema que comparten otros tumores de cabeza y cuello. Además, se considera por primera vez el CEC de cabeza y cuello como un capítulo independiente (en las ediciones previas el CCNM se refería en general a cualquier localización) e incluye el CEC de labio inferior por su relación con la radiación UV. Sin embargo, excluye la localización en el párpado y todos los tumores localizados fuera del área de la cabeza y el cuello. Aunque para las localizaciones especiales de párpado, vulva, pene y región perineal el AJCC ofrece soluciones, no define ningún sistema para la clasificación de tumores localizados fuera del área de la cabeza y el cuello, y que no afectan a estas localizaciones especiales, lo cual constituye un hándicap evidente. Esto hace que un CEC localizado por ejemplo en el dorso de la mano no puede ser clasificado con arreglo a la 8.a edición del TNM del AJCC. Por otra parte, las formas de CCNM distintas del CEC y del CCM se rigen (como sucedía en ediciones anteriores) por los mismos criterios que el CEC.
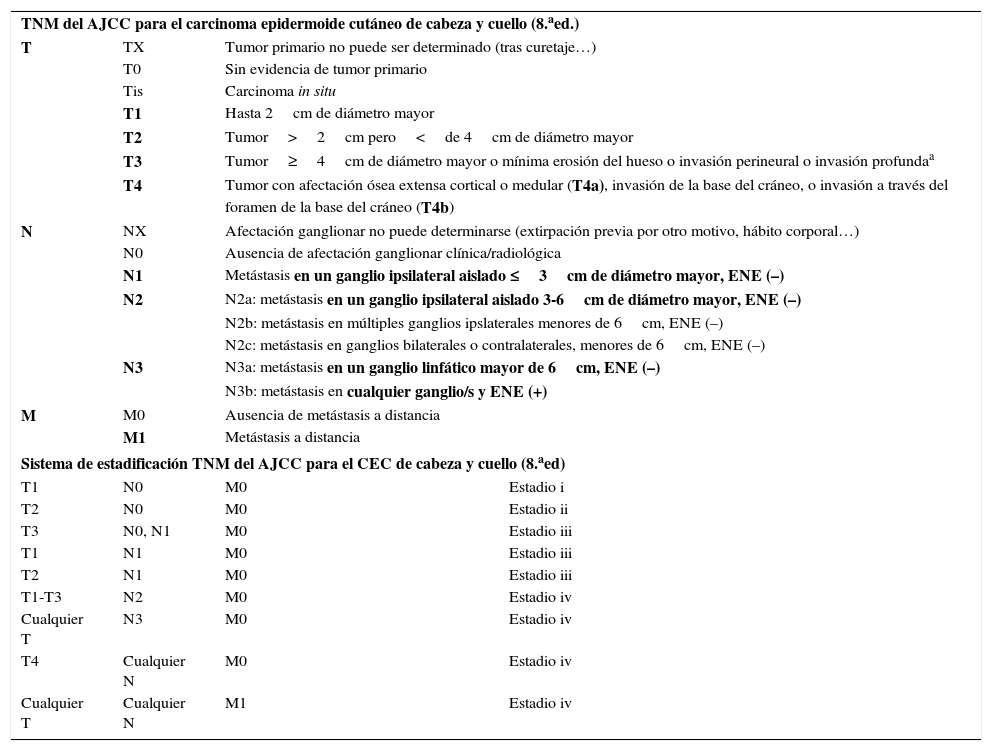
En relación con la categoría T, la 8.ª edición del AJCC considera T1 a un tumor menor de 2cm de diámetro mayor, T2 a un tumor de 2 a 4cm y T3 a un tumor mayor de 4cm de diámetro. Hasta ahora sería bastante similar en la estratificación a las ediciones previas de 2010, no obstante, un tumor es también T3 si tiene un espesor mayor de 6mm, si muestra infiltración perineural de filetes nerviosos de más de 0,1mm, si invade más allá de la grasa o si presenta una mínima erosión del hueso. El tumor se clasifica como T4 si invade el hueso de manera más extensa, así como si invade la base del cráneo o el foramen del cráneo2. De esta forma, el mal pronóstico es posible que se aleje de los tumores T2 y se concentre en los T3. En función del trabajo de O’Brien34 el panel de expertos del AJCC consideró estadificar a los pacientes también de acuerdo a la progresiva afectación ganglionar. La categoría N se basa en el esquema que comparten otros tumores de cabeza y cuello. Se considera N1 al tumor que afecta a un ganglio ipsilateral aislado, menor de 3cm de diámetro y sin extensión extracapsular, N3 si existe metástasis en un ganglio linfático mayor de 6cm de diámetro o de cualquier tamaño si existe extensión extracapsular, N2 se emplea para clasificar a las situaciones intermedias entre N1 y N3 (tabla 3). Por otra parte, la afectación en otros órganos se define como M1 (sin establecer subgrupos). En la tabla 3 se resume la última edición de la estadificación del AJCC para CEC de cabeza y cuello.
Octava edición de la clasificación TNM y la estadificación del AJCC para el carcinoma epidermoide cutáneo (CEC)de cabeza y cuello y cáncer cutáneo no melanoma distinto del carcinoma de células de Merkel de cabeza y cuello
| TNM del AJCC para el carcinoma epidermoide cutáneo de cabeza y cuello (8.aed.) | |||
| T | TX | Tumor primario no puede ser determinado (tras curetaje…) | |
| T0 | Sin evidencia de tumor primario | ||
| Tis | Carcinoma in situ | ||
| T1 | Hasta 2cm de diámetro mayor | ||
| T2 | Tumor>2cm pero<de 4cm de diámetro mayor | ||
| T3 | Tumor≥4cm de diámetro mayor o mínima erosión del hueso o invasión perineural o invasión profundaa | ||
| T4 | Tumor con afectación ósea extensa cortical o medular (T4a), invasión de la base del cráneo, o invasión a través del foramen de la base del cráneo (T4b) | ||
| N | NX | Afectación ganglionar no puede determinarse (extirpación previa por otro motivo, hábito corporal…) | |
| N0 | Ausencia de afectación ganglionar clínica/radiológica | ||
| N1 | Metástasis en un ganglio ipsilateral aislado ≤3cm de diámetro mayor, ENE (–) | ||
| N2 | N2a: metástasis en un ganglio ipsilateral aislado 3-6cm de diámetro mayor, ENE (–) | ||
| N2b: metástasis en múltiples ganglios ipslaterales menores de 6cm, ENE (–) | |||
| N2c: metástasis en ganglios bilaterales o contralaterales, menores de 6cm, ENE (–) | |||
| N3 | N3a: metástasis en un ganglio linfático mayor de 6cm, ENE (–) | ||
| N3b: metástasis en cualquier ganglio/s y ENE (+) | |||
| M | M0 | Ausencia de metástasis a distancia | |
| M1 | Metástasis a distancia | ||
| Sistema de estadificación TNM del AJCC para el CEC de cabeza y cuello (8.aed) | |||
| T1 | N0 | M0 | Estadio i |
| T2 | N0 | M0 | Estadio ii |
| T3 | N0, N1 | M0 | Estadio iii |
| T1 | N1 | M0 | Estadio iii |
| T2 | N1 | M0 | Estadio iii |
| T1-T3 | N2 | M0 | Estadio iv |
| Cualquier T | N3 | M0 | Estadio iv |
| T4 | Cualquier N | M0 | Estadio iv |
| Cualquier T | Cualquier N | M1 | Estadio iv |
Se incluye la localización en labio inferior, se excluye el carcinoma de párpado. Se excluyen tumores de vulva, pene, región perineal y resto de localizaciones fuera de cabeza y cuello.
En negrita, los aspectos más relevantes de la estadificación.
BSGC: biopsia selectiva de ganglio centinela; CEC: carcinoma epidermoide cutáneo; ENE: extensión extranodal o extracapsular, definida como extensión a través de la cápsula del ganglio linfático en el tejido conectivo circundante, con o sin reacción estromal.
Invasión profunda se define como espesor mayor de 6mm o invasión más allá de la grasa subcutánea. La invasión perineural para clasificar un tumor como T3 debe ser de nervios mayores de 0,1mm, más profundos que la dermis, o afectación clínica o radiológica de afectación de nervios nominados sin afectación o invasión de la base del cráneo.
Podrían establecerse críticas tales como: 1) la no inclusión de algunos factores de alto riesgo; 2) la ausencia de un sistema de estadificación específico para el carcinoma basocelular o para otras formas de cáncer cutáneo no melanoma (excluyendo el CCM, que cuenta con un sistema de estadificación propio desde el año 2010); 3) la exclusión de localizaciones fuera de la cabeza y el cuello, lo que supone que algunos casos no puedan ser estadificados según la 8.a edición del TNM del AJCC. No obstante, el sistema parece haber mejorado significativamente frente a las ediciones previas —al menos teniendo en cuenta factores relevantes que se habían pasado por alto en el pasado—, aunque serán necesarias series de validación para comprobarlo.
MelanomaEn el melanoma también se han producido cambios importantes. En relación con la categoría T el conflicto reside en la estratificación de los melanomas más finos (tabla 4). Los cambios a lo largo de los diferentes sistemas de estadificación en el melanoma han sido más llamativos que en el caso del cáncer cutáneo no melanoma (debido fundamentalmente a series de pacientes mejor estudiadas y a una evidencia creciente sobre factores de riesgo que no existía para otras formas de cáncer de piel). Desde que en el año 1970 apareciera el artículo original de Alexander Breslow35, el crédito que se le ha concedido al espesor del melanoma (enmm, medido desde la capa granulosa) ha sido cada vez más sólido. Si bien inicialmente no surgió para desbancar, sino para complementar en el pronóstico del melanoma al nivel de invasión de Clark35, desde la primera edición del TNM del AJCC el llamado índice de Breslow figuraba ya a un nivel de relevancia similar al nivel de invasión de Clark1,11,12, algo que se mantuvo hasta que la sexta y séptima ediciones terminan por desbancarlo24,36. La ulceración, otro de los factores pronósticos clásicos en el melanoma, cuya influencia se conoce desde antes que el índice de Breslow37, es otro de los parámetros que no han dejado de permanecer en los sucesivos sistemas de estadificación1,3,11–14,24.
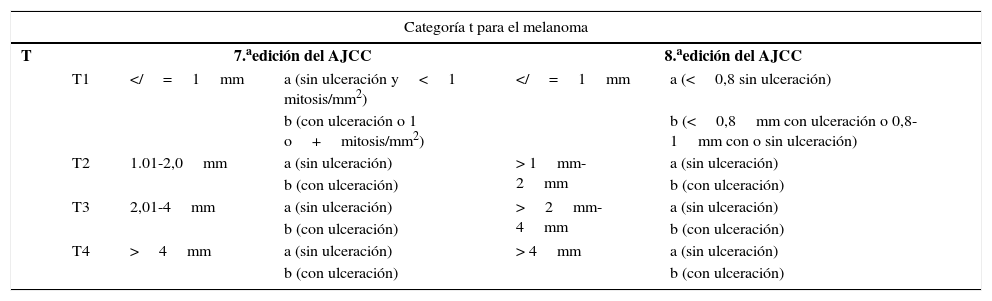
Comparación de la 7.a y 8.a ediciones de estadificación del American Joint Committee on Cancer (AJCC) para el melanoma. Se establecen diferencias para la categoría T1. El índice mitótico desaparece de la categoría T en la 8.a edición y la estratificación se basa exclusivamente en el índice de Breslow y la presencia o ausencia de ulceración
| Categoría t para el melanoma | |||||
|---|---|---|---|---|---|
| T | 7.aedición del AJCC | 8.aedición del AJCC | |||
| T1 | =1mm | a (sin ulceración y<1 mitosis/mm2) | =1mm | a (<0,8 sin ulceración) | |
| b (con ulceración o 1 o+mitosis/mm2) | b (<0,8mm con ulceración o 0,8-1mm con o sin ulceración) | ||||
| T2 | 1.01-2,0mm | a (sin ulceración) | > 1mm-2mm | a (sin ulceración) | |
| b (con ulceración) | b (con ulceración) | ||||
| T3 | 2,01-4mm | a (sin ulceración) | >2mm-4mm | a (sin ulceración) | |
| b (con ulceración) | b (con ulceración) | ||||
| T4 | >4mm | a (sin ulceración) | > 4mm | a (sin ulceración) | |
| b (con ulceración) | b (con ulceración) | ||||
Más adelante, en la séptima edición, surgió la presencia de las mitosis como sistema útil para estratificar el pronóstico de los melanomas de menos de 1mm de espesor38, y pasó a sustituir al nivel de invasión de Clark para estratificar a esos melanomas finos24,36. Se observó que en los tumores T1 la ulceración, la presencia de mitosis y el espesor eran los factores que más influían sobre la supervivencia de los pacientes36. Sin embargo, la influencia de las mitosis en el pronóstico del melanoma se demostraba importante no solamente en los tumores de menos de 1mm de espesor (T1), sino en general en los melanomas localizados39–41. Surgieron trabajos en los que se demostraba su valor pronóstico en melanomas de más de 1mm de espesor y como factores predictores de biopsia selectiva del ganglio centinela positiva42, lo que reducía su especificidad en el pronóstico de los melanomas finos. Por otra parte, se planteó cierta variabilidad entre observadores y una baja reproductibilidad del índice mitótico, lo que hizo evidenciar la necesidad de realizar 3-5 cortes seriados para que se considerara fiable la evaluación de las mitosis43, proponiéndose que podía no ser un buen parámetro para tomar decisiones terapéuticas44. De hecho, algunos estudios multivariantes no fueron capaces de demostrar su relevancia pronóstica real45,46.
En la octava edición de la estadificación del AJCC, una vez más el mayor conflicto se centra en los tumores finos2. Desaparece la influencia de las mitosis para clasificar a los tumores T1 y se centra exclusivamente en el espesor y la presencia de ulceración2. Así, un tumor es clasificado como T1a si mide menos de 0,8mm de espesor y no está ulcerado, y es T1b si mide menos de 0,8mm de espesor y está ulcerado o si mide 0,8-1mm de espesor, independientemente de que se encuentre ulcerado o no2. Las mediciones del espesor deben registrarse con una precisión de 0,1mm (en lugar de 0,01mm, como se planteaba en la 7.ª edición). Los tumores de hasta 1mm de espesor pueden medirse con una precisión de 0,01mm si resulta más práctico, pero deberán después redondearse hacia arriba o hacia abajo de modo que se registre únicamente el espesor con un decimal2. La octava edición de la estadificación del AJCC incluye también, en relación con el estadio T, el concepto de T0, que se aplica a aquellos casos en los que el melanoma haya regresado completamente, y no se usa para los casos de regresión parcial del tumor primario y que comience con afectación a distancia2, básicamente para los casos de melanoma metastásico de primario desconocido.
Por otra parte, existen también cambios relacionados con la estratificación de las categorías N y M, así como en la estadificación. Así, aparece una categoría N1c para la presencia de metástasis en tránsito, satélites o microsatélites sin afectación ganglionar (algo que en la edición anterior se clasificaba como N2c) y N2c se reserva ahora para la presencia de metástasis en un ganglio asociadas a las metástasis en tránsito. La categoría N3 también se estratifica en N3a, N3b y N3c (algo que difiere de lo que sucedía en la edición anterior)2. Se modifica también la categoría M y surge M1d para hacer referencia a los melanomas que desarrollan metástasis en el SNC, algo que hasta ahora se incluía en la categoría M1c. Los niveles de LDH se utilizan para estratificar la categoría M, aunque no afecta el estadio2. En la estadificación no se producen modificaciones sustanciales hasta el estadio IIC ni en el iv, aunque existen cambios en el estadio iii, que lo dota de mayor complejidad2. En la tabla 5 se resumen las características del TNM y la estadificación con arreglo a la última edición del AJCC.
Octava edición de la clasificación TNM y la estadificación del AJCC para el melanoma (cutáneo)
| TNM del AJCC para el melanoma (8.aed) | |||
| T | TX | Tumor primario no puede ser determinado (tras curetaje…) | |
| T0 | Sin evidencia de tumor primario | ||
| Tis | melanoma in situ | ||
| T1 | ≤1mm | a (<0,8 sin ulceración) | |
| b (<0,8mm con ulceración o 0,8-1mm con o sin ulceración) | |||
| T2 | >1mm-2mm | a (sin ulceración) | |
| b (con ulceración) | |||
| T3 | >2mm-4mm | a (sin ulceración) | |
| b (con ulceración) | |||
| T4 | >4mm | a (sin ulceración) | |
| b (con ulceración) | |||
| N | NX | Afectación ganglionar no puede determinarse (extirpación previa por otro motivo, hábito corporal…) | |
| N0 | Ausencia de afectación ganglionar clínica/radiológica | ||
| N1 | N1a: micrometástasis en un ganglio linfático (clínicamente oculto) | ||
| N1b: ganglio linfático clínicamente detectado | |||
| N1c: metástasis en tránsito, satélites o microsatélites sin afectación ganglionar | |||
| N2 | N2a: micrometástasis en 2 o 3 ganglios (clínicamente ocultos) | ||
| N2b: metástasis en 2 o 3 ganglios linfáticos | |||
| N2c: metástasis en un ganglio (oculta o clínica) y metástasis en tránsito, satélites o microsatélites | |||
| N3 | N3a: 4 o más micrometástasis en ganglios linfáticos | ||
| N3b: 4 o más metástasis en ganglios linfáticos, al menos una de ella clínicamente evidente o presencia de conglomerado adenopático | |||
| N3c: 2 o más micrometástasis o metástasis ganglionares clínicamente detectables o presencia de conglomerado adenopático y metástasis en tránsito, satélites o microsatélites | |||
| M | M0 | Sin evidencia de metástasis ganglionares | |
| M1 | M1a: metástasis a distancia en piel, tejidos blandos (incluyendo músculo) y/o ganglios linfáticos no regionales - M1a(0): LDH normal - M1a(1): LDH elevada | ||
| M1b: metástasis pulmonares con/sin M1a - M1b(0): LDH normal - M1b(1): LDH elevada | |||
| M1c: metástasis a distancia en órganos distintos del SNC con/sin M1a y M1b - M1c(0): LDH normal - M1c(1): LDH elevada | |||
| M1d: metástasis al SNC con/sin M1a, M1b o M1c - M1d(0): LDH normal - M1d(1): LDH elevada | |||
| Sistema de estadificación TNM del AJCC para el melanoma (8.aed.) | |||
| Tis | N0 | M0 | Estadio 0 |
| T1a-T1b | N0 | M0 | Estadio IA |
| T2a | N0 | M0 | Estadio IB |
| T2b-T3a | N0 | M0 | Estadio IIA |
| T3b-T4a | N0 | M0 | Estadio IIB |
| T4b | N0 | M0 | Estadio IIC |
| T0 | N1b/1c | M0 | Estadio IIIB |
| T0 | N2b/2c, N3b/3c | M0 | Estadio IIIC |
| T1a/b-T2a | N1a, N2a | M0 | Estadio IIIA |
| T1a/b-T2a | N1b/1c, N2b | M0 | Estadio IIIB |
| T2b/T3a | N1a-N2b | M0 | Estadio IIIB |
| T1a/T3a | N2c/N3a,b,c | M0 | Estadio IIIC |
| T3b/T4a | N1-N3 | M0 | Estadio IIIC |
| T4b | N1a-N2c | M0 | Estadio IIIC |
| T4b | N3a/b/c | M0 | Estadio IIID |
| Cualquier T, Tis | Cualquier N | M1 | Estadio iv |
En negrita, los aspectos más relevantes de la estadificación.
La última edición de la estadificación del AJCC para el melanoma confiere al espesor de Breslow y la ulceración la máxima relevancia. Se establecen modificaciones en la cetegoría N y en la categoría M, así como en la estadificación. Se necesitarán series que puedan validar si la capacidad de predicción de este nuevo sistema de estadificación es superior o no a los previos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesDeclaramos no tener conflicto de intereses.
J.C. ha sido apoyado parcialmente para el desarrollo de este trabajo a través del proyecto GRS1342/A/16 y del programa de intensificación de la Gerencia Regional de Castilla y León (INT/M/16/17).