Los telocitos (TC) son células intersticiales noveles que han sido subvaloradas durante mucho tiempo debido a su similitud histológica con otras células estromales. Los TC pueden separarse de las células estromales debido a sus distintas características inmunohistoquímicas, ultraestructurales y moleculares. A nivel funcional, los TC están implicados en la renovación tisular, el soporte mecánico y la modulación inmune. Dichas células están implicadas también en la transducción de señal, bien mediante sus interacciones directas con las células circundantes, o bien mediante la señalización paracrina, a través de las vesículas extracelulares. Los TC se ven dañados en ciertas situaciones inflamatorias y fibróticas tales como colitis ulcerosa, enfermedad de Crohn, fibrosis hepática, psoriasis y esclerosis sistémica. El trasplante de TC en el tejido dañado puede promover la regeneración tisular. Por tanto, mejorar los TC tisulares mediante trasplante o promoción de su supervivencia y crecimiento, utilizando medicaciones novedosas, representa una estrategia terapéutica innovadora para el futuro. En esta revisión abordamos diversos aspectos de los TC, incluyendo su origen, su distribución, sus características morfológicas y sus funciones. También tratamos la implicación de los TC cutáneos en el desarrollo de diversas situaciones patológicas.
The telocytes (TCs) are novel interstitial cells that have been overlooked for a long time due to their histologic similarity to other stromal cells. TCs can be separated from the stromal cells based on their distinct immunohistochemical, ultrastructural, and molecular features. Functionally, TCs are involved in the tissue renewal, mechanical support, and immune modulation. These cells are also involved in the signal transduction either through their direct interactions with the neighboring cells or through the paracrine signaling via extracellular vesicles. TCs are damaged in several inflammatory and fibrotic conditions such as ulcerative colitis, Crohn's disease, hepatic fibrosis, psoriasis, and systemic sclerosis. The transplantation of TCs in the damaged tissue can promote tissue regeneration. Therefore, enhancing tissue TCs either by their transplantation or by promoting their survival and growth using novel medications represents novel therapeutic strategy in the future. In this review, we addressed several aspects of TCs including their origin, distribution, morphologic features, and functions. We also discussed their involvement of the cutaneous TCs in the development various pathologic conditions.
En 1911 Santiago Ramón y Cajal identificó un nuevo tipo de células con largas prolongaciones citoplasmáticas ubicadas en el interior de la capa muscular del tubo digestivo humano. Cajal denominó a estas células como «neuronas intersticiales» debido a sus características proyecciones citoplasmáticas y ubicación entre las células del músculo liso y las terminaciones nerviosas1. En 1977, Faussone-Pellegrini et al. investigaron las características ultraestructurales de estas neuronas intersticiales usando microscopia electrónica. Indicaron que estas células no eran verdaderas neuronas, por lo que las rebautizaron como «células intersticiales de Cajal» (CIC). Los autores describieron las características ultraestructurales de las CIC como células fusiformes con largas prolongaciones citoplásmicas mediante las cuales estas células pueden interactuar entre sí y con otros tipos de células2. En 1996, Lecoin et al. confirmaron el origen mesenquimatoso de los CIC. También indicaron que los CIC en embriones de pollo expresaban el gen que codifica al receptor de citocinas tirosina quinasa «Kit»3.
En 2005, Popescu et al. describieron células que se asemejan mucho a las CIC en el páncreas exocrino, y las acuñaron como «células intersticiales tipo Cajal» (CITC)4. En 2010, Popescu y Faussone-Pellegrini indicaron que estas células tenían propiedades físicas únicas, como la presencia de núcleos ovalados rodeados de escaso citoplasma y telópodos (Tps). Ellos acuñaron estas células como «telocitos» (TC), además de indicar que los TC eran células completamente diferentes a los CIC, ya que tenían características ultraestructurales, inmunohistoquímicas y genéticas únicas, así como otro perfil de expresión de proteínas5.
La distribución de los TC en los tejidos humanosSe han detectado TC en el tejido de varios vertebrados, como ratones, ratas, cobayos, pollos y humanos. Inicialmente, se pensó que los TC estaban predominantemente ubicados en el aparato intestinal del cuerpo humano6. Sin embargo, la creciente evidencia indica que los TC están presentes en casi todos los órganos humanos, como son el corazón7, los vasos sanguíneos8, los pulmones9, las meninges10, la piel10,11, las glándulas salivales12, el hígado, la vesícula biliar13, el páncreas4,14,15, la médula ósea16, la mama15, las trompas de Falopio17, la placenta18, el miometrio14, el riñón, la vejiga y la próstata19. En estos órganos, los TC se encuentran comúnmente en el tejido intersticial, donde pueden interactuar con las células del estroma, las células inmunitarias y los vasos sanguíneos circundantes. La distribución de los TC en diferentes tejidos humanos y sus interacciones celulares se resumen en la tabla 1.
La distribución de los telocitos en los diferentes tejidos humanos y sus interacciones celulares con otras células
| Órgano | Localización | Células asociadas | Referencias |
|---|---|---|---|
| Corazón | Endocardio, miocardio y epicardio | Capilares, nervios, linfocitos, plasma y células satélite | 7 |
| Válvulas cardíacas | Ápice y base de todas las válvulas cardíacas | Células madre | 58 |
| Vasos sanguíneos | La capa muscular circundante | Arteriolas, capilares y vénulas | 8 |
| Pulmones | Estroma subepitelial y uniones broncoalveolares | Células epiteliales y madre | 9 |
| Meninges y plexo coroideo | Intersticio | Vasos sanguíneos, células ependimales y células madre | 10 |
| Músculo esquelético | Intersticio | Capilares, nervios y miocitos | 9 |
| Dermis | En la dermis papilar y reticular, alrededor de las glándulas sudoríparas sebáceas y ecrinas y en la vaina perifolicular | Células madre inmunitarias, vasos sanguíneos y músculo erector del pelo | 11 |
| Limbo y úvea | Lámina propia conjuntival, esclerótica, estroma del iris, pars plana del cuerpo ciliar y el epitelio subcorneal | Células madre epiteliales y del estroma, melanocitos, macrófagos y fibras nerviosas | 59 |
| Esófago | Lámina propia y capa muscular | Linfocitos, capilares y nervios | 60 |
| Duodeno | En la lámina propia y rodeando las criptas | Células inmunitarias, nervios y vasos sanguíneos | 6 |
| Yeyuno | Lámina propia y muscular de la mucosa | Células inmunitarias, fibras nerviosas, células epiteliales y de músculo liso | 61 |
| Colon | Lámina propia | Células musculares, fibras nerviosas, vasos sanguíneos y células madre epiteliales | 6 |
| Glándula parótida | Estroma interacinar y subductal | Acinos, conductos y vasos sanguíneos | 12 |
| Vesícula biliar | Subepitelio y entre fibras musculares lisas | Capilares y células musculares lisas y haces nerviosos | 13 |
| Páncreas | Páncreas exocrino | Células acinares y ductales y vasos sanguíneos | 4 |
| Médula ósea | Médula ósea | Capilares y arteriolas | 16 |
| Glándula mamaria | Estroma | Fibras nerviosas, células inmunitarias, fibroblastos y capilares | 15 |
| Trompas de Falopio | Lámina propia y entre las fibras musculares lisas | Células epiteliales y capilares | 17 |
| Miometrio | Entre fibras musculares | Células musculares lisas, nervios y capilares | 14 |
| Placenta | Tejido conjuntivo central de las vellosidades | Células de músculo liso vascular y fibras de colágeno | 18 |
| Riñón | Espacio subcapsular | Macrófagos | 19 |
| Vejiga urinaria | Haces de músculo liso de la mucosa muscular | Haces nerviosos, capilares y células musculares lisas | 19 |
| Próstata | Estroma | Vasos sanguíneos, células inmunitarias y haces nerviosos | 62 |
La microscopia electrónica de transmisión (MET) bidimensional (2D), la tomografía de microscopia electrónica de barrido de haz iónico enfocado (TME-BHI) y las técnicas de imagen tridimensional (3D) se utilizan para examinar las características ultraestructurales de los TC20–24. Los TC tienen cuerpos celulares y procesos citoplásmicos (Tps) con características ultraestructurales únicas que las distinguen de otras células del estroma (tabla 2). Varios factores pueden afectar la densidad y la morfología de los TC, como el embarazo, el envejecimiento y el estrés oxidativo. Por ejemplo, durante el embarazo, la densidad de los TC del endometrio aumenta significativamente, mientras que la densidad de los TC del miometrio disminuye significativamente en comparación con el útero no embarazado23. Por otro lado, el estrés oxidativo y el envejecimiento afectan la morfología de los TC mediante la formación y la migración de sus Tps17,24–26.
Las características ultraestructurales de los telocitos
| Características | Descripción | Referencias |
|---|---|---|
| Localización | Espacios no epiteliales | 17,20,22–26 |
| Contactos celulares | Células epiteliales, fibras nerviosas, capilares y células del músculo liso | |
| Cuerpo celular | Cuerpo celular pequeño que mide alrededor de 9–15μmLa forma del cuerpo celular difiere según el número de Tps presentes, por lo que la forma puede ser piriforme o fusiforme o triangular con 1 o 2 o 3 Tps, respectivamente. Si ≥3 Tps, el cuerpo puede estar estrellado | |
| Núcleo | Núcleo único de forma ovalada con cromatina condensada (40 a 45% de eucromatina y 55 a 60% de heterocromatina)Sin nucléolo evidente | |
| Citoplasma | Citoplasma escaso que contiene pocos organelos como mitocondrias, aparato de Golgi pequeño, retículo endoplásmico, microtúbulos, filamentos intermedios y delgadosSe detectan varias caveolas en la membrana celular | |
| Proyecciones citoplasmáticas (Tps) | Número: 1-5, promedio de 2-3 en los cortes bidimensionalesLongitud: 10-1000μmGrosor: 0,05-0,2μmRamificación: patrón de ramificación dicotómicoForma: alternando segmentos largos y delgados llamados «podomers» (75-80nm) y segmentos dilatados llamados «podoms» (250-300nm) creando un patrón en collar de cuentasLos «podoms» contienen las unidades funcionales necesarias para la captación/liberación de Ca2+, incluidas las mitocondrias, el retículo endoplásmico y las caveolasLos «podomers» están anclados por uniones homocelulares y heterocelulares (permiten interacciones con los haces nerviosos, los capilares sanguíneos, las fibras musculares lisas, las células madre y la matriz extracelular, como las fibras de colágeno y elastina) |
En los cortes teñidos con hematoxilina y eosina, es difícil distinguir los TC de las células estromales similares a los fibroblastos. El grosor de los cortes histológicos dificulta capturar la totalidad de las estructuras 3D de los TC y detectar la distribución de los Tps de estas células27. La inmunohistoquímica combinada con la MET representa un método fiable para identificar a los TC. Se utilizarán distintas tinciones inmunohistoquímicas para poder etiquetar a los TC en los tejidos humanos, como el C-Kit/CD117, el receptor del factor de crecimiento derivado de plaquetas α (PDGFR α), CD34, actina de músculo liso α (α-SMA) y vimentina. Sin embargo, ninguna de estas tinciones es específica por sí misma para la detección de los TC. Por lo tanto, los métodos de inmunotinción doble como la de CD34/vimentina, CD34/PDGFRα o CD34/c-kit son más fiables para la detección de los TC24,28. En la tabla 3 se presenta un resumen de las inmunotinciones utilizadas para resaltar los TC.
Las características inmunohistoquímicas de los telocitos en los diferentes tejidos humanos
| Órganos | Perfil inmunológico de los telocitos | Referencias |
|---|---|---|
| Corazón | CD34, c-kit, y S100 | 7 |
| Válvulas cardíacas | CD34, c-kit, vimentina, y PDGFR-β | 58 |
| Pulmones y tráquea | CD34, c-kit, vimentina, PDGFR-β, Sca-1, y VEGF | 9,29 |
| Meninges y plexo coroideo | C-Kit | 10 |
| Tracto gastrointestinal(lámina propia) | CD34, c-kit, vimentina,PDGFRα, FOXL1,GLI1, SOX6, y CD90 | 32,63,64 |
| Vesícula biliar | CD34, c-kit, y vimentina | 13 |
| Glándulas salivales | c-kit, vimentina, y α-SMA | 12,65 |
| Páncreas | CD34, c-kit, vimentina, α-SMA ocasional, y S100 | 65 |
| Miometrio | CD34 y c-kit | 66 |
| Placenta | CD34, c-kit, y vimentina | 18 |
| Trompas de Falopio | CD34, c-kit, S100, y ocasionalmente vimentina | 17 |
| Uréter y vejiga urinaria | Doble positividad para el CD34/calreticulina, y PDGFRα/calreticulina | 67 |
| Riñón | CD34, c-kit, y vimentina | 68 |
| Piel | CD34, c-kit, y vimentina | 11 |
| Músculo estriado | c-kit, PDGFR- β, vimentina, caveolin-1, y VEGF | 29 |
También hay subtipos de TC específicos de órganos, que muestran inmunorreactividad para inmunotinciones adicionales. Por ejemplo, los TC en el pulmón también expresan marcadores de células madre como el antígeno de células madre-1 (Sca-1)9,29, lo que sugiere su papel en la regeneración de tejidos. Los TC del músculo esquelético expresan VEGF, lo que indica su papel en la angiogénesis29. Los TC del miometrio30, las trompas de Falopio30, la lámina propia de la pelvis renal, el uréter, la vejiga y la uretra31 expresan receptores de esteroides de estrógeno y progesterona, lo que indica que estas células actúan como sensores para hormonas esteroides y modulan la transducción de señales a través de receptores de esteroides. En el intestino, los TC expresan la proteína Foxl1 necesaria para el mantenimiento de las células madre32. En el bazo, los TC expresan Nanog (un factor de transcripción implicado en la autorrenovación de las células madre embrionarias indiferenciadas) y Sca-133. Los TC cardíacos expresan CD34/c-kit, CD34/vimentina y CD34/PDGFR-β positivos34,35.
Los genes, proteínas y microARN de los TCSong et al. examinaron los perfiles de expresión génica (cromosomas 1, 2, 3, 17 y 18) en los TC del tejido pulmonar de ratón36. Estos autores sugirieron que, en comparación con las células del estroma, existía una regulación positiva de varios genes sobre los TC, como por ejemplo el del colágeno tipo IV, el del factor de crecimiento del tejido conectivo, del nidogen1, el de las metalopeptidasas de matriz 3 y 10, el del inhibidor tisular de metaloproteinasa-3 y el de las transgelinas. Estos genes se caracterizan por tener efectos reguladores sobre la señalización celular, la división, la migración, la adhesión, la embriogénesis y la reparación de tejidos. También tienen funciones esenciales en la homeostasis tisular, la modulación inmunitaria y el mantenimiento del microambiente oxidativo. En consecuencia, pueden prevenir la tumorigénesis y las respuestas antiinflamatorias36. Los TC también expresarán muchos microARN proangiogénicos (miR126, miR-21, miR130a, miR-143, miR-503, miR-27b, miR-199a y miR-100)37,38.
Las funciones de los TC en la biología humanaLos TC tienen varias funciones, como se resume en la tabla 4, que incluyen (i) comunicación y señalización de célula a célula, (ii) soporte mecánico y estructura de órganos, (iii) reparación de tejidos, angiogénesis, regeneración y homeostasis, (iv) modulación y vigilancia inmunitarias, y (v) actúan como sensores hormonales en el aparato reproductor femenino.
Funciones de los telocitos (TC) en la biología humana
| Función | Mecanismo y efecto | Referencias |
|---|---|---|
| Comunicación de célula a célula y señalización con células vecinas homogéneas o heterogéneas | La señalización se establece mediante uniones gap que facilitan el contacto directo entre las células y permiten el paso de iones y moléculas (p. ej., proteínas o microARN) entre ellas | 24 |
| Soporte mecánico de los diferentes tejidos | La estructura 3D distinta de los TC y su capacidad para conectar a las células circundantes brindan soporte estructural en los diferentes tejidos. Por ejemplo, los TC pueden establecer un soporte mecánico para proteger contra la deformación de la pared de la vejiga durante la distensión y la relajación | 67 |
| Reparación de tejidos, angiogénesis, regeneración y homeostasis | Estos roles están mediados por dos mecanismos: | |
| -Primero: tras el daño tisular, los TC actúan como células progenitoras CD34 positivas que se activan con su posterior proliferación, alteraciones en su morfología, distribución y diferenciación a otros tipos celulares | 69,70 | |
| -Segundo: los TC actúan como células intersticiales dentro de los nichos de células madre (microambiente para células madre) donde se integran con las células madre y otros componentes del nicho como la matriz extracelular y los vasos sanguíneos. Los TC en los nichos realizan varias funciones, incluido el control homeostático, el apoyo, el cuidado, la inducción de señales y la regulación | 71,72 | |
| Modulación y vigilancia inmunitaria | Los TC pueden activar varias células inmunitarias (linfocitos, mastocitos, macrófagos y eosinófilos) mediante la secreción de varias citocinas como la IL-10, la IL1-R1, el TNFα, la IL-6, y por lo tanto, juegan algunos roles en la regulación inmune | 73 |
| Los TC constituyen un componente funcional de las principales barreras inmunológicas en los tejidos humanos como la barrera hemato-testicular y la barrera hemato-miocardio | 74 | |
| Sensores hormonales en el aparato reproductor femenino | Los TC pueden expresar receptores de estrógeno y progesterona y pueden regular las contracciones miometriales y la motilidad de las trompas de Falopio mediante uniones comunicantes o señalización yuxtacrina y/o paracrina | 30 |
Las alteraciones de los TC ocurren en varias enfermedades y se conocen colectivamente como «telocitopatías». En la tabla 5 se presenta un resumen de estas condiciones. Hay una alteración funcional significativa y pérdida de TC en varias enfermedades inflamatorias y fibróticas crónicas. Estas incluyen la esclerodermia, el síndrome de Sjögren primario, la colitis ulcerosa, la enfermedad de Crohn y la fibrosis hepática. No está claro si la alteración de la función y la pérdida cuantitativa son la causa principal del desarrollo de la enfermedad o si por el contrario ocurren como resultado de otros factores desconocidos que alteran el microambiente celular con la subsiguiente pérdida de los TC39. Algunos tumores surgen de los TC (telocitomas), como los tumores del estroma gastrointestinal (GIST), los pólipos fibroides inflamatorios del tracto gastrointestinal y los tumores del estroma extragastrointestinal40. Estas neoplasias tienen la mutación PDGFRα, uno de los antígenos específicos de los TC en el tracto gastrointestinal41. Algunos tumores del estroma extragastrointestinal (eGIST) en la próstata42, el útero43 y la vagina44 surgen de los TC porque estos tumores y los TC comparten la expresión de la proteína c-kit (CD117)6. En 2018, Ricci et al. sugirieron el término «telocitoma» para los tumores con posible origen telocítico40. En el carcinoma lobulillar de la mama, existe un efecto proliferativo de los TC al secretar vesículas extracelulares, lo que sugiere que los TC se han activado en el momento y lugar equivocados45.
Las condiciones patológicas (telopatías) asociadas a la distrofia (funciones alteradas) y densidad disminuida de los telocitos
| Órganos | Enfermedades (telocitopatías) | Referencias |
|---|---|---|
| Piel | Carcinoma de células escamosas, carcinoma de células basales, psoriasis y esclerosis sistémica | 51,5247,49,50 |
| Intestino | Enfermedades inflamatorias del intestino (colitis ulcerosa y enfermedad de Crohn) | 75,76 |
| Glándulas salivales | Enfermedad de Sjögren | 77 |
| Antro gástrico | Pólipo fibroide inflamatorio | 43 |
| Vesícula biliar | Cálculos biliares | 78 |
| Páncreas | Tumor del estroma extragastrointestinal | 79 |
| Riñón | Obstrucción de la unión uretero-pélvica | 80 |
| Vejiga urinaria | Hiperactividad del detrusor neurogénico | 81 |
| Pulmón | Fibrosis después de neumonía | 82 |
| Testículos | Hiperplasia de las células de Leydig en testículos no descendidos (criptorquidia) | 83 |
| Próstata | Cáncer de próstata e hiperplasia benigna de próstata | 84 |
| Útero | Leiomiomas | 85 |
| Trompas de Falopio | Endometriosis, daño tubárico e infertilidad | 86 |
| Ovarios | Insuficiencia ovárica prematura | 87 |
| Placenta | Preeclampsia | 88 |
| Mama | Cáncer de mama | 45 |
| Ojos | Queratocono | 89 |
| Corazón | Insuficiencia y arritmia cardíaca | 90 |
| Tejido conectivo | Varios cambios degenerativos | 91 |
La piel humana es el órgano más grande del cuerpo, y una comprensión de la biología de los TC dérmicos mejorará nuestra comprensión de los mecanismos básicos de la homeostasis cutánea.
La distribución de los TC en la piel humana normalHistológicamente, los TC se distribuyen discretamente por toda la dermis de la piel normal. Aparecen como células fusiformes. Se localizan principalmente en la dermis reticular que rodea los vasos sanguíneos. Los TC forman 2 o 3 vainas concéntricas incompletas alrededor de las estructuras dérmicas, incluidas las glándulas sebáceas, las glándulas sudoríparas ecrinas, los músculos erectores del pelo y dentro de la vaina perifolicular. En la dermis papilar, la densidad de los TC se reduce gradualmente hacia la unión dermoepidérmica. La epidermis está desprovista de TC11.
Características inmunohistoquímicas de los subtipos de los TC cutáneosLas características inmunofenotípicas de los TC cutáneos difieren según su subtipo y distribución. Dos subtipos de los TC cutáneos tienen una morfología similar pero diferentes características de inmunofenotipado. El primer subtipo son los TC positivos para CD34 y vimentina, que residen en la dermis reticular alrededor de las glándulas sebáceas, los folículos pilosos, los músculos erectores del pelo y las glándulas sudoríparas (fig. 1). El segundo subtipo son los TC positivos para CD117 y vimentina, que residen alrededor de los folículos pilosos y las glándulas sudoríparas (fig. 2). Algunos TC positivos para PDGFRα residen en la dermis papilar11.
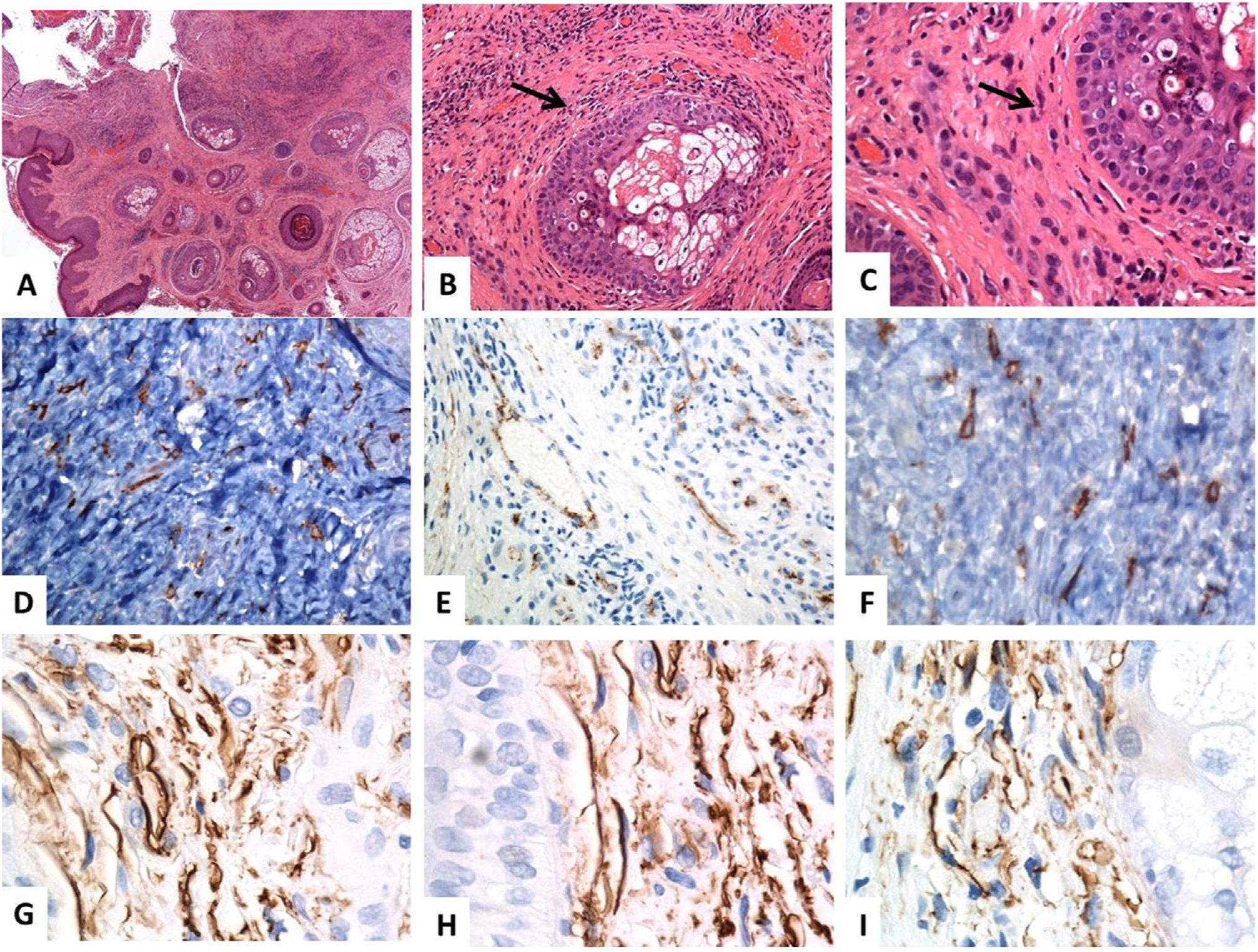
Localización histológica e inmunohistoquímica (CD34) de los telocitos en la piel normal. (A-C) Tinción con hematoxilina y eosina de la piel humana normal, que revela una epidermis y un tejido conjuntivo dérmico anodinos. Dentro de los tejidos conectivos dérmicos, algunas células fusiformes están finamente distribuidas (flechas) por toda la dermis (aumentos originales: A: ×40, B: ×200, C: ×400). (D–F) La inmunotinción CD34 y la cromogendiaminobencidina marrón decoran la localización de varios telocitos (TC)/células positivas para CD34 distribuidas por toda la dermis. Los telocitos aparecen como células fusiformes, con un cuerpo celular nucleado de forma ovalada o triangular y proyecciones largas, delgadas, moniliformes, y tortuosas (aumentos originales: D: ×400, E: ×400, F: ×600). (G–I) Los telocitos positivos para CD34 forman una capa casi continua alrededor de la membrana basal de los folículos pilosos (vaina externa de la raíz de las células) y las glándulas sebáceas (capa germinativa) (aumentos originales: G–I: ×1000, inmersión en aceite).
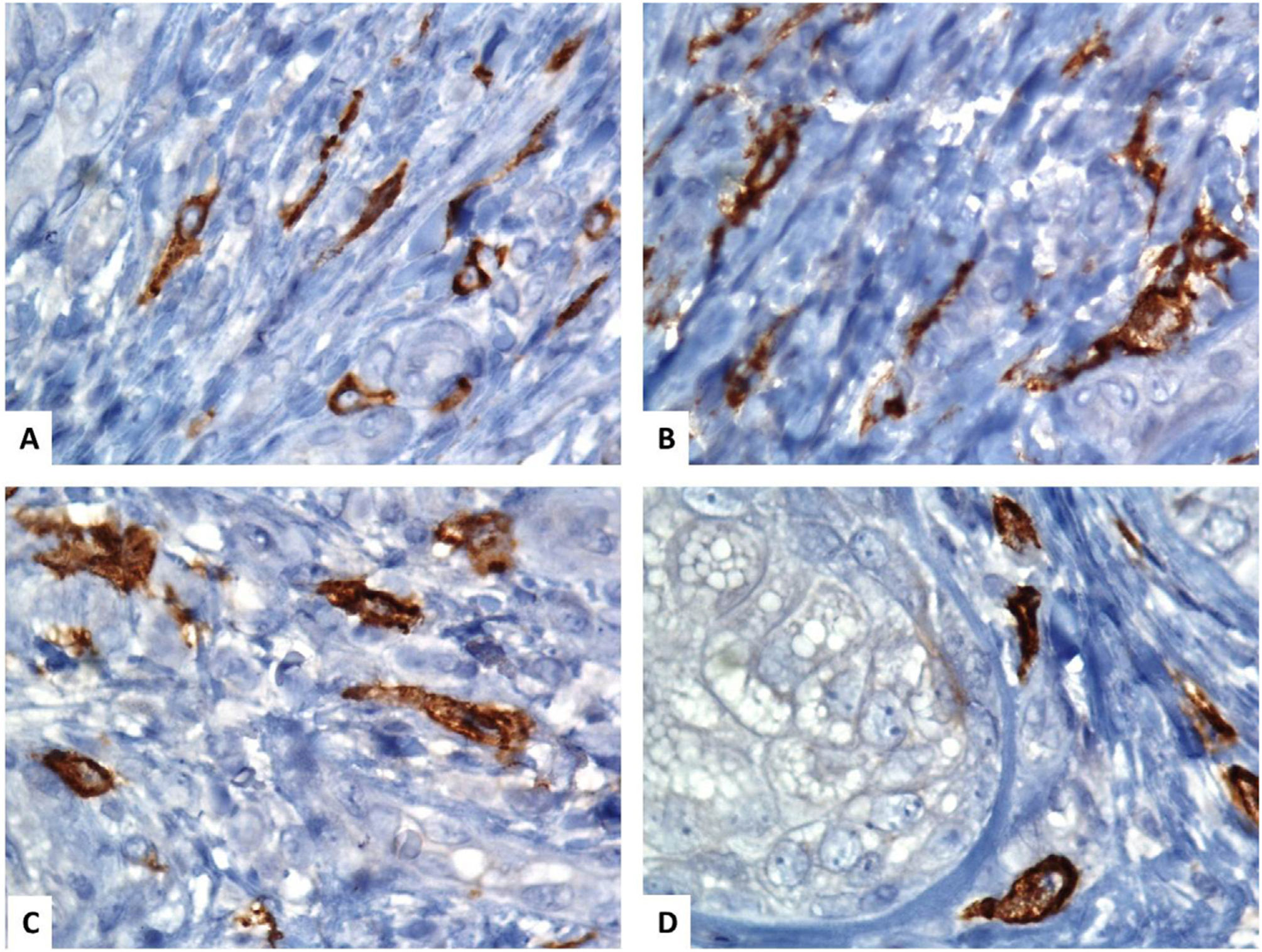
Localización inmunohistoquímica de los telocitos en la piel humana normal usando CD117 (C-KIT). (A–D) Los telocitos en forma de huso (TC) se tiñen con CD117 y la cromogendiaminobencidina marrón. Los TC se pueden separar fácilmente de las otras células estromales circundantes. Los TC tienen una apariencia alargada con núcleos ovalados o triangulares (contrateñidos con hematoxilina de Mayer) y largas proyecciones tortuosas similares a renacuajos que se extienden desde sus cuerpos celulares (aumento original, ×1000, inmersión en aceite).
Los TC dérmicos con sus características extensiones largas (Tps) tienen características ultraestructurales similares a los TC descritos en los otros órganos. En la piel, los Tps presentan de manera alterna segmentos fibrilares delgados (podómeros) y segmentos dilatados similares a cisternas (podomas), que contienen las mitocondrias, el retículo endoplásmico y las caveolas. La estructura de podómero/podón imparte una apariencia moniliforme en el Tps11. Al examinar la configuración 3D de los TC dérmicos utilizando la microscopia electrónica de barrido de haz de iones de enfoque (MEB-HIE) se observaron algunos hallazgos interesantes. Se pudo objetivar que los TC pueden excretar microvesículas (>100nm) en lugar de exosomas (<100nm), y que los Tps aparecen como estructuras tubulares dispares con la presencia de dilataciones irregulares o de segmentos en banda variables22.
El perfil de expresión de citocinas de los TC cutáneosLos TC representan una población celular distinta que se puede separar de otras células intersticiales del estroma dérmico, como los fibroblastos, las células dendríticas, los miofibroblastos, las células de Langerhans utilizando algunos marcadores inmunohistoquímicos (tabla 6). En los TC se han evidenciado elevados niveles de expresión del péptido activado por neutrófilos epiteliales (78ENA-78) y de las citocinas de la proteína quimiotáctica de granulocitos (2GCP-2), en comparación con los fibroblastos del estroma. La expresión de estas citocinas en los TC dérmicos respalda sus funciones en la homeostasis cutánea, la angiogénesis, la modulación inmunitaria, la señalización intercelular y la carcinogénesis. Alternativamente, los valores de expresión de las citocinas involucradas en la cicatrización de heridas son más altos en los fibroblastos dérmicos que en los TC46.
Las variaciones inmunohistoquímicas entre los telocitos cutáneos y las células intersticiales circundantes
| Tipos celulares | Marcadores inmunohistoquímicos | Referencias |
|---|---|---|
| Telocitos | PDGFRα y CD34 | 49 |
| Fibroblastos | Procolageno-1 | 46 |
| Células endoteliales | CD31 | 92 |
| Miofibroblastos | αSMA | 93 |
| Pericitos | PDGFRβ, αSMA, CD146, NG2, y nestina | 94 |
| Macrófagos | CD68, CD11c, CD11b, CD64, CD40, y CD14 | 95 |
| Melanocitos | HMB45, S-100, y Melan-A | 96 |
| Células de Langerhans | CD1a, S100, CD68, y Langerina | 49 |
| Células madre | CD34, CD29, SCA-1, CD90, y CD44 | 97 |
| Células dendríticas dérmicas | CD83, CD11c, y CD208 | 49 |
| Células dendríticas plasmacitoides | CD205, CD11c, TNFα, y CD123 | 49 |
| Células dendríticas inflamatorias | CD209, CD11c, NOS, y CD14 | 49 |
Aunque las funciones biológicas exactas de los TC cutáneos aún no están claras, varios estudios han propuesto algunas funciones para estas células. La configuración 3D de los TC mantiene la microarquitectura de la dermis al sostener las redes entre el colágeno dérmico y las fibras elásticas47. Los TC actúan como células protectoras de las células madre mesenquimales epiteliales y dérmicas; por lo tanto, los TC dérmicos estarán involucrados en la reparación y en la regeneración de la piel. Esta función biológica se explica por el hecho de que los Tps de los TC envuelven grupos de células madre dérmicas cerca de la protuberancia del folículo piloso, y esta interacción directa respalda su función como células cuidadoras48. Los TC desempeñan funciones en la modulación inmunitaria a través de la interacción de los TC dérmicos a través de las uniones heterocelulares con varias células inmunitarias dérmicas, como son los macrófagos y los mastocitos. A favor de este hecho, los TC serán importantes agentes inmunomoduladores en algunos trastornos alérgicos y autoinmunes cutáneos11. Los TC ayudarán en la reparación y en la regeneración de la piel. Estas células pueden mantener la integridad vascular y la angiogénesis a través de sus interacciones directas con las células endoteliales dérmicas49. Además, los TC pueden actuar modificando las células estromales circundantes. Controlan las funciones de los fibroblastos al secretar algunas moléculas de señalización paracrina como los microARN y desprender las vesículas extracelulares11.
La implicación de los TC cutáneos en algunas dermatosisLos TC parecen estar implicados en el desarrollo de algunas dermatosis, como la psoriasis vulgar y la esclerosis sistémica49,50. Estos trastornos se asocian a la distrofia de los TC y a la reducción de su densidad en la piel lesionada. En la piel psoriásica, hay distrofia y una disminución severa en el número de TC. Ultraestructuralmente, hay núcleos apoptóticos, desintegración citoplásmica, membranas basales interrumpidas, Tps fragmentados y pérdida de las uniones homocelulares entre los TC. Los TC en la piel normal perilesional son estructural y numéricamente normales49. En la psoriasis vulgar existe una ectasia vascular dérmica papilar (papilas dérmicas vascularizadas) debida a la pérdida de la función contráctil de las células del músculo liso vascular. La pérdida de los TC alrededor de los vasos sanguíneos está implicada en esta ectasia vascular y el característico «signo de Auspitz» que se observa en la psoriasis. La rotura de la membrana basal de los TC en la psoriasis facilita la migración de las células de Langerhans desde la epidermis a la dermis, lo que da como resultado la activación de las células T. Las alteraciones de las interacciones entre la red de los TC y la reacción inmune mediada por células T son esenciales en el inicio y en la progresión de la psoriasis49,50.
La esclerosis sistémica es una enfermedad multiorgánica caracterizada por una fibrosis excesiva, inflamación y vasculopatía (debido a la lesión de las células endoteliales). Afecta la piel, el corazón, los pulmones, el esófago y los riñones47. En la esclerosis sistémica, hay una pérdida de los TC y una fibrosis extensa que altera la microanatomía de la dermis. Las alteraciones de los TC en la esclerosis sistémica incluyen la vacuolización citoplasmática, la inflamación de las mitocondrias y cuerpos de lipofuscina. Estos cambios se deben al daño isquémico de los T C como resultado de la lesión de las células endoteliales y de la privación de oxígeno. En las primeras fases de la esclerosis sistémica, la densidad de los TC alrededor de los folículos pilosos, las glándulas sebáceas, las arteriolas y los nervios se reduce en la dermis reticular y está ausente en la dermis papilar. La progresión de la enfermedad se asocia con la pérdida de la mayoría de los TC dérmicos, excepto unas pocas células alrededor de las glándulas sudoríparas ecrinas. La pérdida de los TC se debe a los cambios isquémicos asociados47. Los TC envuelven fibras colágenas y elásticas en la dermis, por lo que las alteraciones de los TC afectan también a la matriz extracelular ya que los TC envuelven a las fibras colágenas y a las elásticas47.
La participación de los TC en los carcinomas cutáneos de células escamosas y basocelularesHasta la fecha, se desconocen las funciones de los TC en la carcinogénesis cutánea. Es bien sabido que una limitación del contacto célula-célula es el sello distintivo de los carcinomas invasivos. Diversos estudios respaldan el papel de los TC en el desarrollo de los carcinomas cutáneos. Por ejemplo, la presencia de los TC en el estroma tumoral del carcinoma cutáneo de células escamosas y del carcinoma basocelular51. En estos carcinomas hay una disminución de la densidad de las uniones heterocelulares entre los TC y las células estromales peritumorales. Sin embargo, se conservan las uniones homocelulares. Las uniones TC-mastocitos también se pierden, lo que resulta en la pérdida de control sobre la secreción de los gránulos de los mastocitos y la sobreexpresión de mediadores inflamatorios en el estroma tumoral.
Además, en estos tumores se pierden las uniones TC-células endoteliales. La pérdida de las uniones heterocelulares de los TC resulta de la pérdida de las funciones de los TC en el estroma tumoral. Los TC pueden ejercer una función paracrina mediante el desprendimiento de microvesículas extracelulares en estos tumores51. Estas señales de transferencia de microvesículas son necesarias para la motilidad de las células cancerosas, la progresión del tumor y la metástasis. Por lo tanto, los TC están implicados en el desarrollo y en la progresión tumoral51,52.
Las implicaciones de los TC como terapia dirigidaLos TC juegan un papel importante en la reparación, homeostasis y regeneración de tejidos a través de su comunicación con las células madre y progenitoras. Los TC expresan marcadores de células madre (Sca-1, c-kit y Oct 4) y, como tales, representan futuras armas prometedores en el campo de la medicina regenerativa9,53. Los TC también expresan VEGF y PDGFR-β, que promueven la angiogénesis durante los procesos de reparación tisular53. Por lo tanto, los TC representan una nueva diana terapéutica54. Varias observaciones respaldan esta afirmación. En un modelo murino de hepatectomía parcial, los TC estimulan la proliferación y la regeneración de hepatocitos y células progenitoras para restaurar el tamaño del hígado55. El trasplante de TC en un modelo experimental de asma puede mejorar la hiperreactividad de las vías respiratorias y la inflamación a través de la supresión de la diferenciación de las células Th2 y la estimulación de las células Th1, así como de las citocinas relacionadas. Por lo tanto, el trasplante de estos TC representa una nueva estrategia terapéutica en el asma bronquial56. En los modelos experimentales del infarto de miocardio, la inyección directa de los TC en el músculo cardíaco lesionado se asoció con la regeneración y disminución del tamaño de las áreas infringidas57.
En conclusión, los TC son nuevas células intersticiales ampliamente distribuidas no solo en el intestino sino también en la mayoría de los órganos humanos. Tienen características inmunohistoquímicas y ultraestructurales específicas que ayudan a separarlas de otras células intersticiales.
La investigación futura debe abordar varios temas, como (i) si los TC representan una población homogénea de células o subpoblaciones heterogéneas de células específicas para cada órgano; (ii) cuáles son los marcadores inmunohistoquímicos específicos del TC para facilitar su identificación; (iii) cuál es el papel exacto de los TC en las condiciones neoplásicas y no neoplásicas, y (iv) cuáles son las implicaciones terapéuticas de los TC en las enfermedades humanas. Una mejor comprensión de estos problemas ayudará a utilizar los TC como nuevos objetivos terapéuticos en el futuro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.