La micosis fungoide (MF) es el tipo más común de linfoma cutáneo de células T tanto en adultos como en niños. En algunos países se ha observado un aumento de la prevalencia de MF en niños. Hasta la fecha, no existen estudios descriptivos de MF en la población pediátrica colombiana.
MétodosEn una revisión ambispectiva de 128 pacientes con el diagnóstico confirmado de MF en la Sección de Dermatología y del Laboratorio de Dermatopatología de la Universidad de Antioquia entre los años 2008-2017, se describen las variantes clínicas e histopatológicas, la respuesta al tratamiento y la progresión de la enfermedad de 23 pacientes menores de 18 años de edad.
ResultadosLos casos de MF en niños constituyeron el 18% del total. La mediana de edad de inicio de las lesiones fue de 9 años; la mediana de edad al momento del diagnóstico fue de 11 años y la mediana del tiempo promedio entre el inicio de las lesiones y el diagnóstico fue de 2 años. Todos los pacientes se encontraban en estadios tempranos de la enfermedad. La MF hipopigmentada fue la presentación clínica más frecuente (52,2%), seguida por la MF clásica (30,4%). La MF foliculotropa se presentó en el 17,4%. Todos los pacientes recibieron terapias dirigidas a la piel con esteroides tópicos y fototerapia, uno recibió quimioterapia, aún en estadio temprano. El 59,1% obtuvieron remisión completa y el 40,9% respuesta parcial. Solo 2 casos permanecieron asintomáticos durante 5 años.
ConclusiónEn nuestra experiencia, la MF hipopigmentada fue la presentación clínica más común en pacientes menores de 18 años. No se presentaron progresiones a estadios avanzados. Sin embargo, las recurrencias después de la interrupción del tratamiento fueron comunes.
Mycosis fungoides (MF) is the most common type of cutaneous T-cell lymphoma in adults and children. The prevalence has increased in some countries, but no descriptive studies of MF in the pediatric population have been done in Colombia to date.
MethodsA combined prospective-retrospective study of 128 patients with a diagnosis of MF confirmed by the dermatology department and dermatopathology laboratory of Universidad de Antioquia between 2008 and 2017. We describe the clinical and histopathologic variants, response to treatment, and progression of the disease in 23 patients under 18 years of age.
ResultsThe pediatric cases of MF accounted for 18% of all the cases on record. The median age of onset of lesions was 9 years, the median age at diagnosis was 11 years, and the median time between onset of lesions and diagnosis was 2 years. All patients were in early stages of the disease. Hypopigmented MF was the most common clinical presentation (in 52.2%), followed by classical MF (in 30.4%). Folliculotropic MF was identified in 17.4%. All patients were treated with topical corticosteroids and phototherapy. One patient received chemotherapy while still in the early stage of disease. Complete remission was achieved in 59.1% and a partial response in 40.9%. Only 2 patients remained asymptomatic for 5 years.
ConclusionWe found hypopigmented MF to be the most common clinical presentation in patients under 18 years of age. The disease did not progress to advanced stages in any of the patients, although recurrence after treatment interruption was common.
Los linfomas cutáneos primarios son un grupo heterogéneo de trastornos linfoproliferativos malignos clasificados dentro de los linfomas no Hodgkin1–3. Según su estirpe, se clasifican en linfomas cutáneos de células T (LCCT) y linfomas cutáneos de células B (LCCB), siendo más frecuentes los LCCT en todos los grupos etarios, correspondiendo al 73,8%, mientras que los LCCB representan el 23,2%4. En la niñez, los linfomas cutáneos primarios son más frecuentes que los linfomas secundarios; sin embargo, las manifestaciones cutáneas pueden ser el primer signo de enfermedad sistémica en un linfoma secundario2,3.
La micosis fungoide (MF) es la forma más frecuente de LCCT5. La mayoría de los casos se presentan en adultos mayores de 50 años y, aunque se ha considerado poco frecuente en los niños, es el linfoma cutáneo que más se diagnostica en este grupo de edad2,6,7. En las primeras series de MF en niños, la proporción de esta condición oscilaba entre el 0,5 y el 5% del total de casos8,9; sin embargo, en los últimos años se han descrito series con frecuencias de MF infantil del 9 y 16,6%, en Brasil y Kuwait, respectivamente10,11. La semejanza clínica con otras dermatosis inflamatorias como pitiriasis alba, vitíligo, pitiriasis versicolor y dermatitis atópica12, retarda el diagnóstico. Se describe que el tiempo para el diagnóstico puede ser hasta de 7,5 años13,14. El diagnóstico de MF se establece por medio de una correlación clínico-patológica, aunque también pueden utilizarse estudios de citometría de flujo, inmunohistoquímica y reordenamientos del receptor de células T (TCR). No existen guías de manejo específicas para la MF en los niños y, en general, se usan las mismas terapias que en los adultos, que se seleccionan según los estadios de gravedad. Los tratamientos de primera línea son los esteroides tópicos y la fototerapia, en especial la ultravioleta B de banda estrecha (UVB-BE), aunque también se han empleado los psoralenos más luz ultravioleta A (PUVA) y ultravioleta A 340-400nm (UVA-1)15,16. La MF en niños tiene buen pronóstico, y se describen tasas de supervivencia del 95 y 93% a 5 y 10 años, respectivamente. La progresión de la enfermedad es del 5% a los 5 años y del 29% a los 10 años; el avance a estadios tardíos y casos de muerte es excepcional, y solo se han descrito casos aislados17. Hasta la fecha, no se encontraron estudios descriptivos de MF en la población pediátrica colombiana en la literatura indexada revisada. Describimos a continuación la experiencia de la Sección de Dermatología de la Universidad de Antioquia en la MF en niños y adolescentes, con el objetivo de caracterizar la enfermedad en nuestra población, comparar los datos con la literatura, y describir la frecuencia de las variantes clínicas de MF, la repuesta al tratamiento y la evolución de la enfermedad en este grupo, aspectos altamente debatidos en las diferentes series de casos.
MetodologíaLos datos se obtuvieron mediante la revisión ambispectiva de los registros clínicos y patológicos de la base de datos de linfoma de la Sección de Dermatología y del Laboratorio de Dermatopatología de la Universidad de Antioquia, Medellín, Colombia, de los pacientes diagnosticados de MF desde agosto del 2008 a enero del 2017. A efectos del estudio, se incluyeron aquellos pacientes con diagnóstico confirmado de MF y una edad menor o igual a 18 años.
Este estudio se considera de riesgo mínimo, se preserva la identidad de los pacientes, los cuales acudieron al servicio de dermatología en compañía de sus padres o acudientes. Los padres manifestaron el consentimiento. Se cuenta con aprobación del Comité de Bioética de la Facultad de Medicina, Universidad de Antioquia para el banco de datos clínicos.
El diagnóstico de MF se realizó por correlación clínico-patológica, los estudios histopatológicos fueron revisados por 2 profesores de dermatopatología reportando de forma descriptiva los hallazgos. Algunos pacientes requirieron la toma de varias biopsias para el diagnóstico. Estudios de reordenamiento del TCR no estuvieron disponibles. La asignación del estadio de gravedad se llevó a cabo por el examen físico, revisión de la historia clínica y estudios de extensión en todos los casos (rayos X de tórax, ecografía abdominal y hemograma con extendido de sangre periférica (automático y manual) y/o citometría de flujo. También se realizaron estudios de inmunohistoquímica.
El seguimiento de los pacientes se realizó por medio de valoraciones clínicas periódicas y llamadas telefónicas posteriores al diagnóstico, cada 1 a 3 meses dependiendo de la modalidad de tratamiento. Para calcular la extensión de la superficie corporal comprometida se usó como método de medición la palma (incluyendo los dedos) del paciente, correspondiendo al 1% de la superficie corporal total18. Como respuesta al tratamiento se consideró la clasificación de United States Cutaneous Lymphoma Consortium, y Cutaneous Lymphoma Task Force of the European Organisation for Research and Treatment of Cancer, a saber: completa (100% de respuesta, desaparición de todas las lesiones), parcial (respuesta entre el 50-99%), y sin respuesta (respuesta <50%)19.
Se describieron variables epidemiológicas (sexo y edad), clínicas (edad de aparición, tiempo de evolución, edad al momento del diagnóstico, tipo de lesión, estadio de gravedad, fototipo), tratamiento (terapias dirigidas a la piel, terapia sistémica, tipo de fototerapia, esquema de fototerapia, respuesta al primer ciclo de fototerapia, seguimiento).
Se realizó análisis univariado de frecuencias absolutas y relativas, además, tablas para describir las características cualitativas. Respecto a la edad y el tiempo de evolución se describe la mediana y el intervalo.
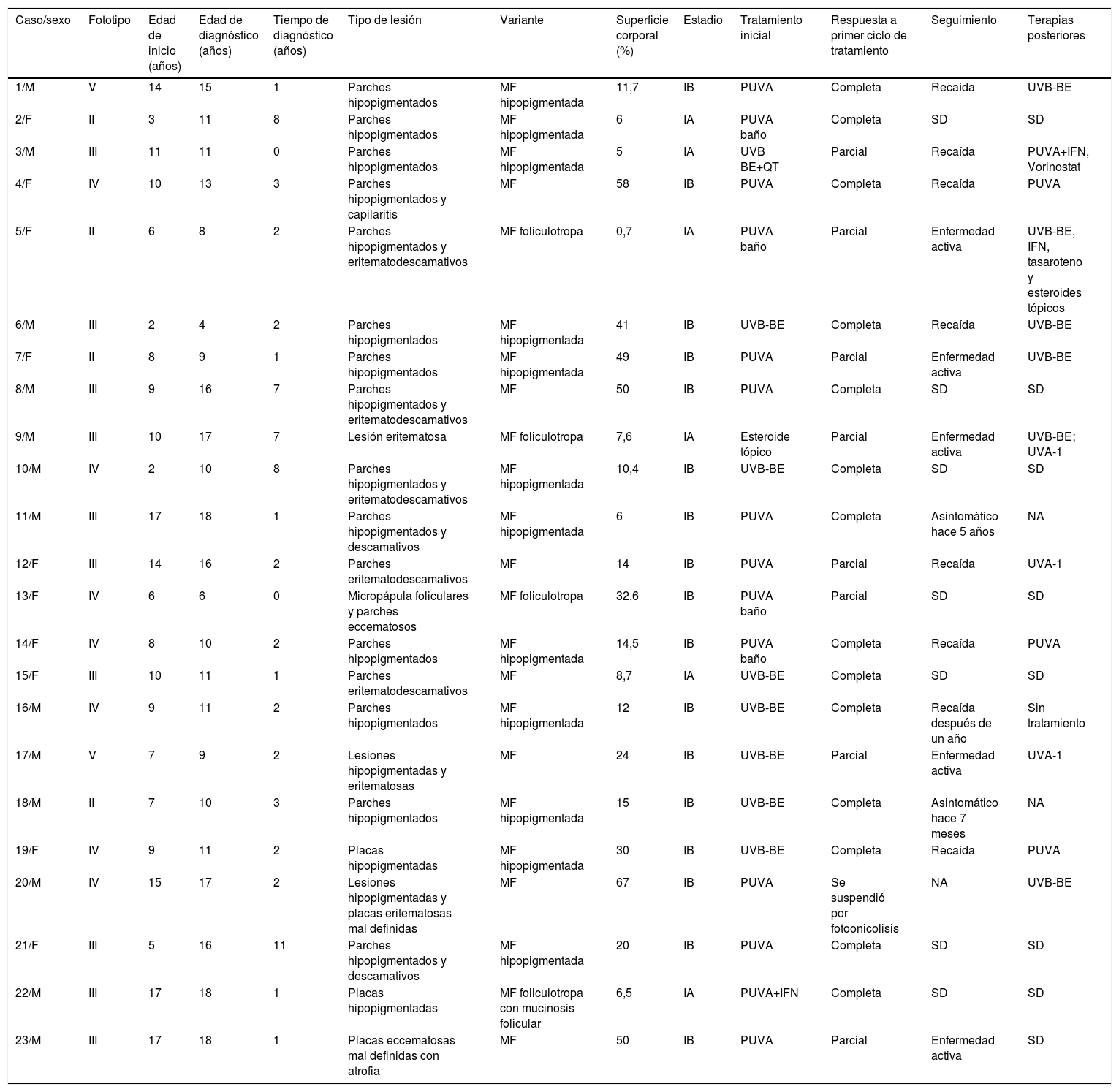
ResultadosEn el período comprendido entre agosto de 2008 a enero de 2017, a la Sección de Dermatología de la Universidad de Antioquia consultaron 128 pacientes con MF, de los cuales 23 eran niños y adolescentes hasta los 18 años, 18% del total de casos (tabla 1). La mediana de edad de inicio de las lesiones fue de 9 años (intervalo: 2-17); La mediana de edad al momento del diagnóstico fue de 11 años (intervalo: 4-18) y la mediana del tiempo entre el inicio de las lesiones y el diagnóstico fue de 2 años (intervalo: 0-8). Se incluyeron 13 varones y 10 mujeres con una relación masculino:femenino (M:F) de 1,3:1. El fototipo predominante fue el III (43,8%), seguido del II (30,4%).
Datos demográficos y clínicos de los niños y adolescentes con MF
| Caso/sexo | Fototipo | Edad de inicio (años) | Edad de diagnóstico (años) | Tiempo de diagnóstico (años) | Tipo de lesión | Variante | Superficie corporal (%) | Estadio | Tratamiento inicial | Respuesta a primer ciclo de tratamiento | Seguimiento | Terapias posteriores |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1/M | V | 14 | 15 | 1 | Parches hipopigmentados | MF hipopigmentada | 11,7 | IB | PUVA | Completa | Recaída | UVB-BE |
| 2/F | II | 3 | 11 | 8 | Parches hipopigmentados | MF hipopigmentada | 6 | IA | PUVA baño | Completa | SD | SD |
| 3/M | III | 11 | 11 | 0 | Parches hipopigmentados | MF hipopigmentada | 5 | IA | UVB BE+QT | Parcial | Recaída | PUVA+IFN, Vorinostat |
| 4/F | IV | 10 | 13 | 3 | Parches hipopigmentados y capilaritis | MF | 58 | IB | PUVA | Completa | Recaída | PUVA |
| 5/F | II | 6 | 8 | 2 | Parches hipopigmentados y eritematodescamativos | MF foliculotropa | 0,7 | IA | PUVA baño | Parcial | Enfermedad activa | UVB-BE, IFN, tasaroteno y esteroides tópicos |
| 6/M | III | 2 | 4 | 2 | Parches hipopigmentados | MF hipopigmentada | 41 | IB | UVB-BE | Completa | Recaída | UVB-BE |
| 7/F | II | 8 | 9 | 1 | Parches hipopigmentados | MF hipopigmentada | 49 | IB | PUVA | Parcial | Enfermedad activa | UVB-BE |
| 8/M | III | 9 | 16 | 7 | Parches hipopigmentados y eritematodescamativos | MF | 50 | IB | PUVA | Completa | SD | SD |
| 9/M | III | 10 | 17 | 7 | Lesión eritematosa | MF foliculotropa | 7,6 | IA | Esteroide tópico | Parcial | Enfermedad activa | UVB-BE; UVA-1 |
| 10/M | IV | 2 | 10 | 8 | Parches hipopigmentados y eritematodescamativos | MF hipopigmentada | 10,4 | IB | UVB-BE | Completa | SD | SD |
| 11/M | III | 17 | 18 | 1 | Parches hipopigmentados y descamativos | MF hipopigmentada | 6 | IB | PUVA | Completa | Asintomático hace 5 años | NA |
| 12/F | III | 14 | 16 | 2 | Parches eritematodescamativos | MF | 14 | IB | PUVA | Parcial | Recaída | UVA-1 |
| 13/F | IV | 6 | 6 | 0 | Micropápula foliculares y parches eccematosos | MF foliculotropa | 32,6 | IB | PUVA baño | Parcial | SD | SD |
| 14/F | IV | 8 | 10 | 2 | Parches hipopigmentados | MF hipopigmentada | 14,5 | IB | PUVA baño | Completa | Recaída | PUVA |
| 15/F | III | 10 | 11 | 1 | Parches eritematodescamativos | MF | 8,7 | IA | UVB-BE | Completa | SD | SD |
| 16/M | IV | 9 | 11 | 2 | Parches hipopigmentados | MF hipopigmentada | 12 | IB | UVB-BE | Completa | Recaída después de un año | Sin tratamiento |
| 17/M | V | 7 | 9 | 2 | Lesiones hipopigmentadas y eritematosas | MF | 24 | IB | UVB-BE | Parcial | Enfermedad activa | UVA-1 |
| 18/M | II | 7 | 10 | 3 | Parches hipopigmentados | MF hipopigmentada | 15 | IB | UVB-BE | Completa | Asintomático hace 7 meses | NA |
| 19/F | IV | 9 | 11 | 2 | Placas hipopigmentadas | MF hipopigmentada | 30 | IB | UVB-BE | Completa | Recaída | PUVA |
| 20/M | IV | 15 | 17 | 2 | Lesiones hipopigmentadas y placas eritematosas mal definidas | MF | 67 | IB | PUVA | Se suspendió por fotoonicolisis | NA | UVB-BE |
| 21/F | III | 5 | 16 | 11 | Parches hipopigmentados y descamativos | MF hipopigmentada | 20 | IB | PUVA | Completa | SD | SD |
| 22/M | III | 17 | 18 | 1 | Placas hipopigmentadas | MF foliculotropa con mucinosis folicular | 6,5 | IA | PUVA+IFN | Completa | SD | SD |
| 23/M | III | 17 | 18 | 1 | Placas eccematosas mal definidas con atrofia | MF | 50 | IB | PUVA | Parcial | Enfermedad activa | SD |
Bx: biopsia; Edad de inicio: edad en la que aparecieron las primeras lesiones; F: femenino; IFN: interferón; M: masculino; MF: micosis fungoide; NA: no aplica; PUVA: psoraleno y UVA; QT: quimioterapia; SD: sin datos; Tiempo de diagnóstico, años entre inicio de las lesiones y el diagnóstico; UVA: luz ultravioleta A; UVB-BE: luz ultravioleta B de banda estrecha.
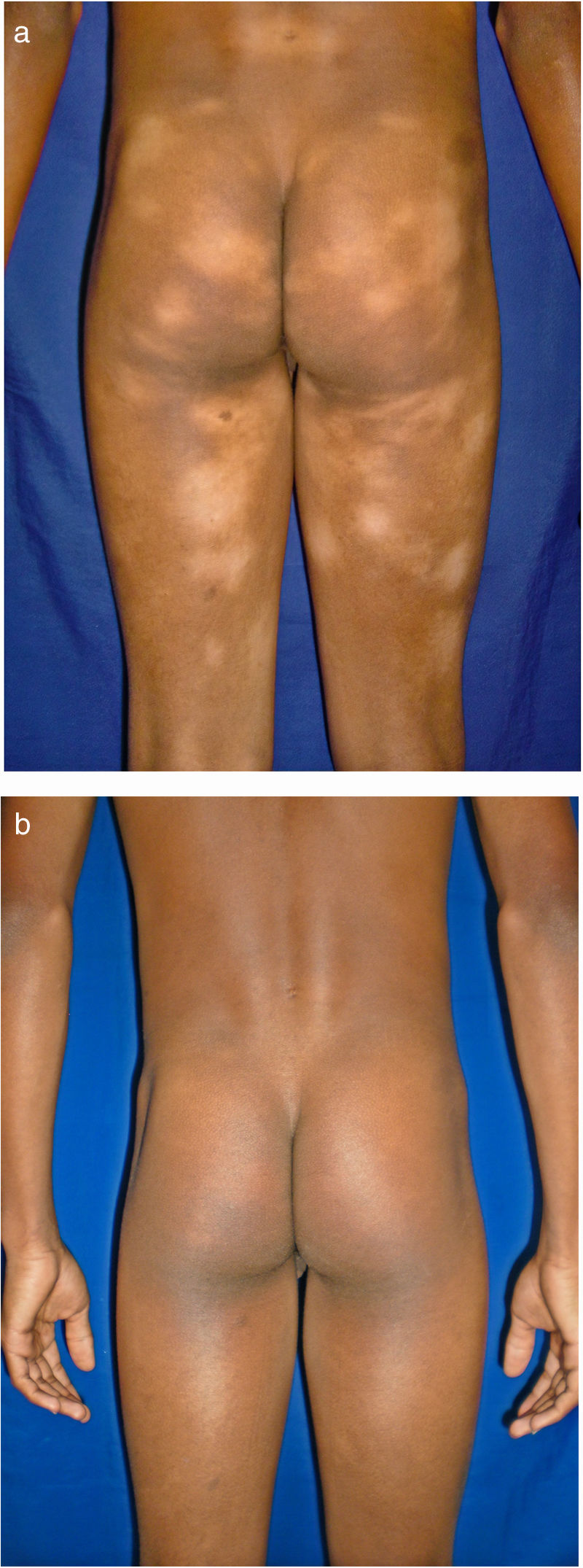
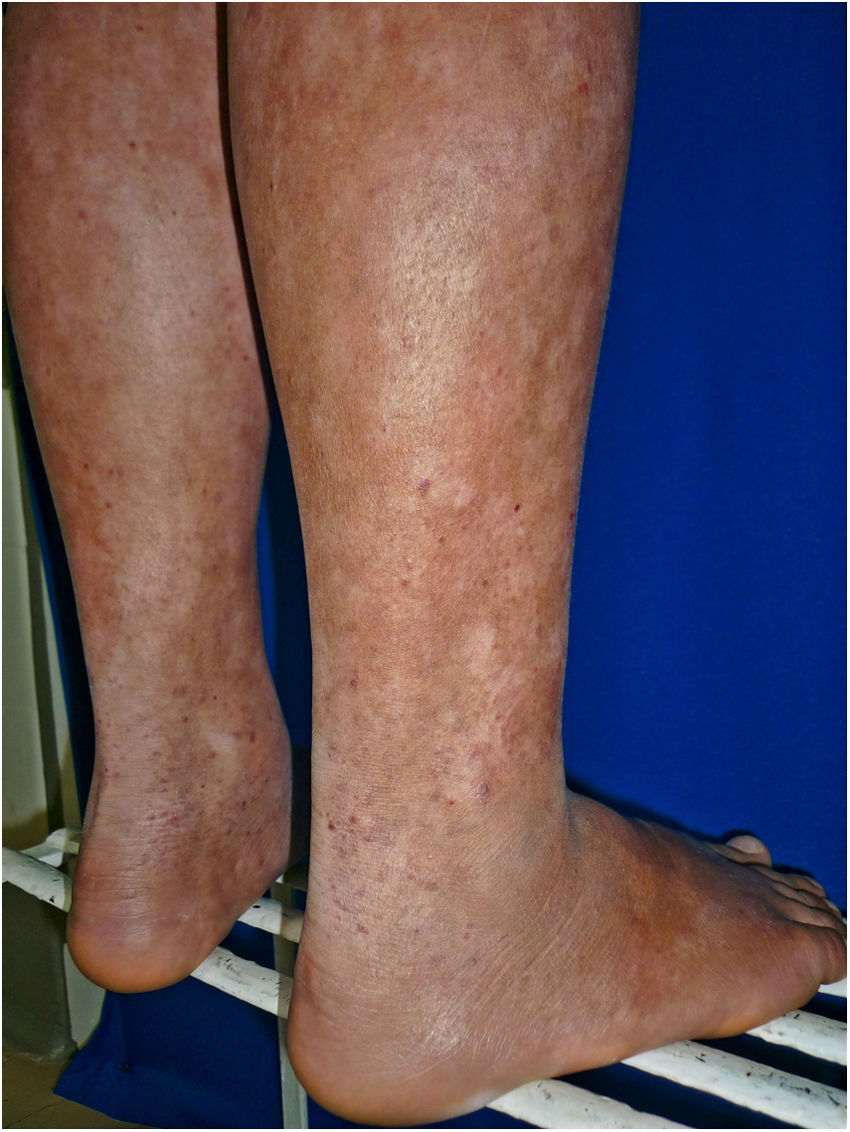
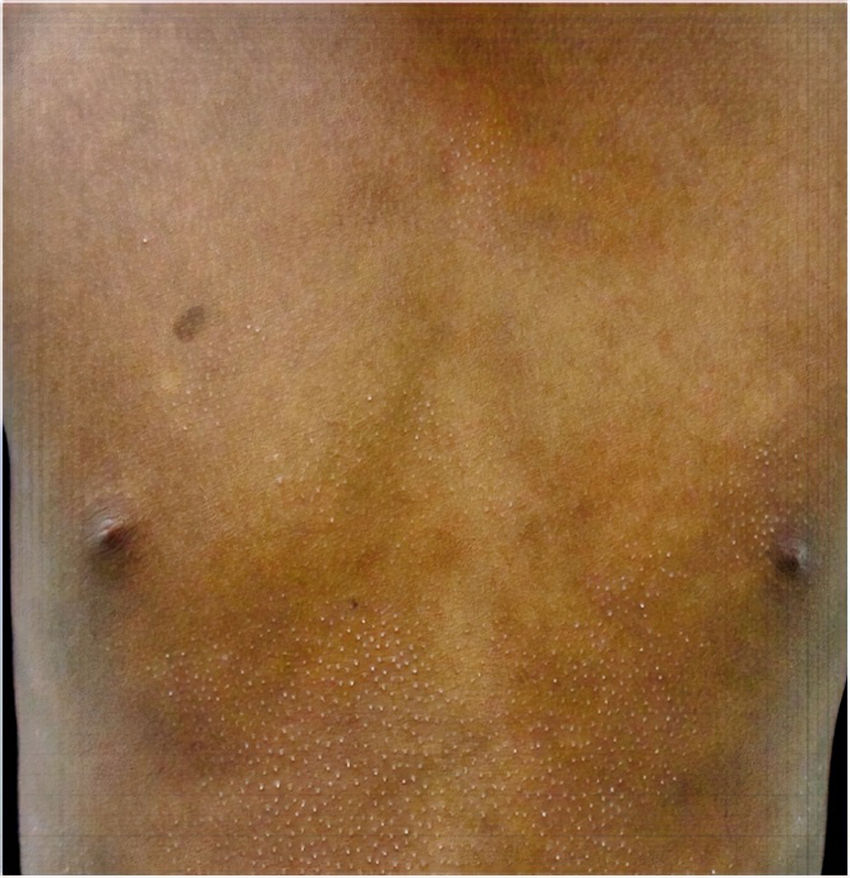
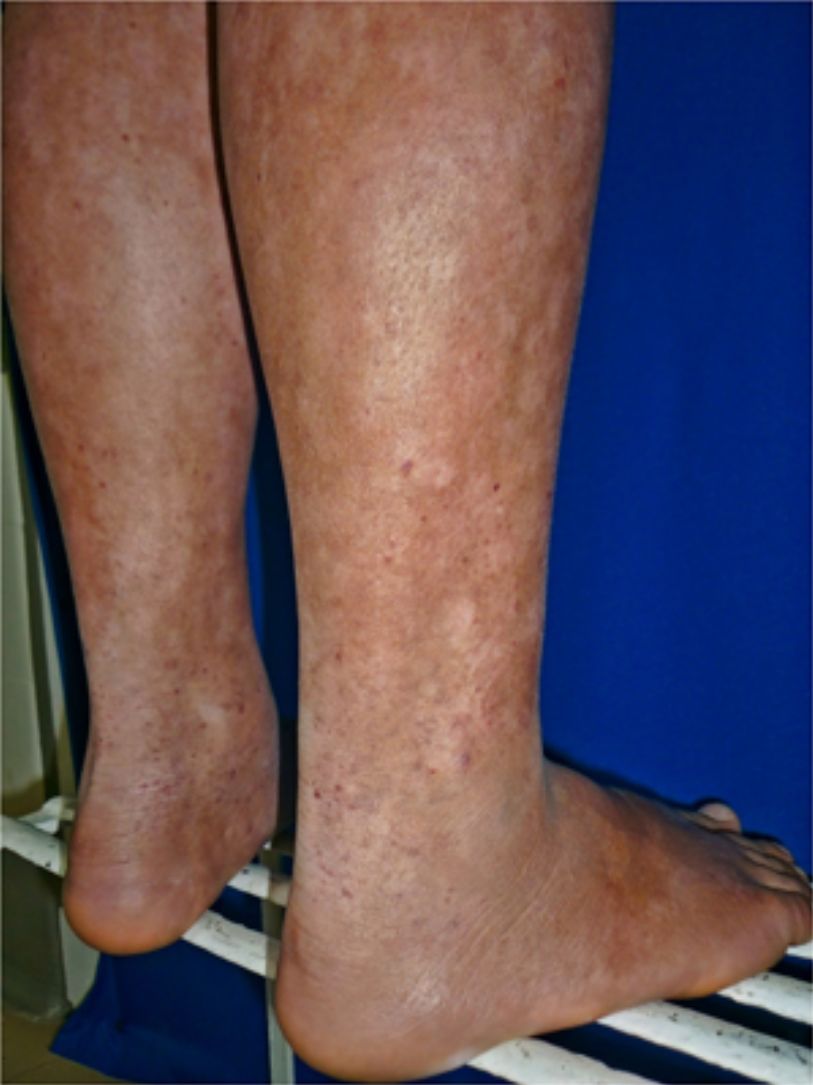
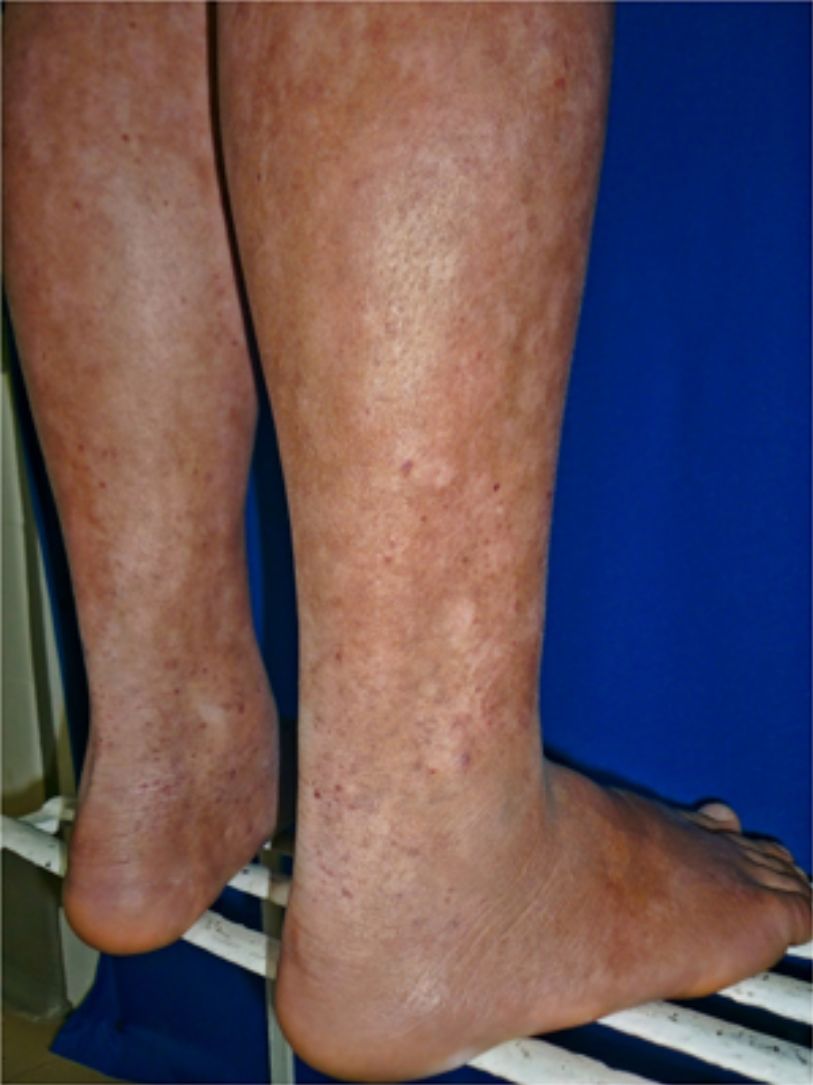
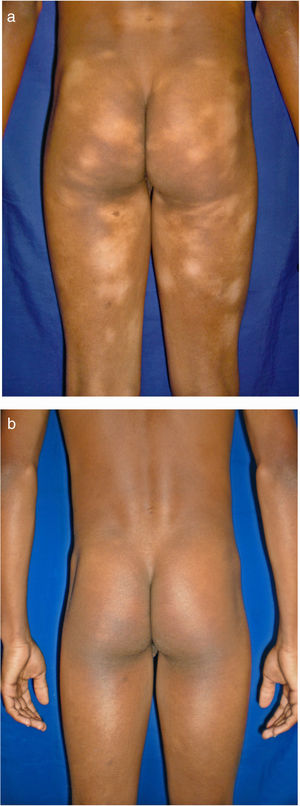
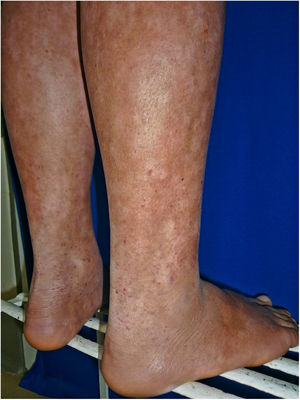
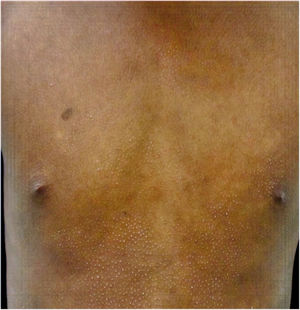
Todos los pacientes se encontraban en estadios tempranos de la enfermedad, 6 en estadio IA (26,1%) y 17 en IB (73,9%). La MF hipopigmentada fue la presentación clínica más frecuente, encontrándose en 12 de los pacientes (52,2%) (fig. 1); de forma interesante, un caso de MF hipopigmentada presentó numerosas máculas hipopigmentadas no antecedidas por ninguna lesión, acompañadas de otras que simulaban pitiriasis liquenoide crónica (PLC), esto es, placas eritematosas redondas de 0,5 a 3cm de diámetro, cubiertas por una escama blanquecina compacta. Al analizar los hallazgos clínicos, histopatológicos y de inmunohistoquímica de los 2 tipos de lesiones, estas correspondieron a MF. En segundo lugar, la MF clásica con 7 casos (30,43%), uno de los cuales se asoció a capilaritis (fig. 2). La MF foliculotropa se presentó en 4 casos (17,4%), uno de estos similar a liquen espinuloso (fig. 3 y tabla 2).
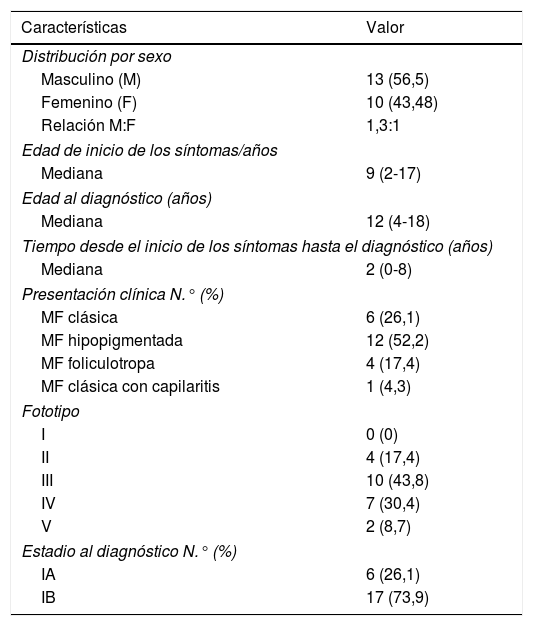
Características demográficas de 23 niños y adolescentes con MF
| Características | Valor |
|---|---|
| Distribución por sexo | |
| Masculino (M) | 13 (56,5) |
| Femenino (F) | 10 (43,48) |
| Relación M:F | 1,3:1 |
| Edad de inicio de los síntomas/años | |
| Mediana | 9 (2-17) |
| Edad al diagnóstico (años) | |
| Mediana | 12 (4-18) |
| Tiempo desde el inicio de los síntomas hasta el diagnóstico (años) | |
| Mediana | 2 (0-8) |
| Presentación clínica N.° (%) | |
| MF clásica | 6 (26,1) |
| MF hipopigmentada | 12 (52,2) |
| MF foliculotropa | 4 (17,4) |
| MF clásica con capilaritis | 1 (4,3) |
| Fototipo | |
| I | 0 (0) |
| II | 4 (17,4) |
| III | 10 (43,8) |
| IV | 7 (30,4) |
| V | 2 (8,7) |
| Estadio al diagnóstico N.° (%) | |
| IA | 6 (26,1) |
| IB | 17 (73,9) |
MF: micosis fungoide; N.°: número de casos.
Todos los niños y adolescentes recibieron terapias dirigidas a la piel con esteroides tópicos (principalmente mometasona y clobetasol), tanto previos como concomitante con fototerapia, para quienes la recibieron. Veintidós pacientes iniciaron tratamiento con fototerapia, 14 de ellos PUVA, incluyendo 4 tratados en modalidad de PUVA baño y 8 recibieron UVB-BE. Un paciente recibió, de entrada, tratamiento con quimioterapia por oncología con metotrexate, citarabina y vincristina. Un paciente con MF foliculotropa inició su esquema de tratamiento con PUVA mas interferón 3.000.000 de unidades 3 veces a la semana. De los 22 pacientes que recibieron fototerapia, 14 obtuvieron remisión completa (64%) y 8 respuesta parcial (36%). La fototerapia fue bien tolerada por todos los pacientes, excepto por uno que presentó foto-onicolisis relacionada con PUVA a las 48 sesiones, por lo que se suspendió y se inició tratamiento con UVB-BE.
El esquema de fototerapia UVB-BE se calculó con base en el fototipo del paciente, y con una frecuencia de 3 veces por semana y un promedio de 52 a 62 sesiones por ciclo. Para UVA-1 se emplean dosis bajas o medias, como máximo 50J/cm2, 3 sesiones semanales, un promedio de 40 sesiones.
En el seguimiento, 6 de los pacientes que estaban en respuesta completa, recayeron, requiriendo un segundo ciclo de fototerapia. El tiempo para la recaída fue de 3 meses a 7 años. Solo 2 casos han permanecido asintomáticos, uno durante 5 años, el cual tiene el antecedente familiar de MF en su abuelo y otro lleva 7 meses sin síntomas. Seis de los pacientes que alcanzaron respuesta completa no han regresado al seguimiento en nuestra institución (tabla 3).
Respuesta al primer ciclo de fototerapia
| Fototerapia (N.°) | Respuesta completa (%) | Respuesta parcial (%) |
|---|---|---|
| PUVA (14) | 8 (57) | 6 (43) |
| PUVA baño (4) | 2 (50) | 2 (50) |
| PUVA+interferón (1) | 1 (100) | |
| UVB BE (8) | 6 (75) | 2 (25) |
| Con quimioterapia (1) | 1 (100) | |
| Total: 22 | 14 (64) | 8 (36) |
Uno de los pacientes no recibió fototerapia como tratamiento de primera línea, se hizo manejo con esteroides tópicos exclusivamente con respuesta parcial, requiriendo posteriormente fototerapia UVB.
En la Unidad de Fotodermatología de la Universidad de Antioquia se emplea la modalidad de fototerapia UVA-1. Tres de los pacientes con respuesta parcial a UVB-BE o PUVA han sido tratados con UVA-1, 2 alcanzaron respuesta parcial mayor del 90% y uno aún se encuentran en tratamiento con resultados satisfactorios a la fecha.
De los pacientes que están en seguimiento ninguno ha tenido progresión a estadios avanzados de la MF. El seguimiento más largo a la fecha es 10 años.
DiscusiónLa MF es la forma más común de LCCT, afecta predominante a pacientes mayores, el 75% de los casos son diagnosticados después de los 50 años y el 0,5-5% de los casos antes de los 20 años10. Recientemente, los reportes de MF en niños han aumentado, sin embargo, la verdadera incidencia en la edad pediátrica y la caracterización clínica, inmunohistoquímica e inmunofenotípica no ha sido determinada con precisión20. De 128 pacientes con diagnóstico MF, 23 fueron niños y adolescentes, lo que corresponde al 18% de los casos. Esta proporción es similar a las reportadas en pacientes asiáticos (16,6%), sin embargo, hay reportes con valores menores como en latinos (9%) y en norteamericanos (2%)10,11, esto podría estar explicado por un aumento en la incidencia de esta condición, un diagnóstico más temprano, o que existe una mayor prevalencia de MF en este grupo etario en ciertas zonas geográficas. La relación masculino-femenino de MF en este estudio es de 1,3:1, cifra equiparable a la reportada en la mayoría de las series pediátricas, 1,25:1 en árabes y de 3,6:1 en coreanos17,21. En concordancia con la literatura, la MF hipopigmentada fue la presentación clínica más común15,22, a diferencia de los adultos en quienes solo representa el 3,5%23, teniendo como diagnósticos diferenciales hipopigmentación postinflamatoria, pitiriasis alba, pitiriasis versicolor, vitíligo, enfermedad de Hansen y en algunos casos PLC7,20 y, aunque no es una variante reconocida en la clasificación de la WHO/EORTC24, esta mayor frecuencia de casos la hace de especial interés en asiáticos y latinos, y se ha relacionado con un posible pronóstico más favorable25. De acuerdo a la literatura, se considera que la MF hipopigmentada es aquella en la que se presentan únicamente lesiones hipopigmentadas26 y, a nuestro juicio, debería ser incluida en la clasificación de la EORTC/WHO como una variante de la MF. El dermatólogo debe tener presente la MF como diagnóstico diferencial en pacientes con lesiones recurrentes, de características eccematosas e inflamatorias, y con poca respuesta al tratamiento. En esta serie se presentaron formas poco frecuentes como la MF foliculotropa y la MF con capilaritis; en el caso de la MF foliculotropa, en los adultos es la variante no clásica más común y presenta un curso potencialmente más agresivo que puede requerir manejo combinado con terapias sistémicas27, contrario a esto, la MF foliculotropa en edades pediátricas es rara y tiene una mejor respuesta terapéutica, y un pronóstico comparado con los adultos22. Son pocos los casos de MF con capilaritis descritos en niños; se encontró un paciente (2,2%) en una serie de casos en Singapur28, y otro, en una serie de casos en New York, estos sin diferencias en el estadio, la respuesta terapéutica ni el pronóstico, frente a la MF clásica en niños20. Se encontró un caso de MF con lesiones que simulaban PLC. La PLC es un desorden linfoproliferativo benigno que afecta principalmente a jóvenes, en el que se han identificado poblaciones monoclonales de linfocitos T con pérdida del CD7; se ha atribuido su comportamiento benigno a una respuesta inmune antitumoral de linfocitos CD8+. En el contexto de un paciente con lesiones tipo PLC, es importante considerar que estas pueden ocasionalmente preceder a una MF, o la MF puede simular una PLC, es por esto que se recomienda seguimiento clínico y nuevas biopsias cuando las placas aumenten de tamaño o sean de evolución prolongada7. El incremento en la atipia nuclear de los linfocitos, la disminución de los queratinocitos apoptóticos y de los linfocitos CD7+ y CD8+, pueden alertar sobre la evolución a MF29.
Los hallazgos histopatológicos en todos los pacientes fueron consistentes con MF. En nuestro servicio no se usa el reordenamiento del TCR pues no está disponible. Se encontró un caso de MF familiar, donde el abuelo presenta MF psoriasiforme, esto podría estar relacionado con lo reportado de casos de MF en pacientes de la misma familia relacionados a Human Leukocyte Antigen (HLA) específicamente el HLA-DQB1*035,6. En la literatura se encontró reporte de 15 casos de MF con asociación familiar, asociado a familiares de primer grado. De acuerdo con los datos disponibles, parece que la MF familiar no difiere de la MF esporádica en términos de desenlace clínico30. En nuestra serie todos los pacientes están en estadios tempranos (IA/IB) con recaídas frecuentes, y ninguno ha progresado a estadios tardíos, hallazgos similares a los encontrados en otros estudios10,15.
En general, los pacientes con MF jóvenes, tienen un buen pronóstico, con una evolución favorable; entre los factores asociados a progresión de la MF están las formas de poiquilodermia, los afrodescendientes y el estadio avanzado al momento del diagnóstico. Las formas hipopigmentadas son de pronóstico favorable31.
La MF en la infancia en la mayoría de los casos tiene un comportamiento crónico e indolente21, es importante el seguimiento y el acompañamiento de los pacientes. Se deben evitar tratamientos agresivos que afecten la calidad de vida y que podrían potencialmente disminuir la respuesta inmune, y a largo plazo afectar el curso de la enfermedad25.
FinanciaciónLa presente investigación se realizó con recursos propios y no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al grupo de apoyo Linfoma Piel y al Servicio de Dermatología de la Facultad de Medicina de la Universidad de Antioquia en sus sedes IPS Universitaria y el Hospital Universitario San Vicente Fundación.