La neoplasia blástica de células dendríticas plasmocitoides (NBCDP) es una neoplasia hematodérmica poco frecuente y agresiva. En esta serie de casos retrospectiva, se identificaron 10 casos de NBCDP, con un 90% de afectación de la piel, presentándose predominantemente como nódulos violáceos y/o placas hematoma-like. Las lesiones cutáneas mostraban infiltrados dérmicos difusos o nodulares de blastos de tamaño intermedio con zona de Grenz. El inmunofenotipado fue CD4+, CD56+, CD123+ y CD303+. Los genes mutados más frecuentes fueron TET2 (3/7) y NRAS (2/7). Se administró multi-quimioterapia (QT) como tratamiento de primera línea, y cinco pacientes se sometieron a trasplante alogénico de progenitores hematopoyéticos (alo-TPH). Se observaron mejores resultados en los pacientes más jóvenes y aquellos tratados con QT similar a la leucemia linfoblástica aguda (LLA) seguida de alo-TPH. Este estudio muestra el rango clínico de las lesiones cutáneas de NBCDP. A pesar de no haber un gold standard terapéutico, los regímenes de QT mieloablativos y alo-TPH parecen tener un pronóstico más favorable.
Blastic plasmacytoid dendritic cell neoplasm (BPDCN) is a rare and aggressive hematodermic neoplasm usually involving the skin. In this retrospective case series, 10 cases of BPDCN were identified, 90% of which had skin involvement and exhibited predominantly violaceous nodules and/or bruise-like plaques. Skin lesions showed diffuse or nodular dermal-based infiltrates of intermediate sized blasts with a Grenz zone. Tumor immunophenotyping was CD4(+), CD56(+), CD123(+) and CD303(+). The most frequently mutated genes according to targeted next-generation sequencing were TET2 (3/7) and NRAS (2/7). Multiagent chemotherapy (CT) was administered as first-line therapy, and a total of 5 patients underwent allogenic hematopoietic stem cell transplantation (allo-HSCT). Better outcomes were observed in younger patients and those treated with acute lymphoblastic leukemia (ALL)-like CT followed by allo-HSCT. This study shows the clinical range of cutaneous lesions of BPDCN. Despite the absence of a gold standard therapy, patients treated with myeloablative intensive regimens and allo-HSCT seems to have a more favorable prognosis.
La neoplasia blástica de células dendríticas plasmocitoides (NBCDP) es una neoplasia hematológica rara y agresiva con tropismo cutáneo, que representa el 0,7% de todas las neoplasias hematológicas cutáneas1. Fue descrita por primera vez en 1995 como «leucemia agranular aguda de células CD4+natural killer(NK)»2 y, desde 2008, ha sido reconocida como una entidad distinta por la Organización Mundial de la Salud (OMS)3–5.
La NBCDP surge de precursores clonales de células dendríticas plasmocitoides (CDP), caracterizados por células CD4+/CD56+/CD123+que son negativas para marcadores específicos de linaje6,7. Además, BDCA-2/CD303, BDCA-4/CD304 y T-Cell Leukemia/Lymphoma 1 (TCL 1) son marcadores específicos de CDP8. Aunque el diagnóstico final se basa en el inmunofenotipo, la piel es el órgano más afectado (> 80% de los pacientes) y el reconocimiento clínico es clave para un tratamiento precoz9.
No existe un tratamiento de referencia para esta entidad. Aunque los regímenes de quimioterapia (QT) logran altas tasas de respuesta completa (RC), las recurrencias se producen de manera precoz. Existen pruebas del beneficio del trasplante de células madre autólogo10 y alogénico (TCMH alogénico)10,11. Recientemente, han surgido nuevas opciones de terapia dirigida, que pueden mejorar la evolución de los pacientes12,13.
En el presente artículo, describiremos las características clínicas, el perfil mutacional y los resultados de 10 pacientes con NBCDP tratados en una sola institución.
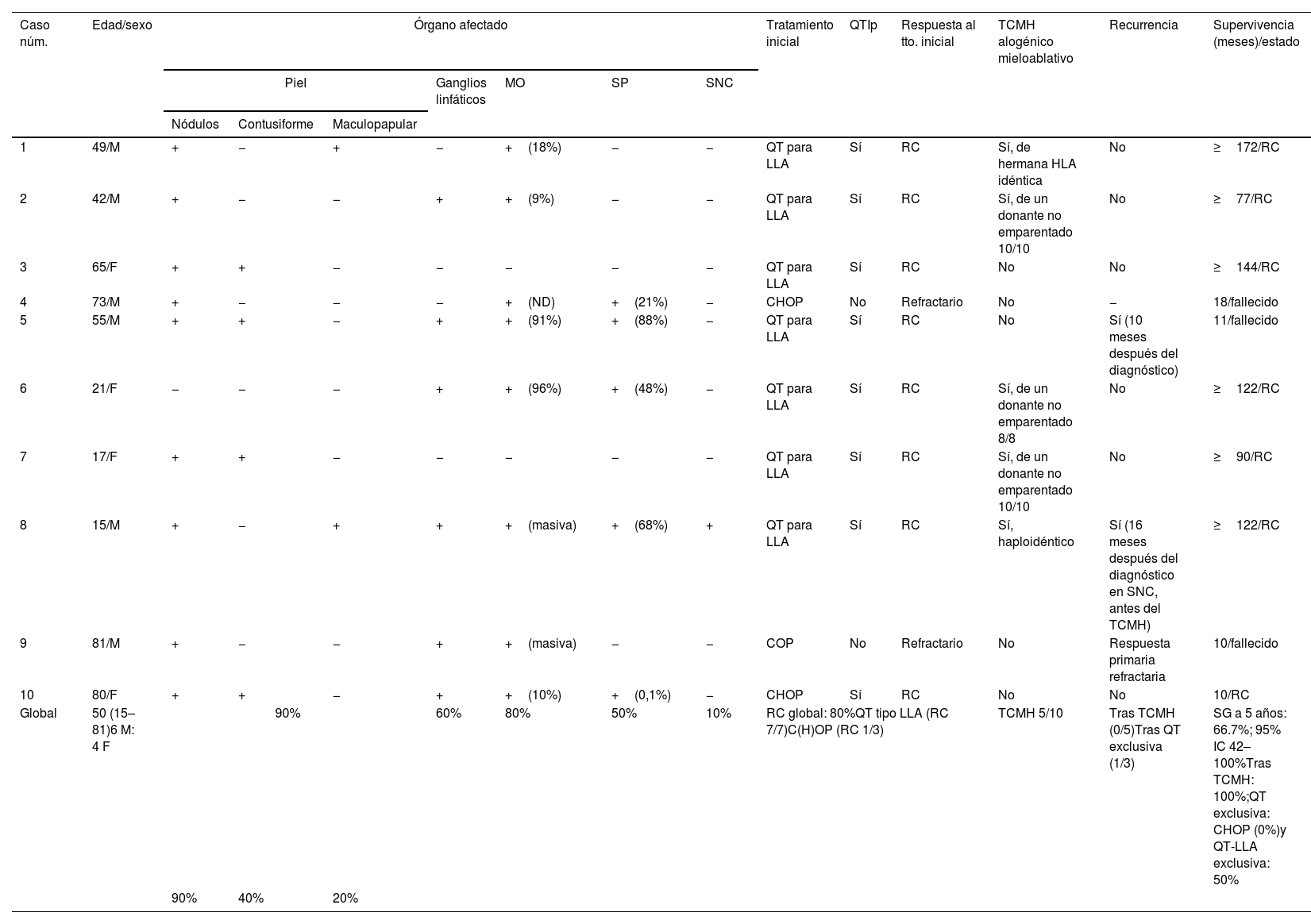
InformeCaracterísticas clínicasLas principales características de los pacientes se muestran en la tabla 1. Se incluyeron 10 pacientes con NBCDP, seis varones, con una mediana de edad de 50 años (rango, 15-81). Tres pacientes tenían una neoplasia hematológica previa (síndrome mielodisplásico, n=2; mielofibrosis primaria, n=1). La piel fue el órgano más frecuentemente afectado (90%), con dos pacientes que solo presentaban signos cutáneos, seguida de la médula ósea (80%), los ganglios linfáticos (60%), la sangre periférica (50%) y el sistema nervioso central (SNC) (10%).
Descripción clínica, regímenes de tratamiento y respuesta terapéutica en pacientes con neoplasia blástica de células dendríticas plasmocitoides
| Caso núm. | Edad/sexo | Órgano afectado | Tratamiento inicial | QTIp | Respuesta al tto. inicial | TCMH alogénico mieloablativo | Recurrencia | Supervivencia (meses)/estado | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Piel | Ganglios linfáticos | MO | SP | SNC | ||||||||||
| Nódulos | Contusiforme | Maculopapular | ||||||||||||
| 1 | 49/M | + | − | + | − | +(18%) | − | − | QT para LLA | Sí | RC | Sí, de hermana HLA idéntica | No | ≥172/RC |
| 2 | 42/M | + | − | − | + | +(9%) | − | − | QT para LLA | Sí | RC | Sí, de un donante no emparentado 10/10 | No | ≥77/RC |
| 3 | 65/F | + | + | − | − | − | − | − | QT para LLA | Sí | RC | No | No | ≥144/RC |
| 4 | 73/M | + | − | − | − | +(ND) | +(21%) | − | CHOP | No | Refractario | No | − | 18/fallecido |
| 5 | 55/M | + | + | − | + | +(91%) | +(88%) | − | QT para LLA | Sí | RC | No | Sí (10 meses después del diagnóstico) | 11/fallecido |
| 6 | 21/F | − | − | − | + | +(96%) | +(48%) | − | QT para LLA | Sí | RC | Sí, de un donante no emparentado 8/8 | No | ≥122/RC |
| 7 | 17/F | + | + | − | − | − | − | − | QT para LLA | Sí | RC | Sí, de un donante no emparentado 10/10 | No | ≥90/RC |
| 8 | 15/M | + | − | + | + | +(masiva) | +(68%) | + | QT para LLA | Sí | RC | Sí, haploidéntico | Sí (16 meses después del diagnóstico en SNC, antes del TCMH) | ≥122/RC |
| 9 | 81/M | + | − | − | + | +(masiva) | − | − | COP | No | Refractario | No | Respuesta primaria refractaria | 10/fallecido |
| 10 | 80/F | + | + | − | + | +(10%) | +(0,1%) | − | CHOP | Sí | RC | No | No | 10/RC |
| Global | 50 (15–81)6 M: 4 F | 90% | 60% | 80% | 50% | 10% | RC global: 80%QT tipo LLA (RC 7/7)C(H)OP (RC 1/3) | TCMH 5/10 | Tras TCMH (0/5)Tras QT exclusiva (1/3) | SG a 5 años: 66.7%; 95% IC 42–100%Tras TCMH: 100%;QT exclusiva: CHOP (0%)y QT-LLA exclusiva: 50% | ||||
| 90% | 40% | 20% | ||||||||||||
C(H)OP: ciclofosfamida (doxorrubicina) vincristina y prednisona; ERM: enfermedad residual mínima; F: femenino; IC: intervalo de confianza; LLA: leucemia linfoblástica aguda; M: masculino; MO: médula ósea; QT: quimioterapia; QTI: quimioterapia intratecal; RC1: primera respuesta completa; RC2: segunda respuesta completa; SG: supervivencia global; SNC: sistema nervioso central; SP: sangre periférica; TCMH: trasplante alogénico de células madre hematopoyéticas; tto: tratamiento.
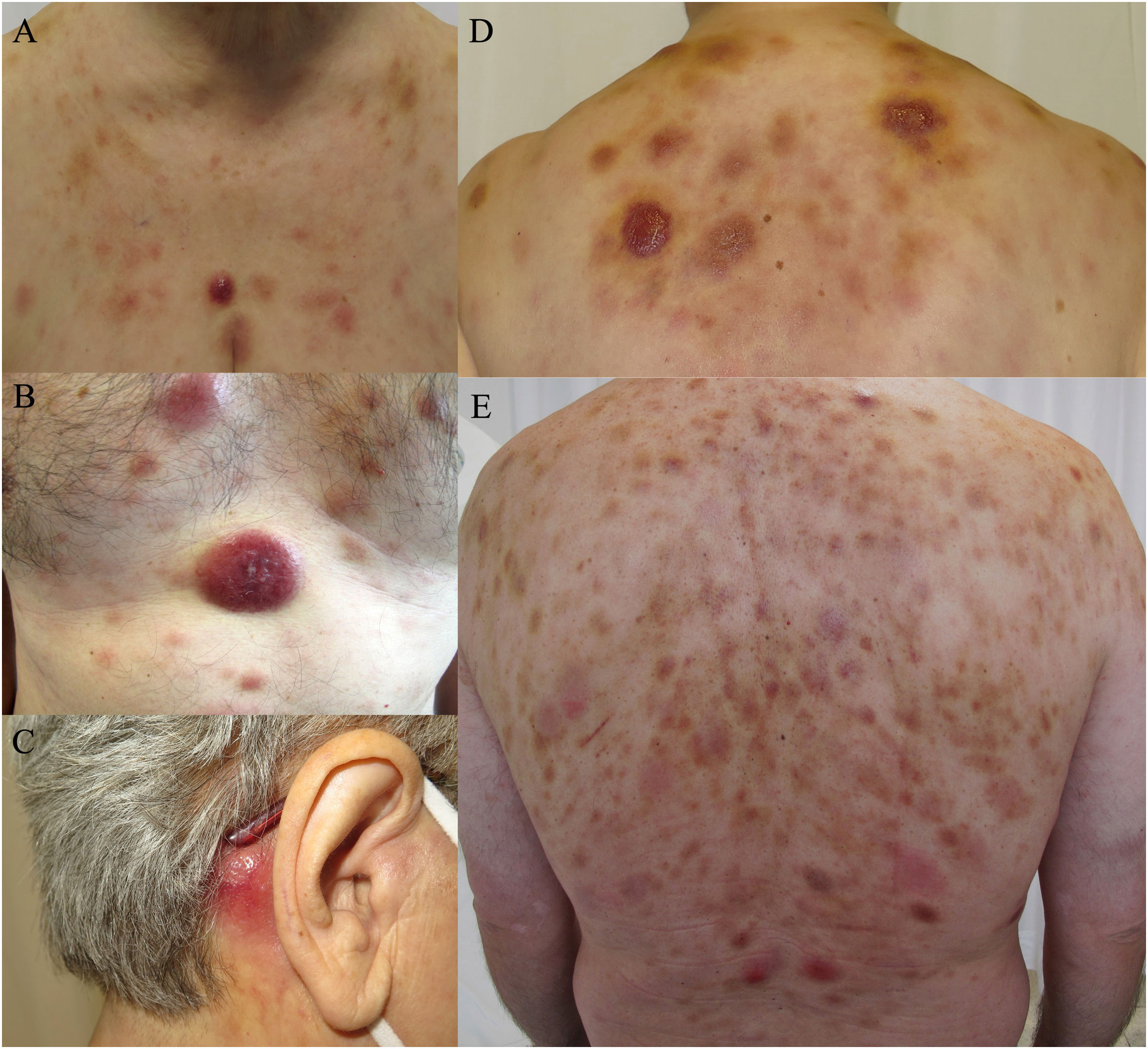
Las lesiones cutáneas presentaron tres morfologías principales: nódulos eritematovioláceos indurados (9/10), placas tipo hematoma (4/10) y exantemas maculopapulares (2/10) (fig. 1). Diferentes tipos de lesiones coexistieron con frecuencia (60% de los casos).
Espectro clínico de las lesiones cutáneas de la neoplasia de células dendríticas plasmocitoides blásticas. (a, b, d) Múltiples nódulos eritematosos con placas de aspecto contusiforme en el tórax y la parte superior de la espalda. (c) Lesión nodular eritematosa aislada en la zona retroauricular. (e) Placas eritematosas difusas en la espalda con presencia de lesiones nodulares violáceas dispersas.
Las lesiones no presentaban ulceración, ni los pacientes mostraban signos de dolor o prurito. El tronco fue la zona más frecuentemente afectada.
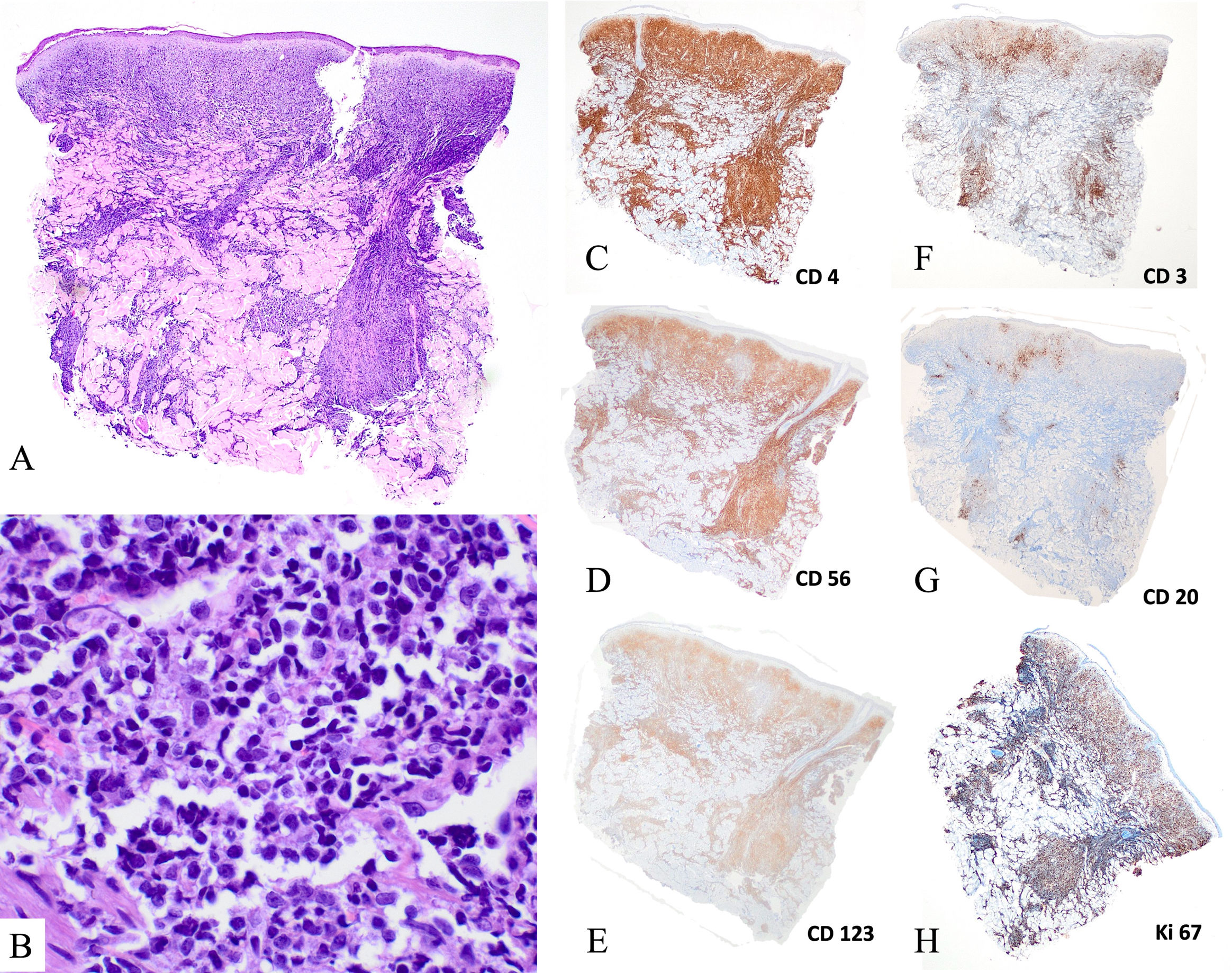
Hallazgos patológicosHistológicamente, las lesiones cutáneas mostraban infiltrados dérmicos de blastos de tamaño medio con núcleos irregulares. Las mitosis fueron un hallazgo frecuente, y no se observó invasión vascular ni ulceración (fig. 2A, B). Los ganglios linfáticos presentaban un patrón de infiltración leucémica, causando ocasionalmente un borramiento difuso de la arquitectura ganglionar. Los patrones de afectación de la médula ósea fueron heterogéneos, desde la afectación focal detectada por inmunohistoquímica hasta la infiltración masiva. Las células blásticas eran de tamaño variable y tenían un aspecto similar a los linfoblastos.
Hallazgos histológicos de biopsias cutáneas de neoplasia blástica de células dendríticas plasmocitoides. (A, B) Tinción de hematoxilina-eosina (A, ×20; B, ×400). Presencia de un denso infiltrado dérmico de células de tamaño intermedio con núcleos atípicos, con zona de Grenz y sin epidermotropismo ni tropismo vascular. (C) Tinción inmunohistoquímica (×2) positiva para CD4, CD56 y CD123, y negativa para CD3 y CD20. Presencia de un elevado número de mitosis (ki67>50%).
Los detalles inmunofenotípicos y de biología molecular se proporcionan en el Anexo A, Tabla S1. Se observó la expresión de CD4, CD56, CD123 y Human Leukocyte Antigen – DR (HLA-DR) en las muestras de todos los pacientes (fig. 2C-E). En seis pacientes se evaluó la expresión de CD303 y CD304, y todos los resultados fueron positivos. Algunos casos expresaron antígenos aislados, no definitorios de linaje, de células B, células T, mieloides o monocíticas (CD22, CD38, CD2, CD7, CD33 y/o CD68).
Estado mutacionalSe realizó una secuenciación de nueva generación (NGS) dirigida en siete casos con un panel que incluía genes con mutaciones recurrentes en leucemia mieloide aguda (LMA) (Anexo AS Tabla suplementaria S2). En general, se detectaron mutaciones en cuatro de los siete casos. Curiosamente, dos de los tres casos sin ninguna mutación identificable tenían una presentación exclusivamente cutánea. Se encontraron mutaciones en TET2 (3/7), NRAS (2/7), TP53 (1/6), RUNX1 (1/6) y SRSF2 (1/6) (Anexo A, Tabla S2).
Tratamiento y resultadosEl tratamiento y los resultados se detallan en la tabla 1. Siete de los 10 pacientes fueron tratados con regímenes de leucemia linfoblástica aguda de alto riesgo (LLA-AR), incluida la quimioterapia intratecal profiláctica (QTIp), basada en vincristina, daunorrubicina, esteroides, mitoxantrona, citarabina, metotrexato, ciclofosfamida y l-asparaginasa. Tres pacientes se sometieron a regímenes de ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOP), según el estado funcional y la edad, y un paciente recibió QTIp. La tasa de respuesta global fue del 80%. Los siete pacientes que recibieron QT de tipo LLA y uno de los tres que recibieron CHOP alcanzaron una RC (Anexo A, Fig. S1. Material suplementario). Ninguno de los dos pacientes no respondedores tratados con CHOP recibió QTIp, y uno murió por afectación del SNC. Cinco fueron sometidos a un TCMH alogénico, todos con un régimen de acondicionamiento mieloablativo con ciclofosfamida e irradiación corporal total (ICT). Ninguno de los pacientes injertados murió por progresión tumoral o complicaciones relacionadas con el trasplante (Anexo A, Fig. S1. Material suplementario). Tras una mediana de seguimiento de 77 meses (8-172 meses), los cinco pacientes sometidos a TCMH alogénico permanecen en RC. La tasa de supervivencia global (SG) a cinco años fue del 66,7% para todos, que fue superior (83%) para aquellos tratados con un protocolo LLA (solo falleció un paciente, sin haberse sometido a un TCMH alogénico). La edad más joven (< 50 vs. > 50 años; p=0,022) y los protocolos LLA (p=0,018) fueron factores pronósticos favorables de SG. Aunque los pacientes sometidos a un TCMH alogénico mostraron una tendencia hacia una mejor supervivencia, no se alcanzó significación estadística. Por el contrario, el hecho de estar limitado a la piel no fue un factor pronóstico (p=0,31) (Anexo A, Fig. S1. Material suplementario).
DiscusiónLa NBCDP es una neoplasia hematológica agresiva muy poco frecuente que se manifiesta principalmente en la piel. En esta serie de casos retrospectiva, proporcionamos una descripción detallada de las lesiones cutáneas y los resultados del tratamiento en 10 pacientes, haciendo hincapié en el QT para LLA y el TCMH alogénico.
Nuestra serie presenta las características típicas de la NBCDP: predominio masculino y notable tropismo por la afectación de la piel y la médula ósea. La edad en el momento del diagnóstico era inferior a la de otras series1,7,8. Las lesiones cutáneas presentaban tres morfologías principales (lesiones nodulares violáceas, placas de aspecto contusiforme y lesiones maculopapulares)1,7. Dado que la piel es el órgano más frecuentemente afectado (> 90% de los pacientes), el diagnóstico inicial suelen realizarlo en dermatología9,14. Curiosamente, los pacientes con enfermedad limitada a la piel en el momento del diagnóstico no tienen un mejor pronóstico1,7. En el momento de la presentación, el 80% de los pacientes tenían afectación sistémica y el 30% tenía antecedentes de neoplasia hematológica, lo que pone de relieve el riesgo de neoplasias hematológicas secundarias o concurrentes14.
Todos los casos expresaron CD4, CD56 y CD123 y, en los casos evaluados, los antígenos específicos pDC (células dendríticas plasmacitoides) BDCA-2/CD303 y BDCA-3/CD304. Otros marcadores específicos de linaje fueron negativos6,7. Observamos un panorama mutacional similar al de informes previos sobre NBCDP, con un 43% de casos que presentaban mutaciones en TET215–17. Este hallazgo puede proporcionar una justificación para incorporar terapias epigenéticas (es decir, agentes hipometilantes como azacitidina y decitabina) en pacientes no aptos para regímenes intensivos15,18. Las mutaciones NRAS –que encontramos en dos de los siete pacientes estudiados– resultaron ser recurrentes (27,3% de los casos) y mutuamente excluyentes con las mutaciones KRAS y ATM19. En general, el panorama mutacional de los NBCDP recuerda al de las neoplasias mieloides, lo que puede explicar su presentación secuencial o concurrente.
En cuanto al tratamiento, dada la ausencia de un protocolo establecido, se emplean desde terapias dirigidas a la piel hasta QT sistémica1,9,12,13. En 2018, el tagraxofusp –un tratamiento antiCD123– fue el primer agente aprobado por la Administración de Alimentos y Medicamentos de EE. UU. (FDA) para el tratamiento de la NBCDP12,13,20. Por lo tanto, es probable que el tagraxofusp se incorpore como esquema de primera línea, junto con la profilaxis del SNC y el TCMH alogénico20. Históricamente, los regímenes de QT multiagente13 han proporcionado tasas de RC que oscilan entre el 40% y el 80%, pero la enfermedad tiende a recurrir, con una mediana de SG de 12 a 14 meses13. A pesar de albergar mutaciones observadas en neoplasias mieloides3,14,18, los regímenes para LLA han sido particularmente eficaces8,20 y han puesto de manifiesto la importancia de la profilaxis del SNC20,21. En los últimos años, la importancia del TCMH alogénico para consolidar la respuesta se ha hecho cada vez más evidente1,10,11,17,21, debido a una menor tasa de mortalidad y una SG más prolongada9,13,14. Cuando fue posible, los pacientes de nuestro estudio fueron tratados de forma homogénea con un tratamiento intensivo basado en LLA seguido de un TCMH alogénico precoz con acondicionamiento mieloablativo17. El control de la enfermedad fue excelente, sin recaídas tras una mediana de 10 años de seguimiento en los pacientes sometidos a TCMH alogénico. Sin embargo, los pacientes no elegibles para un TCMH alogénico, como se observó en este estudio, reciben con frecuencia terapias menos intensivas sin QTIp y desarrollan recidivas tempranas, lo cual resulta en un pronóstico desfavorable. Los nuevos tratamientos dirigidos, como los antiCD123, los inhibidores de BCL-2 (venetoclax)13,14 o las células T con receptores quiméricos de antígenos (CAR-T) pueden mejorar la SG y permitir el tratamiento de pacientes más frágiles.
En conclusión, nuestra serie mostró los rasgos clínicos, morfológicos y fenotípicos característicos de la NBCDP. Un tratamiento basado en LLA seguido del TCMH alogénico precoz dio lugar a una elevada tasa de remisión y una duración prolongada de la respuesta en los pacientes considerados elegibles para un tratamiento intensivo.