El melanoma maligno (MM) es uno de los tumores malignos que más ha aumentado su incidencia en las últimas décadas. Durante muchos años hubo controversia en la comunidad médica en relación con el efecto potencialmente adverso de las hormonas femeninas (exógenas o endógenas asociadas al embarazo) sobre los nevus melanocíticos y el MM. Considerando que las mujeres han retrasado la maternidad hasta la tercera y cuarta décadas de la vida, y que la incidencia de MM aumenta en estas décadas, la probabilidad de aparición de un MM durante el embarazo es mayor.
Evidencias clínicas y experimentales recientes permiten sugerir que el embarazo no influye en el pronóstico del MM, y que no parece causar cambios significativos en los nevus. La finalidad de este artículo es revisar la asociación entre MM, nevus y factores hormonales y reproductivos.
Se realizó una búsqueda de artículos utilizando la base bibliográfica Medline y los buscadores “Pubmed” y “Ovid”, en inglés y español, en el periodo de 1966 a marzo del 2010. Los artículos fueron revisados y se consiguieron referencias adicionales de las bibliografías.
Malignant melanoma is among the malignant tumors whose incidence has risen markedly in recent decades. For many years the medical community debated the potential adverse effects of female hormones (whether of exogenous or pregnancy-related endogenous origin), on melanocytic nevi and malignant melanoma. Given that women have been delaying pregnancy until their thirties or forties and that the incidence of malignant melanoma increases in those decades, the likelihood of this tumor developing during pregnancy has increased. Recent clinical and experimental evidence has suggested that pregnancy does not affect prognosis in malignant melanoma and that it does not seem to lead to significant changes in nevi. This review examines the relationship between malignant melanoma and hormonal and reproductive factors. Evidence was located by MEDLINE search (in PubMed and Ovid) for articles in English and Spanish for the period from 1966 to March 2010; additional sources were found through the reference lists of the identified articles.
Desde hace años existe controversia respecto a la relación del impacto del embarazo sobre los nevus melanocíticos y el melanoma maligno (MM). En la práctica clínica no es infrecuente examinar mujeres embarazadas alarmadas por cambios morfológicos de uno o más nevus1–3.
Considerando que las mujeres han retrasado la maternidad hasta la tercera, cuarta e incluso la quinta décadas de la vida y que la incidencia de MM edad-específica aumenta en estas décadas, la probabilidad de un diagnóstico de MM durante el embarazo ha aumentado, así como el número de mujeres que desean quedarse embarazadas o que desean usar contraceptivos orales para evitar un embarazo tras el diagnóstico de un MM4,5.
La incidencia de MM en la mujer es rara antes de la pubertad, aumenta durante los años reproductivos hasta los 50, y disminuye tras la menopausia6. Algunos cambios en la pigmentación, como el melasma, están asociados con el embarazo, con el uso de contraceptivos orales y con terapia hormonal sustitutiva. Más recientemente se ha identificado un nuevo receptor estrogénico (RE β), presente en nevus benignos, nevus displásicos, lentigos malignos y MM de diverso grosor7–10. Estas observaciones han llevado a la especulación sobre la relación entre hormonas, nevus y MM11.
Nevus melanocíticos y embarazoExisten pocos estudios en los que se hayan investigado objetivamente los cambios reales en los nevus melanocíticos (NM) durante el embarazo.
Cambios como el aumento u oscurecimiento de las lesiones cutáneas pigmentadas (LCP) han sido descritos con frecuencia a partir de observaciones subjetivas percibidas por las pacientes. De este modo, se han descrito cambios clínicos subjetivos de LCP en el 10,5%1 y en el 32,5%12 de las mujeres embarazadas. Estos cambios incluyeron LCP localizadas en las mamas y el abdomen (áreas sujetas a una expansión fisiológica durante el embarazo) y lesiones cutáneas no melanocíticas, como dermatofibromas o acrocordones.
Los dos primeros estudios prospectivos en los que se describían alteraciones en los NM durante el embarazo se publicaron en los años 90. En 1991 Ellis13 describió cambios objetivos en nevus durante el embarazo observados en 17 pacientes con síndrome del nevus displásico (SND) durante 22 embarazos. Las pacientes presentaban nevus melanocíticos con una morfología atípica (tamaño mayor de 5mm, discromía, bordes irregulares e imprecisos) y una histología con atipias celulares y arquitecturales. Los cambios se documentaron mediante fotografías. Los autores concluyeron que la tasa de cambio clínico de los nevus era 3,9 veces más elevada durante el embarazo comparada con mujeres no embarazadas. Este resultado es consistente con la naturaleza del SND, en el que los nevus atípicos son más susceptibles a cambios y estos pacientes presentan un riesgo más elevado de desarrollar melanoma.
En 1997 Pennoyer et al14 evaluaron los cambios en el tamaño de los nevus en 22 mujeres caucásicas embarazadas, con un total de 129 nevus. Se tomaron fotografías, en el primer y tercer trimestre, de todos los nevus localizados en la espalda con tamaño igual o superior de 2mm. Se eligió la espalda como sitio anatómico del estudio, dado que otras áreas del cuerpo presentan un estiramiento de la piel durante el embarazo (abdomen, mamas) que pueden causar cambios en los nevus. De los 129 NM solamente 8 (6,2%) cambiaron su diámetro: 4 aumentaron de diámetro en 1mm y 4 disminuyeron de 1mm. Aunque la muestra era pequeña, a partir de estos hallazgos los autores sugirieron que el embarazo no se asociaba a cambios significativos en el tamaño de los nevus de la espalda.
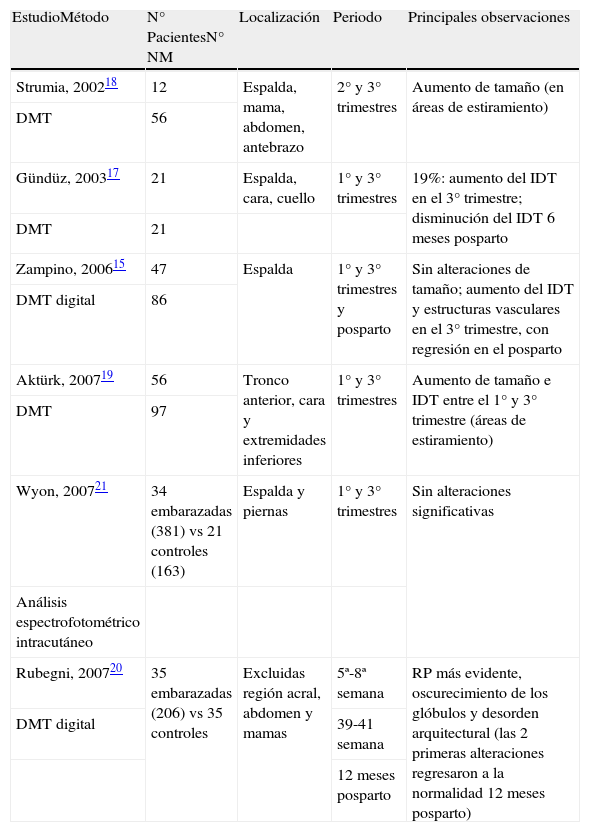
Los primeros estudios prospectivos de nevus melanocíticos durante el embarazo utilizando la dermatoscopia fueron publicados a partir del año 2002 (tabla 1).
Estudios prospectivos con métodos objetivos de evaluación de los nevus melanocíticos durante el embarazo
| EstudioMétodo | N° PacientesN° NM | Localización | Periodo | Principales observaciones |
| Strumia, 200218 | 12 | Espalda, mama, abdomen, antebrazo | 2° y 3° trimestres | Aumento de tamaño (en áreas de estiramiento) |
| DMT | 56 | |||
| Gündüz, 200317 | 21 | Espalda, cara, cuello | 1° y 3° trimestres | 19%: aumento del IDT en el 3° trimestre; disminución del IDT 6 meses posparto |
| DMT | 21 | |||
| Zampino, 200615 | 47 | Espalda | 1° y 3° trimestres y posparto | Sin alteraciones de tamaño; aumento del IDT y estructuras vasculares en el 3° trimestre, con regresión en el posparto |
| DMT digital | 86 | |||
| Aktürk, 200719 | 56 | Tronco anterior, cara y extremidades inferiores | 1° y 3° trimestres | Aumento de tamaño e IDT entre el 1° y 3° trimestre (áreas de estiramiento) |
| DMT | 97 | |||
| Wyon, 200721 | 34 embarazadas (381) vs 21 controles (163) | Espalda y piernas | 1° y 3° trimestres | Sin alteraciones significativas |
| Análisis espectrofotométrico intracutáneo | ||||
| Rubegni, 200720 | 35 embarazadas (206) vs 35 controles | Excluidas región acral, abdomen y mamas | 5ª-8ª semana | RP más evidente, oscurecimiento de los glóbulos y desorden arquitectural (las 2 primeras alteraciones regresaron a la normalidad 12 meses posparto) |
| DMT digital | 39-41 semana | |||
| 12 meses posparto |
DMT: dermatoscopia; IDT: índice dermatoscópico total; NM: nevus melanocíticos; RP: retículo pigmentado.
Zampino et al15 realizaron un estudio prospectivo, evaluando los cambios dermatoscópicos en los NM durante y después del embarazo. En este trabajo analizaron 86 nevus localizados en la espalda de 47 mujeres embarazadas utilizando un aparato de dermatoscopia digital. Se realizaron 3 controles: en el primer trimestre, en el tercero y a los 6 meses posparto. Las alteraciones dermatoscópicas evidenciadas se clasificaron como: a) ausencia de alteraciones significativas en las dimensiones de los nevus (podía haber un pequeño aumento durante el embarazo en áreas de mayor estiramiento de la piel y retorno a la normalidad en el período postparto); b) disminución de la pigmentación global y presencia de una red de pigmento menos prominente durante el embarazo y especialmente en el período posparto, que podía ser atribuible a la menor exposición solar durante este período, relatada por las participantes del estudio; c) aumento en número de las estructuras vasculares (vasos puntiformes y, en menor grado, vasos en coma) durante el embarazo y regresión en el postparto, consideradas alteraciones vasculares fisiológicas del embarazo, por la influencia hormonal; d) aumento en el índice dermatoscópico total (IDT), según la regla ABCD de Stolz16. El aumento en el IDT y los cambios en la simetría durante el embarazo indican una influencia hormonal intrínseca sobre la actividad melanocítica, conllevando temporalmente a un aspecto dermatoscópico ligeramente más irregular y retorno a la normalidad después del parto. Estos datos están de acuerdo con las observaciones de Gündüz et al17.
Strumia et al18 evaluaron las características dermatoscópicas de 56 nevus mayores de 4mm en 12 mujeres embarazadas, examinadas en el segundo y tercer trimestre. En las áreas influenciadas por el estiramiento típico del embarazo, como las mamas y el abdomen, las LCP con patrón reticular mostraron un aumento sin cambio en la forma, mientras que las lesiones con patrón globular también presentaron un aumento periférico en el número de glóbulos marrones. Los nevus localizados en otras áreas, poco modificables por el embarazo, como la espalda, no presentaron cambios significativos en la forma o color.
Aktürk et al19 evaluaron dermatoscópicamente 97 nevus en 56 mujeres embarazadas en el primer y tercer trimestre. Encontraron un aumento estadísticamente significativo en el tamaño y en el IDT entre el primer y tercer trimestre, siendo el aumento de tamaño de los nevus observado principalmente en la superficie anterior del tronco. También se observó una nueva formación de puntos en 6 nevus, y aparición de nuevas lesiones névicas en 3 mujeres embarazadas en el tercer trimestre. Los resultados fueron compatibles con los estudios de Strumia y Gündüz17,18.
En el estudio de Rubegni et al20 se evaluaron 35 mujeres embarazadas y 35 controles con análisis dermatoscópico digital. Fueron incluidos todos los nevus de más de 4mm, anteriores al embarazo, y se excluyeron las LCP en regiones acrales, abdomen y mamas, efélides y lesiones con atipia clínica/ dermatoscópica. Fueron estudiados un total de 206 nevus, entre las semanas 5-8 y 39-41 del embarazo y 12 meses posparto con los siguientes resultados: retículo pigmentado más grueso y evidente, oscurecimiento de los glóbulos (lesiones con patrón globular) y desorden arquitectural. Las dos primeras alteraciones regresaban a la condición original un año después del parto, pero la última persistía.
Recientemente en el estudio de Wyon et al21 se evaluaron los cambios en los NM durante el embarazo con el análisis espectrofotométrico intracutáneo. Esta metodología emplea una fuente de luz en la región del visible hasta el infrarrojo cercano, permitiendo una penetración más profunda en la piel y posterior análisis computarizado de las imágenes. Este estudio comparó imágenes de 384 NM en 34 mujeres, durante el primer y tercer trimestre. Se incluyó un grupo control de 163 NM en mujeres no embarazadas. Como conclusiones, los autores señalaron la ausencia de diferencias significativas en los NM durante el embarazo.
En resumen, durante el embarazo los nevus melanociticos pueden presentar cambios reversibles, incluyendo oscurecimiento, progresiva reducción del espesor y patrón reticulado prominente, nueva aparición de puntos o glóbulos, incremento de vascularización y aumento de tamaño (sobre todo en áreas sujetas a un mayor estiramiento de la piel, como la superficie anterior del tronco)15,17,19,20,22,23. Sin embargo, cualquier lesión con cambios sospechosos de trasformación a MM (como retículo pigmentado atípico, velo azul-blanquecino, patrón vascular atípico, etc.) debería ser biopsiada inmediatamente, al igual que en una paciente no embarazada. Las pacientes con SND deberían tener un control dermatoscópico digital al principio del embarazo y controles cada trimestre, favoreciendo la detección de cualquier cambio2.
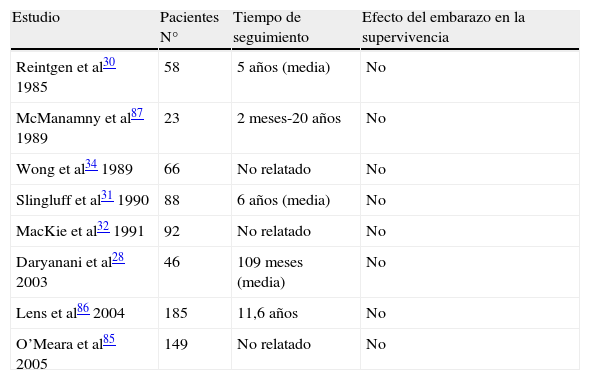
Melanoma y factores hormonales y reproductivosMelanoma maligno diagnosticado durante el embarazoAunque durante muchos años los estudios realizados sugirieron que el embarazo podía aumentar el riesgo de melanoma24–27, las evidencias clínicas actuales no respaldan esta afirmación. Numerosos trabajos de investigación, como el de Daryanani et al28, aportaron evidencias importantes de que el curso clínico, el pronóstico y la supervivencia global de mujeres embarazadas con MM localizado (American Joint Committee on Cancer-AJCC, estadio I-II) es similar al encontrado en las mujeres no embarazadas (tabla 2). El pronóstico de la mujer embarazada con MM depende primariamente del grosor del tumor y de la presencia o ausencia de ulceración.
Estudio caso-control de melanoma localizado diagnosticado durante el embarazo
| Estudio | Pacientes N° | Tiempo de seguimiento | Efecto del embarazo en la supervivencia |
| Reintgen et al30 1985 | 58 | 5 años (media) | No |
| McManamny et al87 1989 | 23 | 2 meses-20 años | No |
| Wong et al34 1989 | 66 | No relatado | No |
| Slingluff et al31 1990 | 88 | 6 años (media) | No |
| MacKie et al32 1991 | 92 | No relatado | No |
| Daryanani et al28 2003 | 46 | 109 meses (media) | No |
| Lens et al86 2004 | 185 | 11,6 años | No |
| O’Meara et al85 2005 | 149 | No relatado | No |
El análisis combinado de Karagas et al29 revisó un conjunto de 10 estudios con casos-controles (total de 5.590 mujeres, 2.391 casos y 3.199 controles) y evaluó los efectos del embarazo sobre el riesgo de desarrollar MM, sin encontrar asociación entre el riesgo de MM y el embarazo.
En otros dos estudios (Reintgen y Slinguff)30,31 el intervalo libre de enfermedad estaba significativamente reducido en las pacientes embarazadas comparado con el grupo control de mujeres no embarazadas, con el ganglio linfático como sitio más frecuente de recaída.
Algunos estudios30–33 mostraron un aumento del espesor del tumor en las embarazadas comparado con las no embarazadas, probablemente como resultado de un diagnóstico más tardío. Un diagnóstico precoz es muy importante y las lesiones sospechosas deben ser biopsiadas inmediatamente, sin esperar el término del embarazo.
En ensayos recientes bien controlados, y estudios con gran número de pacientes28,30,32,34, no se mostraron diferencias en cuanto al sitio anatómico de la lesión primaria o el tipo histopatológico de los MM diagnosticados durante el embarazo cuando se comparan con el grupo control.
Evaluación y tratamiento de un melanoma maligno diagnosticado durante el embarazoEn general, la evaluación de la paciente embarazada con MM es similar a la de la paciente no embarazada, y el tratamiento depende del estadio de la enfermedad. Sin embargo, hay algunos cuidados a seguir para proteger el bienestar del feto.
Una vez diagnosticado el MM localizado está indicada la extirpación local amplia con los márgenes recomendados, bajo anestesia local32,35. La lidocaína se considera segura para la anestesia local durante el embarazo29, pero el uso de anestesia general debería evitarse.
Si el tumor está asociado a un alto riesgo de recaída la biopsia selectiva del ganglio centinela (BSGC)36,37 puede ser considerada para el estadiaje. Existe controversia en cuanto a la seguridad de esta técnica en la mujer embarazada. Antes de realizar la BSGC en la embarazada debe obtenerse un consentimiento informado en el que estén reflejados los riesgos, beneficios y limitaciones de la técnica. Se debe informar a la paciente de que este procedimiento no ha demostrado aumentar la supervivencia global, y por tanto puede no realizarse en caso de no desear un tratamiento futuro. No está claro cuál es el modo más seguro de realizar esta técnica en embarazadas, y cada cirujano y/o centro médico puede realizarlo indistintamente, utilizando un radiocoloide (como el sulfuro coloidal marcado con 99mTc), un colorante azul o ambos36. Aunque el riesgo para la madre y el feto sea relativamente pequeño, esta técnica tiene riesgos potenciales como reacciones alérgicas al colorante azul y exposición fetal a la radiación. Algunos médicos prefieren evitar el uso del radiocoloide durante el embarazo38, pero otros afirman que la dosis de radiación a la que está expuesto el feto está por debajo del índice teratogénico4,36. Schwartz, Mozurkewich y Johnson4 demostraron un riesgo de 0,7 a 1,1% de anafilaxia en respuesta al colorante. Para evitar este riesgo es posible usar solamente el radiocoloide. La BSGC expone el feto a dosis de radiación inferiores a 5 mGy (la Sociedad de Medicina Nuclear recomienda un test del embarazo cuando la paciente tiene que realizar cualquier procedimiento que exponga el feto a dosis de radiación mayores de 50 mGy). Alternativamente, para mujeres en el segundo y tercer trimestre del embarazo y a las que se extirpe MM con márgenes histológicos suficientes es razonable esperar el postparto para realizar la BSGC, con un seguimiento periódico durante el embarazo.
Aunque la investigación de metástasis a distancia sea necesaria, la seguridad de las técnicas de imagen en embarazadas también es motivo de polémica. La radiografía de tórax con protección puede realizarse con seguridad, así como la ecografía abdominal (Shapiro et al)39. La tomografía computarizada (TC) con contraste endovenoso y la tomografía por emisión de positrones (PET) generalmente están contraindicadas, dado que emiten unas dosis de radiación elevadas que serán absorbidas por el feto40. La resonancia magnética (RM)41 es más segura que la TC, pero no es recomendable durante el primer trimestre debido al calentamiento de los tejidos que causa la radiofrecuencia usada en esta técnica y la exposición a ruidos excesivos, que puede causar pérdidas auditivas de alta frecuencia en los recién nacidos41.
La experiencia es muy limitada en mujeres embarazadas con enfermedad metastásica avanzada tratadas con quimioterapia o interferón, debido a su eficacia limitada y a los potenciales efectos adversos para el feto42. Hemos encontrado 36 casos publicados en la literatura de tratamiento con dacarbazina durante el embarazo, 8 durante el primer trimestre43–47 y 28 durante el segundo y tercer trimestres47–52. En dos casos se observaron anormalidades congénitas durante el primer trimestre (microftalmia e hipermetropía severa)44. Un feto falleció47 y se observó un caso de sindactilia50 durante el segundo y tercer trimestre. En todos estos casos dacarbazina fue administrada con otros fármacos citotóxicos. Sin embargo, el periodo de seguimiento de los niños expuestos a la quimioterapia in utero fue muy corto (14 meses en media) y el riesgo de malignidad secundaria puede estar infraestimado. Existe una publicación de Japón53 que describe una mujer con MM estadio III durante el segundo trimestre de embarazo tratada con quimioterapia DAV-ferón (dacarbazina, nimustina, vincristina e interferón beta). El parto fue a las 35 semanas de gestación, sin signos de afectación placentaria y un bebé sano.
La radioterapia durante el embarazo puede causar malformaciones, retraso mental y muerte fetal y su eficacia es pobre en el MM. Existe una publicación refiriendo su utilización durante el embarazo en dos pacientes con MM y metástasis cerebrales sintomáticas, sin afectación del recién nacido54.
Riesgo para el fetoLa incidencia estimada del MM complicando el embarazo varía de 0,1 a 2,8 por 1.000 embarazos. Según una revisión de la literatura, llevada a cabo por Alexander et al55, la aparición de metástasis en la placenta o en el feto de cualquier tipo de cáncer es un evento muy raro (solamente 87 casos relatados en los últimos 140 años). Aunque el MM no sea el tumor más frecuente durante el embarazo, probablemente sea el que más pueda dar metástasis en la placenta y en el feto, siendo responsable del 31% (27/87) de los casos.
El pronóstico para el feto en una mujer embarazada con MM depende del estadio de la enfermedad materna. En general, el pronóstico para el feto es excelente, a menos que la madre tenga una enfermedad diseminada. Las metástasis transplacentarias del MM materno en el feto ocurren raramente, y sólo se han descrito en mujeres con metástasis a distancia. Cuando hay afectación de la placenta esto no implica siempre metástasis en el feto, estimándose que solo el 25% de los fetos están afectados cuando la placenta lo está. La prematuridad es una complicación común en niños nacidos de madres con enfermedad placentaria, con una edad gestacional media de 34 semanas, pero la tasa de mortalidad secundaria a la prematuridad fue baja55.
Cuando aparecen metástasis del MM en el feto los sitios más frecuentes son la piel y el hígado, causando mortalidad fetal intrauterina o posparto en más de un 80% de los casos55,56.
En mujeres con enfermedad avanzada se recomienda un examen minucioso (macroscópico e histológico) de la placenta, buscando metástasis de MM, incluyendo técnicas inmuno-histoquímicas (S-100, HMB-45, Melan-A, MART-1)55. Si se confirma la afectación placentaria y el neonato no presenta metástasis al nacimiento se recomienda un seguimiento periódico hasta los 24 meses posparto como mínimo. La evaluación debe incluir una radiografía de tórax basal, pruebas de la función hepática, LDH y exploración cutánea minuciosa.
Debido a la rareza del MM congénito o infantil, no existen guías clínicas para el tratamiento del MM en recién nacidos de madres con metástasis placentarias. No hay publicaciones sobre el tratamiento adyuvante con dosis altas de interferón alfa en estos niños55.
Melanoma maligno diagnosticado antes del embarazoAlgunos estudios realizados en un número pequeño de pacientes30,32 concluyen que el embarazo tras un diagnóstico de MM localizado no altera el pronóstico de la mujer. El consejo en cuanto a futuros embarazos cambia según los facultativos, y algunos no recomiendan el embarazo. Una proporción significativa de pacientes con MM localizado (AJCC estadios I-II) pueden eventualmente presentar recaídas. Aunque aproximadamente el 50% de las recaídas en pacientes con lesiones gruesas se presenten en el período de tres años, pueden también ocurrir recaídas tardías en algunos pacientes, incluso con lesiones delgadas, 10 años después del diagnóstico4.
La recomendación sobre cuánto tiempo se debe esperar para un embarazo después de haber tenido un MM debe de ser individualizada para cada caso, y depende primariamente del riesgo de recaída del tumor (espesor y ulceración), edad de la paciente y deseo de quedarse embarazada4. Este tiempo varia de 0 a 5 años. Por ejemplo, una mujer de 40 años con un MM de 0,3mm de espesor tiene un riesgo aproximado de 1-3% de recaída en 5 años, y no se le aconsejaría esperar si ella desea un embarazo y considera el riesgo aceptable. Por otro lado, a una mujer de 21 años con un MM de 4,0mm de grosor se le debería aconsejar esperar 3-5 años (período de mayor probabilidad de recaída).
Cada paciente debe ser abordada individualmente, siendo informada de todos los riesgos para poder tomar una decisión consciente.
Melanoma maligno diagnosticado después del embarazoLos embarazos previos no parecen influir en la supervivencia de mujeres diagnosticadas de MM localizado25. Los pocos estudios disponibles en la literatura57–59 describen la posibilidad de que múltiples embarazos (5 o más) previos al diagnóstico de MM tengan alguna ventaja en la supervivencia.
Uso de contraceptivos orales o terapia de sustitución hormonal y riesgo de desarrollar melanoma malignoLa asociación entre el uso de contraceptivos orales (CO) y riesgo de desarrollar MM ha sido discutida en varios estudios con hallazgos inconsistentes.
En un variado número de estudios epidemiológicos29,60–81 se ha demostrado que el uso de CO no aumenta el riesgo de una mujer para desarrollar MM.
El análisis combinado de Karagas et al29 revisó un conjunto de 10 estudios (total de 5.590 mujeres) y no ha demostrado un riesgo de MM entre usuarias de CO. Entretanto, no hay información específica de si el uso de CO ha aumentado el riesgo de recaída en una mujer con un diagnóstico establecido de MM.
Aunque existan pocos estudios que traten la asociación entre la terapia de sustitución hormonal (TSH) y el MM60,62,65,68,69,72,77,82 no hay evidencias epidemiológicas hasta el momento que demuestren un riesgo aumentado de MM en mujeres con TSH. Para una paciente con un MM delgado, con poca probabilidad de recaída, el uso de CO o TSH no está contraindicado5,83,84.
Con respecto a las evidencias clínicas y experimentales, no hay una relación claramente definida entre hormonas, nevus y MM. La mayoría de las evidencias clínicas están en contra: falta de evidencia firme de cambios fisiológicos significativos en los nevus durante el embarazo, estudios controlados que demuestren que el embarazo no afecta el pronóstico del MM, y estudios epidemiológicos que no muestran efecto de hormonas exógenas (CO y TSH) sobre el riesgo de MM5,88,89. Resulta interesante la identificación del receptor estrogénico beta como el receptor estrogénico predominante en las lesiones melanocíticas7–10, con gran expresión en nevus severamente displásicos y lentigos malignos, comparados con MM gruesos. Se necesitan, sin embargo, más trabajos de investigación en este tema para determinar la importancia de este hallazgo.
ConclusionesAunque durante el embarazo pueden ocurrir cambios leves en el diámetro y estructuras dermatoscópicas de los nevus (sobre todo en áreas sujetas a un mayor estiramiento de la piel, como la superficie anterior del tronco), con retorno a la normalidad en el período posparto, cualquier alteración sospechosa de trasformación a MM (como retículo pigmentado atípico, velo azul-blanquecino, patrón vascular atípico, etc.) debe ser biopsiada inmediatamente, al igual que en una paciente no embarazada.
Las pacientes con SND tienen un índice clínico más elevado de cambios de los nevus durante el embarazo comparado con mujeres con SND no embarazadas.
Son necesarios estudios prospectivos adicionales sobre los cambios de los nevus durante el embarazo, preferiblemente con examen clínico, fotografías e imágenes de dermatoscopia digital.
Basados en un número limitado de estudios bien controlados publicados sobre el tema, el pronóstico de un MM diagnosticado antes, durante o después del embarazo no se modifica. No se ha demostrado una diferencia significativa en las tasas de supervivencia a los 5 años entre pacientes embarazadas y no embarazadas, y por ello no está indicado el aborto terapéutico para aumentar la supervivencia.
El pronóstico para el feto en una mujer embarazada con MM depende del estadio de la enfermedad materna. Las metástasis en el feto son raras, y pueden ocurrir solamente en mujeres con enfermedad ampliamente diseminada. Cuando hay afectación de la placenta esto no siempre implica metástasis en el feto, estimándose que sólo el 25% de los fetos están afectados cuando la placenta lo está.
El tratamiento de una mujer embarazada con MM “delgado” es igual al de la paciente no embarazada, y consiste en extirpación amplia con anestesia local y seguimiento clínico estricto. Sin embargo, si la paciente embarazada es candidata a BSGC y/o técnicas de imagen para estadiar la enfermedad y para la búsqueda de metástasis a distancia, la conducta varía enormemente de un centro médico a otro y las decisiones deben tomarse de modo individualizado.
La recomendación sobre cuánto tiempo hay que esperar para un embarazo después de un MM debe ser individualizada en cada caso, y depende primariamente del riesgo de recaída del tumor (espesor, ulceración, afectación del ganglio centinela), edad de la paciente y deseo de quedarse embarazada. No hay respuesta única y las pacientes deben ser bien orientadas sobre los riesgos de su enfermedad para tomar decisiones conscientes. En mujeres diagnosticadas con MM de alto riesgo, con mayor probabilidad de recaída, es aconsejable esperar como mínimo 3-5 años.
El uso de CO no aumenta el riesgo de una mujer para desarrollar MM. No hay información específica de si el uso de CO aumenta el riesgo de recaída en una mujer con un diagnóstico establecido de MM.
Aunque existan pocos estudios que traten el tema, la TSH no parece aumentar el riesgo de una paciente de desarrollar un MM, pero no se sabe si hay algún efecto sobre el riesgo de recaída de un MM ya diagnosticado. Para una paciente con un MM delgado, con poca probabilidad de recaída, el uso de CO o TSH no está contraindicado si no existen alternativas razonables.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.