La pitiriasis rubra pilaris (PRP) es una entidad rara de etiopatogenia desconocida. La falta de guías clínicas la convierte en un desafío para los clínicos.
ObjetivoContribuir con nuestra experiencia a aumentar la evidencia disponible sobre esta entidad.
MétodoRealizamos un estudio retrospectivo, descriptivo y multicéntrico de 65 pacientes con PRP, siendo la serie de casos europea más grande de pacientes con PRP.
ResultadosLa PRP fue más frecuente en los varones con una edad promedio de 51 años, pero las formas eritrodérmicas se presentaron en pacientes de mayor edad, en torno a los 61 años.
Seis (75%) de los pacientes pediátricos y 10 (60%) de los adultos no eritrodérmicos controlaron su enfermedad con corticoides tópicos. Por el contrario, 26 (68%) de los pacientes eritrodérmicos necesitaron terapia biológica como última línea terapéutica eficaz; requiriendo un promedio de 6,5 meses para lograr una respuesta completa.
ConclusiónNuestro estudio mostró una diferencia estadística en términos de resultado y respuesta al tratamiento entre niños o pacientes con enfermedad limitada y pacientes que desarrollan eritrodermia.
PRP is a rare entity of unknown etiopathogenesis. Lack of management guidelines makes it a challenge for clinicians.
ObjectiveTo add our experience to increase evidence about PRP.
MethodsWe performed a retrospective, descriptive and multicentric study of 65 patients with PRP, being the largest European case series of patients with PRP.
ResultsPRP was more frequent in male patients with an average age of 51 years, but erythrodermic forms presented in older patients (average age 61 years).
Six (75%) paediatric patients and ten (60%) non-erythrodermic adults controlled their disease with topical corticosteroids. On the contrary, 26 (68%) erythrodermic patients required biologic therapy as last and effective therapy line requiring an average of 6.5 months to achieve complete response.
ConclusionOur study showed a statistical difference in terms of outcome and response to treatment between children or patients with limited disease and patients who develop erythroderma.
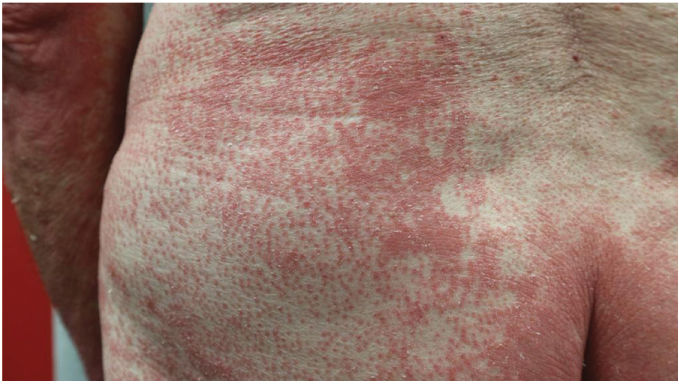
La pitiriasis rubra pilaris (PRP) es una enfermedad inflamatoria poco frecuente, la cual se considera tradicionalmente como una dermatosis reactiva.1–3 Por edad se presentará con una distribución bimodal tanto en la primera como en la quinta décadas de la vida, y con una frecuencia similar entre ambos sexos. Clínicamente se caracterizará por pápulas y placas foliculares hiperqueratósicas de color salmón. Algunos pacientes desarrollarán una eritrodermia con la presencia de islotes de piel no afectada.1,2
El diagnóstico requiere de una buena correlación clinicopatológica. La principal característica histopatológica es la alternancia de ortoqueratosis y paraqueratosis, conocida como “patrón en tablero de ajedrez”. Las opciones de tratamiento incluyen diversos fármacos, como los corticosteroides tópicos, los retinoides orales, los tratamientos inmunosupresores y los agentes biológicos.2,4–6 Se cree que la PRP comparte el mismo perfil de las citocinas presentes en la psoriasis.7
No existen directrices del tratamiento y las evidencias científicas actuales se limitan a informes y series de casos. En consecuencia, el tratamiento de la PRP representa un reto.
ObjetivoDescribir las características clinicopatológicas y demográficas de los pacientes con PRP y analizar las diversas modalidades de tratamiento.
MétodosSe realizó un estudio observacional retrospectivo multicéntrico en ocho hospitales españoles donde se incluyeron pacientes con diagnóstico clinicopatológico de PRP, tratados durante 20 años (entre enero de 2002 y febrero de 2022). Las variables fueron recogidas por cada centro en una base de datos anónima. En la muestra pediátrica se incluyeron aquellos pacientes menores de 16 años. Se utilizó el área de superficie corporal (ASC) para evaluar la respuesta al tratamiento y se consideró como respuesta completa al ASC <3%. Se realizó un análisis estadístico descriptivo, utilizando la media y la desviación estándar (DE) para las variables cuantitativas y frecuencias absolutas y relativas para las variables cualitativas. Los contrastes de hipótesis en las variables cualitativas se realizaron mediante el test del Chi-cuadrado o el test exacto de Fisher y para las variables cuantitativas mediante el test de la T de Student. Un valor p <0,05 se consideró estadísticamente significativo. Todos los análisis se realizaron con el programa estadístico Stata® (StataCorp, College Station, Texas) versión 16 para Windows. El estudio se realizó siguiendo la Declaración de Helsinki y fue aprobado por el Comité de Ética Médica del Hospital 12 de Octubre (n°: 22/233).
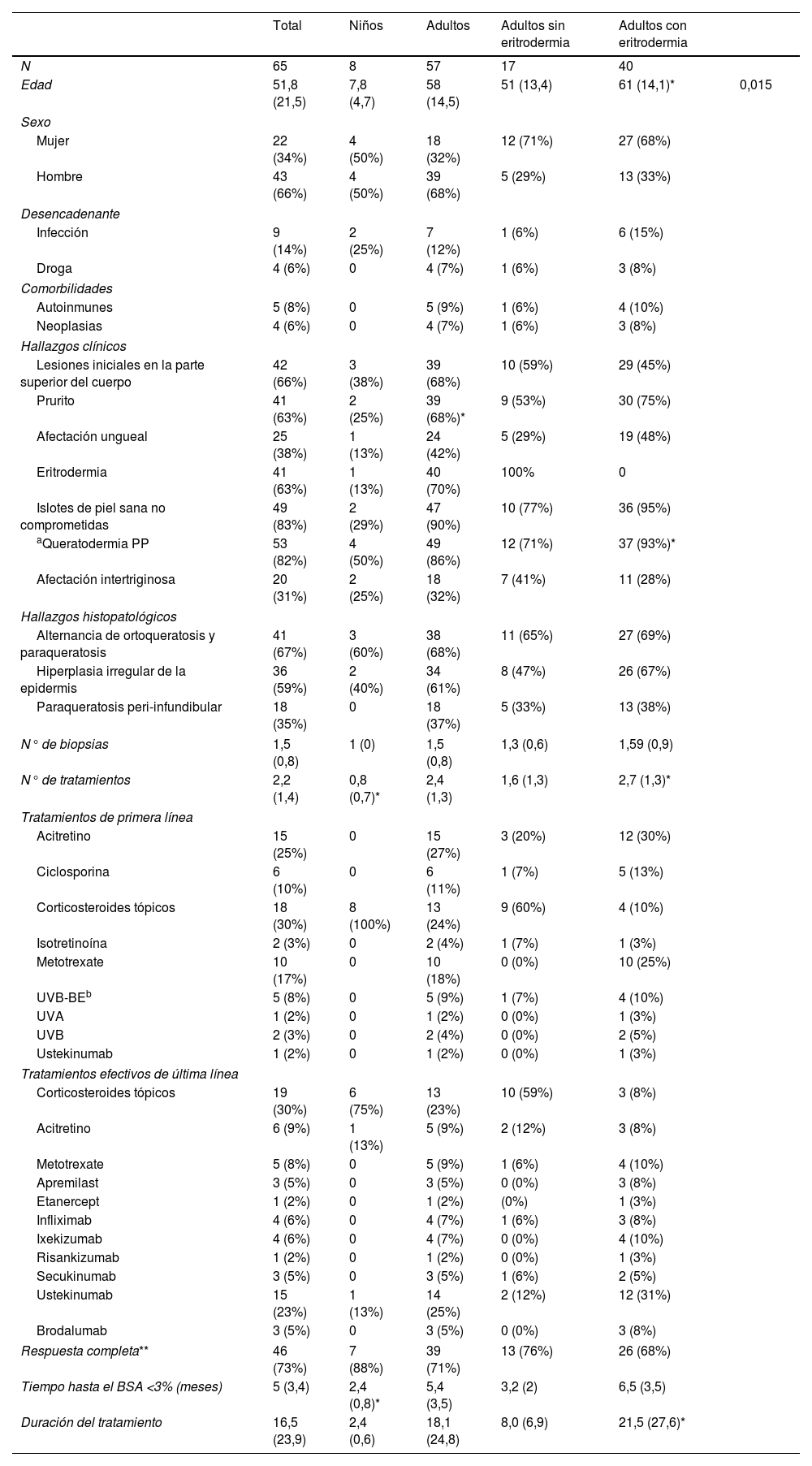
ResultadosLos resultados epidemiológicos, clínicos, histopatológicos y terapéuticos se pueden consultar en la tabla 1.
Características detalladas de los pacientes
| Total | Niños | Adultos | Adultos sin eritrodermia | Adultos con eritrodermia | ||
|---|---|---|---|---|---|---|
| N | 65 | 8 | 57 | 17 | 40 | |
| Edad | 51,8 (21,5) | 7,8 (4,7) | 58 (14,5) | 51 (13,4) | 61 (14,1)* | 0,015 |
| Sexo | ||||||
| Mujer | 22 (34%) | 4 (50%) | 18 (32%) | 12 (71%) | 27 (68%) | |
| Hombre | 43 (66%) | 4 (50%) | 39 (68%) | 5 (29%) | 13 (33%) | |
| Desencadenante | ||||||
| Infección | 9 (14%) | 2 (25%) | 7 (12%) | 1 (6%) | 6 (15%) | |
| Droga | 4 (6%) | 0 | 4 (7%) | 1 (6%) | 3 (8%) | |
| Comorbilidades | ||||||
| Autoinmunes | 5 (8%) | 0 | 5 (9%) | 1 (6%) | 4 (10%) | |
| Neoplasias | 4 (6%) | 0 | 4 (7%) | 1 (6%) | 3 (8%) | |
| Hallazgos clínicos | ||||||
| Lesiones iniciales en la parte superior del cuerpo | 42 (66%) | 3 (38%) | 39 (68%) | 10 (59%) | 29 (45%) | |
| Prurito | 41 (63%) | 2 (25%) | 39 (68%)* | 9 (53%) | 30 (75%) | |
| Afectación ungueal | 25 (38%) | 1 (13%) | 24 (42%) | 5 (29%) | 19 (48%) | |
| Eritrodermia | 41 (63%) | 1 (13%) | 40 (70%) | 100% | 0 | |
| Islotes de piel sana no comprometidas | 49 (83%) | 2 (29%) | 47 (90%) | 10 (77%) | 36 (95%) | |
| aQueratodermia PP | 53 (82%) | 4 (50%) | 49 (86%) | 12 (71%) | 37 (93%)* | |
| Afectación intertriginosa | 20 (31%) | 2 (25%) | 18 (32%) | 7 (41%) | 11 (28%) | |
| Hallazgos histopatológicos | ||||||
| Alternancia de ortoqueratosis y paraqueratosis | 41 (67%) | 3 (60%) | 38 (68%) | 11 (65%) | 27 (69%) | |
| Hiperplasia irregular de la epidermis | 36 (59%) | 2 (40%) | 34 (61%) | 8 (47%) | 26 (67%) | |
| Paraqueratosis peri-infundibular | 18 (35%) | 0 | 18 (37%) | 5 (33%) | 13 (38%) | |
| N° de biopsias | 1,5 (0,8) | 1 (0) | 1,5 (0,8) | 1,3 (0,6) | 1,59 (0,9) | |
| N° de tratamientos | 2,2 (1,4) | 0,8 (0,7)* | 2,4 (1,3) | 1,6 (1,3) | 2,7 (1,3)* | |
| Tratamientos de primera línea | ||||||
| Acitretino | 15 (25%) | 0 | 15 (27%) | 3 (20%) | 12 (30%) | |
| Ciclosporina | 6 (10%) | 0 | 6 (11%) | 1 (7%) | 5 (13%) | |
| Corticosteroides tópicos | 18 (30%) | 8 (100%) | 13 (24%) | 9 (60%) | 4 (10%) | |
| Isotretinoína | 2 (3%) | 0 | 2 (4%) | 1 (7%) | 1 (3%) | |
| Metotrexate | 10 (17%) | 0 | 10 (18%) | 0 (0%) | 10 (25%) | |
| UVB-BEb | 5 (8%) | 0 | 5 (9%) | 1 (7%) | 4 (10%) | |
| UVA | 1 (2%) | 0 | 1 (2%) | 0 (0%) | 1 (3%) | |
| UVB | 2 (3%) | 0 | 2 (4%) | 0 (0%) | 2 (5%) | |
| Ustekinumab | 1 (2%) | 0 | 1 (2%) | 0 (0%) | 1 (3%) | |
| Tratamientos efectivos de última línea | ||||||
| Corticosteroides tópicos | 19 (30%) | 6 (75%) | 13 (23%) | 10 (59%) | 3 (8%) | |
| Acitretino | 6 (9%) | 1 (13%) | 5 (9%) | 2 (12%) | 3 (8%) | |
| Metotrexate | 5 (8%) | 0 | 5 (9%) | 1 (6%) | 4 (10%) | |
| Apremilast | 3 (5%) | 0 | 3 (5%) | 0 (0%) | 3 (8%) | |
| Etanercept | 1 (2%) | 0 | 1 (2%) | (0%) | 1 (3%) | |
| Infliximab | 4 (6%) | 0 | 4 (7%) | 1 (6%) | 3 (8%) | |
| Ixekizumab | 4 (6%) | 0 | 4 (7%) | 0 (0%) | 4 (10%) | |
| Risankizumab | 1 (2%) | 0 | 1 (2%) | 0 (0%) | 1 (3%) | |
| Secukinumab | 3 (5%) | 0 | 3 (5%) | 1 (6%) | 2 (5%) | |
| Ustekinumab | 15 (23%) | 1 (13%) | 14 (25%) | 2 (12%) | 12 (31%) | |
| Brodalumab | 3 (5%) | 0 | 3 (5%) | 0 (0%) | 3 (8%) | |
| Respuesta completa** | 46 (73%) | 7 (88%) | 39 (71%) | 13 (76%) | 26 (68%) | |
| Tiempo hasta el BSA <3% (meses) | 5 (3,4) | 2,4 (0,8)* | 5,4 (3,5) | 3,2 (2) | 6,5 (3,5) | |
| Duración del tratamiento | 16,5 (23,9) | 2,4 (0,6) | 18,1 (24,8) | 8,0 (6,9) | 21,5 (27,6)* | |
Se incluyó a un total de 65 pacientes. En el momento de la inclusión, ocho niños tenían una edad media de 7,8 años y cuatro (50%) eran mujeres.
Treinta y nueve pacientes varones representaban el 68% de la muestra adulta y 40 de ellos (70%) desarrollaron eritrodermia, mientras que sólo un niño la desarrolló. La edad media fue mayor en los adultos eritrodérmicos (61 años) que en los no eritrodérmicos (51 años, valor p=0,015).
Factores desencadenantes y comorbilidadesTrece pacientes (20%) señalaron un posible desencadenante: infección previa en siete (12%) adultos y dos (25%) niños; y fármacos en cuatro (7%) adultos.
En los niños, todas las infecciones fueron de las vías respiratorias superiores. Entre los pacientes adultos no recogimos datos específicos de agentes microbiológicos.
Cuatro (7%) de nuestros pacientes adultos tenían neoplasias concomitantes y cinco (9%) comorbilidades autoinmunes.
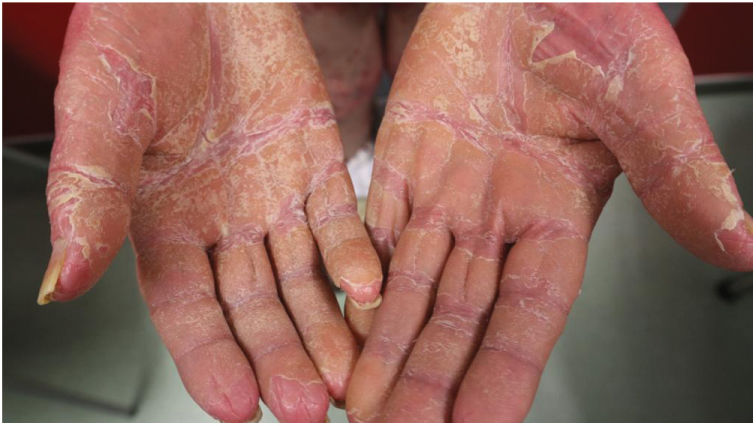
Hallazgos clínicosLas características clínicas más frecuentes fueron la presencia de islotes de piel sana (n=49, 83%) y la queratodermia palmoplantar (PP) (n=53, 85%), que también fueron los hallazgos clínicos más frecuentes en los pacientes eritrodérmicos (figs. 1 y 2). La diferencia fue estadísticamente significativa en el caso de la queratodermia PP (p-valor 0,029). Sin embargo, los niños sólo presentaron en dos (29%) y cuatro (50%) de los casos la presencia de islotes de piel sana y queratodermia PP, respectivamente.
Cuarenta y uno (63%) de los pacientes refirieron prurito, de los cuales sólo dos (25%) eran niños, mientras que 39 (68%) eran adultos (p-valor 0,017).
Otras características clínicas se detallan en la tabla 1.
HistologíaLos hallazgos histológicos más frecuentes fueron la presencia de una alternancia entre la ortoqueratosis y la paraqueratosis (n=41, 67%) y la hiperplasia epidérmica irregular (n=36, 59%).
TratamientoLa duración media del tratamiento fue de 2,4 meses en niños, 8 meses en adultos no eritrodérmicos y 21,4 meses en adultos eritrodérmicos. El tiempo transcurrido hasta un BSA <3% fue más corto y el número de tratamientos menor en los niños y en los adultos no eritrodérmicos que en sus homólogos (tabla 1).
Todos los niños fueron tratados inicialmente con corticosteroides tópicos. Sólo uno de ellos precisó acitretino. Uno de los niños desarrolló una eritrodermia y necesitó ustekinumab para controlar la enfermedad. Se consiguió una respuesta completa (RC) en siete (88%) de los niños.
Los adultos no eritrodérmicos (n=17, 30%) fueron tratados con éxito con terapia tópica en nueve (60%) pacientes. Seis fueron tratados con agentes sistémicos (acitretino en tres y fototerapia en un paciente). Sólo cinco pacientes necesitaron un agente biológico. Se consiguió una RC en 13 (76%) de los adultos no eritrodérmicos.
Por otro lado, 29 (71%) pacientes eritrodérmicos fueron tratados inicialmente con agentes sistémicos como acitretino en doce (30%) de los casos o metotrexato en diez (25%) de los pacientes, fototerapia en siete (18%) y un paciente comenzó con ustekinumab. El último tratamiento que fue eficaz incluye una gran variedad de fármacos (tabla 1) y se consiguió una respuesta completa en 26 (68%) de los pacientes. El uso de la terapia biológica en algún momento de la enfermedad fue necesaria en 31 (68%) de los pacientes, siendo el ustekinumab el tratamiento biológico utilizado con mayor frecuencia.
LimitacionesNuestro estudio tiene varias limitaciones. En primer lugar, nuestros datos se recogieron de forma retrospectiva con un tamaño de muestra relativamente pequeño. Además, no existen criterios diagnósticos estandarizados de PRP ni escalas de gravedad para evaluar la respuesta al tratamiento. Por último, la disponibilidad de nuevas terapias biológicas a lo largo de la última década puede haber ejercido cierta influencia en los resultados terapéuticos de los pacientes diagnosticados en los últimos años.
DiscusiónEste estudio presenta de manera detallada datos demográficos, clinicopatológicos y terapéuticos de 65 pacientes diagnosticados de PRP. Hasta donde sabemos, se trata de la mayor serie europea de casos de pacientes con PRP.
Nuestro estudio demostró predominio en pacientes adultos de sexo masculino (n=39, 68%), lo que difiere de los datos de la literatura que mantienen una distribución equitativa por sexos.1–4 La distribución bimodal fue coherente con la literatura,1–4 pero llamativamente los pacientes adultos que presentaban eritrodermia tenían una media de 10 años más (valor p <0,05).
En diversos informes de casos publicados se afirma que existe una posible causalidad entre neoplasias malignas o trastornos autoinmunitarios y la PRP.1,7 Sin embargo, nuestros pacientes adultos mostraron una baja frecuencia de comorbilidades autoinmunitarias (9%) y neoplasias malignas (6%), lo que sugiere que su frecuencia puede no diferir de la población general y que los procedimientos de cribado deben guiarse por la historia clínica y la exploración física.
Habitualmente se han descrito agentes infecciosos y farmacológicos como desencadenantes de la PRP.1,2 Curiosamente, el 25% de los niños de nuestro estudio refirieron el antecedente de un desencadenante infeccioso, pero sólo en el 6% de los adultos eritrodérmicos se demostró la presencia de un fármaco que fuese responsable. Esto apoya la idea de que la PRP es una enfermedad multifactorial, en la que los factores ambientales desempeñan un papel, pero no son necesarios para el desarrollo de la enfermedad.
La característica histológica más frecuente fue la alternancia entre la ortoqueratosis y la paraqueratosis, lo que coincide con los datos presentados en la literatura. Sin embargo, la histología puede ser inespecífica y a menudo el diagnóstico se guía predominantemente por los rasgos clínicos característicos.1–4 El 66% de nuestros pacientes presentaron inicialmente lesiones en la parte superior del cuerpo, lo que concuerda con la progresión cefalocaudal descrita clásicamente.1–4 Curiosamente, el 94% de nuestros pacientes eritrodérmicos presentaron queratodermia PP (valor p 0,02).
Fouarge et al.,8 ya propusieron la queratodermia PP como posible factor de resistencia a un antagonista de IL-23/p19. En nuestra opinión, puede ser un marcador de progresión y podría ayudar a identificar a los pacientes con mayor riesgo de desarrollar formas eritrodérmicas de PRP.
El 75% de los pacientes pediátricos y el 60% de los adultos no eritrodérmicos controlaron su enfermedad con corticosteroides tópicos. La buena respuesta a la terapia tópica ya se describió en la PRP pediátrica,9 pero suponemos que es extensible a los adultos con enfermedad localizada. Sin embargo, la mayoría de los pacientes eritrodérmicos (68%) requirieron terapia biológica como última línea terapéutica eficaz. Entre ellos, el 68% alcanzó respuesta completa, pero tras una media de 6,5 meses de tratamiento. Además, estos suelen recibir más líneas de tratamiento (media de 2,7) que los pacientes con lesiones localizadas y pueden beneficiarse de un abordaje más invasivo y precoz.
ConclusiónEn conclusión, en nuestro estudio se evidenció que la PRP puede ser más frecuente en hombres y que las formas eritrodérmicas podrían aparecer en pacientes de edad avanzada. No hubo una asociación clara con el cáncer o las enfermedades autoinmunes en nuestros pacientes. La queratodermia PP puede ser un marcador de progresión a la eritrodermia. En nuestra muestra los niños y los adultos que presentaban una enfermedad localizada respondieron a los corticosteroides tópicos. Por el contrario, los pacientes eritrodérmicos recibieron múltiples líneas terapéuticas, además de necesitar una media de tratamiento de 6,5 meses y un agente biológico para poder controlar su enfermedad. Se necesitan más estudios para investigar esta difícil enfermedad.
Consentimiento Informado de los pacientesLos pacientes de este manuscrito han dado su consentimiento informado por escrito para la publicación de los detalles de sus casos.
FinanciaciónNo se declara ninguna.
Conflictos de intereses- -
El Dr. Ruiz Genao ha sido remunerado por Almirall, Pfizer, Janssen, Amgen, Abbvie, Lilly, UCB, Novartis y Leo-Pharma por servicios de asesoramiento y conferencias.
- -
L. Puig ha recibido honorarios como consultor/ponente y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Biogen, Boehringer Ingelheim, Bristol Myers Squibb, Janssen, Leo-Pharma, Lilly, Novartis, Pfizer, Sandoz, Sanofi y UCB.
Los autores confirman que el manuscrito se ha presentado exclusivamente a esta revista y no está presentado, en prensa o publicado en ningún otro idioma. Cada autor ha participado lo suficiente en el trabajo como para asumir la responsabilidad pública del contenido.