El dermatofibrosarcoma protuberans (DFSP) es un tumor fibrohistiocítico, de crecimiento lento, de malignidad intermedia que presenta una alta tasa de recidivas locales pero muy baja capacidad metastásica. Las formas congénitas han sido raramente descritas, probablemente debido a que las lesiones iniciales pueden pasar inadvertidas o confundirse con otras entidades. Existe evidencia de que tras la cirugía micrográfica de Mohs las tasas de recidivas son menores que cuando se realiza cirugía con márgenes amplios1. Sin embargo, en 3 series pediátricas publicadas recientemente la escisión amplia convencional fue la técnica utilizada en la mayoría (41/43) de los pacientes2–4. Presentamos un caso congénito de fibroblastoma de células gigantes, que es un subtipo histológico de DFSP, diagnosticado y tratado a los 8 años. Se señalan las ventajas de la cirugía micrográfica de Mohs y la utilidad en la infancia de los sistemas de vacío mediante presión negativa.
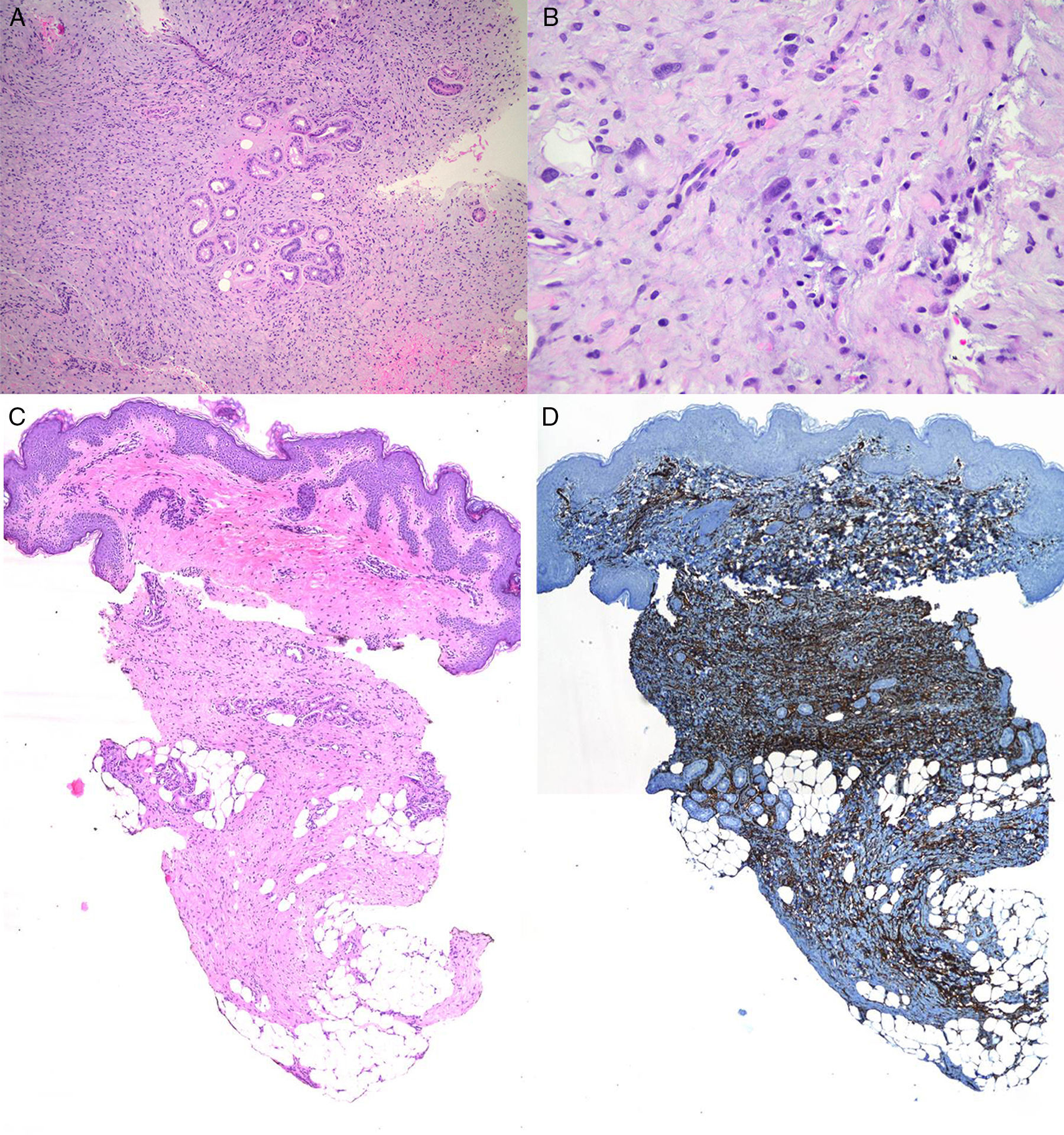
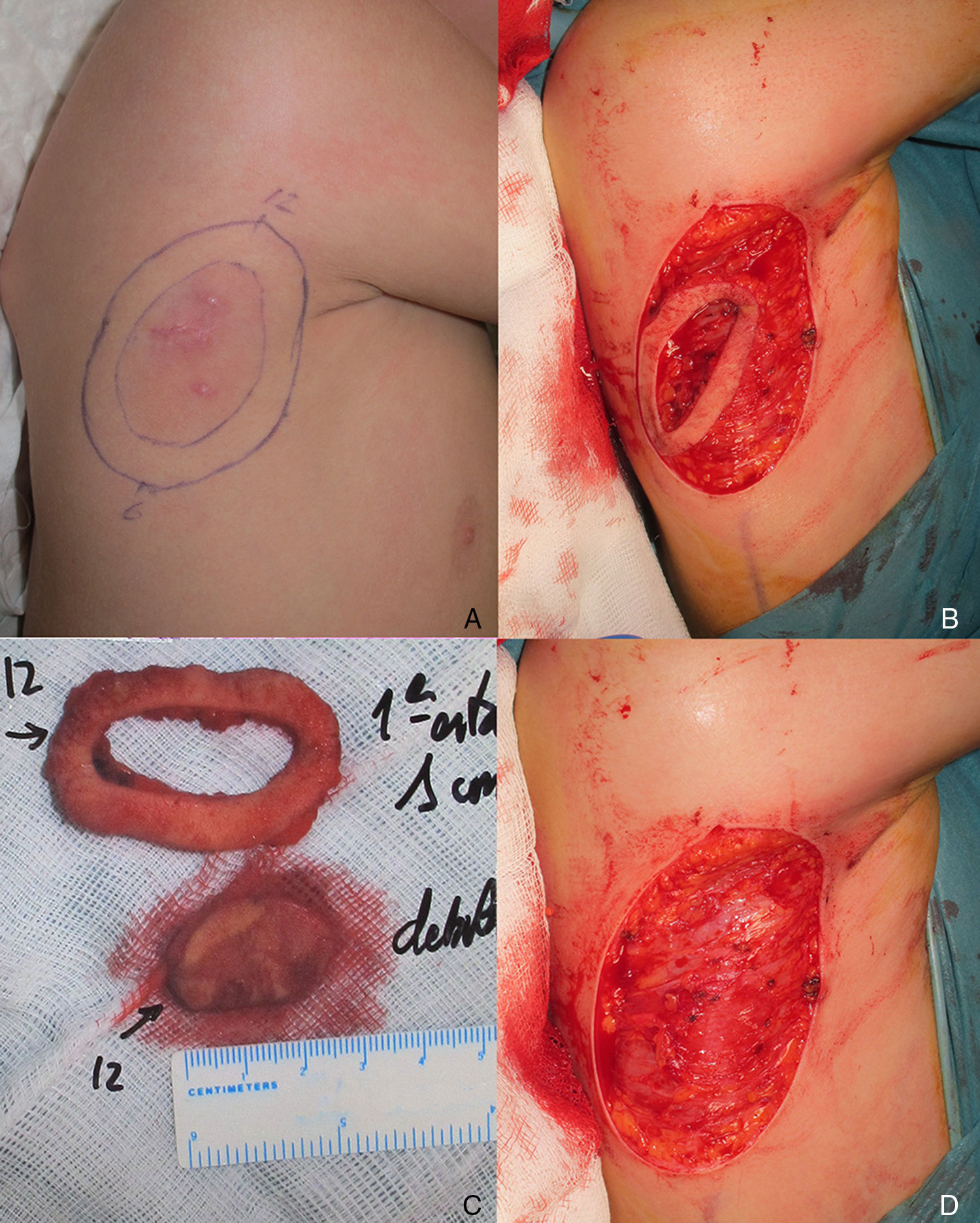
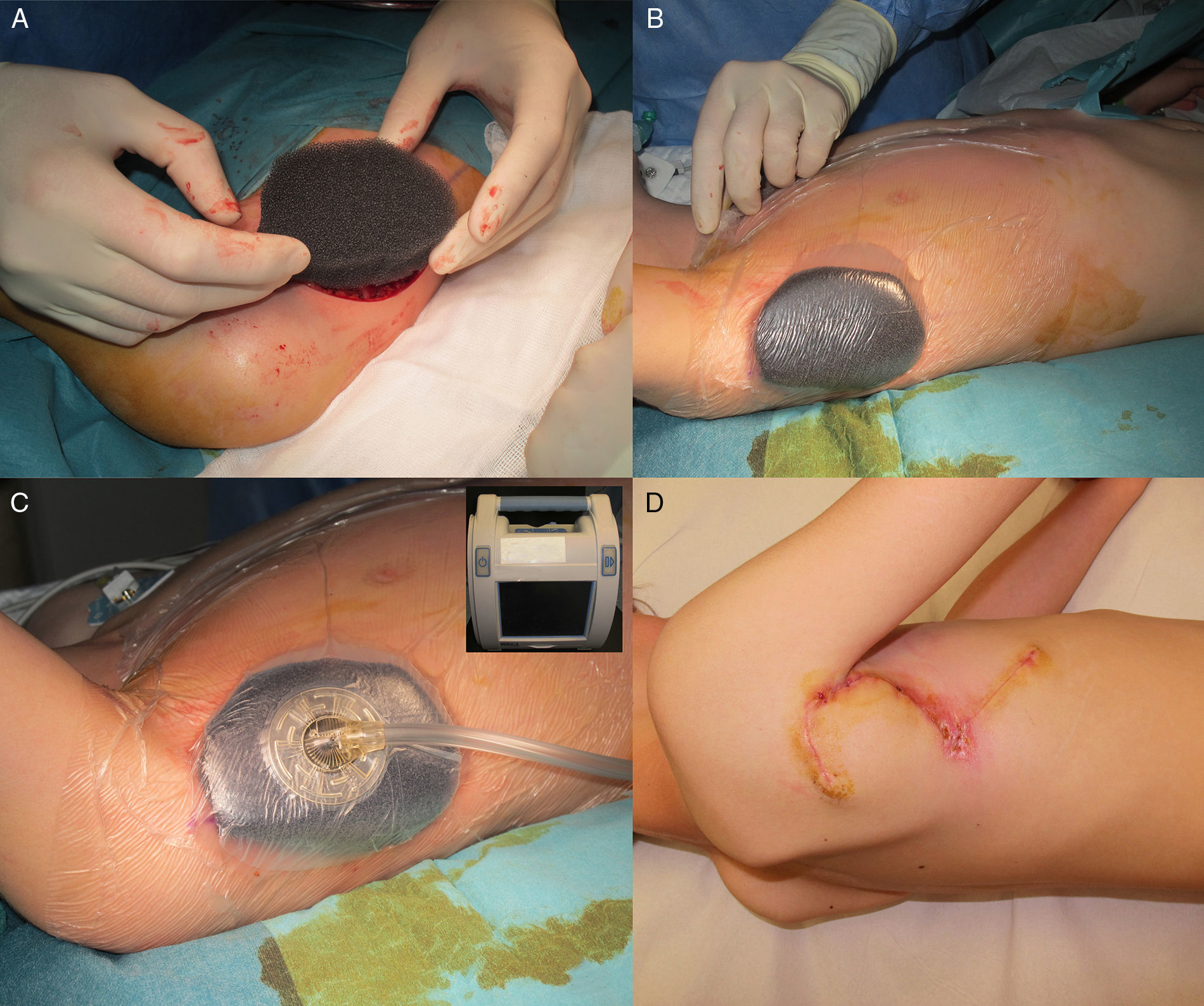
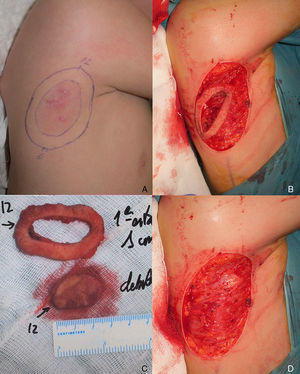
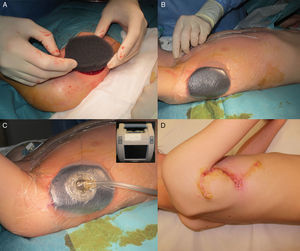
Varón de 8 años, sin antecedentes de interés, que consultó por crecimiento e induración progresiva de una lesión congénita, inicialmente rojiza y plana, en la axila derecha. A la exploración se evidenció una placa infiltrada y móvil de 4×2,5cm, de color rosado, con una zona algo sobreelevada de color violáceo; no se palpaban adenopatías locorregionales. Se realizó una biopsia que mostró una lesión tumoral mal delimitada que ocupaba prácticamente toda la dermis y que se extendía hacia el tejido celular subcutáneo, constituida por células fusiformes y ovales. Se observaban espacios pseudovasculares delimitados por células gigantes multinucleadas. Las células fusiformes expresaban el marcador CD34 y eran negativas para la proteína-S100 y SMA (fig. 1). Con el diagnóstico de fibroblastoma de células gigantes se solicitó una resonancia magnética, que descartó invasión extracutánea y se procedió a extirpar la lesión bajo anestesia general. Se eligió la variante en diferido de la cirugía de Mohs utilizando la técnica de Breuninger, con márgenes de 1cm en el primer estadio (fig. 2). Esta técnica consiste en la extirpación en bloque de la tumoración con un ángulo de 90° respecto a la superficie, llegando hasta la fascia muscular en nuestro caso, y consiguiendo un fondo uniforme. La pieza se fija en formol y se procesa en parafina. La lectura de las laminillas histológicas del fondo y del borde periférico es diferida en el tiempo, por lo que se optó por la cobertura del defecto quirúrgico con un sistema de vacío con presión negativa continua de 125 mmHg (Kinetic Concepts Inc., Wiesbaden, Alemania) (figs. 3 A-C). A los 9 días, habiendo comprobado histológicamente los márgenes libres de tumor, se procedió a la reconstrucción del defecto quirúrgico mediante un colgajo tipo Limberg sobre el tejido de granulación formado por el sistema de vacío, sin requerir ningún tipo de preparación previa (fig. 3D). Tras 4 años de seguimiento no se ha observado recidiva.
A. Proliferación de células fusiformes organizadas en fascículos (hematoxilina-eosina×100). B. Espacios pseudovasculares irregulares delineados por células gigantes multinucleadas (hematoxilina-eosina×100) C. Ocupación de la dermis con extensión al tejido celular subcutáneo (hematoxilina-eosina×20) D. Las células fusiformes expresan el marcador CD34 (×20).
El DFSP es un tumor muy infrecuente en la edad pediátrica, con una incidencia estimada de uno por 1.000.000 habitantes menores de 20 años al año5, que puede estar subestimada debido a que la demora en su diagnóstico es de 5 a 15 años. Las formas congénitas son aún más raras; en una serie de 152 casos de DFSP en la infancia solo 20 eran congénitos6.
Las características inmunohistoquímicas, la traslocación entre los cromosomas 17 y 22, y su asociación con el producto de fusión COL1A1-PDGFB en los DFSP congénitos son similares a las del DFSP del adulto. En cuanto a la clínica es más habitual que el DFSP congénito se presente como una mancha o una placa atrófica que como un tumor. El diagnóstico diferencial es amplio e incluye anomalías vasculares, aplasia cutis, atrofodermia, miofibromatosis, fibromatosis infantil o fibrosarcomas.
Cuando se comparan las series de DFSP en niños frente a las de adultos destaca una mayor frecuencia de localización de las lesiones en las extremidades inferiores y en las zonas acras, una menor incidencia de recurrencias tumorales, la excepcional aparición de metástasis y el poco uso de la cirugía micrográfica de Mohs en la edad pediátrica6.
El tratamiento del DFSP es quirúrgico7, reservándose el imatinib8 o la radioterapia para tumores recurrentes, irresecables o metastásicos. Serra-Guillen et al.1 revisando la literatura y los resultados de su propia serie de 74 pacientes, la mayoría adultos, concluyen que las recidivas tras la cirugía micrográfica de Mohs son muy inferiores a las encontradas cuando se emplea cirugía con márgenes amplios, y además se consigue una mayor preservación de tejido sano. La variante de cirugía de Mohs en diferido, cubriendo el defecto con un material biosintético de piel artificial u otros apósitos, es la técnica más utilizada. Como alternativa a los sustitutos dérmicos para la cobertura transitoria del defecto se ha propuesto la utilización de un sistema de vacío mediante presión negativa9. Este sistema reduce el número de curas, el dolor, la necesidad de analgesia y sedaciones y a la vez, en nuestro caso, permitió la deambulación y la movilidad de la extremidad superior. Existen sistemas de vacío portátiles que no requieren ingreso hospitalario, pero debido a la distribución geográfica de nuestra comunidad insular no fue posible utilizarlos.
En 2014 se publicaron 3 series de DFSP en la edad pediátrica procedentes de hospitales de Taiwán2, Canadá3 y España4, que incluían respectivamente 13, 17 y 13 sujetos menores de 18 años. Sorprendentemente solo en 2/43 pacientes se realizó cirugía micrográfica de Mohs. Si esta técnica quirúrgica es la que consigue mejores resultados terapéuticos, funcionales y estéticos, ¿por qué la cirugía micrográfica de Mohs está infrautilizada en el DFSP infantil? Reiteramos la importancia de una estrecha colaboración multidisciplinar para lograr que los niños con DFSP sean diagnosticados y tratados correctamente.