La psoriasis es un proceso inflamatorio crónico y sistémico con múltiples comorbilidades. Entre las más frecuentes se encuentran las enfermedades mentales y en especial la depresión, con la que interrelacionan negativamente llegando a producir un peligroso círculo vicioso. Clásicamente se ha explicado la depresión de los pacientes con psoriasis como reactiva a factores psicosociales y el deterioro en la calidad de vida. Sin embargo, la asociación de estas dos patologías a través del proceso inflamatorio crónico ofrece una nueva hipótesis para su comprensión y tratamiento. Este enfoque incide en nuevos fármacos y la importancia del estilo de vida.
Psoriasis is a chronic, systemic inflammatory disorder with multiple comorbidities.
The most common comorbidities are mental disorders, especially depression, which can interact negatively with psoriasis to produce a dangerous vicious circle. Depression in psoriasis has traditionally been explained as a response to psychosocial factors and impaired quality of life.
However, a new hypothesis linking depression and psoriasis through chronic inflammation offers insights that should help to understand and treat these diseases. In this approach, new drugs and lifestyle have an important role.
La psoriasis es una enfermedad inflamatoria crónica que afecta al 2-3% de la población. Produce un gran impacto físico y psicosocial, deteriorando la calidad de vida de los pacientes1. Aunque tradicionalmente se ha considerado una enfermedad cutánea, hay numerosas evidencias de su implicación sistémica, con la afectación concomitante de otros órganos y sistemas. En este contexto la psoriasis presenta una alta prevalencia de comorbilidades asociadas, como la artritis psoriásica, el síndrome metabólico, la patología cardiovascular, el hígado graso no alcohólico, la enfermedad inflamatoria intestinal, el tabaquismo, el abuso de alcohol y enfermedades psiquiátricas, entre las que predominan la ansiedad y la depresión. Si estas patologías se presentan, es importante abordarlas y tratarlas precozmente, ya que su combinación puede producir una compleja interrelación negativa2. Por ello, el dermatólogo desempeña un papel crucial en el manejo integral e interdisciplinar de esta enfermedad3,4.
Asociación entre psoriasis y depresiónLa psoriasis se asocia a varias enfermedades mentales y en especial a la ansiedad y la depresión5. Los pacientes con psoriasis presentan ansiedad en una media del 43% de los casos6.
La comorbilidad con la depresión se estima que puede llegar a prevalencias de entre el 20-30% y según algunos trabajos hasta del 62%7,8. Estos índices son superiores1,5 a los de la población general o con otras enfermedades de la piel9, y la prevalencia se incrementa en los casos de psoriasis más severa8,10,11. Kurd et al. confirman estos datos y encuentran, en una larga serie de pacientes con psoriasis, altas prevalencias de depresión, ansiedad e ideación suicida (39, 31 y 44%, respectivamente), que se incrementan en los casos más graves de la enfermedad dermatológica12.
De forma inversa, la depresión que padecen los pacientes con psoriasis es más grave que en la población general y se asocia con mayor frecuencia a ansiedad e ideación suicida (entre el 2,5 y el 9,7%, respectivamente)13.
Factores que contribuyen a la depresión en los pacientes con psoriasisLa vinculación entre la piel y la psique es diversa. El sistema nervioso y la piel tienen un origen embriológico común. La piel es la envoltura del cuerpo que nos da identidad. Nos contiene y nos protege. Es un órgano esencial en la interacción con el entorno. A través de ella somos percibidos y percibimos el mundo. Nos ayuda a comunicarnos con los demás, expresando nuestros sentimientos y emociones.
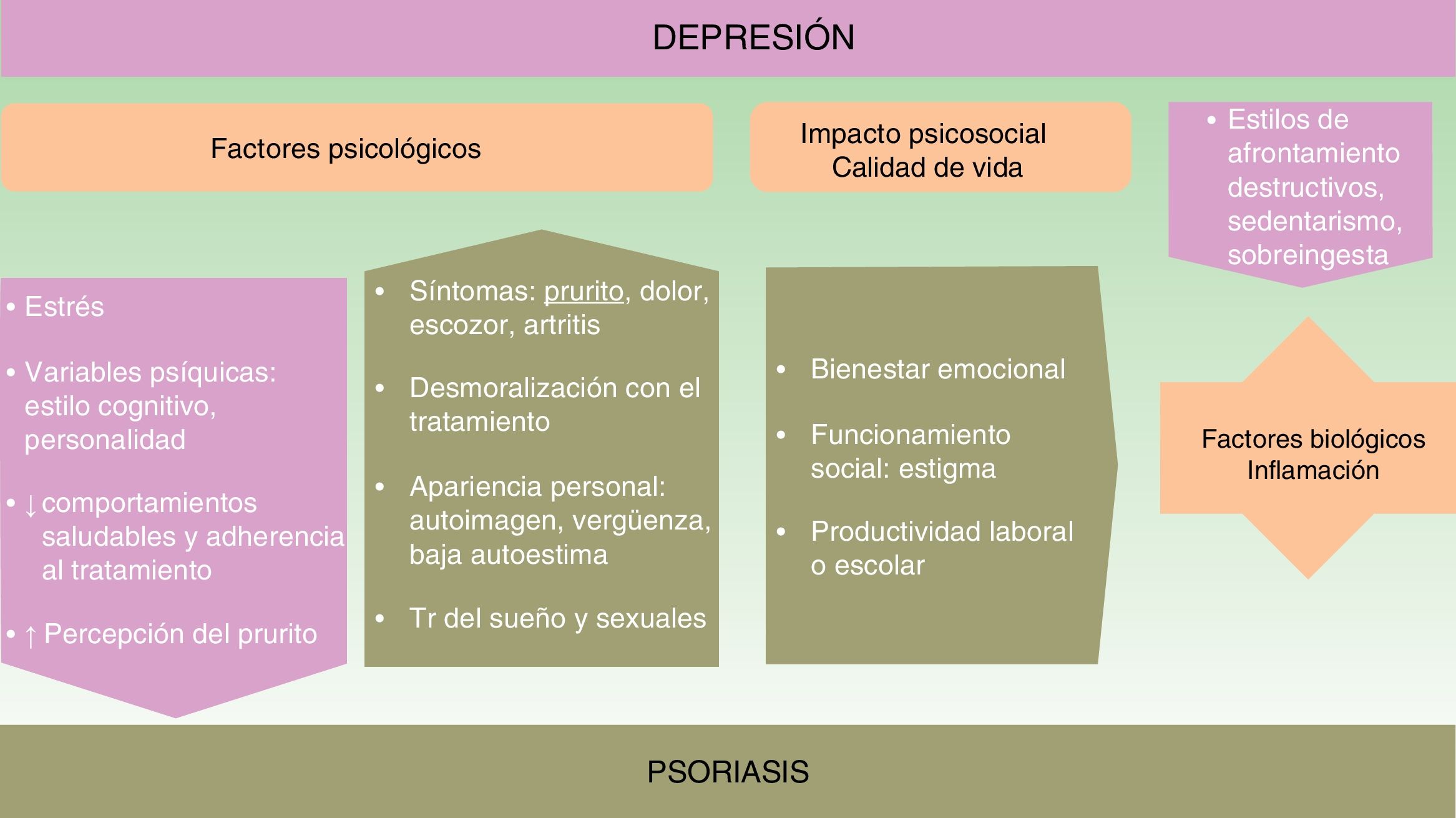
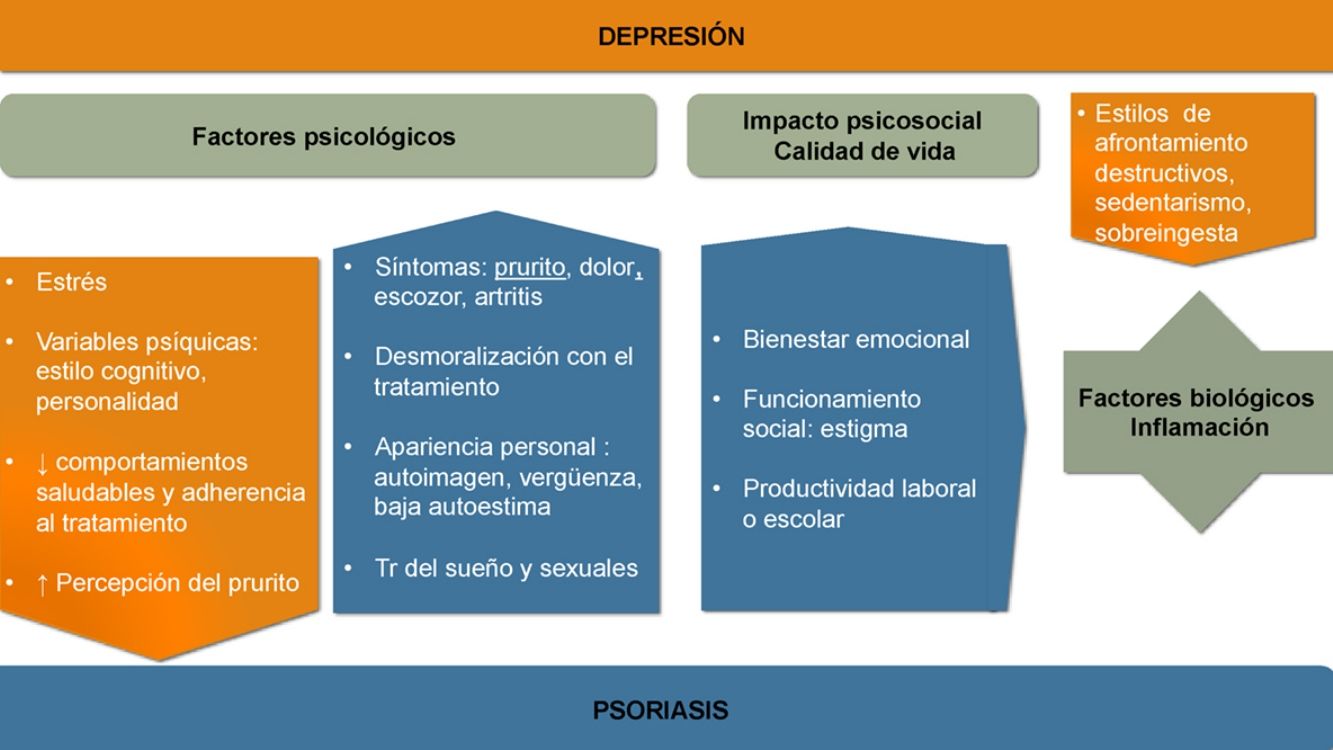
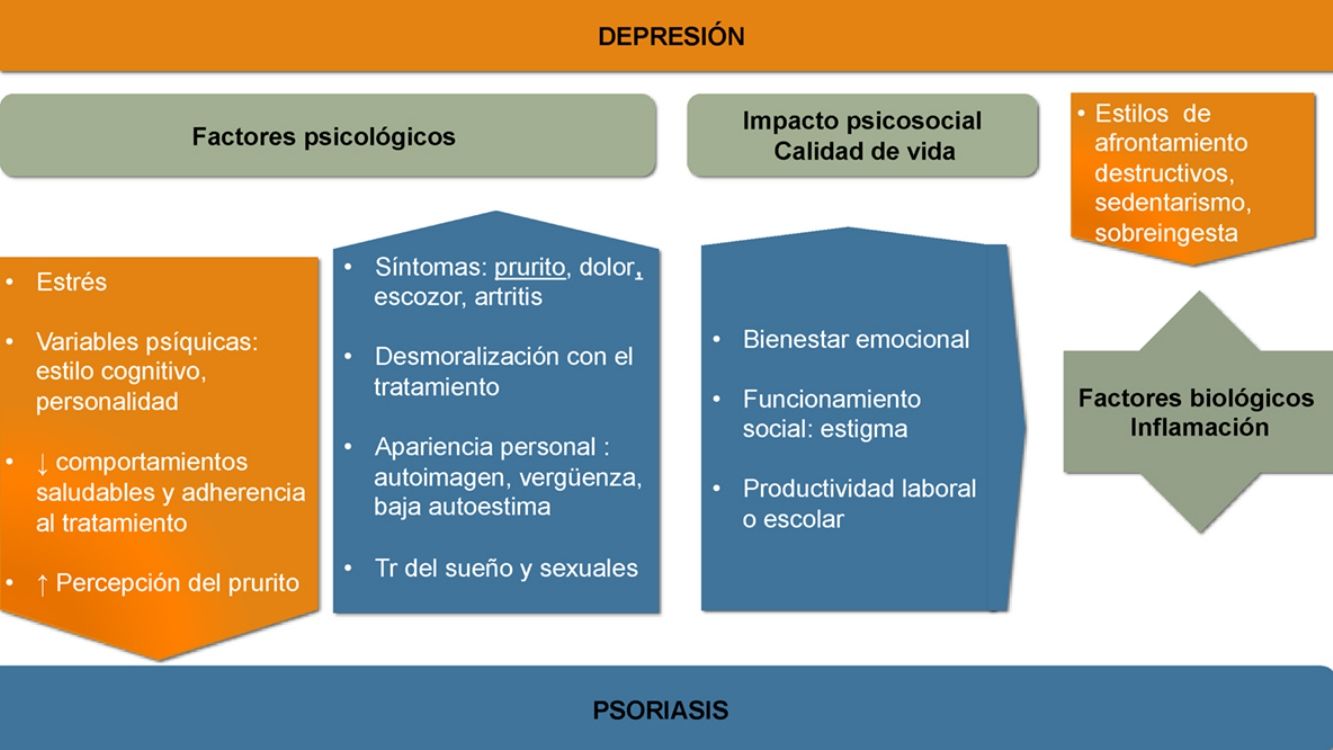
Aunque la asociación entre las patologías psiquiátricas y las dermatológicas es bien conocida, no se han establecido aún todos los nexos de unión entre unas y otras. La aparición y evolución de la depresión en los casos de psoriasis parece estar influida por múltiples factores (ver fig. 1).
Factores psicológicosReconocer la psoriasis desde un modelo biopsicosocial puede ayudarnos a identificar muchos de los factores implicados y a realizar un manejo multidisciplinario que mejore su pronóstico.
Los síntomas de la psoriasis, como la presencia de lesiones cutáneas que producen dolor, prurito, escozor o sangrado, pueden afectar más allá de la piel. Todo ello reduce el bienestar del paciente y produce preocupación acerca de la apariencia personal, desarrollando distrés emocional, sentimientos de vergüenza, baja autoestima, estigmatización, exclusión social y dificultades laborales que con frecuencia pueden provocar un gran impacto psicológico y asociarse a síntomas ansioso-depresivos14-16. La cronicidad e insatisfacción con el tratamiento o los rasgos de personalidad y el estilo cognitivo pueden modular la respuesta.
La depresión afectando a las estrategias de afrontamiento y autocuidado ensombrece el pronóstico de la psoriasis. Se desarrollan con más frecuencia estilos de afrontamiento destructivos y hábitos poco saludables17,18. Entre ellos destacan el sedentarismo, el tabaquismo, no seguir una dieta saludable (como la mediterránea), así como el consumo perjudicial de alcohol, que en ocasiones se utiliza como automedicación19. Empeora la adherencia20 y la eficacia de diversos tratamientos como la fotoquimioterapia21.
Calidad de vidaEn la psoriasis se registran descensos significativos, en cerca del 80% de los casos, del bienestar emocional, la capacidad de funcionamiento social o la productividad laboral o escolar22.
La utilización de escalas de calidad de vida en los protocolos clínicos nos facilita avanzar en las decisiones del plan de tratamiento de esta compleja enfermedad. Nos permite valorar su impacto de una forma más completa sumando a la dimensión física, la psicológica y la social. Nos ayuda a ponderar aspectos tan importantes como la discapacidad o los costes socioeconómicos. Entre las escalas más utilizadas destacan la Dermatology of life Quality Index (DLQI) o índice de Calidad de Vida en Dermatología, la SKINDEX-29 (con capacidad de predicción de patología psiquiátrica), la PSO-LIFE o la Psoriasis Disability Index (PDI). La Cumulative Life Course Impairment (CLCI) o Discapacidad Acumulada en el Transcurso Vital nos permite además valorar la discapacidad acumulada e interferencia en el potencial vital del paciente23.
Por otro lado, debemos tener en cuenta que la puntuación de estas escalas puede verse agravada o confundida por los síntomas depresivos, ya que incluyen ítems relacionados con la interferencia de las actividades laborales, sociales o el afrontamiento de la enfermedad.
Factores biológicosLa prevalencia de la depresión en la psoriasis es mayor que la que se observa en otras enfermedades dermatológicas desfigurantes, por lo que se deben sumar otros factores etiopatogénicos.
ComorbilidadTanto en la psoriasis como en la depresión es frecuente la asociación de otras enfermedades médicas que incrementan la interrelación negativa24.
Los estudios epidemiológicos muestran en la depresión mayor una alta incidencia de trastornos inflamatorios como las enfermedades dermatológicas, autoinmunes, cardiovasculares, diabetes, obesidad, síndrome metabólico, así como asma y alergias25,26. Entre los factores etiológicos implicados parece encontrarse la desregulación inmune-inflamatoria.
InflamaciónAunque no está claro que la depresión sea una enfermedad inflamatoria primaria, un número cada vez mayor de datos indica que la inflamación juega un papel en la patofisiología de las enfermedades mentales, incluida la depresión mayor.
La interrelación negativa de la depresión-inflamación está demostrada. La depresión, las experiencias adversas tempranas y las dificultades relacionales favorecen las respuestas de estrés e incrementan la inflamación, que a su vez pueden empeorar la depresión27. El sistema simpático, en respuesta al estrés, favorece la liberación de aminas (noradrenalina y otras) que inducirían la proliferación de células mieloides (como los monocitos). Estas células interaccionan con otras sustancias también producidas por el estrés, algunas de ellas procedentes de las bacterias (por ejemplo, del microbioma intestinal), como los lipopolisacáridos o la flagelina, pero en particular las llamadas stress-induced damage-associated molecular patterns. Además, se produce una resistencia a los corticoides por el efecto inhibidor sobre los receptores que activa el eje hipotálamo-pituitario-adrenal y amplía el proceso inflamatorio28.
De forma similar a lo que ocurre en el microambiente cutáneo, el proceso inflamatorio se mantiene en el sistema nervioso por la interacción entre los elementos receptores y productores de citoquinas, como el astrocito, la microglía y los oligodendrocitos29.
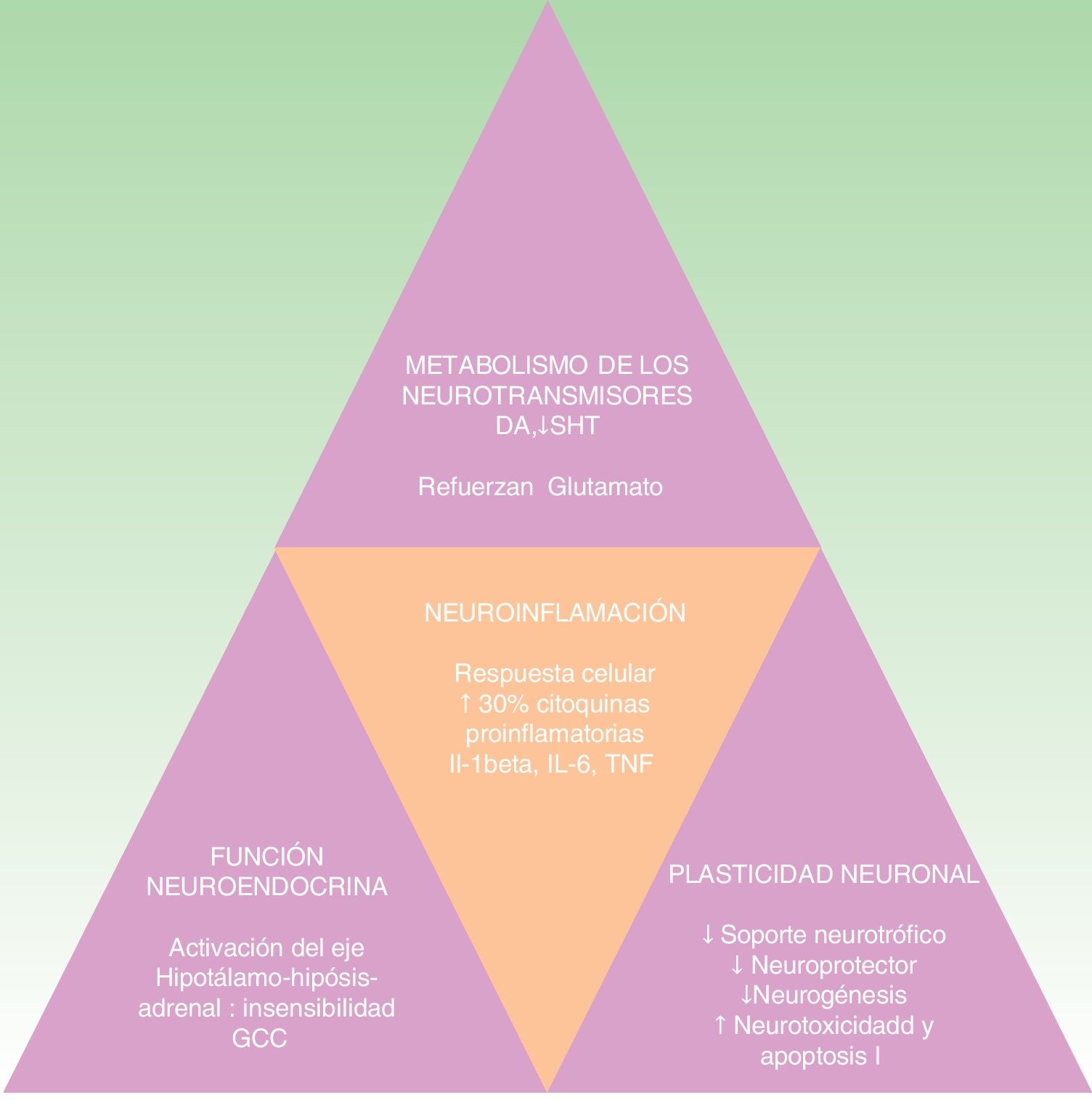
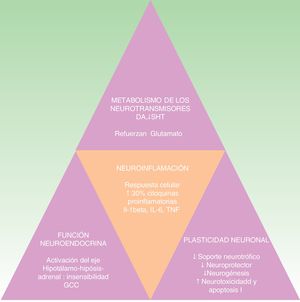
La hipótesis de las citoquinas explica la interconexión entre el sistema inmune, las alteraciones neuroendocrinas y conductuales que se dan en ciertas formas de depresión. Se apoya en múltiples estudios que demuestran la elevación de las citoquinas proinflamatorias en un 30% en los pacientes con depresión comparados con la población sana. Entre ellas destacan las interleucinas IL-1ß, IL-6, el factor de necrosis tumoral alfa (TNF-alfa), la proteína C reactiva (PCR), moléculas de adhesión, y las prostaglandinas19,30,31. Estos biomarcadores inflamatorios acceden al cerebro e interaccionan con prácticamente todas las esferas fisiopatológicas conocidas que participan en la depresión. Afectan al metabolismo de los neurotransmisores (como la dopamina, serotonina y glutamato), la función neuroendocrina e incluso la neuroplasticidad mediante la confluencia de la disminución del soporte neurotrófico o neuroprotector, la neurogénesis, el aumento de la neurotoxicidad y la apoptosis neuronal32-34. Todo ello coincide con los hallazgos neuropatológicos que caracterizan los trastornos depresivos y entre los que se encuentra la reducción del volumen del hipocampo35 (ver fig. 2). Esta hipótesis explicaría la alta incidencia del trastorno depresivo mayor en los pacientes con enfermedades inflamatorias o que reciben inmunoterapia con interferón alfa (IFN-alfa), IL-2 e IL-12 por enfermedades infecciosas (como hepatitis C) o cáncer36. Además se apoya en el hecho de que la administración de citoquinas inflamatorias produce un cuadro sintomático llamado «comportamiento enfermo» y que incluye muchos síntomas que se encuadran dentro del trastorno depresivo37-40.
Todos estos datos avalan la concepción de la depresión como una enfermedad heterogénea donde la inflamación pueda jugar, al menos en algunos casos, un papel importante. En este sentido, supondría un novedoso cambio en el abordaje de esta enfermedad la identificación de un subgrupo de pacientes respondedores al tratamiento antiinflamatorio mediante la detección de posibles biomarcadores o endofenotipos (tabla 1)41. Entre ellos podría encontrarse ese 30% de depresiones resistentes a los tratamientos actuales42.
Factores que indican un mayor riesgo de inflamación y que podrían de forma indirecta facilitar la detección del fenotipo inflamatorio
| Sexo femenino |
| Mayor edad |
| Acontecimientos estresantes tempranos |
| Comorbilidad |
| Depresión atípica (con hipersomnia, fatiga, incremento del apetito y ganancia de peso) |
| Depresión crónica recurrente |
| Obesidad |
| Insomnio |
| Dieta poco saludable |
| Sedentarismo |
| Dolor |
| Fatiga |
| Adicción al tabaco o al alcohol |
Fuente: Kiecolt-Glaser et al., 201541.
Los endofenotipos corresponden a las alteraciones bioquímicas, neurofisiológicas, neuroanatómicas o cognitivas que están determinadas por factores genéticos y ambientales y que en conjunto muestran los procesos fisiopatológicos subyacentes de la enfermedad, y que son expresión de la vulnerabilidad. Por lo tanto, su presencia indica un riesgo aumentado de manifestar la enfermedad43.
Tratamiento de la depresión en los pacientes con psoriasisEl tratamiento eficaz de la psoriasis debe ser multidimensional y contemplar el bienestar psicológico, social y físico. La prevención y el tratamiento precoz de la depresión en los pacientes con psoriasis es importante no solo para mejorar su calidad de vida, sino que además puede ser útil para mejorar la psoriasis. El apoyo psicosocial que aminore el distrés o potencie los recursos personales o interpersonales, así como el trabajo con las familias, puede resultar beneficioso para estos pacientes44. La realización de intervenciones antiestigma contribuye a cambiar la actitud de la población hacia estas enfermedades que afectan a la imagen personal.
Si se parte de la teoría de que el trastorno inmune-inflamatorio sistémico crónico es un punto crítico de conexión entre la psoriasis y las comorbilidades asociadas, se justifica el estudio de los abordajes terapéuticos que reduzcan las respuestas inmunes inflamatorias. Entre ellos se incluyen el tratamiento farmacológico (como los antagonistas de las citoquinas [TNFi, IL12/23i] o el celecoxib) o el cambio del estilo de vida que favorecen una alimentación más sana o reducen el estrés, la obesidad, el sedentarismo o el abuso de sustancias27,45-48 (tabla 2).
Hábitos saludables que reducen la inflamación y el riesgo de depresión
| Ejercicio regular |
| Dieta saludable: rica en frutas, vegetales y omega 3 |
| Buena higiene del sueño |
| Evitar: |
| Tabaquismo |
| Alcohol: estimula la proliferación celular. Favorece fracasos terapéuticos |
| Obesidad: estado proinflamación |
| Estrés: especialmente el trauma infantil |
| Déficit de vitamina D |
Fuente: Nasrallah, 201548.
Estudios de neuroinmunología están promoviendo nuevos descubrimientos farmacológicos en los tratamientos psiquiátricos. Se está investigando el uso de agentes antiinflamatorios en monoterapia o asociados al tratamiento antidepresivo. Aunque los resultados parecen prometedores, la mayor parte de las sustancias están en estudios preclínicos49.
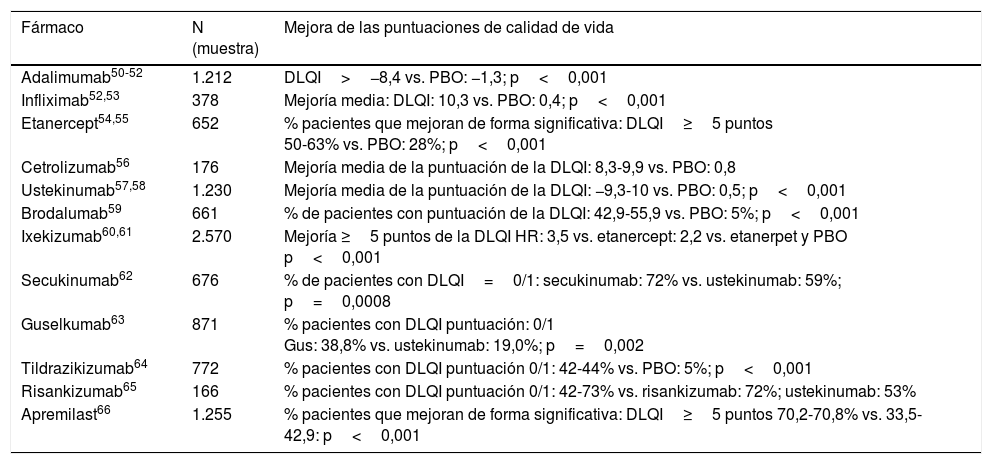
Los agentes biológicos parecen tener un papel importante en el tratamiento de la psoriasis moderada-severa, con un marcado beneficio en la calidad de vida (tabla 3).
Impacto de los tratamientos biológicos de la psoriasis y escalas de calidad de vida
| Fármaco | N (muestra) | Mejora de las puntuaciones de calidad de vida |
|---|---|---|
| Adalimumab50-52 | 1.212 | DLQI>−8,4 vs. PBO: −1,3; p<0,001 |
| Infliximab52,53 | 378 | Mejoría media: DLQI: 10,3 vs. PBO: 0,4; p<0,001 |
| Etanercept54,55 | 652 | % pacientes que mejoran de forma significativa: DLQI≥5 puntos 50-63% vs. PBO: 28%; p<0,001 |
| Cetrolizumab56 | 176 | Mejoría media de la puntuación de la DLQI: 8,3-9,9 vs. PBO: 0,8 |
| Ustekinumab57,58 | 1.230 | Mejoría media de la puntuación de la DLQI: −9,3-10 vs. PBO: 0,5; p<0,001 |
| Brodalumab59 | 661 | % de pacientes con puntuación de la DLQI: 42,9-55,9 vs. PBO: 5%; p<0,001 |
| Ixekizumab60,61 | 2.570 | Mejoría ≥5 puntos de la DLQI HR: 3,5 vs. etanercept: 2,2 vs. etanerpet y PBO p<0,001 |
| Secukinumab62 | 676 | % de pacientes con DLQI=0/1: secukinumab: 72% vs. ustekinumab: 59%; p=0,0008 |
| Guselkumab63 | 871 | % pacientes con DLQI puntuación: 0/1 Gus: 38,8% vs. ustekinumab: 19,0%; p=0,002 |
| Tildrazikizumab64 | 772 | % pacientes con DLQI puntuación 0/1: 42-44% vs. PBO: 5%; p<0,001 |
| Risankizumab65 | 166 | % pacientes con DLQI puntuación 0/1: 42-73% vs. risankizumab: 72%; ustekinumab: 53% |
| Apremilast66 | 1.255 | % pacientes que mejoran de forma significativa: DLQI≥5 puntos 70,2-70,8% vs. 33,5-42,9: p<0,001 |
Fuente: modificada de Frieder et al.67.
Múltiples trabajos también evidencian una mejora significativa en los síntomas afectivos con los tratamientos biológicos. El ustekinumab mejora los síntomas depresivos y ansiosos en pacientes con psoriasis moderada-severa57.
Los antagonistas del TNF-alfa parecen tener efectos positivos sobre el estado de ánimo y el cognitivo, especialmente si los índices de inflamación son altos68,69. Son moléculas que no atraviesan la barrera hematoencefálica, pero parece que producen cambios en la expresión de las citoquinas mediante la acción en el eje hipotálamo-hipofisario-adrenal70. Varios estudios confirman que los anti-TNF disminuyen la gravedad de los síntomas depresivos de forma independiente a la gravedad de la psoriasis71. Por ejemplo, en un estudio con etanercept controlado con placebo a gran escala para el tratamiento de la psoriasis, los pacientes que recibieron el fármaco manifestaron una mejoría significativa de los síntomas depresivos en comparación con el grupo control y de forma independiente de la mejoría de la actividad de la enfermedad72.
Los trabajos con infliximab han reflejado resultados en la misma línea, aumentando la calidad de vida de forma paralela a la mejoría de otras características de la psoriasis, así como los síntomas depresivos en pacientes con enfermedad de Crohn50,73,74.
El adalimumab ha demostrado que mejora la función física, así como los aspectos sociales y psicológicos relacionados con la psoriasis, llegando a niveles incluso superiores a los de la población general51. Varios estudios evidencian que este fármaco mejora la funcionalidad, así como la calidad de vida o los síntomas afectivos de estos pacientes75-77.
Estos tratamientos pueden representar un objetivo que amplíe los límites del abordaje de los trastornos mentales. Parecen mejorar los síntomas depresivos en pacientes con enfermedades inflamatorias crónicas, pero los estudios realizados en este tema presentan múltiples limitaciones para confirmar la evidencia. Las poblaciones son heterogéneas con respecto al mecanismo etiopatogénico, el diagnóstico o la comorbilidad. Las muestras utilizadas no son muy amplias y no cuentan casi con grupos control con placebo. Además, el uso de diferentes herramientas diagnósticas limita la comparación entre diferentes estudios. Se precisan nuevos estudios que determinen qué proporción de la mejoría de los síntomas depresivos se debe al alivio de la psoriasis y cuál se puede atribuir primariamente al tratamiento (tabla 4).
Estudios realizados con la terapia de anti-TNF y su influencia en los síntomas depresivos comórbidos
| Estudio | Anti-TNF-alfa | N (muestra) | Conclusiones |
|---|---|---|---|
| Gelfand et al., 200878 | Etanercept | 2.546 | Mejora la salud mental especialmente si el tratamiento es continuado (vs. alterno) en la psoriasis |
| Tyring et al., 200672 | Etanercept | 618 | Disminuyen la gravedad de la depresión independientemente de la gravedad de la psoriasis |
| Menter et al., 200779 | Infliximab | 116 | Mejora la calidad de vida y depresión en pacientes con enfermedad de Crohn |
| Feldman et al., 200873 | Infliximab | 835 | Mejora la calidad de vida y depresión en pacientes con enfermedad de Crohn |
| Menter et al., 201080 | Adalimumab | 52 | Mejora síntomas afectivos, calidad de vida y funcionalidad en psoriasis |
| Revicki et al., 200851 | Adalimumab | 1.205 | Mejora de los síntomas mentales comparado con placebo |
La comorbilidad de la depresión y la psoriasis interrelaciona negativamente formando un peligroso círculo vicioso. Podemos reducir el impacto de la depresión si la diagnosticamos y tratamos de forma precoz y aliviamos la repercusión biopsicosocial de la psoriasis.
El tratamiento de la psoriasis con inmunorreguladores negativos ofrece un rol prometedor con un efecto beneficioso adicional en la comorbilidad psiquiátrica que se asocia directa o indirectamente a la mejoría de la enfermedad dermatológica. La mayor parte de los tratamientos biológicos de la psoriasis se aprueban exclusivamente en los casos moderados-severos, pero eso conlleva una nueva discusión acerca de la definición de severidad de la psoriasis. Clásicamente se definía la gravedad como la intensidad y extensión de las lesiones de psoriasis. Sin embargo, cobran cada vez más importancia otros aspectos como los socioeconómicos o el impacto de la psoriasis en la actividad física, social y psíquico-emocional, que para la perspectiva del paciente es lo más importante81. La inclusión de estos factores en los árboles de decisión supone un avance en el tratamiento integral de la enfermedad.
Aunque disponemos de numerosos datos sobre esta comorbilidad, todavía queda mucho por hacer. Se precisan más estudios multicéntricos que determinen con claridad los mecanismos fisiopatológicos y que nos permitan mejorar la detección y el manejo clínico, así como la calidad de vida y el pronóstico de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.