La psoriasis es una enfermedad inflamatoria compleja que, en el caso de las mujeres, tiene una alta incidencia durante su etapa reproductiva. El tratamiento de la psoriasis durante el embarazo representa un verdadero reto terapéutico ya que hemos de valorar adecuadamente la extensión de la enfermedad, las comorbilidades asociadas y el potencial riesgo fetal. Actualmente disponemos de escasa evidencia científica que defina el efecto exacto del uso de determinados fármacos sobre el desarrollo embrionario o fetal en gestantes con psoriasis debido a la ausencia de ensayos clínicos llevados a cabo en esta población por razones éticas. Esta revisión intenta proporcionar datos actuales relativos a curso de la psoriasis durante la gestación, comorbilidades asociadas y pautas terapéuticas recomendadas en este contexto.
Psoriasis is a complex inflammatory disease, and in women the incidence is high in child-bearing years. Treatment during pregnancy presents genuine challenges since management requires adequate assessment of the extent of disease, comorbidity, and potential risk to the fetus. Scientific evidence is scarce on the effects that certain drugs have on fetal development given the ethical concerns about enrolling pregnant women in clinical trials. This review presents up-to-date information on the course of psoriasis during gestation and discusses associated conditions and the therapeutic protocols recommended for use during pregnancy.
La psoriasis es una enfermedad inflamatoria crónica, compleja y multifactorial que afecta por igual a ambos sexos. La edad promedio de inicio de la enfermedad en las mujeres se sitúa alrededor de los 28 años, y en el 75% tiene lugar antes de los 40, por lo que la mayoría de mujeres se encuentran en edad fértil en el momento del diagnóstico1. La asociación de la psoriasis con diversas comorbilidades como diabetes, síndrome metabólico o enfermedad cardiovascular, así como la relación observada en varios estudios entre la psoriasis en pacientes gestantes y ciertos factores de riesgo modificables como sobrepeso, hábito tabáquico o depresión y el mantenimiento de una inflamación sistémica pueden conducir al desarrollo de ciertas complicaciones gestacionales, perinatales y del recién nacido2. La comprensión de todos estos factores es crucial para el manejo terapéutico de la psoriasis en la gestación y para un adecuado desarrollo del embarazo, parto y posparto.
La información publicada en la literatura médica sobre gestantes con psoriasis en relación con el pronóstico del embarazo, los factores de riesgo y las comorbilidades asociadas, así como acerca del manejo terapéutico de la enfermedad, es relativamente escasa, y procede en su mayor parte de series de casos y de registros de embarazo3, diseñados para recoger información sobre el mismo y sus complicaciones, y que resultan útiles para identificar la posible teratogenicidad y la seguridad relativa de la exposición a un fármaco específico durante la gestación.
La presente revisión pretende proporcionar datos actuales y revisa la literatura referente a la interrelación entre psoriasis y embarazo y con respecto a las pautas terapéuticas recomendadas en esta situación especial. Por razones de espacio, el apartado correspondiente a los tratamientos biológicos se publicará en una segunda parte.
Material y métodosRealizamos una revisión sistemática en Pubmed con la estrategia «psoriasis and pregnancy», obteniendo 362 referencias, con la estrategia «psoriasis treatment and pregnancy» se obtuvieron 243 referencias; cada terapia utilizada para el tratamiento de la psoriasis fue cruzada con el término «pregnancy» y «lactation». Todas las referencias han sido revisadas individualmente.
Cambios inmunológicos y hormonales durante la gestación y su influencia en la psoriasisDurante el embarazo, existe una adaptación fisiológica del sistema inmunitario materno con el fin de lograr una tolerancia hacia los antígenos paternos expresados en las células fetales y evitar el rechazo del feto. Estas modificaciones, que se producen tanto en la interfase materno-fetal como en la circulación sistémica, vienen determinadas por el efecto de estrógenos, progesterona y cortisol, cuyas concentraciones en sangre aumentan progresivamente durante el embarazo, dando lugar a un cambio de polarización de la respuesta T-helper (Th) que potencia la respuesta Th-2 humoral mientras que inhibe la respuesta Th-1 de la inmunidad celular4. Las citocinas son fundamentales en la regulación de procesos fisiológicos y patológicos, como el embarazo y la psoriasis. Durante el embarazo, la producción de múltiples citocinas corre a cargo de distintos tipos celulares maternos y fetales dentro del útero y de la unidad fetoplacentaria, no solo del sistema inmunitario, sino de otros tipos celulares, como células deciduales maternas y del trofoblasto fetal. La estrecha relación entre el embrión y el endometrio, así como entre la placenta y la decidua, está mediada por las hormonas esteroideas5, diversas citocinas y quimiocinas, estableciéndose una intercomunicación necesaria para un adecuado progreso de la gestación6. Durante la formación de la placenta existe una clara parcialidad hacia la formación de citocinas Th-2. Durante el segundo y tercer trimestres de gestación, el nivel de citocinas Th-2 parece reducirse progresivamente a medida que la placenta se acaba de formar completamente. En el tercer trimestre, y particularmente en las últimas semanas de gestación, el balance de citocinas se vuelve a invertir, predominando las derivadas de Th-1, que ejercen un papel protector materno-fetal frente a la infección durante y después del parto, y estimulan el propio proceso del parto1,2.
En el proceso de la implantación están implicadas numerosas moléculas, y el defecto en una de ellas rara vez tiene un efecto determinante debido a la acción complementaria y compensatoria de otras citocinas7; en el momento de la implantación el balance de citocinas es prácticamente neutral. Hasta la fecha las 2 moléculas identificadas como indispensables para el proceso de la implantación son la IL-1, producida principalmente por macrófagos activados, y el factor inhibidor de la leucemia (LIF),que es indispensable para la implantación e inhibe la diferenciación de las células madre embrionarias, y que es producido por linfocitos Th-2 y por el endotelio endometrial6.
Un adecuado perfil de citocinas es crucial durante los primeros estadios de la implantación embrionaria y la posterior invasión del trofoblasto por parte de los vasos uterinos maternos, y las citocinas producidas por los linfocitos Th-2 al parecer promueven el anclaje del trofoblasto favoreciendo el mantenimiento de la gestación8. Las células Th-2 producen citocinas como la IL-4, IL-5 e IL-13 que, mediante la activación de células B y la producción de anticuerpos, son responsables de la patogenia de algunas enfermedades como el lupus eritematoso9, mientras que las células Th-1 producen las citocinas proinflamatorias IL-2, interferón gamma (IFN-γ), factor de necrosis tumoral alfa (TNF-α) e IL-12, implicadas en el daño tisular mediado por células en algunas enfermedades autoinmunes como la artritis reumatoide, la enfermedad de Crohn y la propia psoriasis, entre otras10. El IFN-γ es el principal efector de la respuesta Th-1, ya que inhibe de forma importante la respuesta Th-2. Estas moléculas son directamente embriotóxicas y dificultan el desarrollo fetoplacentario a través de múltiples mecanismos. La IL-10 es una citocina antiinflamatoria producida por los linfocitos Th-1 y Th-2, e infrarregula la producción de citocinas proinflamatorias por parte de Th-1 y macrófagos, favoreciendo una respuesta Th-211.
En la placenta, la prostaglandina D2 y su metabolito, la ciclopentenona 15-deoxi-Δ12,14-prostaglandina J2 (15dPGJ2), actuando a través de los receptores de prostanoides D (DP1) y el receptor quimiotáctico de los linfocitos Th-2 (CRTH2, o DP2) promueven el predominio local de linfocitos Th-2 en la interfase materno-fetal12 y ejercen un efecto antiinflamatorio a través de la inhibición del factor nuclear kappa B (NF-κB) y los receptores activados por el proliferador de peroxisomas nuclear (PPAR) por parte de la 15dPGJ213.
El conjunto de cambios inmunológicos durante el embarazo, favoreciendo la actividad Th-2, podría explicar por qué determinadas enfermedades autoinmunes como la psoriasis y la artritis reumatoide, en las que intervienen citocinas de tipo Th-1, tienden a mejorar, mientras que aquellas mediadas por citocinas de polaridad Th-2, como el lupus eritematoso, empeoran durante la gestación14.
Por otro lado, la disregulación múltiple en las redes de citocinas puede conducir a complicaciones durante el embarazo como abortos espontáneos, parto prematuro, preeclampsia y retraso del crecimiento intrauterino. Por ejemplo, una elevada secreción de IFN- γ e IL-10 se ha asociado con un mayor riesgo de parto prematuro y la producción elevada de IL-6 e IL-1 en el sitio de implantación se ha implicado en la producción de abortos recurrentes15.
El TNF-α tiene un papel dual, casi paradójico, en el desarrollo embrionario, puesto que es un potente activador de las cascadas de señal apoptótica y antiapoptótica. Parece claro que esta citocina no solo impulsa la destrucción embrionaria si se producen anomalías estructurales graves, sino que estimula aquellos mecanismos protectores que previenen el desarrollo de anomalías que dificulten el desarrollo fetal normal. De hecho, algunos polimorfismos de nucleótido (SNP) de TNF-α se han asociado con defectos cardiacos (tetralogía de Fallot o defecto septal ventricular) y anomalías en las extremidades inferiores16. Los SNP representan el mínimo grado de diferenciación genética entre los individuos y, en la era posgenómica, están siendo cada vez más utilizados para identificar marcadores genéticos en enfermedades complejas. Como las regiones reguladoras de muchos genes están mal definidas, se han intentado caracterizar las variaciones en las áreas de codificación de los genes. Sin embargo, el gen del TNF-α proporciona una oportunidad única para estudiar la distribución de los SNP en un área genética donde las regiones involucradas en la regulación de la transcripción están bien caracterizadas17.
Los cambios hormonales durante el embarazo tienen un papel importante en la mejoría de la psoriasis ya que promueven un estado de inmunotolerancia. Los estrógenos tienen funciones inmunosupresoras e inmunoestimuladoras. Los estrógenos maternos estimulan la producción de IL-2, IL-10 e IFN-γ e inhiben la producción de TNF-α en las células mononucleares periféricas. Se conocen 3 tipos de estrógenos: estradiol y estrona, procedentes de precursores androgénicos y fetales, y estriol, procedente de precursores fetales. A principios de la gestación predominan el estradiol y la estrona mientras que al final el estriol se convierte en el estrógeno principal18. Por otro lado, la progesterona es principalmente inmunosupresora pues infrarregula la respuesta proliferativa de células T y es un factor clave en la inmunosupresión uterina. Debido a que las concentraciones de progesterona se incrementan mucho más que los niveles de estrógenos en el embarazo, se ha propuesto que este cambio en la ratio estrógenos-progesterona sea el responsable de la alteración inmunitaria durante la gestación. En el embarazo, la parcialidad hacia la respuesta Th-2 ocurre tanto a nivel de la circulación sistémica como en la interfase fetomaterna; la progesterona inhibe la producción de citocinas Th-1 e induce la actividad Th-2 contribuyendo al progreso adecuado de la gestación19. La prolactina y el lactógeno placentario humano también parecen tener funciones inmunosupresoras, sin embargo su papel inmunomodulador parece estar menos establecido5.
Además de contribuir a la polarización Th-2, los cambios hormonales durante el embarazo parecen afectar directamente a los queratinocitos: recientemente se ha demostrado que estas células poseen receptores para estrógenos y progesterona, concretamente localizados en el citoplasma de los queratinocitos suprabasales20. La inmunorreactividad del receptor de la progesterona está relacionada con la inflamación existente en la epidermis y la dermis, y no con las hormonas20. Puesto que la progesterona actúa como inmunosupresora, se podría postular que su receptor podría estar inducido por citocinas desconocidas que iniciarían la acción de la progesterona para incrementar o disminuir el proceso inflamatorio, lo que constituye un interesante campo de investigación.
Curso de la psoriasis durante la gestación y factores de riesgo asociadosAunque la influencia de la gestación en el curso evolutivo de la psoriasis es impredecible, generalmente se acepta que un 30-40% de las gestantes con psoriasis experimentan una mejoría clínica de la enfermedad en el curso del embarazo y un empeoramiento entre las 4-6 semanas después del parto; hasta un 40-90% de las mujeres pueden experimentar un rebrote importante en el posparto inmediato21. Un estudio retrospectivo de 91 gestantes con psoriasis objetivó que la enfermedad mejoraba en el 56%, empeoraba en el 26% y permanecía sin cambios en el 17,6%22.
En otro estudio5 se encontró una mejoría de la psoriasis en el 55% de las gestantes, empeoramiento en el 23% y ausencia de cambios apreciables en el 21%; en el posparto, el 9% de las pacientes experimentaron mejoría, el 65% empeoraron y el 26% no presentaron cambios apreciables en la actividad de la enfermedad.
Entre las gestantes que experimentan una mejoría de la psoriasis durante el embarazo, la mayoría lo nota durante el primero y segundo trimestres, siendo la respuesta similar en sucesivos embarazos5.
Boyd et al. postularon que la mejoría de la psoriasis durante el embarazo se asociaba con la supresión del sistema inmunitario mediada por hormonas, con un papel principal para la progesterona no solo a nivel inmunológico sino afectando directamente a la proliferación queratinocítica14. Esta hipótesis contrasta con los resultados del estudio del grupo de Murase et al.5, en el que la mejoría de la psoriasis durante el embarazo se asoció con niveles elevados de estrógenos mientras que no encontraron correlación alguna con los niveles de progesterona.
La inflamación sistémica que se asocia a diversas enfermedades mediadas por el sistema inmunitario como la artritis reumatoide, el lupus eritematoso, la enfermedad inflamatoria intestinal y la psoriasis moderada-grave puede conducir a un pronóstico y un curso adverso de la gestación, con especial riesgo de parto pretérmino y bajo peso al nacer23. Se ha demostrado la elevación de diversas citocinas proinflamatorias (IL-6 y TNF-α) y biomarcadores de inflamación (proteína c reactiva), tanto en el suero materno como en el de cordón umbilical en gestaciones de pacientes con psoriasis que resultan en parto pretérmino o neonatos pequeños para su edad gestacional23. La coexistencia de biomarcadores de inflamación (proteína c reactiva de alta sensibilidad) y de disfunción placentaria (niveles bajos de factor de crecimiento placentario [PIGF]), que se han asociado con defectos de implantación de trofoblasto, preeclampsia y crecimiento intrauterino retardado conlleva un aumento de 6-7 veces en el riesgo de parto prematuro24. El desequilibrio de ciertas citocinas conlleva una disfunción endotelial que resulta en vasculopatía sistémica y placentaria a través de la inducción de agregación plaquetaria, vasoespasmos intermitentes y activación de la coagulación25. Se ha postulado que la vasculopatía placentaria contribuye al bajo peso al nacer, que además es una complicación de la preeclampsia, que también se asocia con un estado de actividad inflamatoria y el consecuente incremento de las mismas citocinas que en la psoriasis25.
En varias publicaciones se ha intentado relacionar la influencia de la psoriasis y su gravedad con el desarrollo de complicaciones gestacionales, fetales y/o perinatales. Un estudio de casos y controles en 145 gestantes con psoriasis encontró una asociación estadísticamente significativa con diversas complicaciones como hipertensión, abortos recurrentes y parto por cesárea26. Cohen-Barak et al.27 efectuaron un estudio retrospectivo en el que comparaban 68 gestaciones de 35 mujeres con psoriasis moderada-severa con 237 gestaciones de 236 controles sanas, con el objetivo de evaluar la asociación entre la gravedad de la enfermedad y la aparición de complicaciones gestacionales y/o fetales. Encontraron que el grupo de psoriasis presentaba una mayor tasa de abortos espontáneos (0,42±0,58 frente a 0,26±0,63, p=0,002) e inducidos (0,32±0,60 frente a 0,06±0,25, p=0,001) y sus recién nacidos tenían un mayor peso al nacer (3.375±543 frente a 3.247±460g, p=0,03) que los controles. También encontraron un mayor porcentaje de enfermedad hipertensiva inducida por el embarazo (7,4 frente a 2,1%, p<0,05), de rotura prematura de membranas (16 frente a 5,5%, p<0,008) y de macrosomía fetal (13 frente a 4,2%, p=0,02) que las gestantes sin psoriasis. Los mencionados autores no encontraron una asociación estadísticamente significativa con la duración de la enfermedad ni con el uso de terapia sistémica durante la gestación en cuanto al desarrollo de complicaciones gestacionales, fetales o perinatales.
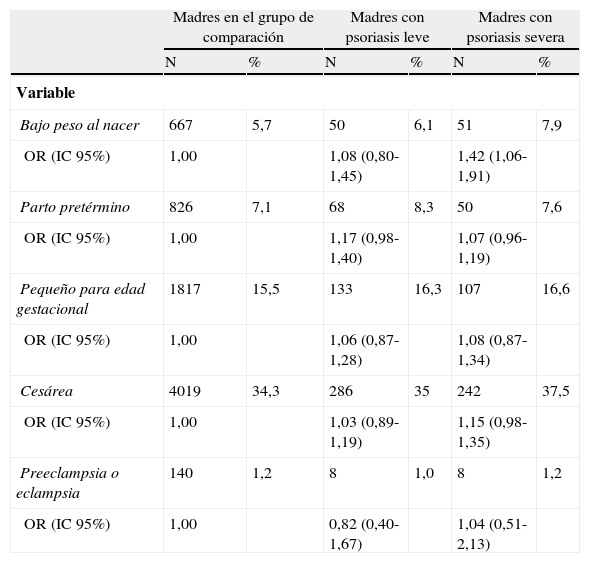
Yang et al.28 llevaron a cabo un estudio extenso en población taiwanesa cuyo objetivo también era correlacionar la gravedad de la psoriasis con el riesgo de complicaciones gestacionales y/o fetales. Para ello compararon un grupo de 1.483 gestantes con psoriasis, clasificadas en subgrupos con leve o severa afectación, con 11.704 gestantes sin psoriasis. De las mujeres con psoriasis, 645 (44,1%) habían sido tratadas mediante fototerapia o terapia sistémica en los 2 años previos al parto y fueron incluidas en el subgrupo de afectación severa. El estudio demostró que las gestantes con psoriasis severa tenían mayor riesgo de dar a luz a recién nacidos con bajo peso al nacer (OR=1,40, IC 95%=1,04-1,89) que las gestantes sin psoriasis. Aunque los datos se ajustaron a la prevalencia de comorbilidades asociadas como diabetes mellitus o enfermedad cardiovascular, no podía excluirse el impacto del uso de tratamiento sistémico durante la gestación; sin embargo, en este estudio se observó un aumento en el riesgo de complicaciones como parto pretérmino, bajo peso al nacer, parto por cesárea y preeclampsia entre aquellas gestantes que recibieron tratamiento sistémico, por lo que alegan que el riesgo intrínseco podría ser únicamente atribuible al medio inflamatorio sistémico de la propia enfermedad. No se observó un riesgo estadístico incrementado de complicaciones entre las gestantes con psoriasis leve cuando se compararon con el grupo control (tabla 1).
Distribución y odds ratios para bajo peso al nacer, parto pretérmino, cesárea, recién nacidos pequeños para su edad gestacional, preeclampsia y eclampsia, comparando madres afectadas de psoriasis con madres no afectadas (2001-2003) (n=13.167)
| Madres en el grupo de comparación | Madres con psoriasis leve | Madres con psoriasis severa | ||||
| N | % | N | % | N | % | |
| Variable | ||||||
| Bajo peso al nacer | 667 | 5,7 | 50 | 6,1 | 51 | 7,9 |
| OR (IC 95%) | 1,00 | 1,08 (0,80-1,45) | 1,42 (1,06-1,91) | |||
| Parto pretérmino | 826 | 7,1 | 68 | 8,3 | 50 | 7,6 |
| OR (IC 95%) | 1,00 | 1,17 (0,98-1,40) | 1,07 (0,96-1,19) | |||
| Pequeño para edad gestacional | 1817 | 15,5 | 133 | 16,3 | 107 | 16,6 |
| OR (IC 95%) | 1,00 | 1,06 (0,87-1,28) | 1,08 (0,87-1,34) | |||
| Cesárea | 4019 | 34,3 | 286 | 35 | 242 | 37,5 |
| OR (IC 95%) | 1,00 | 1,03 (0,89-1,19) | 1,15 (0,98-1,35) | |||
| Preeclampsia o eclampsia | 140 | 1,2 | 8 | 1,0 | 8 | 1,2 |
| OR (IC 95%) | 1,00 | 0,82 (0,40-1,67) | 1,04 (0,51-2,13) | |||
Adaptada y traducida de Yang et al.28
Bandoli et al.2 intentaron determinar si las mujeres embarazadas afectadas de psoriasis presentaban un incremento de factores de riesgo potencialmente modificables que modificasen el curso del embarazo. Para ello recogieron información procedente de la Organización de Especialistas en Información Teratológica para las Enfermedades Autoinmunes Durante el Embarazo (OTIS) y compararon la prevalencia de diversos factores de riesgo entre 170 gestantes con psoriasis y 158 controles. De las pacientes afectadas, 128 estaban recibiendo terapia biológica en algún momento de la gestación. Encontraron que las pacientes con psoriasis, sobre todo de grado moderado-severo, eran más proclives a presentar sobrepeso/obesidad pregestacional (p<0,0001), hábito tabáquico durante el primer trimestre (p<0,0001) o a ser diagnosticadas de depresión (p=0,03) en comparación con las embarazadas del grupo control. También observaron que existía una tendencia a la ingesta de suplementos vitamínicos o ácido fólico en el momento de la concepción (p=0,004) menos frecuente en las embarazadas con psoriasis.
La asociación entre diversas comorbilidades relacionadas con la psoriasis y la presencia de complicaciones durante el embarazo y parto se detalla a continuación y puede resumirse como sigue25:
- -
La hipertensión durante el embarazo se ha asociado con bajo peso al nacer por insuficiencia placentaria, elevada mortalidad perinatal y parto pretérmino.
- -
La diabetes mellitus se ha asociado con macrosomía fetal, hipoglucemia posnatal y malformaciones congénitas como transposición de grandes vasos.
- -
La obesidad se asocia con macrosomía, algunas anomalías congénitas, hipoglucemia y baja puntuación en la escala Apgar.
- -
El hábito tabáquico se asocia con bajo peso al nacer, complicaciones placentarias y paladar hendido.
- -
El consumo de alcohol durante el embarazo puede resultar en síndrome fetal alcohólico y bajo peso al nacer.
- -
La depresión también puede implicar un mayor riesgo de parto pretérmino, bajo peso al nacer y abortos espontáneos.
En un estudio retrospectivo realizado por Lima et al.23 se compararon 162 gestaciones en 122 mujeres afectadas de psoriasis con 501 gestaciones de 290 mujeres sanas, con el objetivo de evaluar la asociación con el desarrollo de complicaciones como el parto pretérmino (< 37 semanas) o el bajo peso al nacer (< 2.500g) realizando análisis uni y multivariantes, ajustando para la prevalencia de otros factores demográficos (raza, nivel educacional y estatus social, número de embarazos previos, etc.), la existencia de comorbilidades asociadas y la gravedad de la enfermedad. En el análisis univariante encontraron un mayor riesgo de parto pretérmino y bajo peso al nacer en las gestantes con psoriasis (OR 1,89, IC 95% 1,06-3,39), que fue estadísticamente significativo en el análisis multivariante. No se encontró asociación estadística significativa con respecto a la tasa de abortos espontáneos, parto por cesárea o preclampsia en el mismo grupo de pacientes.
A medida que vayamos conociendo más datos comprenderemos mejor la influencia recíproca entre gestación y psoriasis y la prevalencia real de los diversos factores de riesgo potencialmente modificables con el objetivo de optimizar el cuidado pregestacional de estas pacientes y evitar complicaciones durante el embarazo y el consiguiente daño fetal.
A continuación se efectúa una revisión de la evidencia científica publicada hasta el momento respecto al uso de las diferentes modalidades terapéuticas en gestantes con psoriasis.
Tratamiento de la psoriasis durante la gestaciónActualmente disponemos de escasa evidencia científica que defina el efecto exacto del uso de determinados fármacos sobre el desarrollo embrionario o fetal en gestantes con psoriasis debido a la ausencia de ensayos clínicos llevados a cabo en esta población, por razones éticas. Algunas de las guías publicadas se basan en estudios retrospectivos e información procedente de mujeres que tomaban un determinado fármaco antes de saber que estaban embarazadas.
En el tratamiento de las mujeres embarazadas con psoriasis se ha de valorar la gravedad y extensión de la enfermedad, el potencial riesgo fetal, el beneficio esperable del tratamiento y la existencia o no de alternativas efectivas y seguras.
Terapia tópica y sistémica no biológicaCorticoides tópicos. Categoría C de la Food and Drug AdministrationLos corticoides tópicos son la base del tratamiento de muchas de las enfermedades inflamatorias cutáneas incluida la psoriasis, en la que se han venido usando desde hace más de 50 años. En el caso de mujeres embarazadas, existe numerosa literatura publicada acerca de los posibles efectos que su uso por vía oral pueden ocasionar en el feto (véase el apartado de corticoides orales), y en estudios experimentales se ha demostrado la exposición fetal a corticoides aplicados por vía tópica en la madre (citado por Chi et al.29). Sin embargo, existe incertidumbre acerca de la seguridad del uso de corticoides por vía tópica en mujeres gestantes, lo que genera inseguridad tanto en el prescriptor como en la paciente y compromete el tratamiento de esta. La absorción percutánea de los corticoides depende de numerosos factores como la dosis, el excipiente, la superficie a tratar y la zona donde se aplique, la duración del tratamiento, el uso de oclusión o el número de aplicaciones30, pero varía entre el 0,5 y el 7% si se aplica sobre piel intacta, pudiendo aumentar en casos de inflamación y/o lesión cutánea31. Además del grado de absorción, también se debe tener en cuenta la biodisponibilidad de un corticoide determinado. La hidrocortisona, considerada como el corticoide de más baja potencia, cuando se aplica sobre dermatosis severas puede conducir a una supresión adrenal, y hay que recordar que el embarazo produce cambios en la hidratación y el flujo sanguíneo cutáneos que pueden determinar variaciones en la disponibilidad de los corticoides tópicos32. En última instancia, el efecto de los corticoides sobre el feto va a depender del paso transplacentario, que viene determinado por la actividad de la 11β-hidroxisteroide deshidrogenasa (11β-HSDH), presente en cantidades abundantes en la placenta, y encargada de la inactivación del cortisol33. Existen diferencias en cuanto a la metabolización placentaria de las diferentes moléculas de corticoides, siendo la prednisolona la que menos atraviesa la barrera placentaria (10-12%)34, seguida de la hidrocortisona (15%), la betametasona (28-33%), la metilprednisolona (45%) y la dexametasona (67%)35–37. El propionato de fluticasona y la budesonida no son metabolizados por la 11β-HSDH, por lo que sería esperable el paso de dosis altas al feto38.
Por lo que respecta a estudios en humanos, Chi et al. efectuaron una revisión sistemática de la literatura39 referente a la posible asociación entre el uso de corticoides tópicos y la aparición de ciertas malformaciones congénitas como labio leporino, retraso de crecimiento, parto pretérmino, muerte fetal, puntuación Apgar baja y tipo de parto. En la mayoría de casos no se pudo observar una asociación estadísticamente significativa, incluso tras realizar una estratificación en función de la potencia de los corticoides usados. Dos estudios relacionan el uso de corticoides de muy alta potencia aplicados en abundancia con la aparición de labio leporino en uno y retraso de crecimiento en el otro. Sin embargo, los autores de la revisión sistemática concluyeron que la evidencia recogida hasta la fecha resultaba insuficiente dado que se trataba de estudios de casos y controles, con alguno de cohortes, pero la mayoría de ellos con tamaños muestrales insuficientes y con numerosos sesgos.
En un estudio de cohortes poblacional efectuado en Reino Unido se comparó a 35.503 mujeres embarazadas que habían recibido corticoides en algún momento desde 3 meses antes del embarazo hasta el final del mismo con 48.630 embarazadas no expuestas40. Se estratificaron los corticoides aplicados en función de su potencia. No se observó asociación entre la exposición materna a corticoides tópicos y el desarrollo de labio leporino. Tampoco se observó un mayor incremento de partos pretérmino ni de muertes fetales con el uso de corticoides de cualquier potencia. En cambio, sí se evidenció una asociación del retraso del crecimiento intrauterino con el uso de corticoides de alta y muy alta potencia, pero no con los de potencia baja y moderada. En otro estudio de cohortes retrospectivo llevado a cabo en Dinamarca en el que se incluyeron 22.480 embarazadas expuestas a corticoides tópicos y 810.156 no expuestas, tras realizar análisis de dosis-respuesta y potencia-respuesta no se observaron diferencias significativas entre los grupos41. Chi et al. elaboraron en junio de 2011 una guía para el uso de corticoides tópicos en gestantes42 en la que recomiendan el uso de corticoides de potencia baja o moderada frente a los de potencia alta y muy alta, debiéndose usar estos últimos como segunda línea de tratamiento durante el menor tiempo posible y con vigilancia obstétrica apropiada (grado de evidencia B). Respecto al uso de los nuevos corticoides lipofílicos estos autores comentan que dada su característica de producir menos efectos secundarios y la ventaja de su aplicación una vez al día cabría esperar también menos efectos en el feto (nivel de evidencia D).
Ácido salicílico tópico. Sin categoría gestacionalNo hay estudios disponibles43. En una publicación se ha relacionado su uso con el cierre precoz del ductus arterioso44. En otro trabajo reciente, se ha relacionado el uso de salicilato tópico al 1% con el síndrome de agnatia-otocefalia45.
Antralina. Categoría C de la Food and Drug AdministrationNo hay estudios desarrollados en animales o humanos46.
Tazaroteno. Categoría x de la Food and Drug AdministrationEl tazaroteno es un retinoide acetilénico que, aplicado en dosis de entre 0,05 y 0,1%, ha demostrado ser efectivo en el tratamiento de la psoriasis en placas leve-moderada. Su forma activa, el ácido tazaroténico, alcanza niveles mesurables en sangre, pero hasta la fecha no ha demostrado tener potencial efecto teratogénico en humanos. Menter et al.46 describieron los resultados no publicados de los ensayos clínicos realizados por la empresa productora, en los que se describe el nacimiento de 8 niños sanos de 6 mujeres que estaban recibiendo tazaroteno tópico, sin especificar dosis ni duración del tratamiento. Sin embargo, también mencionan un aumento de las tasas de malformaciones y muerte fetal en ratas y conejos tratados con tazaroteno por vía oral, cuyas concentraciones en sangre resultaron ser muy inferiores (entre 1 y 13 veces) a la dosis esperada a priori en mujeres tratadas tópicamente. Por este motivo, a diferencia de otros retinoides tópicos como el adapaleno o la tretinoína, que están clasificados como categoría C en el embarazo, se asignó a tazaroteno la categoría X de la FDA. Teniendo en cuenta que en la práctica la biodisponibilidad del tazaroteno tras la aplicación tópica está comprendida entre el 1 y el 5% en pacientes con psoriasis47, el potencial efecto teratogénico del mismo debería ser mucho más bajo que el de los retinoides orales que alcanzan niveles en sangre hasta 100 veces superiores.
Calcipotriol. Categoría C de la Food and Drug AdministrationEstudios en animales han demostrado un incremento de la incidencia de anomalías esqueléticas, osificación incompleta de huesos pélvicos y falanges de los fetos afectados48.
Alquitrán de hulla. Sin categoría gestacionalFranssen et al.49 llevaron a cabo un estudio retrospectivo en 103 gestantes: 59 no utilizaron alquitrán de hulla (coaltar) durante el embarazo (el 19% tuvo un aborto espontáneo y el 5%, malformaciones congénitas), 21 tuvieron un uso dudoso del fármaco durante este período (el 5% muertes fetales y el 5%, malformaciones congénitas) y 23 gestantes con uso confirmado del activo (el 26% tuvo aborto espontáneo y el 4%, malformaciones congénitas), y concluyeron que su administración debería prohibirse durante el primer trimestre y restringirse su uso durante el segundo y tercer trimestres del embarazo.
Tacrolimus. Categoría C de la Food and Drug AdministrationEl tacrolimus es un inhibidor de la calcineurina cuya aplicación tópica es ampliamente usada en el tratamiento de la dermatitis atópica. Sus propiedades inmunosupresoras y la ausencia de atrofia cutánea han hecho de este fármaco una pieza clave en el ahorro de corticoides. Por este motivo se ha estudiado su utilidad en otras dermatosis inflamatorias como la psoriasis, en la que se han obtenido buenos resultados, sobre todo para la afectación facial e intertriginosa50. Actualmente no existen estudios de seguridad sobre su uso en pacientes gestantes. Sin embargo, se ha demostrado que el tacrolimus se absorbe en menor cantidad que los corticoides, y que su uso repetido sobre áreas extensas durante un largo periodo de tiempo da lugar a niveles en sangre bajos o indetectables, aumentando su absorción en el caso de determinadas alteraciones de la barrera cutánea51. El uso de tacrolimus por vía oral en pacientes trasplantadas ha dado lugar a numerosos estudios acerca de su seguridad durante el embarazo. Jain et al.52 analizaron 37 casos de mujeres con trasplante hepático que seguían tratamiento con tacrolimus, observando un riesgo aumentado de prematuridad y bajo peso al nacer. Kainz et al.53 analizaron una serie de 100 embarazadas trasplantadas obteniendo resultados similares a los de otros estudios con tacrolimus, así como con otros inmunosupresores, y concluyeron que después de todo podían considerarse favorables. Se han descrito hiperpotasemia y elevación de creatinina sérica que se resolvieron espontáneamente54 en hijos de madres tratadas con tacrolimus oral. En ningún caso se ha descrito un patrón de malformaciones congénitas asociado al uso de tacrolimus oral. Estos resultados, sumados al hecho de que las concentraciones en sangre de tacrolimus después de su uso tópico en pacientes con dermatitis atópica fueron de 7 a 17 veces inferiores a las de su administración por vía oral, nos lleva a considerar que podría tratarse de un tratamiento seguro en la psoriasis del embarazo, especialmente en la afectación facial e intertiginosa54.
Radiación ultravioleta B (UVB). Sin categoría gestacionalLa fototerapia con UVB basa su eficacia en el tratamiento de la psoriasis solamente en el uso de radiación a 290-320nm sin necesidad de fotosensibilizantes tópicos u orales. Su efecto antiproliferativo e inmunosupresor viene determinado básicamente por la inhibición de la síntesis de ADN a través de la formación de dímeros de pirimidina, así como la liberación de prostaglandinas y citocinas. Desde la introducción en los años 1980 del UVB de banda estrecha (311-313nm) se han obtenido resultados levemente inferiores al uso de PUVA, pero con la ventaja de evitar algunos de sus inconvenientes, como el riesgo de carcinogénesis, el uso de fotosensibilizante sistémico o las náuseas55. Según El-Saie et al.56, el uso de UVB de banda estrecha parece reducir los niveles séricos de folato en mujeres que, por su condición de embarazadas y por presentar psoriasis, tienen una doble predisposición a presentar niveles bajos en sangre que pueden implicar un aumento en el riesgo de defectos de tubo neural en el feto. Para evitarlo, recomiendan la determinación de niveles pretratamiento y su monitorización durante el mismo y el uso de suplementos de ácido fólico a una dosis de 5mg/día. Vun et al.57 publicaron el caso de una embarazada que presentó una psoriasis pustulosa generalizada en el tercer trimestre de gestación. Se inició tratamiento tópico con betametasona en oclusión sin poderse observar una clara mejoría, por lo que se añadió tratamiento con UVB a las 27 semanas tras lo que se logró una mejoría clínica y sintomática. Por todo ello, esta modalidad de tratamiento se ha señalado como una buena alternativa terapéutica en embarazadas con mala respuesta al tratamiento tópico, asociándolo o no al mismo.
Corticoides sistémicos. Categoría C de la Food and Drug AdministrationEl uso de corticoides sistémicos, frecuentemente empleados en otras condiciones durante el embarazo, se ha asociado con el desarrollo de ciertas anomalías congénitas y prematuridad. Un largo estudio retrospectivo realizado por Park-Wyllie et al.58, en 184 pacientes expuestas a prednisona en dosis de 2,5-100mg/día durante el primer trimestre, mostró una asociación estadísticamente significativa con prematuridad, bajo peso al nacer y desarrollo de anomalías congénitas como paladar hendido, anencefalia, atresia de ventrículo izquierdo, hipospadias y estenosis valvular pulmonar, entre otras. Crowther et al.59 evaluaron 1.047 niños nacidos de 982 gestantes expuestas a betametasona en dosis de 11,4mg semanalmente (489 mujeres) frente a la administración en dosis única a la semana 24-28 de gestación (493 mujeres), obteniendo tasas más altas de bajo peso al nacer si la administración ocurrió durante el tercer trimestre y más problemas de atención a la edad de 2 años entre aquellos niños expuestos a dosis repetidas de corticoides. Debemos señalar que los corticoides sistémicos son un tratamiento de elección en la psoriasis pustulosa del embarazo (impétigo herpetiformis), que generalmente ocurre durante el tercer trimestre.
Acitretina. Categoría X de la Food and Drug AdministrationSe han descrito las siguientes malformaciones fetales derivadas de su uso durante la gestación: mielomeningocele, meningoencefalocele, dismorfia facial, sindactilia, ausencia de falanges terminales, malformación de pelvis, tobillo y hombro, paladar hendido, malformaciones cardiovasculares, implantación baja de las orejas, disminución del volumen craneal, alteraciones de las vértebras cervicales60.
Ciclosporina. Categoría C de la Food and Drug AdministrationLa ciclosporina, un potente inhibidor de los linfocitos T, sigue siendo uno de los tratamientos de elección para el tratamiento de la psoriasis moderada/severa. Lamarque et al.61 publicaron en 1997 un estudio retrospectivo de 629 gestantes expuestas a ciclosporina en dosis entre 1,4-14mg/kg/día durante toda la gestación, en el que no se observaron diferencias significativas respecto a la incidencia de muerte fetal ni malformaciones congénitas respecto a la población general. Sí encontraron un aumento de prematuridad (44,5%) y de bajo peso al nacer (44,3%) en el grupo de gestantes expuestas. Bar Oz et al.62 revisaron 15 estudios publicados relativos al uso de ciclosporina en gestantes trasplantadas, observando un incremento de la tasa de prematuridad en este grupo poblacional. Armenti et al.63 revisaron 392 gestantes trasplantadas y tratadas con ciclosporina (no especifican dosis ni duración del tratamiento), sin observar un incremento de malformaciones congénitas en los recién nacidos. Edmonds et al.64 publicaron el caso de una gestante diagnosticada de psoriasis pustulosa tratada con ciclosporina, en dosis de 2,5-3mg/kg/día, y prednisolona, 40mg/día en la semana 21, resultando en parto pretérmino con rotura prematura de membranas y bajo peso al nacer del recién nacido.
Es importante resaltar que estos estudios se refieren a mujeres trasplantadas con comorbilidades asociadas, en ocasiones graves, y múltiples tratamientos concomitantes que indudablemente contribuyen a la afectación fetal y que, por lo tanto, no son realmente superponibles a las pacientes con psoriasis. La hipertensión o la nefrotoxicidad forman parte de los efectos secundarios de la ciclosporina y podrían ocasionar daño fetal. Se ha descrito toxicidad renal en fetos de ratas y ratones, pero no se ha podido comprobar en humanos, al no haberse observado alteraciones de la función renal en hijos de madres tratadas con ciclosporina durante el embarazo65. Cabe esperar que la ciclosporina pueda actuar como potencial inductor de alteraciones en el desarrollo de los linfocitos T. En un estudio de sangre periférica de niños expuestos a ciclosporina in utero, se observó un empeoramiento en el desarrollo de la función de linfocitos T, B y NK que se evidenció hasta el año de vida. Sin embargo, ninguno de ellos presentó evidencia clínica de inmunodepresión66. Por todo ello, la FDA catalogó la ciclosporina como categoría C en 2008, un tratamiento a evitar en mujeres embarazadas a no ser que el potencial beneficio en la madre supere el potencial riesgo para el feto.
Metotrexato. Categoría X de la Food and Drug AdministrationEl metotrexato (MTX) y su análogo, la aminopterina, son 2 conocidos antagonistas del ácido fólico, mediante la unión irreversible a la dihidrofolato reductasa, y entre cuyos efectos destacan la inhibición de la síntesis de ADN y la supresión de la inflamación. En el caso de la psoriasis, su uso se remonta a 1972, siendo empleado hasta la fecha debido a la gran experiencia clínica acumulada y a su bajo coste. Sin embargo, estas mismas particularidades han motivado la publicación de numerosos casos y series de casos describiendo el efecto de la exposición durante el embarazo, habiéndose llegado a aceptar la existencia de la embriopatía por MTX72. El paso transplacentario del MTX se empezó a estudiar después de comprobar la existencia de aberraciones cromosómicas en hijos de madres que recibían tratamiento en el momento del embarazo y Al-Saleh et al.73 fueron los primeros en confirmarlo. El síndrome MTX/aminopterina incluye retraso en el crecimiento, microcefalia, hipoplasia de huesos craneales, craniosinostosis, pelo frontal elevado, puente nasal amplio, ojos prominentes, orejas de implatación baja, hipoplasia maxilar, pliegues en epicantus, extremidades cortas, hipodactilia y sindactilia74,75. Feldkamp y Carey76 señalaron que el periodo comprendido entre las 6 y las 8 semanas de gestación es el de máximo riesgo, siendo 10mg/semana la dosis límite necesaria para dar lugar a las mencionadas alteraciones fetales. En un esfuerzo por esclarecer este tema, Hyoun et al.72 compararon la proporción de defectos descritos en hijos de madres en tratamiento con MTX y los de hijos de madres sin MTX, y observaron que el aumento de casos de atresia pulmonar, craniosinostosis y deficiencias en extremidades en fetos expuestos a MTX resultaba estadísticamente significativo. En el caso del MTX no hay que olvidar que también se han observado alteraciones en la espermatogénesis en forma de aberraciones cromosómicas, anomalías morfológicas y alteraciones de la movilidad de los espermatozoides. Sin embargo, Beghin et al.78 realizaron una revisión de 42 casos de fetos cuyos padres habían estado expuestos a MTX en el momento de la concepción y concluyeron que no parecía que esta condición se tradujera en un mayor riesgo de presentar alteraciones fetales. Por todo ello el uso de MTX para el tratamiento de la psoriasis en mujeres embarazadas queda contraindicado. A pesar de que el ácido fólico ha demostrado disminuir la tasa de malformaciones del tubo neural, cardiovasculares o del tracto urinario o labio leporino en mujeres embarazadas tratadas con otros antagonistas del ácido fólico, su efecto en el caso del MTX no ha sido estudiado79.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.