Las reacciones granulomatosas «sarcoidosis-like» secundarias a ipilimumab afectarán simultáneamente a múltiples órganos y característicamente se presentarán semanas o meses después de haber iniciado el tratamiento. Paciente varón de 67 años, quien consulta por reacción cutánea granulomatosa a nivel de tronco, extremidades y rostro. Esta se presentó 18 meses después de haber iniciado tratamiento con ipilimumab, medicamento pautado por el diagnóstico de un melanoma metastásico. Reportamos reacción granulomatosa de presentación exclusivamente cutánea, como efecto adverso medicamentoso tardío secundario al tratamiento con ipilimumab. Así mismo resaltamos la necesidad de realizar en los pacientes tratados con ipilimumab un seguimiento prolongado.
Granulomatous sarcoidosis-like reactions affecting multiple organ systems at one time have infrequently been described within weeks to months after initiation of Ipilimumab. We present the first case of a 67-year-old man with isolated cutaneous granulomatous reaction involving the trunk, extremities, and face after eighteen months of treatment with ipilimumab for metastatic melanoma. This case documents the eruption of isolated cutaneous granulomatous reaction as a late treatment-related adverse effect of ipilimumab, highlighting the importance of adequate, prolonged follow-up.
Un varón de 67 años acudió a la consulta de dermatología por prurito generalizado de leve intensidad de seis meses de evolución, acompañado de múltiples lesiones papulosas, coalescentes, localizadas inicialmente en espalda, pero que posteriormente se extienden rápidamente hacia rostro, extremidades superiores e inferiores, dorso de manos y pies, ingle y caderas. Entre los antecedentes patológicos cabe mencionar el diagnóstico de melanoma metastásico (estadio IV). El tumor primario había sido diagnosticado en la piel lumbar, y además el paciente presentaba metástasis en el pulmón, el hígado y en ganglios linfáticos retroperitoneales. Gracias al tratamiento con ipilulumab el paciente se encontraba en remisión completa desde hacía dos años. El ipilimumab se pautó inicialmente a altas dosis (10mg/kg) cada 3 semanas por 4 ciclos (fase de inducción) y posteriormente se pasó a pauta de una infusión cada 3 meses (fase de mantenimiento). El paciente presentó sequedad, alopecia y vitíligo como efectos adversos en relación con el ipilimumab; todos fueron de primer grado, por lo que no fue necesario disminuir la dosis. Además del ipilimumab, el paciente se encontraba en tratamiento con venlafaxina, olmesartán, fexofenadina y ranitidina. No se conocía la existencia de alguna alergia medicamentosa.
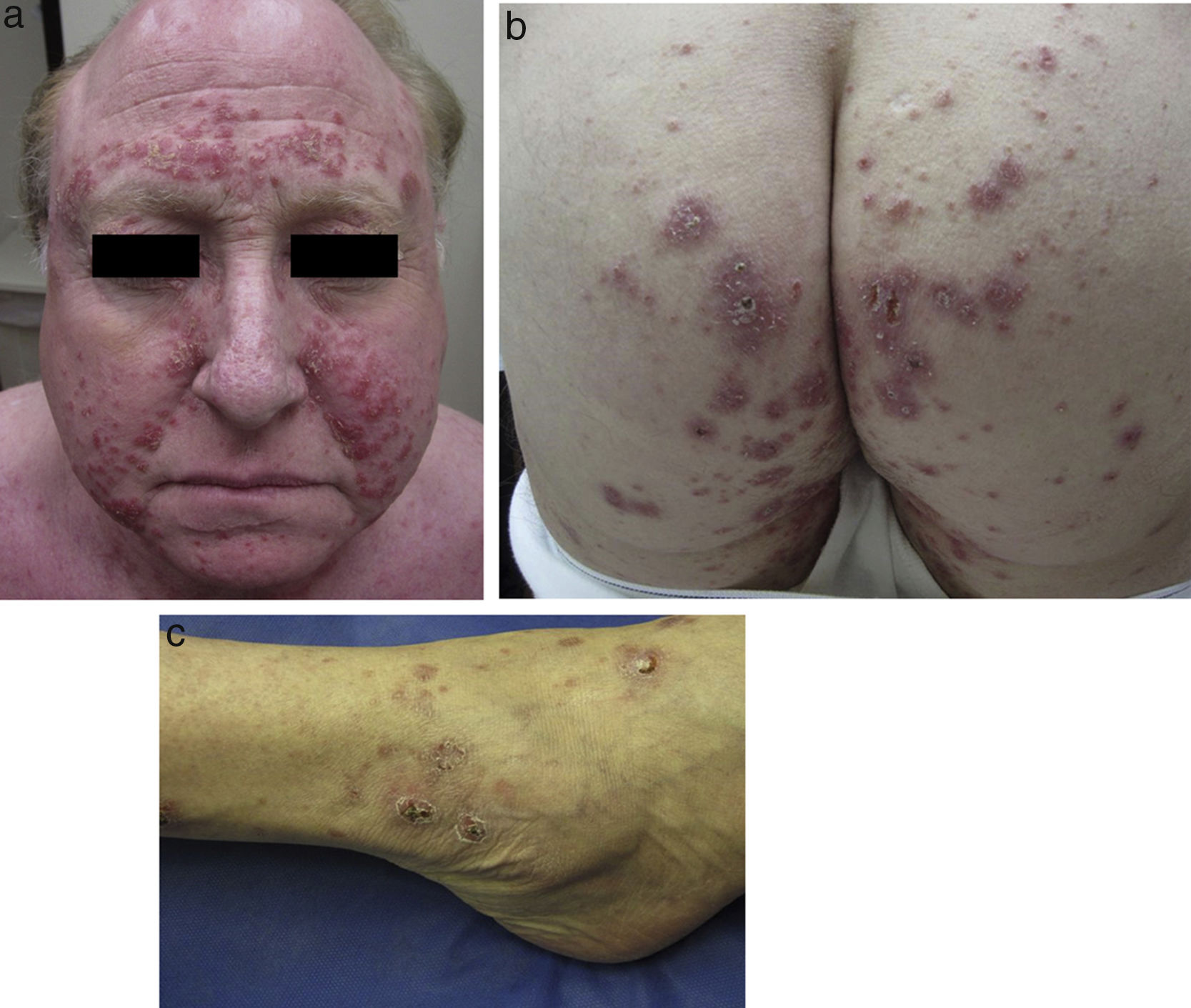
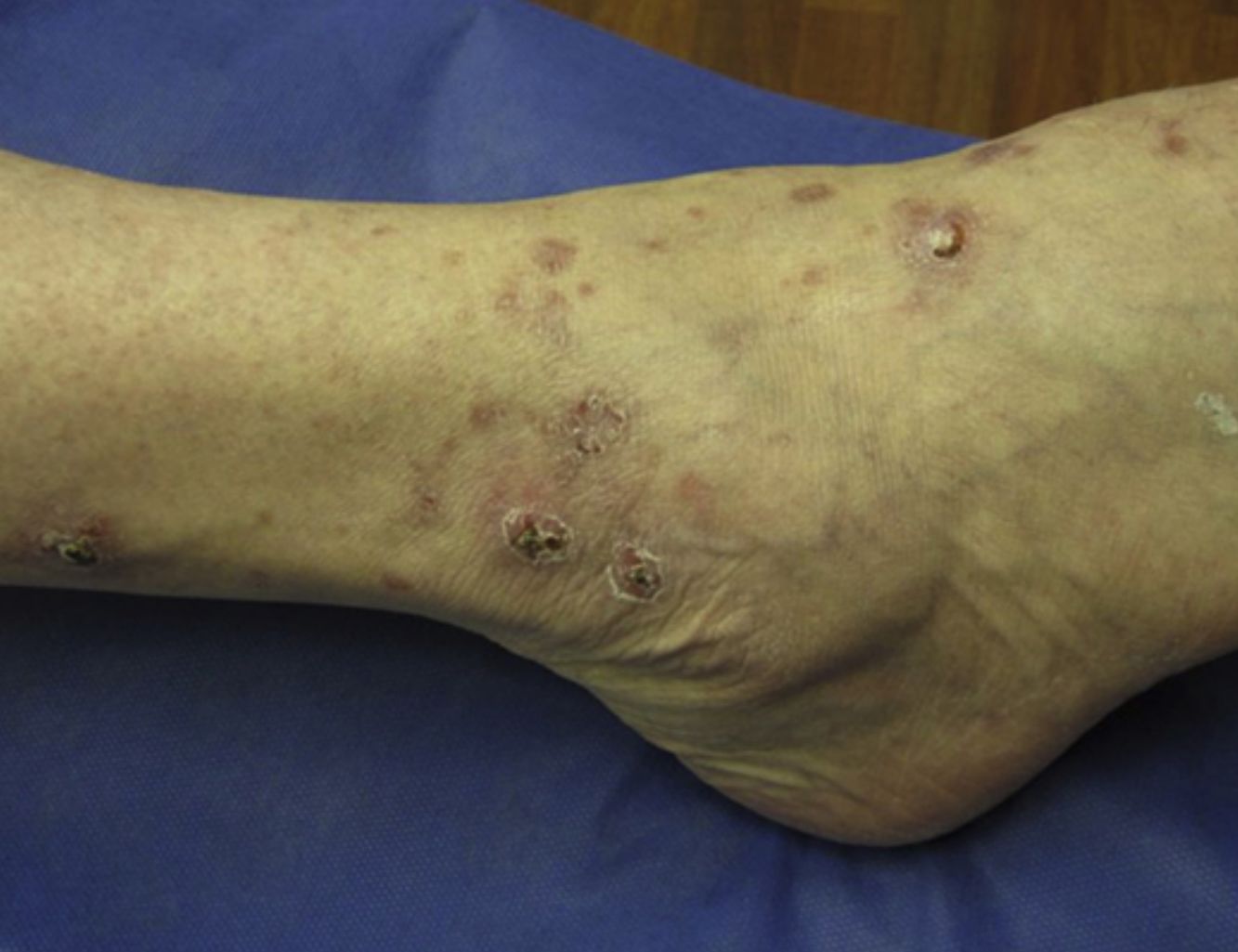
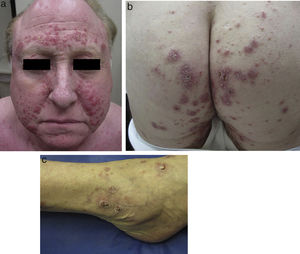
Al examen clínico se evidenciaron múltiples pápulas inflamatorias agrupadas, de aspecto costroso, distribuidas simétricamente a nivel de rostro (a predominio de surcos nasolabiales, arcos supraciliares y glabela) (fig. 1a), así como en cuello, orejas, cuero cabelludo, ingles, espalda, caderas (fig. 1b), codos, muñecas y tobillos (fig. 1c). Analíticamente, tanto la bioquímica sanguínea, el hemograma, el calcio urinario, como la ECA, se encontraban dentro de la normalidad. Los cultivos para micobacterias, bacterias y hongos fueron negativos, así como el PPD y el RPR. Tanto la radiografía de tórax como el PET-TAC no mostraban hallazgos patológicos.
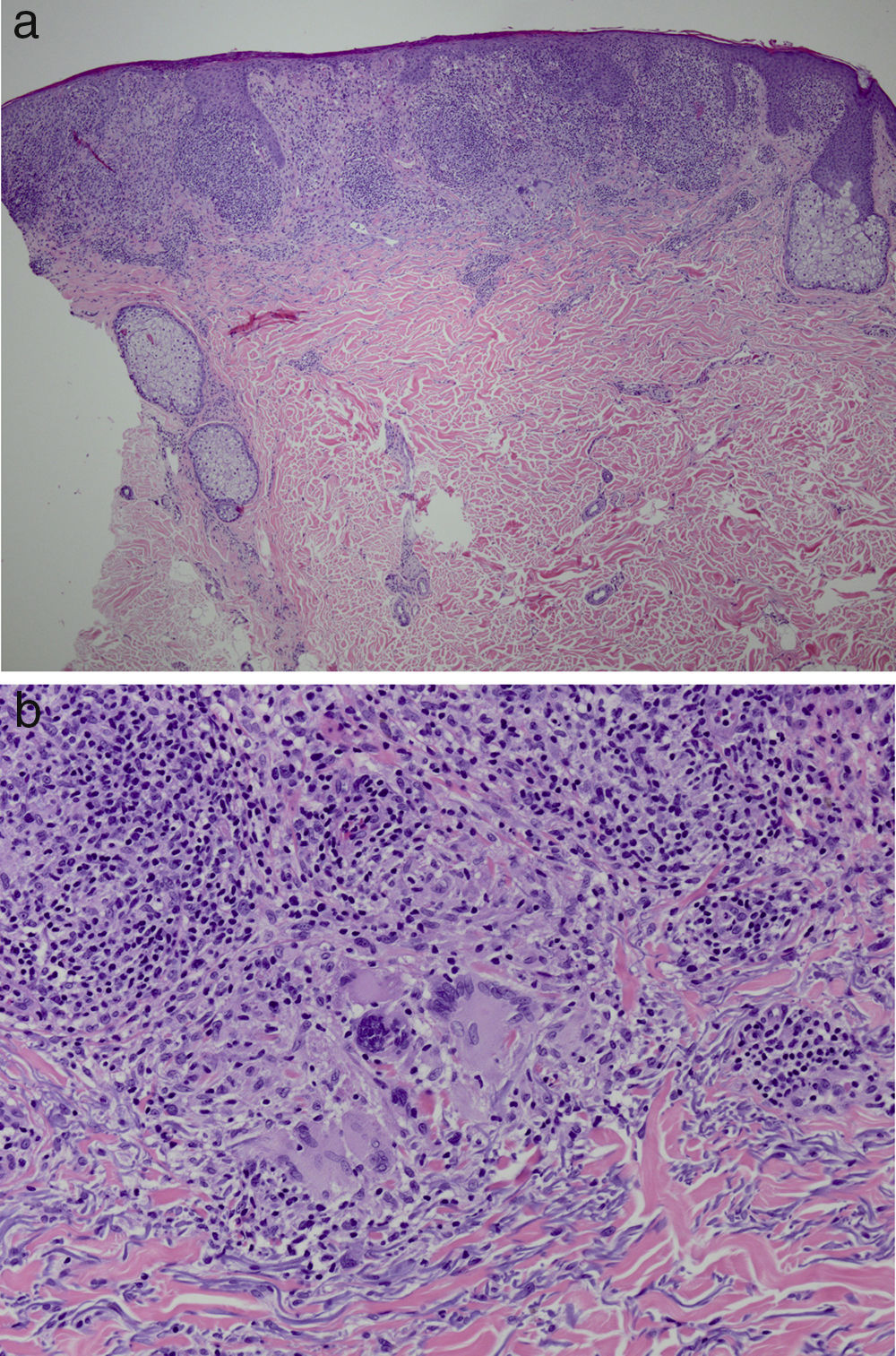
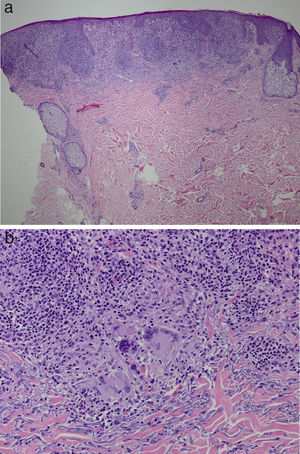
Se decidió biopsiar las lesiones. La histopatología mostraba a nivel de dermis superficial la presencia de granulomas nodulares epitelioides rodeados por linfocitos T. Por otro lado se evidenciaban áreas con epidermotropismo linfocítico, compatibles con una dermatitis granulomatosa (fig. 2 a y b). Se objetivaban escasos linfocitos B CD20 positivo, y el CD30, CD56, CD1a y S100 fueron negativos. El CD58 fue positivo para células gigantes y de igual forma para algunos macrófagos. La mayoría de los linfocitos del infiltrado se marcaban con CD3, CD4 y CD7. La relación CD4:CD8 fue de 2:1. PAS, GMS, giemsa, gram y Fite fueron negativos. Tinciones específicas para treponema de igual forma fueron negativas.
Hallazgos histológicos. Adelgazamiento de la epidermis con una acantosis irregular, discreta espongiosis y paraqueratosis. La dermis papilar está reemplazada casi en su totalidad por granulomas a). Reacción granulomatosa con macrófagos prominentes y células gigantes b). (Hematoxilina y eosina, x10).
Ante los hallazgos clínicos e histológicos se llegó al diagnóstico de una dermatitis granulomatosa secundaria al ipilimumab. Se inició tratamiento con prednisona vía oral, a una dosis de 60mg/día, con lo que el paciente mejoró inicialmente. Sin embargo, tras pauta descendente de predmisona, las lesiones empeoraron. Se pautaron corticoides vía intramuscular y tópica, con lo que el paciente presentó una mejoría clínica relativa. En consenso con oncología, se decide suspender el tratamiento con ipilimumab. Seis meses después de haber suspendido el tratamiento, las lesiones cutáneas se resolvieron completamente. No fue necesario pautar medicación complementaria. En el último control, el paciente se encontraba asintomático y bajo seguimiento tanto por oncología como por dermatología con la finalidad de detectar precozmente la presencia de recidiva tumoral; para lo cual se realiza un PET-TAC cada tres meses así como visitas de seguimiento cada tres a seis meses.
DiscusiónLas dermatosis granulomatosas se caracterizan por presentar un infiltrado inflamatorio predominantemente dérmico, reactivo, no neoplásico, compuesto principalmente por macrófagos tisulares (histiocitos), células epitelioides, así como por células gigantes multinucleadas1. Los granulomas de etiología no infecciosa se pueden observar en el granuloma anular, el granuloma anular elastolítico de células gigantes, la necrobiosis lipoídica, la dermatitis granulomatosa intersticial, la reacción granulomatosa intersticial medicamentosa, la sarcoidosis, las reacciones a cuerpo extraño, así como en neoplasias malignas (ej. micosis fungoides, síndrome de Sézary, enfermedad de Hodgkin, leucemia linfática crónica B, melanoma y otras neoplasias [pulmón, mama, etc.]) entre otras2. Debido a la superposición tanto de las características clínicas como histológicas, el diagnóstico de esta entidad suele ser un reto clínico.
El ipilimumab es un anticuerpo monoclonal humano recombinante (IgG1) que actuará inhibiendo el antígeno asociado 4 de los linfocitos T citotóxicos (CTLA-4), un regulador negativo de la activación de los linfocitos T, gracias al bloqueo de su unión a los receptores B7. Esto conlleva un incremento tanto de la activación/proliferación, como de la producción de la IL-2, causando la amplificación de la respuesta inmune, promoviendo así la inmunidad antitumoral3,4. El ipilimumab fue aprobado por la FDA para el tratamiento del melanoma irresecable o metastásico. Entre los efectos adversos relacionados con el sistema inmune más frecuentes se encuentran la colitis/diarrea, dermatitis5, hepatitis, endocrinopatías, blefaritis5, transaminitits5, uveítis, hipofisitis6, nefritis7–9, tiroiditis5 y la miopatía inflamatoria10–12. Los efectos adversos dermatológicos observados con mayor frecuencia son el exantema morbiliforme, el vitíligo y la alopecia areata13. El exantema morbiliforme se presentará sobre todo a nivel del tronco y extremidades; histológicamente se observará espongiosis epidérmica, edema a nivel de la dermis papilar, así como un infiltrado perivascular compuesto por linfocitos y eosinófilos, y un predominio de linfocitos T CD4 a nivel dérmico10,11. Otros eventos adversos cutáneos, pero que se presentan con menor frecuencia son la presencia de hipopigmentación, prurigo, exantema acneiforme y liquenoide, úlceras simulando un pioderma gangrenoso, toxicidad cutánea en áreas previamente irradiadas, reacciones de fotosensibilidad, síndrome DRESS13, así como el síndrome de Stevens-Johnson/necrólisis epidérmica tóxica13.
Las reacciones granulomatosas «sarcoidosis-like» secundarias al tratamiento con ipilimumab cada vez se presentan con mayor frecuencia12. La sarcoidosis es una entidad granulomatosa multisistémica de etiología desconocida. Esta se suele asociar a neoplasias hematológicas, tumores sólidos y también se ha descrito en relación con medicación antineoplásica. La formación de granulomas se cree que se deberá a una respuesta incontrolada de los linfocitos T helper-1 a antígenos no conocidos. La sobreproducción de IL- 2 e IFN-γ contribuirán además a que se desencadene esta reacción14. La ausencia del bloqueo de la proliferación de los linfocitos T, por ejemplo debido al efecto anti-CTLA-4, podría justificar el desarrollo de estas lesiones granulomatosas, así como ocurre con los linfocitos T autorreactivos en la sarcoidosis15. El mecanismo patogénico exacto por el cual el ipilimumab induce una reacción granulomatosa «sarcoidosis-like» sigue por el momento siendo una incógnita16.
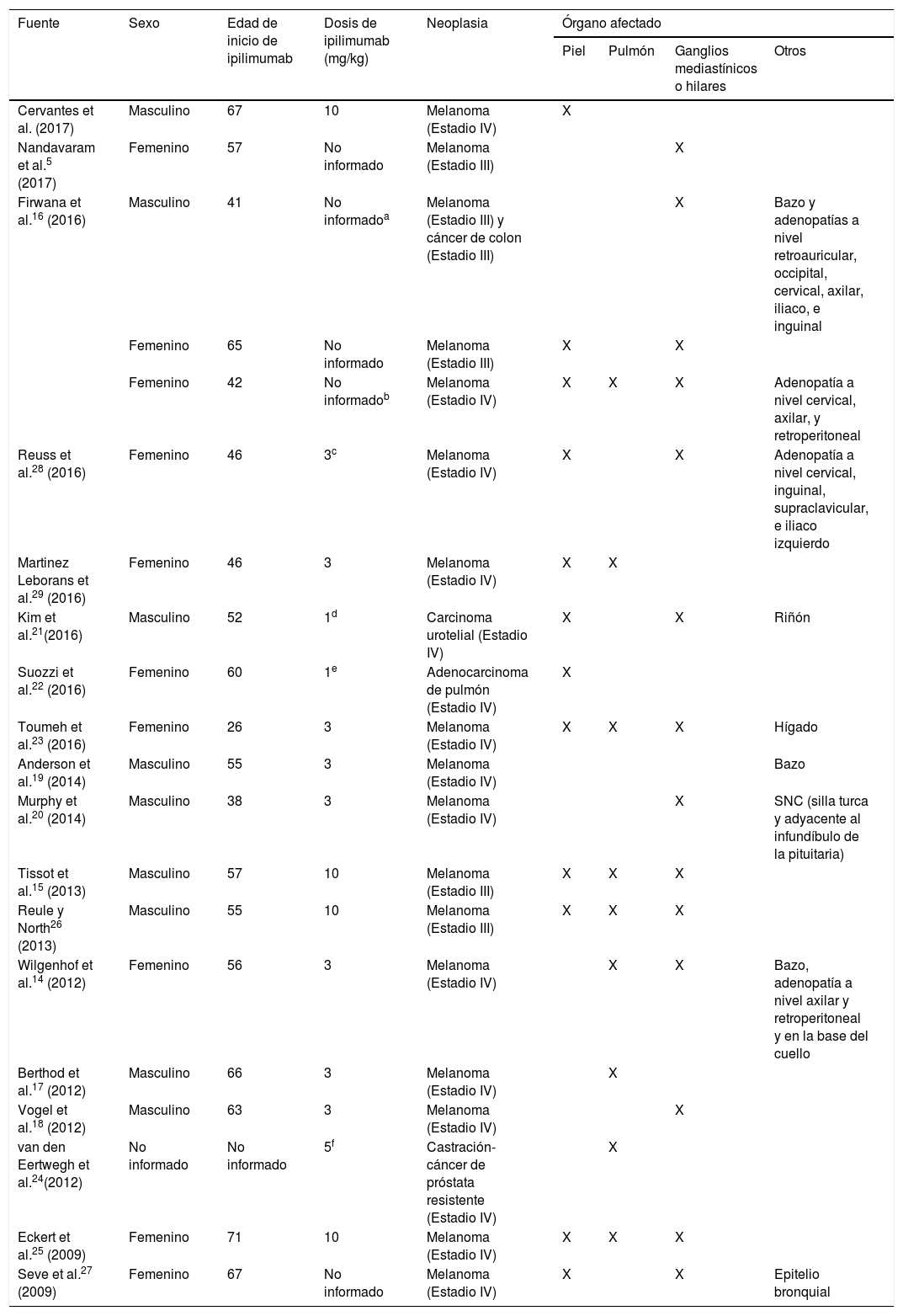
Como efecto secundario al ipilimumab ya se habían descrito el desarrollo de lesiones granulomatosas «sarcoidosis-like» localizadas tanto en mediastino, en pulmón, así como en otras vísceras,5,14,16–24 (tabla 1); Andersen et al.19 reportaron recientemente el caso de un paciente varón, quien veinte meses después de haber iniciado tratamiento con ipilimumab, presentó lesiones granulomatosas localizadas únicamente a nivel esplénico. Sin embargo, si bien existen múltiples publicaciones acerca de lesiones granulomatosas «sarcoidosis-like» inducidas por ipilimumab15,16,21–23,25–29 (tabla 1), la afectación exclusivamente cutánea es considerada excepcional. Por otro lado, a diferencia de los demás casos publicados, donde la reacción granulomatosa se presenta en las primeras semanas o meses, en nuestro paciente esta se dio de forma tardía, 18 meses después de haber iniciado con el ipilimumab. Nuestro paciente presentó una reacción granulomatosa cutánea difusa, 18 meses después de haber iniciado el tratamiento con ipilimumab. La mejoría clínica se logró solo después de que se suspendió el ipilimumab.
Casos clínicos de reacción granulomatosa «sarcoidosis-like» en pacientes con diagnóstico de melanoma u otras neoplasias tratados con ipilimumab
| Fuente | Sexo | Edad de inicio de ipilimumab | Dosis de ipilimumab (mg/kg) | Neoplasia | Órgano afectado | |||
|---|---|---|---|---|---|---|---|---|
| Piel | Pulmón | Ganglios mediastínicos o hilares | Otros | |||||
| Cervantes et al. (2017) | Masculino | 67 | 10 | Melanoma (Estadio IV) | X | |||
| Nandavaram et al.5 (2017) | Femenino | 57 | No informado | Melanoma (Estadio III) | X | |||
| Firwana et al.16 (2016) | Masculino | 41 | No informadoa | Melanoma (Estadio III) y cáncer de colon (Estadio III) | X | Bazo y adenopatías a nivel retroauricular, occipital, cervical, axilar, iliaco, e inguinal | ||
| Femenino | 65 | No informado | Melanoma (Estadio III) | X | X | |||
| Femenino | 42 | No informadob | Melanoma (Estadio IV) | X | X | X | Adenopatía a nivel cervical, axilar, y retroperitoneal | |
| Reuss et al.28 (2016) | Femenino | 46 | 3c | Melanoma (Estadio IV) | X | X | Adenopatía a nivel cervical, inguinal, supraclavicular, e iliaco izquierdo | |
| Martinez Leborans et al.29 (2016) | Femenino | 46 | 3 | Melanoma (Estadio IV) | X | X | ||
| Kim et al.21(2016) | Masculino | 52 | 1d | Carcinoma urotelial (Estadio IV) | X | X | Riñón | |
| Suozzi et al.22 (2016) | Femenino | 60 | 1e | Adenocarcinoma de pulmón (Estadio IV) | X | |||
| Toumeh et al.23 (2016) | Femenino | 26 | 3 | Melanoma (Estadio IV) | X | X | X | Hígado |
| Anderson et al.19 (2014) | Masculino | 55 | 3 | Melanoma (Estadio IV) | Bazo | |||
| Murphy et al.20 (2014) | Masculino | 38 | 3 | Melanoma (Estadio IV) | X | SNC (silla turca y adyacente al infundíbulo de la pituitaria) | ||
| Tissot et al.15 (2013) | Masculino | 57 | 10 | Melanoma (Estadio III) | X | X | X | |
| Reule y North26 (2013) | Masculino | 55 | 10 | Melanoma (Estadio III) | X | X | X | |
| Wilgenhof et al.14 (2012) | Femenino | 56 | 3 | Melanoma (Estadio IV) | X | X | Bazo, adenopatía a nivel axilar y retroperitoneal y en la base del cuello | |
| Berthod et al.17 (2012) | Masculino | 66 | 3 | Melanoma (Estadio IV) | X | |||
| Vogel et al.18 (2012) | Masculino | 63 | 3 | Melanoma (Estadio IV) | X | |||
| van den Eertwegh et al.24(2012) | No informado | No informado | 5f | Castración-cáncer de próstata resistente (Estadio IV) | X | |||
| Eckert et al.25 (2009) | Femenino | 71 | 10 | Melanoma (Estadio IV) | X | X | X | |
| Seve et al.27 (2009) | Femenino | 67 | No informado | Melanoma (Estadio IV) | X | X | Epitelio bronquial | |
En resumen, este caso se puede considerar tanto un reto diagnóstico como terapéutico, ya que la clínica del paciente fue refractaria a altas dosis de corticoides y solo mejoró una vez que se suspendió el ipilimumab. Así mismo resaltamos la importancia de un seguimiento cercano en pacientes tratados con ipilimumab, ya que ha quedado demostrado el riesgo de desarrollar lesiones granulomatosas «sarcoidosis-like» como efecto adverso. Hasta donde sabemos, este es el primer caso descrito de un paciente diagnosticado de melanoma, que ha presentado una reacción granulomatosa con afectación exclusivamente cutánea como efecto secundario al ipilimumab.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al paciente por autorizarnos publicar este caso. Así mismo al Dr. George W. Elgart, del Departamento de Dermatología y Cirugía Cutánea, Facultad de Medicina de la Universidad Miller de Miami, quien nos apoyó con las imágenes histopatológicas y al Dr. Sadegh Amini del Departamento de Dermatología y Cirugía Cutánea, Facultad de Medicina de la Universidad Miller de Miami, quien nos ayudó con este caso. Subrayamos que no han recibido otra gratificación por dicha contribución.