La terapia fotodinámica (TFD) consiste en la aplicación de un fotosensibilizante tópico en la lesión a tratar y su posterior iluminación con una fuente de luz. Su principal indicación es el tratamiento del cáncer de piel no melanoma sin cirugía, con excelente respuesta y resultado cosmético. Su aplicación en las placas de micosis fungoide (MF) en esta última década también ha sido realizada con éxito y se muestra como una alternativa en las terapias dirigidas a la piel. Sus principales ventajas son una buena respuesta, su inocuidad y excelente cosmética. Este artículo revisa los trabajos publicados y la aplicación práctica de la TFD en la MF.
Photodynamic therapy involves the topical application of a photosensitizer to a lesion, which is then subsequently exposed to a light source. It is mainly used in the nonsurgical treatment of nonmelanoma skin cancer, in which it achieves good response and an excellent cosmetic result. In the last 10 years, photodynamic therapy has also been used with some success in the treatment of plaque-stage mycosis fungoides and has emerged as an alternative to skin-directed therapies. Its main advantages are the good response to treatment, lack of toxicity, and excellent cosmetic results. This article reviews the literature and the practical application of photodynamic therapy in mycosis fungoides.
La micosis fungoide (MF) es el linfoma primario cutáneo más frecuente; se calcula que representa aproximadamente el 50% de todos los linfomas cutáneos primarios1. Histológicamente se caracteriza por la aparición de un infiltrado de linfocitos atípicos de núcleo cerebriforme y epidermotropismo2. La MF clásicamente se divide según su presentación clínica en manchas, placas o tumores, si bien existe una amplía variedad de formas de presentación. Todas ellas se incluyen en la última clasificación de la WHO-EORTC de 2007 como «MF y sus variantes y subtipos»3.
La etiopatogenia de la MF no está aclarada, y aún no se ha concretado si los linfocitos T que forman el infiltrado característico de esta dermatosis son reactivos a autoantígenos y su proliferación termina produciendo un linfoma, o se trata de una proliferación neoplásica que aparece de novo4. La acumulación de linfocitos en la piel parece ser debida a un fallo en la apoptosis más que a un aumento de su proliferación5.
La presentación clínica clásica es en forma de manchas o placas persistentes, en ocasiones pruriginosas, generalmente en zonas de piel no fotoexpuesta. Estas lesiones frecuentemente permanecen estables durante años o incluso toda la vida del paciente, pero en ocasiones progresan a lesiones diseminadas, tumorales o afectación extracutánea empeorando el pronóstico de la enfermedad y requiriendo tratamiento sistémico.
La terapia fotodinámica (TFD) es un tratamiento sencillo y local que consiste en la aplicación de un fotosensibilizante tópico, ocluirlo para que sea captado por las células diana y posterior iluminación con una fuente de luz adecuada para su destrucción. Los fotosensibilizantes tópicos más utilizados en Dermatología son el ácido delta-aminolevulínico (ALA) y su éster, el ácido metilaminolevulínico (MAL). Ambos son precursores, a través de la vía de la síntesis del grupo hemo, de la protoporfirina IX (PpIX), que es el compuesto fotosensible. La principal aplicación de la TFD es el tratamiento del cáncer de piel no melanoma sin cirugía, sin embargo en los últimos años se han desarrollado otras indicaciones nuevas y probablemente la MF en placas es la más prometedora.
Aproximación terapéutica general de la micosis fungoideLa tabla 1 resume la estadificación del último documento de consenso publicado en 2011 por la ISCL-EORTC6, que actualiza la previamente publicada por el mismo grupo en 20073 y la de la WHO-EORTC publicada en 20051.
Estadificación de la micosis fungoide del ISCL/EORTC 2011
| TNMB | Descripción |
| Piel | |
| T1 | Manchas, pápulas o placas que afectan a<10% de la piel |
| T2 | Manchas, pápulas o placas que afectan a >10% de la piel |
| T3 | Uno o varios tumores≥1 cm de diámetro |
| T4 | Eritrodermia que afecta>80% de la superficie corporal |
| Ganglios | |
| N0 | Ganglios clínicamente normales |
| N1 | Ganglios clínicamente anormales; histopatología Dutch grado 1 |
| N2 | Ganglios clínicamente anormales; histopatología Dutch grado 2 |
| N3 | Ganglios clínicamente anormales; histopatología Dutch grado 3-4 |
| NX | Ganglios clínicamente anormales sin confirmación histológica |
| Metástasis viscerales | |
| M0 | Sin afectación visceral |
| M1 | Afectación visceral (debe ser confirmada por estudio histológico) |
| Sangre | |
| B0 | Ausencia de afectación<5% de células de Sèzary circulantes |
| B1 | >5% de células de Sèzary sin cumplir criterios de B2 |
| B2 | >1.000 células de Sèzary/mcl o uno de los 3 siguientes: |
| CD4/CD8>10 | |
| Células CD4+/CD7–>40% | |
| Células CD4+/CD26–>30% | |
| Estadio | TNMB |
| IA | T1, N0, M0, B0-1 |
| IB | T2, N0, M0, B0-1 |
| IIA | T1-2, N1-2-X, M0, B0-1 |
| IIB | T3, N0-1-2-X, M0, B0 |
| IIIA | T4, N0-1-2-X, M0, B0 |
| IIIB | T4, N0-1-2-X, M0, B1 |
| IVA1 | T1-4, N0-1-2-X, M0, B2 |
| IVA2 | T1-4, N3, M0, B0-2 |
| IVB | T1-4, N1-2-3-X, M1, B0-2 |
EORTC: European Organisation for Research and Treatment of Cancer; ISCL: International Society for Cutaneous Lymphomas; MF: micosis fungoide; SS: síndrome de Sézary.
Fuente: Olsen E et al.6
La variabilidad en la presentación clínica y la evolución de la MF hace que existan múltiples opciones de tratamiento y algoritmos complejos. Existen varias recomendaciones publicadas acerca del tratamiento de la MF y el síndrome de Sézary (SS). Incluyen las del National Cancer Center Network y las de la European Society of Medical Oncology9. Es importante resaltar que en la MF existen muy pocos ensayos clínicos, ya que es una dermatosis infrecuente, por lo que la evidencia en la que se basan estas guías es limitada.
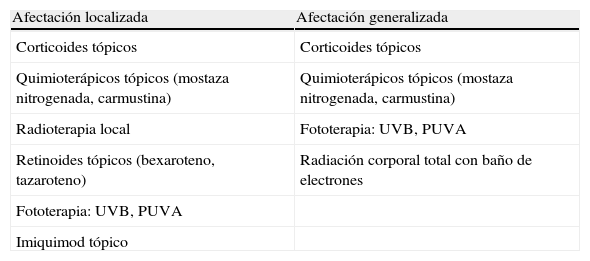
En el manejo de la MF inicial (estadios iA, iiA, iiB) las guías3,6-8 sugieren terapias dirigidas a la piel, en 2 formas: skin limited therapies para enfermedad limitada o localizada y skin generalized therapies, para afectación generalizada de la piel. Estas opciones se resumen en la tabla 2. Los corticoides tópicos son la terapia dirigida a la piel más utilizada en la MF inicial. Si no son eficaces las alternativas más aplicadas son la mostaza nitrogenada, la carmustina, el bexaroteno tópico, la RT local, la escisión quirúrgica o el imiquimod tópico. Cuando las placas son diseminadas el tratamiento más idóneo es la fototerapia (UVB-BE o PUVA), sola o en combinación con terapias sistémicas como bexaroteno, interferón o metotrexato3,6-8.
Tratamientos recomendados para micosis fungoide inicial
| Afectación localizada | Afectación generalizada |
| Corticoides tópicos | Corticoides tópicos |
| Quimioterápicos tópicos (mostaza nitrogenada, carmustina) | Quimioterápicos tópicos (mostaza nitrogenada, carmustina) |
| Radioterapia local | Fototerapia: UVB, PUVA |
| Retinoides tópicos (bexaroteno, tazaroteno) | Radiación corporal total con baño de electrones |
| Fototerapia: UVB, PUVA | |
| Imiquimod tópico |
La TFD, por su forma de aplicación local y limitación en la penetración en la piel, tiene su papel como alternativa prometedora de tratamiento dentro de las terapias dirigidas a la piel de forma localizada (no generalizada). En el resto de los estadios de MF, es decir en estadios avanzados9 (iiB o superior) la TFD no tiene interés, al ser un tratamiento local, aunque se puede usar como tratamiento paliativo en algunas placas o lesiones tumorales de manera ocasional.
Mecanismo de acción de la terapia fotodinámicaEn 1994 Svanberg publicó buenos resultados en 2 pacientes con placas de MF tratadas con TFD10. En ese mismo año Boenhcke demuestra cómo la TFD inhibe la proliferación de los linfocitos de las placas de MF, tanto en estudios in vivo como in vitro11. Posteriormente, en 1995, Rittenhouse-Diakun12 demuestra que los linfocitos malignos de las lesiones de MF expresan más cantidad de CD71 o receptor de transferrina que los linfocitos normales, y que este receptor les proporcionaba mayor capacidad de absorción de hierro y de acumular mayores niveles de protoporfirina ix (PpIX) intracelular, y por tanto ser más sensibles al tratamiento con TFD. Otro autor, Edstrom13, en el año 2000, también demuestra una disminución del infiltrado de linfocitos CD71+ en las placas de MF después del tratamiento con TFD debido a un descenso en su proliferación. El mismo autor en 1998 ya había demostrado la disminución del infiltrado de linfocitos CD4+/CD7- típicos del infiltrado de las placas de MF tras tratamiento con TFD debido a una disminución en su proliferación, sin demostrar la existencia de mecanismos apoptóticos implicados14. Todos estos hallazgos sugieren la capacidad de la TFD de destruir selectivamente los linfocitos malignos de las lesiones de MF.
La mayor capacidad de acumular Ppix intracelular de los linfocitos malignos parece ser debida a su mayor capacidad intrínseca de producción y retención por un metabolismo enlentecido del grupo heme. Esto se debe a varios cambios metabólicos: un aumento de la actividad de la enzima limitante de la producción del grupo heme (porfobilinógeno deaminasa)15, el ciclo celular es más rápido y acelerado en las células tumorales, por lo que la capacidad de captación de ALA es mayor, tienen una mayor densidad mitocondrial y además los valores del pH intracelular son menores16. Por otro lado, la alteración del estrato córneo de la epidermis de las placas favorece la penetración del fotosensibilizante en la piel17.
La respuesta histológica al tratamiento ha sido evaluada en varios de los estudios publicados, si bien los resultados obtenidos no han sido uniformes. Así, Ammann18 y Díez-Recio19 encuentran una curación histológica completa de las placas en respuesta clínica completa y ausencia de infiltrados de linfocitos atípicos tras el tratamiento. Ambos describen cambios pigmentarios con melanófagos, fibrosis de la dermis, atrofia epidérmica y linfocitos residuales en el infiltrado. Sin embargo, Edstrom13 encontró en algunos casos de lesiones clínicamente en respuesta completa la existencia de un infiltrado residual de linfocitos atípicos. Estos hallazgos pueden ser explicados por el límite de penetración de la luz, que puede no llegar a tratar los linfocitos más profundos de las placas de MF. En este sentido, Eich20 trata 8 pacientes con lesiones tumorales de MF mostrando la biopsia posterior una remisión del infiltrado de hasta 1,5mm de profundidad y persistiendo linfocitos atípicos más allá de este límite. Estos hallazgos histológicos obligan al seguimiento de los pacientes en respuesta completa por una posible recidiva, al no haber quedado claro en los estudios publicados si realmente la TFD tiene la capacidad de eliminar totalmente los linfocitos atípicos de la placa. Sin embargo, las repercusiones prácticas de este hallazgo son escasas, ya que los pacientes afectos de MF en placas deben seguirse siempre de forma periódica3,6-8.
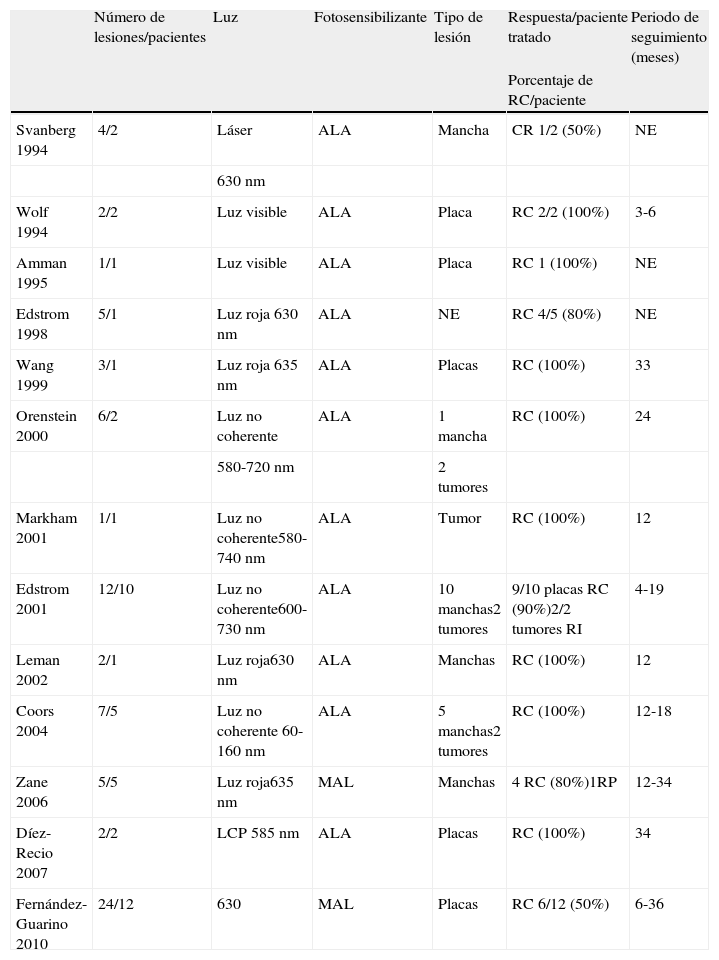
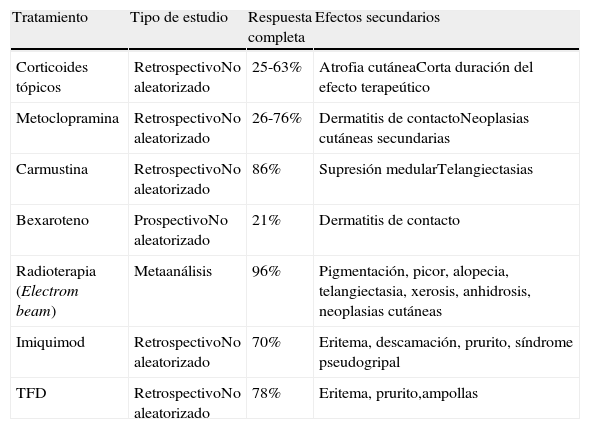
Estudios clínicos publicadosLos estudios publicados de la TFD en la MF se resumen en la tabla 310,13,14,21–28. Suman un total de 45 pacientes con 75 lesiones de MF tratadas con TFD. La mayoría de los autores utilizan ALA y solo en 2 estudios se utiliza su éster, el MAL. La luz roja, coherente o no coherente, es la más utilizada por su mayor penetración en la piel. La respuesta global de todas las lesiones de MF tratadas en todas estas pequeñas series de casos es del 84%, con un 78% en las lesiones maculosas y un 84% en las placas. A pesar de que las lesiones más infiltradas en teoría responden peor a este tratamiento, todas las lesiones tumorales publicadas remitieron. Esto puede deberse a un sesgo de publicación, ya que se tiende a publicar los éxitos pero no los fracasos de los tratamientos. Si comparamos la TFD con otras opciones terapéuticas convencionales de la MF en placas (tabla 4)29, la respuesta es similar o incluso algo superior, con la ventaja de tener menos efectos secundarios. Sin embargo, esta comparación es solo orientativa por la ausencia de homogeneidad en los estudios, su diferente metodología y, sobre todo, la ausencia de ensayos clínicos. La TFD no es comparable a la fototerapia, por ello no se expone en la tabla, ya que la primera tiene su principal aplicación en pacientes con escaso número de lesiones (3-4 máximo) por su aplicación local, mientras que la segunda es especialmente ventajosa en lesiones generalizadas.
Resumen de los estudios publicados del tratamiento de micosis fungoide con terapia fotodinámica
| Número de lesiones/pacientes | Luz | Fotosensibilizante | Tipo de lesión | Respuesta/paciente tratado | Periodo de seguimiento (meses) | |
| Porcentaje de RC/paciente | ||||||
| Svanberg 1994 | 4/2 | Láser | ALA | Mancha | CR 1/2 (50%) | NE |
| 630 nm | ||||||
| Wolf 1994 | 2/2 | Luz visible | ALA | Placa | RC 2/2 (100%) | 3-6 |
| Amman 1995 | 1/1 | Luz visible | ALA | Placa | RC 1 (100%) | NE |
| Edstrom 1998 | 5/1 | Luz roja 630 nm | ALA | NE | RC 4/5 (80%) | NE |
| Wang 1999 | 3/1 | Luz roja 635 nm | ALA | Placas | RC (100%) | 33 |
| Orenstein 2000 | 6/2 | Luz no coherente | ALA | 1 mancha | RC (100%) | 24 |
| 580-720 nm | 2 tumores | |||||
| Markham 2001 | 1/1 | Luz no coherente580-740 nm | ALA | Tumor | RC (100%) | 12 |
| Edstrom 2001 | 12/10 | Luz no coherente600-730 nm | ALA | 10 manchas2 tumores | 9/10 placas RC (90%)2/2 tumores RI | 4-19 |
| Leman 2002 | 2/1 | Luz roja630 nm | ALA | Manchas | RC (100%) | 12 |
| Coors 2004 | 7/5 | Luz no coherente 60-160 nm | ALA | 5 manchas2 tumores | RC (100%) | 12-18 |
| Zane 2006 | 5/5 | Luz roja635 nm | MAL | Manchas | 4 RC (80%)1RP | 12-34 |
| Díez-Recio 2007 | 2/2 | LCP 585 nm | ALA | Placas | RC (100%) | 34 |
| Fernández-Guarino 2010 | 24/12 | 630 | MAL | Placas | RC 6/12 (50%) | 6-36 |
ALA: ácido delta-aminolevulínico; LCP: láser de colorante pulsado; MAL: ácido metilaminolevulínico; NE: no especificado; RC: respuesta completa; RI: respuesta incompleta; RP: respuesta parcial.
Fuente: Svanberg10; Edstrom13,14; Amman18; Wolf21; Wang22; Orestein23; Markham24; Leman25; Coors26; Zane27; Diez-Recio28; Fernandez-Guarino29.
Eficacia publicada y efectos secundarios de los tratamientos habituales en las placas de micosis fungoide y su comparación con la terapia fotodinámica
| Tratamiento | Tipo de estudio | Respuesta completa | Efectos secundarios |
| Corticoides tópicos | RetrospectivoNo aleatorizado | 25-63% | Atrofia cutáneaCorta duración del efecto terapeútico |
| Metoclopramina | RetrospectivoNo aleatorizado | 26-76% | Dermatitis de contactoNeoplasias cutáneas secundarias |
| Carmustina | RetrospectivoNo aleatorizado | 86% | Supresión medularTelangiectasias |
| Bexaroteno | ProspectivoNo aleatorizado | 21% | Dermatitis de contacto |
| Radioterapia (Electrom beam) | Metaanálisis | 96% | Pigmentación, picor, alopecia, telangiectasia, xerosis, anhidrosis, neoplasias cutáneas |
| Imiquimod | RetrospectivoNo aleatorizado | 70% | Eritema, descamación, prurito, síndrome pseudogripal |
| TFD | RetrospectivoNo aleatorizado | 78% | Eritema, prurito,ampollas |
Fuente: modificada de Whittaker et al.29,30.
La mayoría de los trabajos utilizan longitudes de onda largas, sobre los 600nm, en el último pico de absorción de PpIX, para obtener penetraciones significativas en la dermis y así tratar los infiltrados más profundos. Se han utilizado con buenos resultados fuentes de luz láser y no coherentes.
A pesar de la simplicidad de la técnica, los parámetros óptimos no han sido definidos. ALA y MAL se han mostrado eficaces y su tiempo de oclusión es variable según los diferentes protocolos. La dosimetría de la luz y la frecuencia de las sesiones varían mucho de unos a otros trabajos, sin embargo, la necesidad de sesiones repetidas es una constante18,25.
Efectos adversosLas principales ventajas de la TFD en el tratamiento de la MF en placas son su inocuidad, no invasividad, comodidad, sencillez, relativa selectividad, excelente resultado cosmético y ausencia de potencial carcinogénico.
El tratamiento es en general bien tolerado, aunque la mayoría de los estudios describen una leve sensación de quemazón en los pacientes. En los primeros trabajos se realizaban tiempos cortos de iluminación con intensidades altas; sin embargo, en estudios posteriores se comenzó a realizar la iluminación con intensidades más bajas también con buenos resultados y con menor dolor13. El dolor durante la iluminación parece ser muy variable de un paciente a otro27 y los estudios en los que se utilizó MAL como fotosensibilizante en vez de ALA publicaron una excelente tolerancia27,28.
Tras la iluminación es frecuente la aparición de eritema y edema en las placas tratadas, pero la formación de costras y erosiones no es común. Cuando aparecen se resuelven en aproximadamente 2-3 semanas. Tras la respuesta completa de las lesiones pueden quedar leves cambios pigmentarios, siendo más frecuente la hiperpigmentación o la pérdida de pelo27,28.
Diagnóstico de fluorescenciaEl patrón de fluorescencia de las lesiones de MF fue descrito por Orestein23 como débil y difuso en las manchas, e intenso y bien delimitado en las lesiones en placa o tumorales. En este trabajo describió además que la intensidad de la fluorescencia disminuía más rápido en las lesiones en manchas que en las lesiones tumorales.
En nuestra experiencia28 la fluorescencia de las placas de MF es intensa y delimitada. La fluorescencia disminuye de forma paralela a la respuesta clínica, hasta desaparecer en las lesiones en respuesta completa. Así, el diagnóstico de fluorescencia parece una herramienta útil en la monitorización del tratamiento, sin embargo no existen estudios acerca de su superioridad sobre la evaluación clínica.
Aproximación prácticaLa TFD es útil para pacientes con MF en forma de placas aisladas o localizadas en una región no muy extensa. También puede ser una indicación añadida la necesidad de un tratamiento con buen resultado cosmético, como en la cara o en zonas de riesgo de mala cicatrización donde la radioterapia, la mostaza nitrogenada o la carmustina pueden dejar secuelas permanentes y visibles. Las placas situadas en los pliegues axilares o inguinales, donde no llega la fototerapia, también pueden ser tratadas con TFD (tabla 5). Los pacientes con múltiples placas de MF no son buenos candidatos al tratamiento con TFD porque requieren la iluminación de campos separados; estos pacientes deben ser manejados mejor con fototerapia.
Manejo práctico de la terapia fotodinámica para el tratamiento de la micosis fungoide en placas
| Selección del paciente | <3 placas de MF que no hayan respondido a otros tratamientos tópicos.Placas en áreas de difícil tratamiento (cara, piegues) |
| Fotosensibilizante | ALA o MAL |
| Oclusión | ALA 4-12 h/MAL 3 h |
| Fuente de luz | Luz roja, coherente o láser (±600 nm) |
| Frecuencia | Cada 2-4 semanas |
| Número de sesiones | Máximo de 6 |
| Seguimiento | Cada 3 meses después de finalizar el tratamiento |
A pesar de la simplicidad de la técnica los parámetros óptimos de tiempo de oclusión, tiempo de iluminación y fluencia no han sido establecidos por la ausencia de ensayos clínicos. Tanto ALA como MAL han sido utilizados con buenos resultados, pero el tiempo de oclusión es variable de un estudio a otro. En general se deben utilizar los tiempos habituales de oclusión de ambos fotosensibilizantes, 4-16 h para el ALA y 3 h para el MAL en ausencia de más estudios21–28.
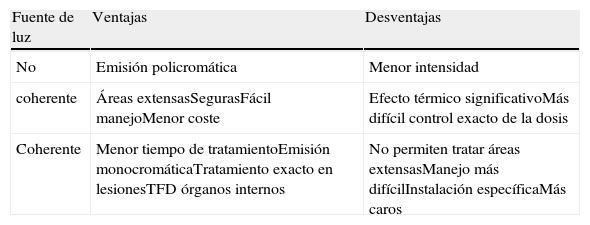
Las fuentes de luz más adecuadas son las de «luz roja» en torno a 630nm, que ofrecen una penetración máxima y acción sobre el espectro de la PpIX en su última banda de absorción. Se han mostrado eficaces tanto las fuentes coherentes como no coherentes, así que la elección de una u otra dependerá de la disponibilidad del sistema o de la preferencia del dermatólogo (la tabla 6 resume las diferencias entre ambas). El láser de colorante pulsado (LCP) es la fuente de luz láser más utilizada y más adecuada para la TFD, ya que emite luz a 595nm (cercano al 630nm ideal).
Diferencias entre fuentes de luz coherentes y no coherentes y su aplicación en terapia fotodinámica
| Fuente de luz | Ventajas | Desventajas |
| No | Emisión policromática | Menor intensidad |
| coherente | Áreas extensasSegurasFácil manejoMenor coste | Efecto térmico significativoMás difícil control exacto de la dosis |
| Coherente | Menor tiempo de tratamientoEmisión monocromáticaTratamiento exacto en lesionesTFD órganos internos | No permiten tratar áreas extensasManejo más difícilInstalación específicaMás caros |
La dosimetría varía mucho de unos a otros trabajos. En general, al no haber estudios propios para la MF, mantener las dosis utilizadas para las indicaciones aprobadas que se manejan de forma habitual es preferible para obtener eficacia sin efectos secundarios. En el caso de las fuentes de luz láser, y a pesar de que existen muchos estudios que demuestran su efectividad, aún no se conocen sus parámetros idóneos ni siquiera para el tratamiento de indicaciones aprobadas. Puesto que el objetivo es iluminar las zonas a tratar se deben manejar dosis bajas (subpurpúricas) en varias pasadas hasta cubrir toda la placa.
Para el tratamiento de la MF con TFD son necesarias sesiones repetidas, aunque la frecuencia exacta de las sesiones tampoco ha sido definida. La mayoría de los autores administran las sesiones cada 2-4 semanas. Esta frecuencia permite la resolución de las posibles costras de una a otra sesión y facilita la adherencia al tratamiento del paciente que se tiene que desplazar al hospital. El número total de sesiones se decide de acuerdo a la respuesta clínica, y es muy variable de un estudio a otro (2-18)21–28. Quizá un total de 6 sesiones es un número adecuado antes de suspender el tratamiento y pensar en otra opción si no se ha evidenciado respuesta.
Las lesiones tumorales no deben ser tratadas con TFD. A pesar de los buenos resultados publicados por algunos autores, otros no han obtenido respuesta13. Por otro lado, la luz roja penetra 1-2mm en la piel, por lo que los linfocitos más profundos no son tratados20. En algunos estudios se ha comunicado fracaso en el tratamiento de placas de gran tamaño, por lo que es recomendable evitar tratar lesiones mayores de 7,5cm de diámetro14.
Después del tratamiento se debe siempre seguir al paciente de forma periódica, ya que placas clínicamente curadas pueden no estarlo histológicamente y se han descrito recaídas tardías13,19,20.
ConclusionesLa TFD es una buena alternativa bien tolerada y con buen resultado cosmético para el tratamiento de placas localizadas de MF. Es un tratamiento especialmente útil en placas que no responden a tratamientos habituales o en áreas difíciles de tratar como la cara, zonas con riesgo de mala cicatrización o los pliegues. La TFD no es un tratamiento adecuado para las lesiones tumorales de MF, placas de gran tamaño o muy numerosas. La TFD obtiene mejoría clínica de las placas de MF, pero no las cura, por lo que es necesario el seguimiento periódico de los pacientes tras el tratamiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.