Los fármacos biológicos han mostrado un excelente perfil en el tratamiento de la psoriasis moderada-grave. Sin embargo, existen situaciones de la práctica clínica habitual que se pueden beneficiar de combinaciones con los diferentes fármacos sistémicos, asi como de la fototerapia, permitiendo mejorar la eficacia, disminuir toxicidades o reducir los costes de tratar la enfermedad psoriásica. Hasta ahora la experiencia publicada de estas combinaciones es escasa pero los resultados son en muchos casos satisfactorios. En esta revisión se repasan las experiencias publicadas más relevantes con respecto a la combinación del fármaco biológico con más experiencia en este campo, etanercept, con metotrexato, acitretina, ciclosporina y fototerapia con ultravioleta B de banda estrecha. La experiencia procedente de la literatura puede ayudar a la hora de tomar decisiones importantes en el manejo de fármacos biológicos y sistémicos en la psoriasis moderada-grave.
Biologic drugs have provided excellent results in the treatment of moderate to severe psoriasis. Nevertheless, in routine clinical practice, combinations of biologic drugs with phototherapy or systemic drugs can increase efficacy, diminish toxicity, and reduce the cost of treatment. Published experience with these combinations is scarce, although the results are often satisfactory. This review examines the most relevant published experience in the combination of the most studied drug in this field—etanercept—with methotrexate, acitretin, ciclosporin, and narrowband UV-B phototherapy. Findings reported in the literature can help when taking major decisions on the management of biologic and systemic drugs in moderate to severe psoriasis.
Tras la aparición de la terapia biológica en psoriasis se pensó que los fármacos sistémicos aprobados en el control de las psoriasis moderadas y graves quedarían en segunda línea y pasarían a ser un mero puente para acceder a la terapia biológica. Sin embargo, con el paso del tiempo y a pesar de los excelentes resultados cosechados en el tratamiento de la enfermedad psoriásica con la terapia biológica, la experiencia clínica ha permitido demostrar que una combinación con un fármaco sistémico o con fototerapia puede permitir resolver situaciones que no pueden ser manejadas con un fármaco biológico en exclusiva. Aunque el potencial papel de las combinaciones ya había sido abordado por otras especialidades que comenzaron antes el manejo de los fármacos biológicos, como la reumatología, existen escenarios específicos de la psoriasis que deben ser evaluados de forma individualizada. El éxito de la terapia combinada se basa en el efecto aditivo o sinérgico que se consigue al combinar 2 fármacos con diferentes mecanismos de acción. Este hecho nos permite, bien aumentar la eficacia que tendrían por separado estos fármacos en monoterapia, bien conseguir la misma eficacia pero con menores dosis de ambos fármacos. Todo esto hace que la combinación de biológicos y sistémicos permita, potencialmente, incrementar la eficacia disminuyendo toxicidades y también el coste económico del tratamiento de la psoriasis moderada-grave1–3.
En esta revisión se abordará la combinación de etanercept (ETN) con los diferentes fármacos sistémicos convencionales utilizados en el tratamiento de la psoriasis moderada-grave y con la fototerapia4,5.
Combinación de metotrexato y etanerceptMetotrexato (MTX) es un fármaco que ha demostrado una gran efectividad en psoriasis. Es uno de los tratamientos más usados en pacientes con psoriasis en placas moderada y severa en Europa6. A pesar de ello, aproximadamente un 50% de los pacientes tratados no responderán a la monoterapia, y su toxicidad acumulada representa un incremento del riesgo de hepatotoxicidad y de toxicidad hematológica que limitan su utilización a largo plazo7.
La combinación de ETN y MTX viene avalada en primer lugar por estudios en artritis reumatoide que demuestran su superioridad frente a ETN o MTX por separado8–10. La experiencia en psoriasis es más limitada. En el estudio EDUCATE, uno de los primeros ensayos clínicos en valorar el uso de ETN en artropatía psoriásica (APs), de los 77 pacientes en tratamiento con MTX al inicio del estudio un 29% fueron capaces de suspenderlo y un 7% de reducir la dosis después de la introducción de ETN11. Yamauchi et al. publicaron una serie de 6 pacientes con psoriasis en los que la introducción de ETN permitió la suspensión gradual de MTX, consiguiendo una respuesta clínica mantenida sin presentar empeoramiento o rebote de la psoriasis12.
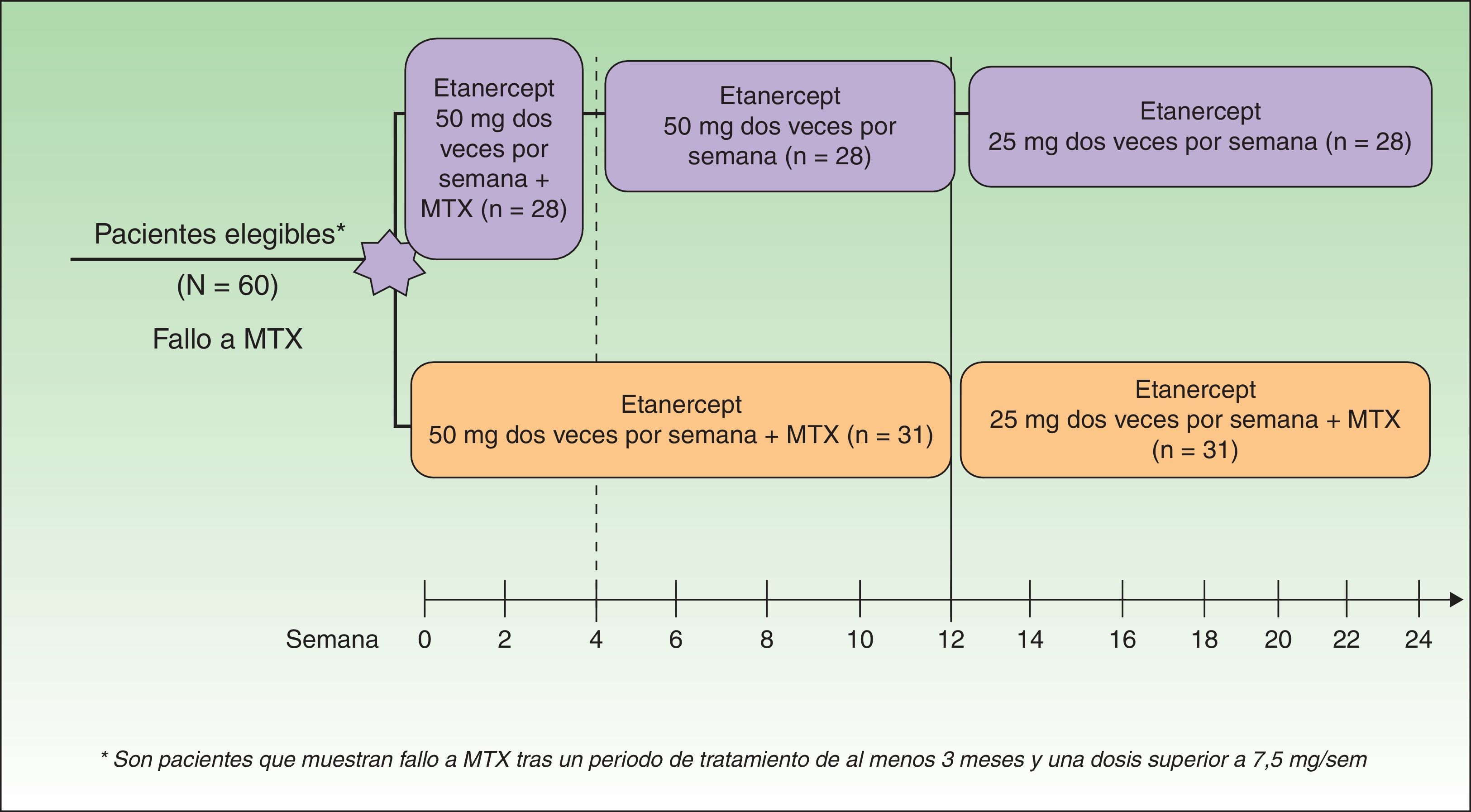
En el año 2008 Zachariae y Driessen publicaron 2 importantes estudios13,14. Zachariae et al. evaluaron la eficacia de la combinación de ETN con MTX de forma continuada frente a ETN en monoterapia al discontinuar MTX tras 4 semanas, en pacientes que no respondían de forma adecuada a MTX13 (fig. 1). La combinación de ETN y MTX consiguió una respuesta PGA 0-1 en el 66,7% de los pacientes en la semana 24 frente al 37% de pacientes con ETN en monoterapia. Además se alcanzó el PASI 75 en un 70% de los pacientes después de 24 semanas de tratamiento. Según este trabajo, el uso combinado de ETN y MTX en pacientes con fallo previo a MTX podría ser una opción más eficaz que cambiar a ETN en monoterapia, circunstancia que permite sugerir un efecto sinérgico entre ambos tratamientos sin incremento de los efectos adversos en la combinación. Driessen et al. estudian en una pequeña serie de 14 pacientes procedentes de la práctica habitual en los que se combinó el tratamiento con etanercept y MTX14, bien por respuesta insuficiente a la monoterapia con ETN o con MTX14 y con el objetivo de completar la transición hasta la suspensión del MTX evitando el rebote de la enfermedad14. La respuesta satisfactoria observada en algunos casos en los que tanto MTX como ETN habían proporcionado una respuesta insuficiente podría hacer pensar de nuevo en el efecto sinérgico de la combinación atribuible a sus diferentes mecanismos de acción. No se encontraron alteraciones en el perfil de seguridad, aparte de la elevación de transaminasas observada en 5 pacientes, que por otra parte no requirió el cese del tratamiento. Los autores concluyen que la combinación de ETN con MTX es razonable cuando la eficacia en monoterapia es insuficiente o cuando se espera un rápido deterioro de la psoriasis al retirar MTX (transición).
Diseño del estudio.
Fuente: Zachariae et al.13.
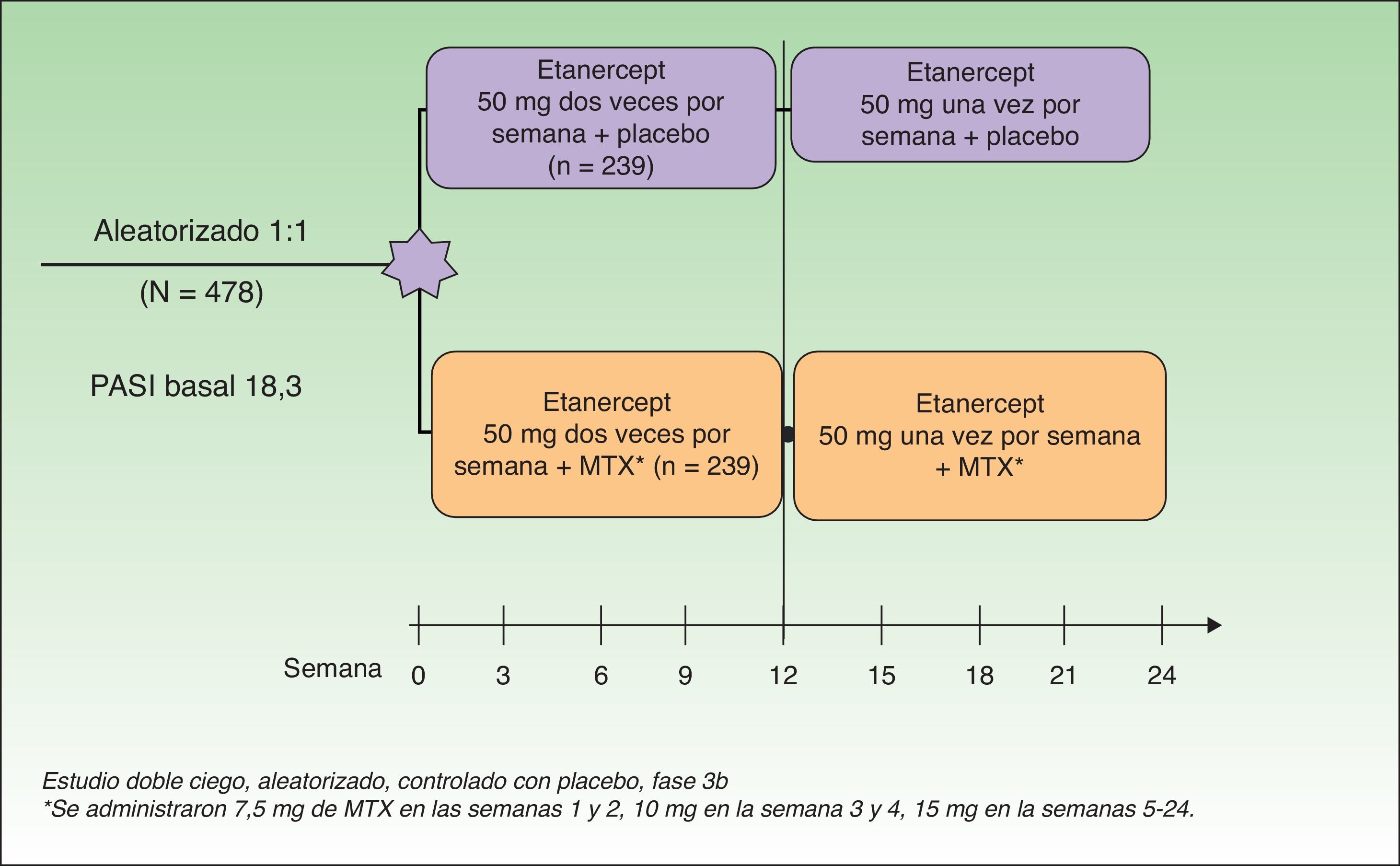
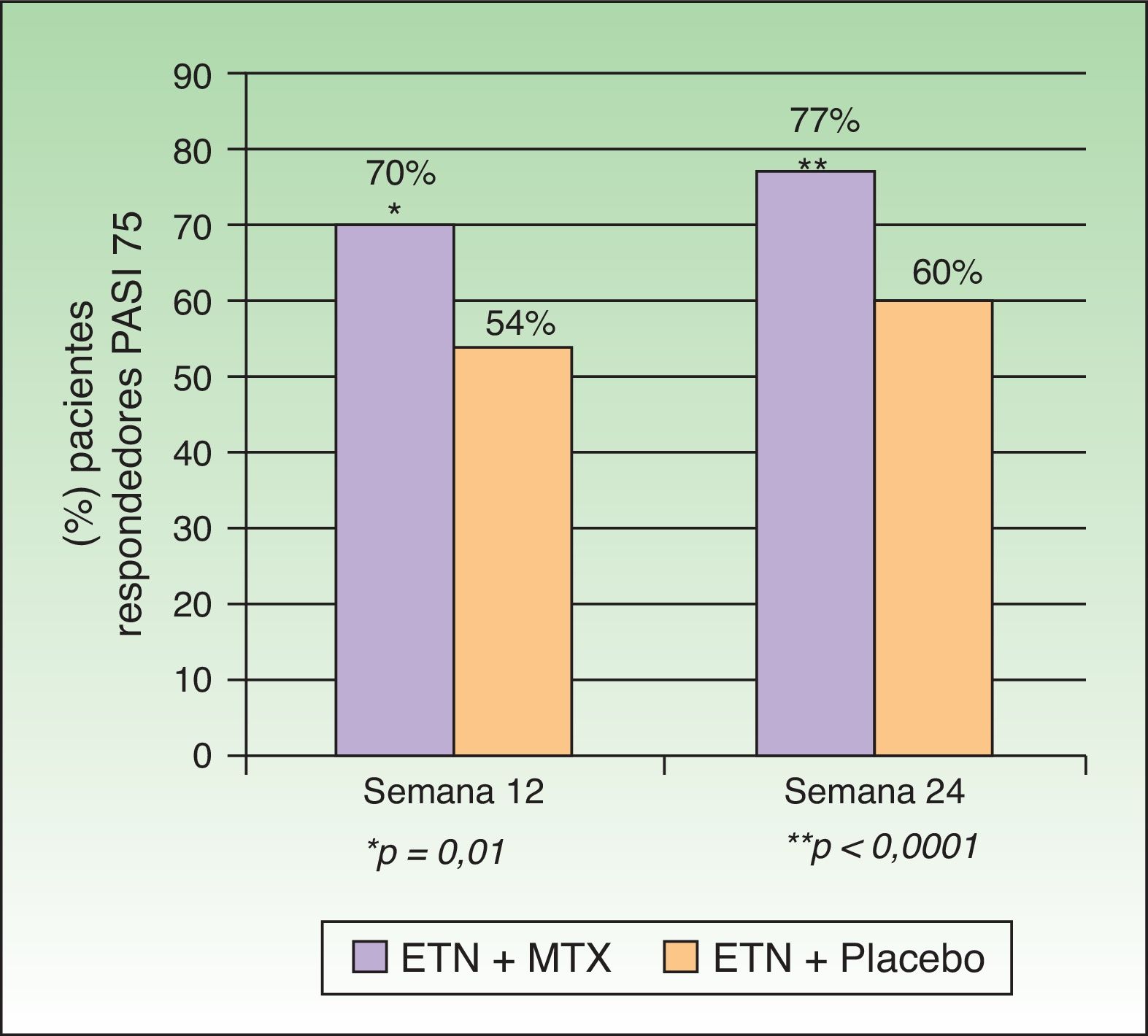
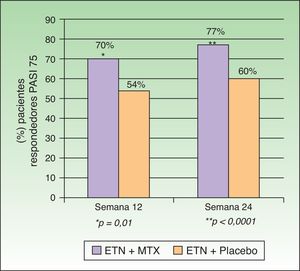
Gottlieb et al. desarrollaron en 2012 un estudio doble ciego aleatorizado controlado con placebo cuyo objetivo era evaluar la eficacia y seguridad de la combinación de ETN y MTX frente a ETN en monoterapia en pacientes que no hubieran fallado previamente a monoterapia con MTX o con ETN. En un primer grupo (monoterapia, n=239) se administró ETN 50mg 2 veces por semana junto a placebo hasta la semana 12 y a partir de la semana 12 ETN 50mg una vez por semana con placebo hasta la semana 24. En un segundo grupo (tratamiento combinado, n=239) se administró la misma dosis de ETN sustituyendo el placebo por MTX (7,5mg de MTX en las semanas 1 y 2, posteriormente 10mg en la semana 3 y 4 hasta un máximo de 15mg o hasta alcanzar la dosis máxima tolerada en las semanas 5 a 24) (fig. 2). En la semana 24 el PASI 75 fue significativamente mayor en el grupo de terapia combinada (77,3%) que en el de monoterapia (60,3%). Esta diferencia de respuesta a favor del tratamiento combinado se observaba ya en la semana 12 (PASI 75 70,2% vs 54,3%) (fig. 3), así como para la respuesta PASI 90 en la semana 12 (34% vs 23,1%) y en la semana 24 (53,8% vs 34,2%). En cuanto a la seguridad, aunque una mayor proporción de pacientes del grupo de terapia combinada experimentaron más acontecimientos adversos que los de monoterapia (74,9% vs 59,8%), la mayoría fueron de intensidad leve o moderada. El aumento de transaminasas fue más frecuente en el grupo combinado (7 pacientes) que en el grupo de monoterapia (4 pacientes) y la retirada de tratamiento por esta causa fue también de más pacientes en la terapia combinada (4 pacientes) que en la monoterapia (2 pacientes). Sin embargo, estos aumentos no fueron considerados en ningún caso graves en ninguno de los pacientes, y no se pudo determinar si la elevación de transaminasas estaba relacionada solo con MTX o por el efecto aditivo con ETN. Hubo muy pocas suspensiones por efectos adversos en ambos grupos y en ningún caso fueron por efectos adversos graves o infecciones graves. No hubo infecciones oportunistas ni muertes.
Diseño del estudio.
Estudio doble ciego, aleatorizado, controlado con placebo, fase 3b.
Fuente: Gottlieb et al.15.
Porcentaje de pacientes respondedores PASI 75 en semanas 12 y 24 con ETN+MTX o ETN+placebo.
Fuente: Gottlieb et al.15.
En conclusión, la combinación de ETN más MTX demostró mayor eficacia que ETN en monoterapia en relación con la respuesta PASI 50, 75 y 90, tanto en la semana 12 como en la semana 24 con una seguridad aceptable. Hasta un 77,3% de los pacientes en tratamiento combinado alcanzaron una respuesta PASI 75 en la semana 24, y además el efecto de añadir MTX en la fase de inducción de 12 semanas de ETN incrementó la respuesta PASI 75 hasta el 70% de los pacientes.
La combinación de MTX y ETN se ha relacionado también en alguna publicación con una mayor supervivencia del tratamiento de pacientes con APs. Kristensen et al. comprobaron cómo en un registro sueco de pacientes con APs los pacientes tratados con la combinación de MTX con anti-TNF se relacionaban con una mayor supervivencia de los anti-TNF consecuencia de una menor frecuencia de acontecimientos adversos16. Por otro lado, en un registro danés de pacientes con psoriasis tratados con biológicos (DERMBIO) no se demostró mayor supervivencia en general en los tratados en combinación con MTX, pero sí en un subgrupo de pacientes que previamente habían fallado a un anti-TNF y recibieron MTX con el siguiente biológico17.
En cuanto a la seguridad, en los estudios que hemos comentado de psoriasis la combinación de ETN y MTX se ha mostrado segura y bien tolerada, lo que vendría a apoyar los estudios realizados en artritis reumatoide, con un número considerable de pacientes y con seguimientos de hasta 10 años8–10. En el estudio CORRONA se evaluaron los efectos adversos de la combinación de MTX con anti-TNF en pacientes con artritis reumatoide, sin que se identificara un riesgo mayor de infecciones en los pacientes en combinación frente a los pacientes en monoterapia18.
Combinación de acitretina y etanerceptAlgunos autores consideran que acitretina (ACI) es el fármaco ideal para su uso en combinación con los fármacos biológicos, puesto que no es un fármaco inmunosupresor y puede actuar de forma sinérgica con estos sin incrementar el riesgo de toxicidad1,4. Además, sus propiedades preventivas sobre el cáncer de piel pueden tener un valor añadido en el caso de pacientes con psoriasis moderada-grave en los que ETN, como otros fármacos sistémicos utilizados para el tratamiento de psoriasis, podría incrementar el riesgo de carcinoma escamoso19–21.
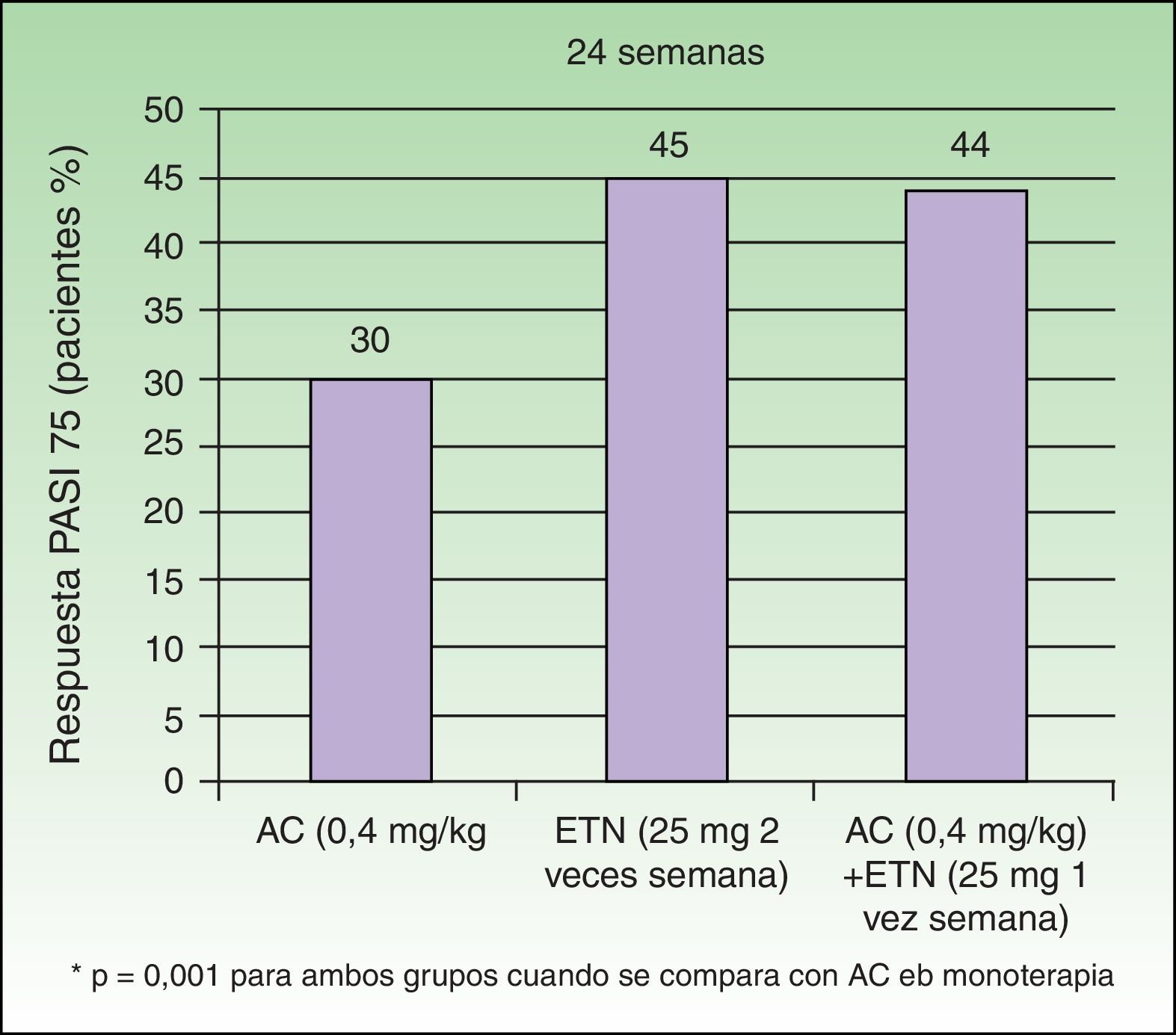
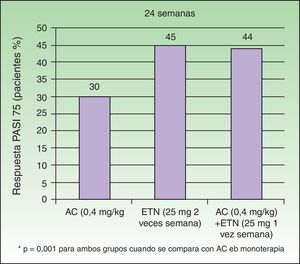
Gisondi et al. comprobaron en un estudio sobre 60 pacientes con psoriasis moderada-grave cómo la combinación de dosis bajas de ETN 25mg/semana con acitretino oral a dosis de 0,4mg/kg/día permitía conseguir resultados similares a los obtenidos con dosis de ETN 25mg/2 veces por semana22. En la semana 24 la proporción de pacientes que alcanzaron el PASI 75 fue similar entre los grupos tratados con ETN en monoterapia y ETN+ACI (45% y 44% respectivamente) mientras que la eficacia del tratamiento con ACI en monoterapia resultó ser significativamente menor (30%) (fig. 4). El perfil de seguridad fue similar en los 3 grupos. Estos resultados avalan que esta combinación permitiría reducir los costes derivados del tratamiento al utilizar únicamente 25mg semanales de ETN manteniendo una tasa de respuesta similar a la obtenida con la dosis habitual de 50mg semanales. Una pregunta que se plantea es si la combinación de ACI con ETN a dosis habituales conseguiría potenciar la eficacia del ETN mejorando su respuesta inicial, o la de los pacientes no respondedores4,22. En cuanto a la seguridad, el tratamiento combinado no se asoció con una mayor frecuencia de efectos adversos, tales como alteraciones en las concentraciones séricas de AST, ALT, colesterol o triglicéridos.
Porcentaje de pacientes que obtiene PASI 75 a las 24 semanas según grupo.
Fuente: Gisondi et al.22.
En una revisión retrospectiva de 15 pacientes tratados con ACI (10-50mg/día) en combinación con un fármaco biológico (4 de ellos con ETN), Smith et al. concluyeron que este régimen de tratamiento era una opción terapéutica válida para aquellos pacientes con psoriasis refractaria a otros tratamientos23. Se han descrito también casos aislados de tratamiento con esta combinación como una pustulosis palmo-plantar con artro-osteítis tratada con ETN y ACI24.
Combinación de ciclosporina y etanerceptLa ciclosporina (CsA) es un fármaco muy utilizado en pacientes con psoriasis moderada-grave, gracias a su efecto inmunosupresor sobre los linfocitos T. Es uno de los medicamentos disponibles para la psoriasis de acción más rápida y eficaz. Sin embargo, la toxicidad renal, su asociación a hipertensión arterial y su potencial carcinogénico limitan su uso1,25.
En la revisión realizada por Segaert acerca de ETN y sus posibles combinaciones concluye que desde el punto de vista de seguridad es la combinación teóricamente menos aconsejable por sus efectos inmunosupresores (favoreciendo la malignidad e infecciones graves)4. En un estudio sobre APs se evaluó la eficacia y seguridad de añadir CsA a ETN en 11 pacientes con APs con buen control articular pero insuficiente resultado cutáneo26. En este trabajo la adición de CsA a dosis de 3mg/kg día durante 24 semanas permitió una respuesta PASI 75 en 9 de estos 11 pacientes en la semana 24. En un estudio sobre 7 pacientes Lee et al. propusieron la combinación de dosis bajas de CsA (200mg/d) junto con ETN (50mg por semana) en pacientes con historia previa de mala respuesta a fármacos sistémicos con un control parcial o pobre de su psoriasis27. Tras conseguir el control de la enfermedad en una primera fase, tanto las dosis de CsA como las de ETN se reducían en la fase de mantenimiento (100mg/d en el caso de la primera y 25mg cada 2 semanas para el segundo). Un 85% de los pacientes alcanzaron una respuesta PASI 90 tras una media de 6,85 semanas. Posteriormente, la media de tiempo de seguimiento de los pacientes en terapia de mantenimiento fue de 56,5 semanas. La disminución media del PASI fue del 94,9% en el periodo inicial y del 93,2% tras el descenso de dosis en el periodo de mantenimiento. El PASI medio en el periodo de mantenimiento se mantuvo en 1,25, mientras que al final del periodo inicial había sido de 0,94. El tratamiento fue bien tolerado sin cambios significativos en las pruebas de laboratorio ni efectos adversos graves ni alteraciones en el estado inmunológico de los pacientes después de un año. Para estos autores la combinación de CsA y ETN, debido a la sinergia por sus diferentes mecanismos de acción, consigue un rápido y más eficaz efecto que el tratamiento de ETN en monoterapia. Este hecho permitiría reducir la dosis de ambos fármacos, y por lo tanto la toxicidad de la CsA y el coste de ETN. Aunque en los casos publicados no hay infecciones graves o casos de malignidad, el potencial inmunosupresor de esta asociación puede ofrecer dudas en relación con neoplasias hematológicas y cáncer cutáneo no melanoma. Por tanto, no es aconsejable la combinación a largo plazo, sino de manera puntual, pudiendo utilizarse de manera alternativa en psoriasis refractarias como las de este estudio27.
Atzeni et al. no encontraron diferencias en un grupo de 41 pacientes tratados bien con la combinación de ETN (50mg/semana) y CsA (3mg/Kg día) o ETN (50mg/semana) y MTX (7,5-15mg/semana) en pacientes con APs moderada/severa28, aunque la combinación de ETN y CsA fue más eficaz en la reducción de la afectación cutánea.
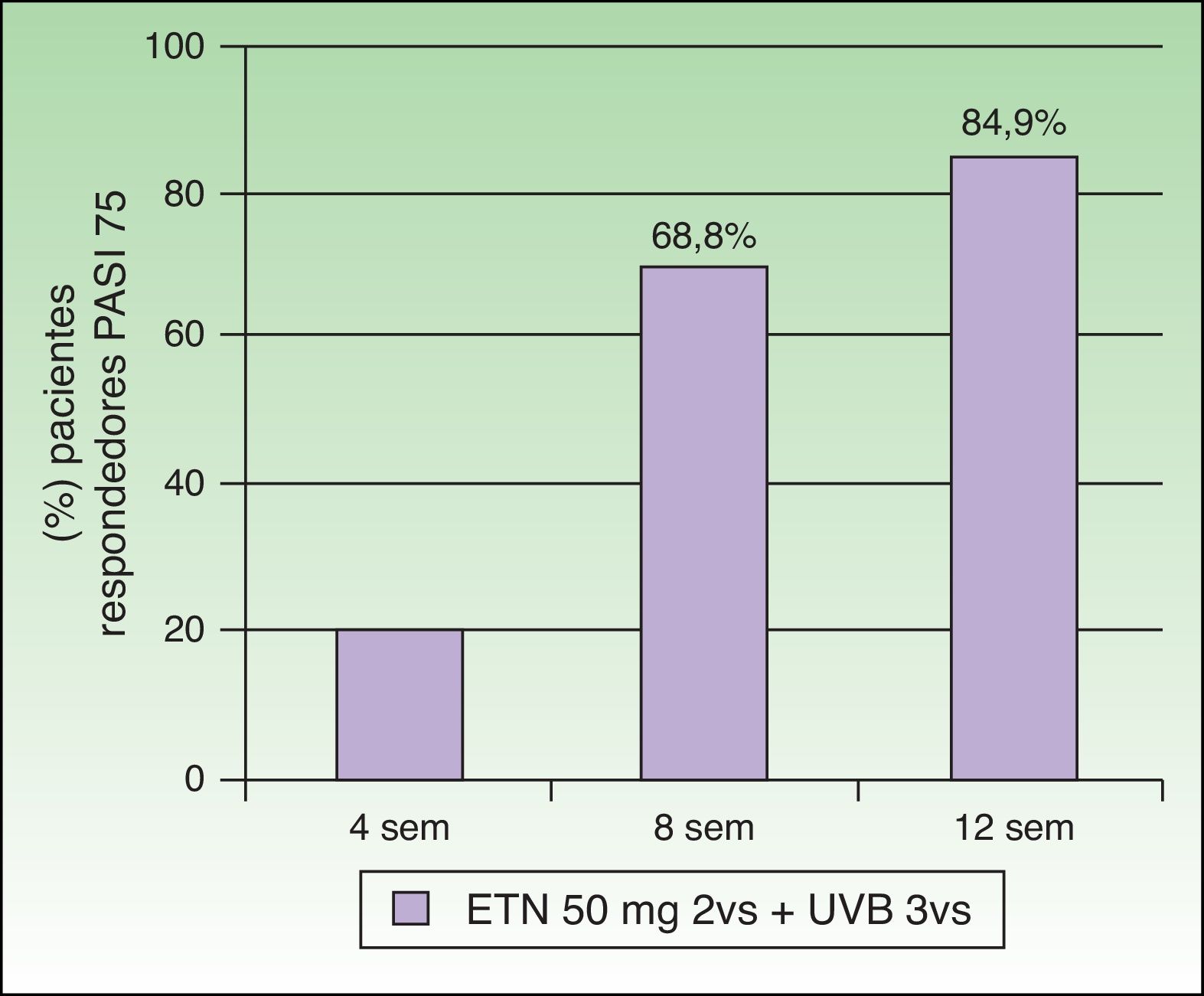
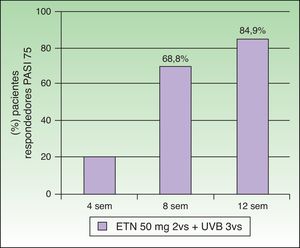
Combinación de etanercept y fototerapia ultravioleta B de banda estrechaEl tratamiento simultáneo con ETN y la terapia UVB-BE ha sido evaluado en 7 estudios (tabla 1). Kircik et al. llevaron a cabo un primer estudio prospectivo, abierto, multicéntrico y con un único grupo de tratamiento (n=86), en el que evaluaron la eficacia y la seguridad del tratamiento simultáneo con ETN (50mg/2 veces por semana) y fototerapia UVB-BE 3 veces por semana en pacientes con psoriasis en placas moderada-grave durante 12 semanas (estudio UNITE)29. En la semana 12 el 84,9% de los pacientes alcanzaron el PASI 75, el 58,1% el PASI 90 y el 26% el PASI 100. El tiempo medio para alcanzar el PASI 75 fue de 57 días. Hay que destacar que ya el 69,8% de los pacientes había adquirido un PASI 75 en la semana 8 (fig. 5). La alta tasa de eficacia de esta combinación a las 12 semanas de tratamiento, 84,9% de pacientes con PASI 75, estaría justificada por los autores por el efecto sinérgico alcanzado. Wolf et al. valoraron el efecto de la terapia UVB-BE en una pequeña serie de 5 pacientes que tras 6 semanas de tratamiento con ETN (50mg/2 veces por semana) no habían alcanzado una respuesta PASI 75, y en los que la fototerapia no había sido eficaz en monoterapia30. Durante otras 6 semanas se administró fototerapia UVB-BE en un hemicuerpo seleccionado aleatoriamente 3 veces por semana manteniendo el tratamiento con ETN a dosis de 50mg 2 veces a la semana. Tras finalizar las 6 semanas de tratamiento los valores medios de PASI para la mitad de cuerpo irradiada frente a la no irradiada fueron de 1,6 frente a 4,7, resultando estadísticamente significativa la reducción del PASI en la mitad de cuerpo tratada con UVB-BE. Recientemente el mismo grupo de trabajo ha publicado una actualización de los pacientes que han tratado con fototerapia UVB-BE y los distintos biológicos, entre los que se incluyen los 5 pacientes tratados con ETN. En estos 5 pacientes el porcentaje de reducción del PASI fue del 85% en la zona irradiada frente al 55,2% en la zona no irradiada en la semana 6, y de un 90,7% en la zona tratada con UVB frente al 81% en la zona no tratada con UVB en la semana 1231. Por tanto, la fototerapia con UVB-BE aumentaría la respuesta del tratamiento con ETN en psoriasis moderadas o graves, especialmente en pacientes con respuestas lentas o insuficientes. Sin embargo, los autores resaltan la importancia de realizar ensayos clínicos controlados que incluyan un mayor número de pacientes. También sugieren que sería de gran interés determinar si la asociación de la fototerapia pudiera disminuir de forma significativa la frecuencia de recidiva de la enfermedad tras la suspensión de la administración del fármaco biológico.
Estudios publicados de ETN en combinación con UVB-BE
| Autor | Año de publicación | Diseño del estudio | Número de pacientes | Régimen de tratamiento |
|---|---|---|---|---|
| Kircik et al.29 | 2008 | Prospectivo, abierto, multicéntrico con un único grupo de tratamiento | 86 | Etanercept 50mg/2 veces por semana+fototerapia UVB-BE 3 veces/semana |
| Wolf et al.30,31 | 2009 | Prospectivo, aleatorizado, comparación de ambos tratamientos en un mismo paciente | 5 | Etanercept 50mg/2 veces por semana±UVB-BE 3veces/semana/6 semanas |
| De Simone et al.32 | 2011 | Prospectivo, abierto, con un solo grupo de tratamiento | 33 | Etanercept 50 mg/semana 12 semanas+UVB-BE 3 veces/semana 8 semanas |
| Gambichler et al.33 | 2011 | Prospectivo, aleatorizado, controlado, simple ciego, comparación de ambos tratamientos en un mismo paciente | 14 | Etanercept 25 mg/2 veces por semana±UVB-BE 3 veces/semana/6 semanas |
| Lynde et al.34 | 2011 | Prospectivo, abierto, multicéntrico, simple ciego | 75 | Etanercep 50mg/una vez por semana±fototerapia UVB-BE 3 veces/semana |
| Park et al.35 | 2012 | Prospectivo, aleatorizado, en 2 fases (pacientes obesos) | 30 | Etanercept 50 mg/semana±fototerapia UVB-BE 3 veces/semana |
| Calzavara-Pinton et al.40 | 2013 | Prospectivo | 20 (8) | Etanercept 50 mg/2 veces por semana±fototerapia UVB-BE 3 veces/semana |
Porcentaje de pacientes que obtiene PASI 75 a las 4, 8 y 12 semanas.
Fuente: Kirck et al.29.
De Simone et al. evaluaron la eficacia del tratamiento combinado con ETN (50mg/una vez por semana) y UVB-BE (3 veces/semana) en una serie de 33 pacientes32. El tratamiento con ETN se realizó durante 12 semanas, mientras que la fototerapia solo durante las primeras 8 semanas. A las 4, 8 y 12 semanas un 24,2%, 66,7% y 81,8% de los pacientes, respectivamente, alcanzaron un PASI 75. Es de destacar en este estudio que la pauta de tratamiento con la dosis de mantenimiento habitual con ETN (50mg semanales) junto con UVB-BE fue más efectiva que la monoterapia con la dosis de ETN de 50mg 2 veces por semana o que la fototerapia con UVB-BE sin ETN de otros estudios. El coste económico del régimen de tratamiento podría ser menor con respecto al estándar en terapia biológica. Gambichler et al., en un estudio prospectivo con 14 pacientes, iniciaron tratamiento con ETN (25mg/2 veces por semana) y 3 sesiones semanales de UVB-BE (311nm) durante 6 semanas33. Se seleccionaron 2 placas de psoriasis, una en el lado izquierdo del tronco y otra en el derecho, y de forma aleatoria se tomó la decisión sobre cuál de estas 2 lesiones se trataría con etanercept en monoterapia (se ocluiría con un parche opaco durante las sesiones de fototerapia), y cuál de ellas recibiría el tratamiento combinado. Sobre estas 2 lesiones se calculó el PASI modificado y se tomaron biopsias para el estudio histológico. Después de 6 semanas de tratamiento la reducción relativa del PASI modificado de la lesión tratada con ETN+UVB-BE fue del 64,7+–27,8%, lo que resultó ser significativamente mayor que en el caso de la lesión tratada con ETN en monoterapia (53,7+–36,9%). Además, el índice histológico calculado en función de la presencia de la hipogranulosis, paraqueratosis, hiperplasia psoriasiforme e infiltrado inflamatorio en la biopsia realizada al final de la sexta semana de tratamiento, así como la reactividad epidérmica para CD1a, CD4 y CD8, fueron significativamente más altos en la lesión tratada solo con ETN frente a la lesión tratada con ETN+UVB-BE.
A pesar de objetivarse una diferencia significativa en la respuesta clínica entre los 2 grupos de tratamiento, los marcadores inmunohistoquímicos de diferenciación (involucrina) y proliferación (Ki67) fueron similares entre los 2 grupos, indicando que en la semana 6 de tratamiento ambos regímenes terapéuticos no se diferenciaron significativamente en su efecto sobre la queratinización prematura y la proliferación epidérmica, hallazgos histopatológicos típicos de la psoriasis. Los autores explican la disminución en los niveles de CD1a, CD4 y CD8 observada en las lesiones tratadas con UVB-BE frente a las no irradiadas, por el efecto conocido de la radiación UVB sobre la apoptosis de las células de Langerhans y los linfocitos T.
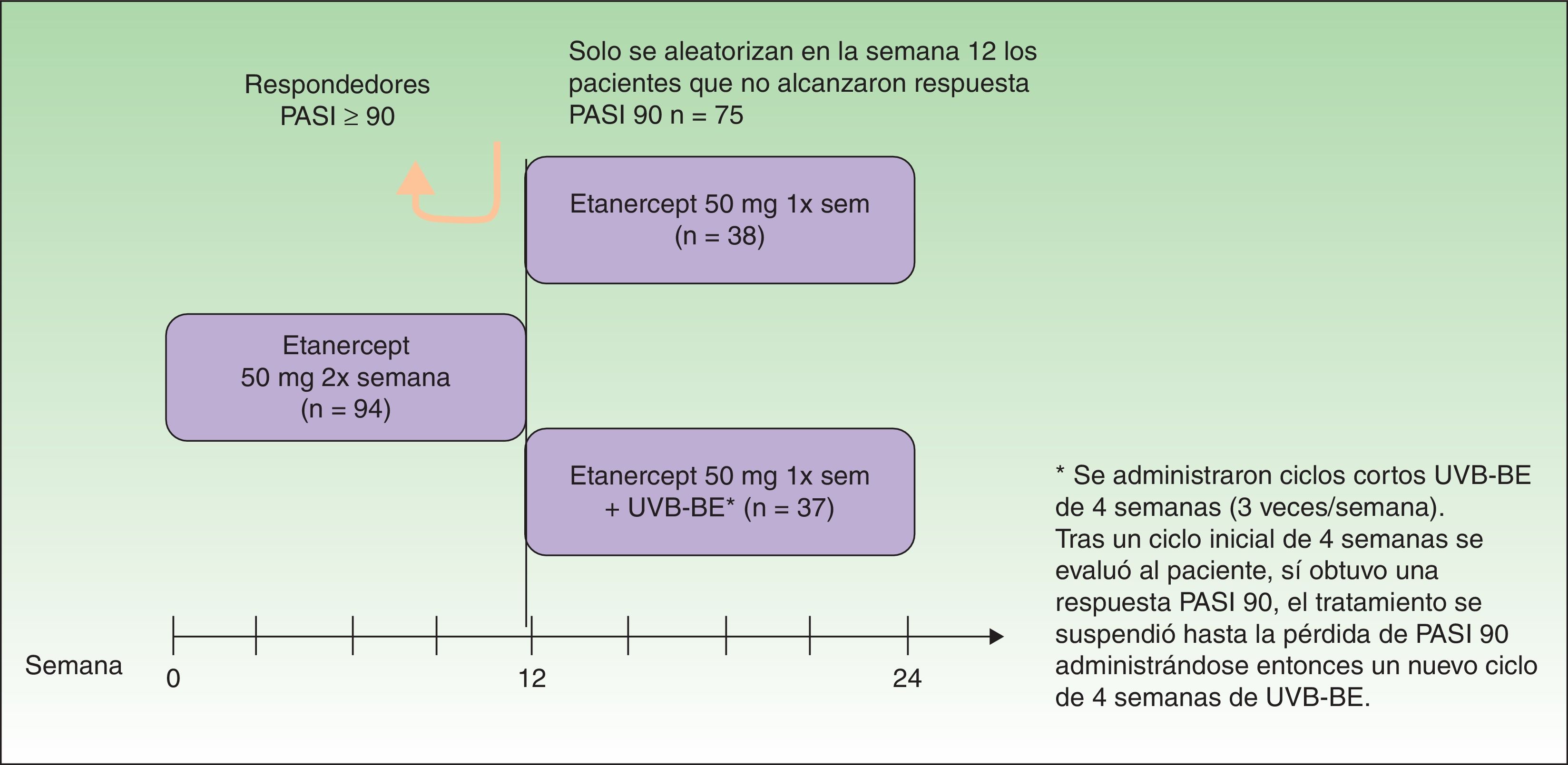
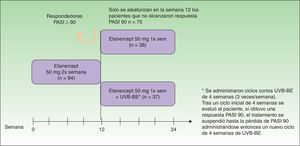
Lynde et al. evaluaron 75 pacientes con psoriasis moderada-grave que tras 12 semanas de tratamiento con ETN a la dosis habitual de inducción (50mg/2 veces por semana) no habían alcanzado el PASI 90 con el objetivo de evaluar si la adición de ciclos cortos de UVBBE podría permitir alcanzar una respuesta óptima (respuesta PASI 90) (fig. 6)34. Al evaluar los resultados los autores no encontraron diferencias significativas en la proporción de pacientes que alcanzaron el PASI 90 a las 24 semanas de tratamiento entre el grupo de ETN (15,8%) y el que recibió tratamiento con ETN+UVB-BE (16,2%), lo que podría hacer pensar que esta combinación no mejoraba la respuesta. Sin embargo, cuando en el análisis solo se incluyeron aquellos pacientes que recibieron al menos el 90% de las inyecciones de ETN y al menos el 80% de las sesiones de fototerapia UVB-BE previstas en el protocolo del estudio, es decir, aquellos que mostraron una alta adherencia (29 pacientes en el grupo de ETN en monoterapia y 7 pacientes en el grupo de tratamiento combinado) la diferencia alcanzó la significación estadística en la semana 24 de tratamiento para el PASI 90 con un 42,9% de pacientes en la combinación frente a un 20,7% de pacientes en monoterapia con ETN. También los tratados en combinación alcanzaron el PASI 75 en proporción más alta que los de monoterapia con ETN en semana 24 (100% frente a 55,2%). Los autores postulan que los resultados obtenidos podrían deberse al pequeño número de pacientes que presentaron una buena adherencia al tratamiento con fototerapia (n=7). La asociación de ciclos cortos de fototerapia con UVB-BE mejoró por tanto la respuesta clínica, alcanzando el PASI 90 en el grupo de pacientes que mantuvieron buena adherencia al tratamiento con UVB-BE en las semanas 16 y 24.
Diseño del estudio.
Fuente: Lynde et al.34.
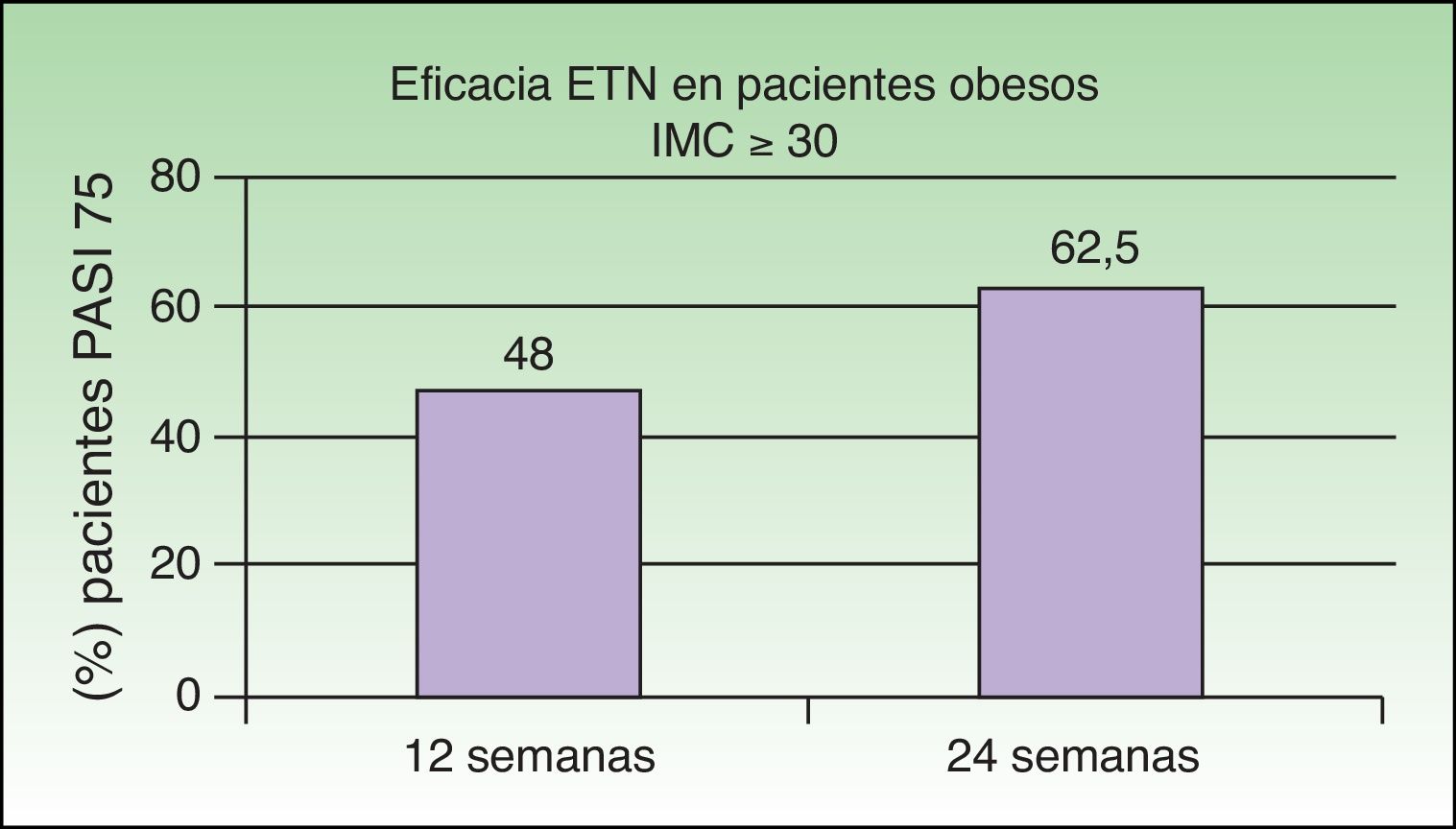
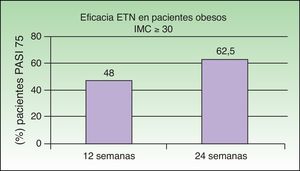
Park et al. centraron el estudio de la eficacia del tratamiento combinado con ETN+UVB-BE en pacientes obesos (índice de masa corporal [IMC]≥30) con psoriasis moderada-grave35, grupo en el que se ha descrito una respuesta menos favorable a ETN que en pacientes con un IMC normal36,37 y en los que la sinergia sería en especial adecuada. El objetivo de este estudio fue evaluar la combinación de UVB-BE con ETN (50mg a la semana) en pacientes obesos con psoriasis moderada-grave. La proporción de pacientes que alcanzaron el PASI 75 fue del 48% en la semana 12 y del 62,5% en la semana 24, cifras similares a las alcanzadas en estudios pivotales (fig. 7)38,39. El porcentaje de pacientes que alcanzó el PASI 75 en semana 24 fue similar en los 2 grupos (el 46,7% eran del grupo de monoterapia y el 53,3% del grupo combinado) sin diferencias en función del índice de masa corporal. A la vista de estos resultados los autores concluyeron que el tratamiento con ETN en monoterapia es eficaz en pacientes obesos, y que esta eficacia no depende del peso en el objetivo PASI 75, aunque sí se apreció en objetivos de PASI 90 o 100. La combinación con UVB-BE no ofrecería beneficio adicional en este grupo de pacientes, considerando el objetivo PASI 75, ya que no se pudo demostrar el efecto sinérgico al añadir UVB-BE como se ha observado en otros estudios descritos anteriormente29,32,34.
Porcentaje global de pacientes con IMC>30 que obtiene PASI 75 con etanercept con o sin UVB-BE a las 12 y 24 semanas.
Fuente: Park et al.35.
Por último, en un estudio publicado recientemente, Calzavara-Pinton et al. describen la respuesta con ETN y fototerapia UVB-BE en 20 pacientes con psoriasis en placas que no habían alcanzado previamente el PASI 75 con UVB-BE40. En estos pacientes se inició tratamiento con ETN (50mg/2 veces por semana). Si a la semana 12 los pacientes no alcanzaron el PASI 75 (n=8) se añadió tratamiento con UVB-BE en combinación con ETN. Los 8 pacientes que precisaron tratamiento combinado con ETN+UVB-BE alcanzaron el PASI 75 y 3 de ellos presentaron una remisión completa, a pesar de haber fracasado anteriormente a la monoterapia con UVB-BE o ETN. Todos los pacientes toleraron bien el tratamiento y no se apreció ningún caso de efectos secundarios agudos graves.
ConclusionesAunque en la actualidad ninguna combinación entre fármacos sistémicos y fármacos biológicos se encuentra aprobada para su uso en el tratamiento de la psoriasis moderada/grave, se han publicado diversos estudios en este sentido que vienen a avalar lo que en la práctica clínica diaria se lleva realizando desde hace unos años41. A pesar de ello, hay que recordar que las publicaciones son escasas y que tampoco se han definido las pautas de monitorización adecuadas.
A la vista de esta experiencia acumulada se puede concluir que es posible aumentar la eficacia que por separado tendrían un fármaco sistémico o un biológico, debido al efecto sinérgico que se deriva de los diferentes mecanismos de acción que poseen estos fármacos1–5. Los potenciales beneficios de la combinación pasarían por el empleo de la combinación cuando la monoterapia con uno de ellos no es suficiente. Es posible también disminuir la toxicidad esperada para el medicamento en monoterapia gracias a la reducción de dosis que permite el efecto sinérgico de la combinación. Además, esta reducción de dosis mejorará la eficiencia asociada al tratamiento de la psoriasis con medicamentos biológicos. En otros casos la combinación acelera el efecto terapéutico de cada una de las opciones combinadas. Otras situaciones en las que podrían ser recomendables las combinaciones serían el tratamiento de psoriasis recalcitrantes a la monoterapia, en los periodos de transición entre fármacos y para evitar pérdida de eficacia por anticuerpos anti-fármaco mediante el empleo concomitante de MTX. Por último, la combinación con fármacos sistémicos es una de las opciones a considerar en caso de fallo secundario de un biológico, es decir, frente a la pérdida de respuesta de un fármaco que era eficaz pero que comienza a perder esa buena respuesta. Con ello se puede evitar aumentar la dosis o disminuir la frecuencia de administración del fármaco biológico que siempre son opciones con más coste económico. De esta manera se puede mantener la eficacia y prolongar la supervivencia de los fármacos biológicos. El papel de las combinaciones entre biológicos y sistémicos está en evolución, pero cada día va tomando más protagonismo en el tratamiento de la psoriasis grave-moderada.
FinanciaciónEste artículo ha sido financiado por Laboratorios Pfizer pero no ha participado en su contenido, que ha sido libremente redactado por los autores.
Conflicto de interesesMariano Ara ha participado en asesorías de Abbvie, MSD, Pfizer y Janssen, así como realizado ponencias con el patrocinio de los mismos.
El resto de autores declara no tener conflicto de intereses.