El alemtuzumab es un anticuerpo monoclonal que se ha utilizado como terapéutica en casos refractarios de síndrome de Sézary (SS) y micosis fungoide en estadio avanzado.
Presentamos 5 pacientes diagnosticados de SS tratados con alemtuzumab entre los años 2008 y 2012, con una tasa de respuesta global del 80% (40% respuestas parciales y 40% respuestas completas). La pauta de 10mg vía subcutánea fue bien tolerada y con una toxicidad aceptable. En nuestra casuística la mediana de duración de la respuesta fue de 13 meses, sin embargo uno de los pacientes continúa en remisión completa tras 67 meses, hecho destacable dada la baja supervivencia del SS.
Como conclusión, creemos que el alemtuzumab es un fármaco que podría ser útil en casos de SS refractarios a otros tratamientos. Dado que no existen tratamientos curativos en el SS, sería una alternativa terapéutica a tener en cuenta.
Alemtuzumab is a monoclonal antibody that has been used to treat refractory cases of Sézary syndrome (SS) and advanced mycosis fungoides.
We present 5 patients with SS who were treated with alemtuzumab between 2008 and 2012, with an overall response rate of 80% (40% partial response and 40% complete response). A regimen of 10mg administered subcutaneously was well tolerated with acceptable toxicity. The median duration of response was 13 months. However, one patient remains in complete remission after 67 months, a remarkable outcome given the low survival rate associated with SS.
In conclusion, we believe that alemtuzumab may be useful in cases of SS refractory to other treatments. As there are no curative treatments for SS, alemtuzumab should be considered as a therapeutic option.
El síndrome de Sézary (SS) es una entidad infrecuente que representa aproximadamente el 3% de todos los linfomas cutáneos de células T. Se considera una variante agresiva que se caracteriza por la presencia de eritrodermia, linfocitos T atípicos circulantes (células de Sézary) con o sin adenopatías1. Se clasifica como un T4, N0-3, M0-1, B2 según la International Society for Cutaneous Lymphomas (tabla 1)1–3. El prurito es el síntoma principal y puede llegar a tener un gran impacto en la calidad de vida.
Clasificación de la micosis fungoide/síndrome de Sézary propuesta por la ISCL y la EORTC
| Piel (T) | |
| T1 | Máculas limitadas, pápulas y/o placas cubriendo <10% de la superficie cutánea. T1a (solo máculas) y T1b (máculas y placas) |
| T2 | Máculas, pápulas y/o placas cubriendo ≥10% de la superficie cutánea. T2a (solo máculas) y T2b (máculas y placas) |
| T3 | Uno o más tumores (>1cm de diámetro) |
| T4 | Confluencia de eritema≥80% de la superficie cutánea |
| Ganglios(N) | |
| N0 | No ganglios linfáticos periféricos anormales, la biopsia no es necesaria |
| N1 | Ganglios periféricos clínicamente anormales, histológicamente Dutch grado 1 o NCI LN0-2. N1a clonalidad negativa y N1b clonalidad positiva |
| N2 | Ganglios periféricos clínicamente anormales, histológicamente Dutch grado 2 o NCI LN3. N2a clonalidad negativa y N2b clonalidad positiva |
| N3 | Ganglios periféricos clínicamente anormales, histológicamente Dutch grado 3-4 o NCI LN4 clonalidad positiva o negativa |
| Nx | Ganglios periféricos clínicamente anormales sin confirmación histológica |
| Visceral (M) | |
| M0 | No existencia de afectación visceral |
| M1 | Afectación visceral (debe tener confirmación histológica y debe especificarse el órgano) |
| Hematológica (B) | |
| B0 | Ausencia de afectación hematológica significativa (≤5% de linfocitos atípicos/células de Sézary). B0a clonalidad negativa y B0b clonalidad positiva |
| B1 | Baja afectación hematológica (>5% de linfocitos atípicos/células de Sézary). B1a clonalidad negativa y B1b clonalidad positiva |
| B2 | Alta afectación hematológica definida como uno de los siguientes: ≥1.000 células de Sézary/μl con TCR positivo; CD4/CD8>10 con TCR positivo; o células CD4+ CD7–≥40% o CD4+ CD26– ≥30% con TCR positivo |
EORTC: European Organisation for Research and Treatment of Cancer; ISCL International Society for Cutaneous Lymphomas; LN: lymph node; NCI: National Cancer Institute; TCR: receptor de linfocito T.
Fuente: Olsen et al.2.
El pronóstico es pobre, con una supervivencia del 24% a los 5 años, con pocas respuestas y remisiones duraderas tras los tratamientos4.
Para su tratamiento son necesarias terapias sistémicas, ya que las dirigidas exclusivamente a la piel son insuficientes. La elección viene determinada por la extensión de la enfermedad, el impacto en la calidad de vida, la edad y las comorbilidades del paciente. Aunque existen diferentes tipos de tratamiento para el SS (tabla 2)3, hay pocos estudios sobre su eficacia.
Tratamientos en el SS
| Tipo de terapia | Tratamiento |
|---|---|
| Inmunomoduladores | Interferón (IFN alfa e IFN gamma) |
| Retinoide (bexaroteno) | |
| Denileukin diftitox | |
| Fotoféresis extracorpórea | |
| Terapias biológicas | Alemtuzumab |
| Radioterapia | Irradiación corporal total con electrones (electron beam) |
| Tratamientos combinados | IFN alfa+fototerapia o retinoide |
| Retinoide+fototerapia | |
| Fotoféresis extracorpórea+IFN alfa o retinoide | |
| Quimioterapia sistémica | |
| Monoterapia | Metotrexato |
| Doxorrubicina pegilada | |
| Poliquimioterapia | Análogos de las purinas/pirimidinas (fludarabina, 2-clorodeoxiadenosina, deoxicoformicina, gemcitabina, forodesina) |
| Agentes alquilantes (clorambucilo, mostaza nitrogenada, ciclofosfamida, temozolamida) | |
| Inhibidores topoisomerasa (etopósido, doxurribicina pegilada) | |
| Inhibidores histona deacetilasa (vorinostat, romidepsina) | |
| CHOP y CHOP-like | |
| TPMO | Autólogo |
| Alogénico | |
| Alogénico no mieloablativo | |
IFN: interferón; TPMO: transplante de progenitores de médula ósea.
Fuente: modificada de Jawed et al.3.
En los últimos años han aparecido nuevas terapéuticas, entre las que encontramos las terapias biológicas. El alemtuzumab es un anticuerpo monoclonal humanizado dirigido contra la glucoproteína CD52 que se expresa en la superficie de los linfocitos T y B, células natural killer, monocitos y macrófagos, consiguiendo su depleción en sangre periférica3,5. Se cree que actúa por lisis celular directa mediada por neutrófilos, complemento y citotoxicidad dependiente de anticuerpos y apoptosis3–6. En el año 2001 se aprobó su uso para el tratamiento de la leucemia linfática crónica B, aunque algunos autores lo han utilizado en casos refractarios de SS y MF en estadio avanzado.
Casos clínicosPresentamos 5 pacientes (3 mujeres y 2 hombres) diagnosticados de SS estadio IVA1 (T4, N0, M0, B2) tratados con alemtuzumab desde el año 2008 hasta el 2012. Cuatro habían realizado tratamientos previos (fototerapia, prednisona, metotrexato, gemcitabina y bexaroteno).
Respecto al tratamiento con alemtuzumab hemos recogido las siguientes variables (tabla 3): 1) duración; 2) tipo de respuesta; 3) tiempo transcurrido hasta el inicio de la respuesta; 4) duración de la misma tras la suspensión del tratamiento; y 5) las células de Sézary en sangre periférica. Además, hemos analizado la evolución, el tiempo de seguimiento y las complicaciones asociadas al alemtuzumab.
Nuestra serie de 5 casos de SS tratados con alemtuzumab
| Sexo | Edad(años) | Duracióndeltratamiento | Iniciode larespuesta | Respuesta Cutáneaa | Respuesta sanguíneab(células de Sézary/μl y %) | Respuesta global | Duración de la respuesta | Complicaciones | Evolución y tiempo de seguimiento tras inicio del tratamiento |
|---|---|---|---|---|---|---|---|---|---|
| M(1) | 57 | 4S | 4 S | RC | RCPre-tto→1.050 (7%)Post-tto→0 (0%) | RC | 66m | No | RC67m |
| H(2) | 65 | 8S | 2 S | RC | RCPre-tto→9.530 (32%)Post-tto→147 (3%) | RC | 11m | Sd liberación citocinasReactivación CMVNeumonía neumocócica | Éxitus por LNH alto grado24m |
| M(3) | 85 | 13S | 4S | RC | RPPre-tto→1.215 (12%)Post-tto→379 (6%) | RP | 5m | No | Retratamiento a las 4S sin mejoría.Actualmente leukeran-prednisona27m |
| H(4) | 75 | 5S | 1S | RP | RCPre-tto→554 (4%)cPost-tto→0 (0%) | RP | 15m | Sd liberación citocinasReactivación CMV | Actualmente fotoféresis32m |
| M(5) | 57 | 10S | NR | PE | RCPre-tto→1.342 (8%)Post-tto→55 (1%) | PE | NR | Sd liberación citocinas | Trasplante alogénico de médula ósea20m |
| (X¯) | 65 | 8S | 3S | 13m |
H: hombre; LNH: linfoma no Hodgkin; m: meses; M: mujer, NR: no respuesta, PE: progresión de la enfermedad; RC: remisión completa; RP: respuesta parcial, Sd: síndrome; S: semanas; (X¯): mediana.
RC: 100% del aclaramiento de las lesiones, RP: 50-99% del aclaramiento de las lesiones iniciales sin nuevos tumores (T3) en pacientes con T1, T2 o T4, PE≥25% de incremento de la enfermedad cutánea o nuevos tumores (T3) en pacientes con T1, T2 o T4 o pérdida de respuesta en pacientes con respuesta completa o respuesta parcial2.
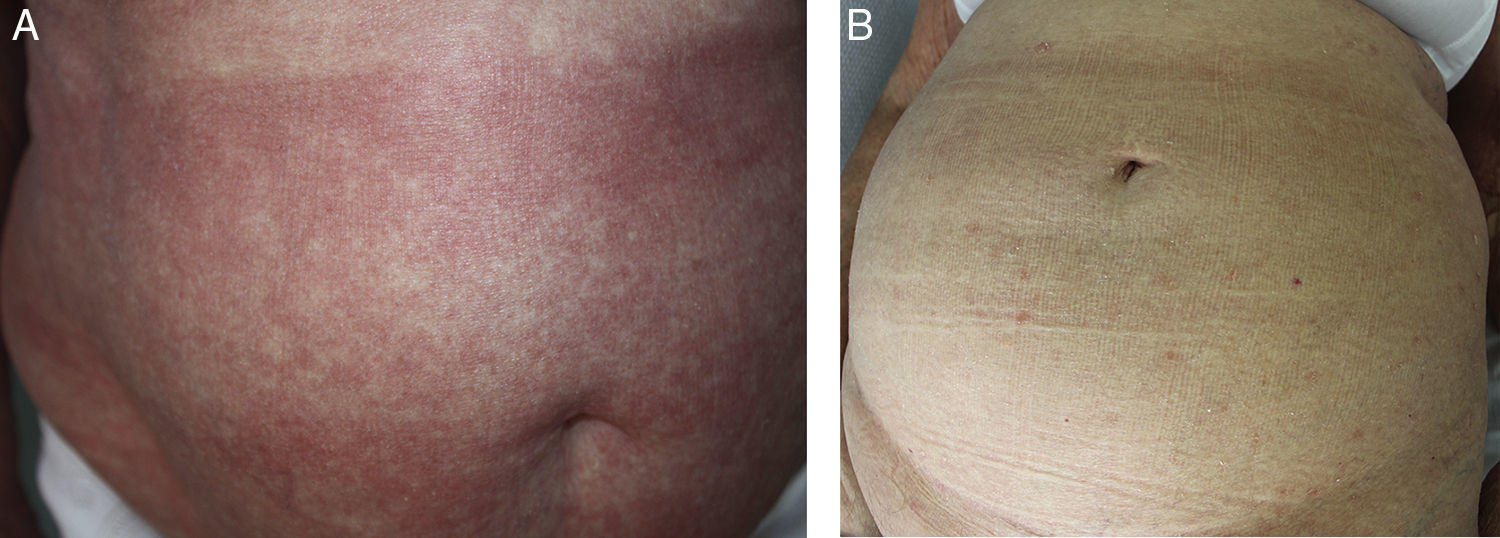
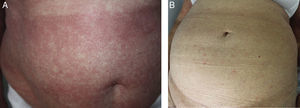
Hemos clasificado el tipo de respuesta de la siguiente manera: completa (RC), parcial (RP) o progresión de la enfermedad (PE), basándonos en el trabajo de Olsen et al.2 (fig. 1).
La pauta utilizada fue la administración subcutánea de una primera dosis inicial de 3mg y posteriormente 10mg 3 veces por semana.
Los 5 pacientes recibieron profilaxis oral para Pneumocystis jiroveci con sulfametoxazol-trimetroprim, aciclovir para herpes y fluconazol para Candida. Para la profilaxis de citomegalovirus (CMV) se realizó carga viral semanal, utilizando tratamiento anticipatorio con valganciclovir oral en los casos de reactivación.
En cuanto a los resultados se obtuvo respuesta en 4 de 5 pacientes (tasa de respuesta global del 80%): 2 RP (40%) y 2 RC (40%). La mediana de duración del tratamiento fue de 8 semanas (4-13) y la mediana de duración de la respuesta tras suspender el tratamiento de 13 meses (5-66).
Como complicaciones un paciente presentó una neumonía neumocócica, 3 un síndrome de liberación de citocinas y tuvimos 2 casos de reactivaciones subclínicas de CMV. No tuvimos ningún caso de complicación hematológica.
La mediana de seguimiento fue de 27 meses (23-67) tras el inicio del tratamiento. Un paciente falleció a los 24 meses por una transformación a un linfoma no Hodgkin de alto grado. Actualmente, 3 pacientes están en progresión y una sigue en remisión completa tras 67 meses de finalizar el tratamiento.
DiscusiónEl alemtuzumab se ha utilizado tanto en casos refractarios de MF en estadio avanzado como de SS. La primera descripción es de 1998 en 8 pacientes con MF7. En 2003 se demostró su utilidad en un estudio en fase ii en 22 pacientes con MF/SS8. Desde entonces se han publicado algunas series cortas y casos aislados. En la literatura revisada hemos encontrado un total de 13 series4,6–17 y 6 casos aislados de MF y SS recogiéndose las primeras en la tabla 4.
Series publicadas de pacientes con SS/MF tratados con alemtuzumab
| Series | N.° de pacientes | Pauta de alemtuzumab | Duración del tratamiento | Respuesta clínica | Duración de la respuesta (mediana) | Complicaciones graves |
|---|---|---|---|---|---|---|
| Lundin J et al.7 (1998) | 50 LNH bajo grado(8MF) | 30mg vía iv 3 días/semana | 6-12S | RG: 20%MF: RG: 50%, 2RC | 10m | Infecciones oportunistas (7), sepsis (9), neutropenia grado iv (14) |
| Lundin J et al.8 (2003) | 22MF/SS | 30 mg vía iv 3 días/semana | 10S | RG: 55%7RC, 5RP, 3EE, 7PE | 12m | Reactivación CMV (4), FOD (3), VHS generalizado (1), aspergilosis pulmonar (1), Mycobacterium pneumoniae (1), neutropenia febril (1) |
| Kennedy GA et al.10 (2003) | 5MF/2SS1MF transformada a célula grande | 30 mg vía iv 3 días/semana | 3-13S | RG: 38%3RP, 2EE, 3PE | Menos de 3m | Pancitopenia grado iv con sepsis (2), MRSA cutáneo y VHS oral (1), bronquiolitis viral (1), VVZ cutáneo (1), CMV (1), osteomielitis por Pseudomona e infección Parvovirus (1), sepsis por Klebsiella (1) |
| Ferrajoli et al. 11 (2003) | 6LCCT | 30 mg vía iv 3 días/semana | 4-12S | 2RP | ND | ND |
| Capalbo S et al.12 (2003) | 1MF/2SS | 30 mg vía iv 3 días/semana | 3,6 y 12S | 1RC, 1RP, 1 éxitus (IAM) | 11m3m | No |
| Lenihan DJ et al.13 (2004) | 5SS y 3MF | 30 mg vía iv 3 días/semana | 8,5S | 3RP, 2EE, 3PE | ND | Eventos cardiovasculares (5): ICC/arritmiasDos exitus por infecciones no especificadasUna neumonía Legionella pneumoniae |
| Zinzani et al. 14 (2005) | 4MF6LCT periféricos | 10mg vía sc 3 días/semana | 4S | 3RP (MF) | ND | Reactivación CMV (1) |
| Bernengo et al.4 (2007) | 14SS | 10-15mg vía sc 3 días/semana | ND | 1RC, 11RP, 2EE | 12m | Infecciones en pacientes tratados con 15mg:Sepsis estafilocócica (1)Reactivación CMV subclínica (3) |
| Alinari et al.15 (2007) | 5SS | 30mg vía sc 3 días/semana | 5-9S | RG: 100%5RC | 8S | Reactivación CMV asintomática (2), reactivación VEB (1) |
| Querfeld et al. 16 (2009) | 17SS2MF eritrodérmicas | 30mg vía iv y sc 3 días/semana | 12S | RG: 84%9RC, 7RP, 3PE | 6m | Éxitus por pancitopenia grado iv (1)Absceso cervical (1), sepsis por MRSA (1), herpes zóster (1), infección del catéter central (1), neutropenia febril (1) |
| Clark et al.6 (2012) | 18LCCT-L | 10mg vía sc 3 días/semana | 6S | RG: 89%9RC, 7RP, 2PE | ND | Reactivación CMV (1) |
| De Masson et al.9 (2014) | 23SS/16MF | 30mg vía iv y sc 3 días/semana | 12S | RG: 51%(70% SS, 25% MF)7RC (6SS, 1MF)13RP (10SS, 3MF) | 3,4m6ptes >24m(5SS, 1MF) | Viremia CMV (10), tbc (2), infección cutánea por Mycobacterium chelonae (1), infección bacteriana (5), toxoplasmosis (1), aspergilosis (1), neumonía (7), citopenias grado 3 (10), exitus (2), transformación a LCCT célula grande (5), LCCB grande (1) |
| Watanabe et al.17 (2014) | 17SS/6MF | 10mg vía sc 3 días/semana | ND | SS: 13 RC, 4 RPMF: 1 RC tras electron beam, 5 PE | ND | ND |
| Nuestra serie | 5SS | 10mg vía sc 3 días/semana | 8S | 2 RC,2 RP, 1 PE | 13m | Neumonía neumocócica (1)Reactivación CMV asintomática (2) |
CMV: citomegalovirus; EE: enfermedad estable; FOD: fiebre de origen desconocido; IAM: infarto agudo de miocardio; ICC: insuficiencia cardíaca congestiva; iv: intravenosa; LCCB: linfoma cutáneo de célula B; LCCT: linfomas cutáneos de células T; LCCT-L: linfomas cutáneos de células T leucemizados; LCT periféricos: linfomas de células T periféricos; LNH: linfoma no Hodgkin; MRSA: Staphilococcus aureus meticilín resistente; PE: progresión de la enfermedad; RC: respuesta completa; RG: respuesta global; RP: respuesta parcial; sc: subcutánea; tbc: tuberculosis; VEB: virus Epstein Barr; VHS: virus herpes simple; VVZ: virus varicela zóster.
Respecto a la respuesta tras el tratamiento, en los 2 trabajos más amplios, de 22 y 39 pacientes, la tasa de respuesta global fue del 55% y 51% respectivamente8,9. La duración mediana de la respuesta fue de 12 meses, aunque es variable según las distintas series4,6–17. En la serie de 39 casos se observó que el alemtuzumab puede inducir remisiones duraderas (más de 2 años) en el SS (5 pacientes), no así en los casos de MF (un caso)9.
La pauta de tratamiento ha variado con los años. La dosis utilizada en los primeros trabajos era vía intravenosa: una primera dosis inicial de 3mg, luego 10mg y finalmente 30mg, manteniendo esta última dosis 3 veces por semana7,8,10–13. Posteriormente, se observó que el alemtuzumab vía subcutánea a dosis bajas podría ser igual de efectivo4,14.
Las infecciones y la toxicidad hematológica son complicaciones ligadas al tratamiento. La pauta de 10mg vía subcutánea ha demostrado una menor incidencia de estos efectos adversos4,14,15. La infección oportunista más frecuente es la reactivación del CMV, aunque también se han descrito otros tipos de infecciones4. En cuanto a la toxicidad hematológica, la mielosupresión es la más común4.
El síndrome de liberación de citocinas es la complicación más frecuente durante la terapia7,8,10,11. Para disminuir su aparición se realiza una escalada progresiva de la dosis. Lenihan et al. publicaron 4 casos de toxicidad cardíaca durante el tratamiento en pacientes previamente sanos13. Dado que no se observó en ningún otro estudio, se ha puesto en entredicho esta relación causal. Recientemente se ha descrito un caso de hematofagocitosis cutánea localizada en el sitio de inyección del alemtuzumab en una paciente sin reactivación viral del Epstein-Barr18.
En la literatura revisada el alemtuzumab se ha utilizado indistintamente tanto para la MF como para el SS. De hecho, la mayoría de los trabajos agrupan el SS con la MF en estadio avanzado. Actualmente se considera que la MF eritrodérmica es una progresión de la MF con ausencia o poca afectación hematológica, a diferencia de lo que acontece en el SS, que aparece de novo y tiene una importante afectación sanguínea1. En 2012 Clark et al. publicaron que el alemtuzumab podría ser eficaz solo cuando existiera afectación hematológica (en el SS y en casos de MF eritrodérmica con afectación sanguínea)6. Estos autores postulan que ambas entidades provienen de distintos tipos de células T memoria: los linfocitos malignos en pacientes con SS presentarían un fenotipo de células memoria central CCR7+/L-selectina+ (células migratorias que se encuentran circulando en la sangre, en la piel y en los ganglios linfáticos), mientras que los linfocitos malignos de la MF derivarían de células no migratorias residentes en la piel que no circulan por la sangre. El alemtuzumab deplecionaría todos los linfocitos T en la sangre, pero la población de células residentes en la piel escaparía del efecto del anticuerpo, permaneciendo después del tratamiento. Además, el alemtuzumab requiere la presencia de neutrófilos y células natural killer (ambas presentes en sangre y no en piel) para la depleción de linfocitos, por lo que solo eliminaría las células en sangre periférica. De esta forma, los pacientes con SS serían los principales candidatos para este tratamiento.
Lamentablemente, en agosto de 2012 se anuló su uso para la leucemia linfática crónica B y otras enfermedades hematológicas, y actualmente solo está disponible para la esclerosis múltiple. Para el tratamiento en pacientes con SS solo se puede conseguir mediante acceso individualizado con protocolo.
ConclusionesPresentamos 5 casos de SS tratados con alemtuzumab con una tasa de respuesta del 80%. La pauta de 10mg vía subcutánea fue bien tolerada y la mediana de duración de la respuesta fue de 13 meses. El alemtuzumab puede ser un fármaco útil en casos de SS refractarios a otros tratamientos, con una rápida respuesta clínica y mejoría de la calidad de vida con disminución o desaparición del prurito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.