El queratoacantoma (QA) es un tumor cutáneo crateriforme, de crecimiento rápido; aproximadamente el 25% de los QA presentan transformación maligna (QAm), observándose áreas de carcinoma epidermoide (CE). La laminina-332 se ha relacionado con progresión a fases invasoras en diversos CE. El objetivo de este estudio es evaluar si la tinción con laminina-332 es útil para distinguir QA, QAm y CE.
Material y métodosSeleccionamos 74 casos del archivo de Anatomía Patológica. Se analizaron 4 grupos: 20 QA sin CE, 20 QAm con áreas evidentes de CE, 20 CE invasores sin relación con QA (8 con morfología crateriforme) y 14 casos «problema» (QA con «dudosas» áreas de CE). Posteriormente se realizó tinción inmunohistoquímica para laminina-332 a todas estas lesiones.
ResultadosEn las áreas de CE asociado a QAm y en los CE invasores, la tinción con laminina fue positiva de forma intensa, habitualmente en el frente invasor del CE, a diferencia de los QA, en que la tinción fue positiva solo de forma débil y focal, en células aisladas o en pequeños «grupos» celulares. Los casos «problema» se reexaminaron tras valorar la tinción con laminina-332 (8 se diagnosticaron de QA con CE incipiente, 6 de QA sin CE).
ConclusionesLa tinción con laminina-332 es diferente en los QA respecto a los CE, por lo que ayudaría a diferenciar los QA de los CE invasores y de las áreas de CE en QAm, así como en el diagnóstico de QA con «dudosas» áreas de CE y QA con CE incipientes.
Keratoacanthoma is a fast-growing crateriform skin tumor. Approximately 25% of such tumors undergo malignant transformation and develop areas of squamous cell carcinoma (SCC). The presence of laminin-322 has been associated with progression to invasive forms of SCC. The aim of this study was to determine whether or not immunohistochemical staining for laminin-322 would be of value in distinguishing between keratoacanthomas, keratoacanthomas with areas of squamous cell carcinoma, and SCCs.
Material and methodsSeventy-four lesions were selected from the pathology archives of our hospital and divided into 4 groups: 20 keratoacanthomas without SCC, 20 keratoacanthomas with areas of squamous cell carcinoma, 20 invasive SCCs (8 with crateriform morphology) unrelated to keratoacanthoma, and 14 problem lesions (keratoacanthomas with areas suggestive of SCC). All 74 lesions were stained for laminin-322.
ResultsLaminin-322 staining was strongly positive both in areas of SCC in keratoacanthomas with malignant transformation and in invasive SCCs (mostly at the invasive front of the SCC). However, in benign keratoacanthomas, it was only weakly positive and furthermore it was confined to isolated cells or small groups of cells. The 14 problem lesions were reexamined after laminin-322 staining and 8 were diagnosed as keratoacanthomas with incipient SCC and 6 as keratoacanthomas without SCC.
ConclusionsLaminin-322 staining is different in keratoacanthomas and SCCs and would thus be a useful test for differentiating keratoacanthomas from both invasive SCCs and keratoacanthomas with areas of squamous cell carcinoma. It would also be of value in diagnosing keratoacanthomas with areas suggestive of SCC or with incipient SCC.
El queratoacantoma (QA) es un tumor cutáneo crateriforme, exo-endofítico, de crecimiento rápido y regresión espontánea en unos meses. La forma clínica más frecuente es un nódulo solitario, habitualmente localizado en áreas fotoexpuestas; presenta una evolución característica que se puede dividir en fase proliferativa, fase madura o «de estado» y fase de regresión1,2.
El diagnóstico diferencial entre QA y carcinoma epidermoide (CE) entraña, en ocasiones, bastante dificultad, tanto clínica como histológicamente. Aunque algunos autores opinan que el QA es un CE muy bien diferenciado3,4, nosotros pensamos, como Sánchez Yus et al.1,5 y otros autores2,6,7, que solo es un subgrupo de QA el que sufre transformación maligna a CE (QAm), aproximadamente un 25%5. Esta transformación maligna ocurre más frecuentemente en pacientes de más edad y en lesiones localizadas en áreas fotoexpuestas, y podría suceder en cualquier fase del QA, incluyendo la fase de regresión5.
La laminina-332 (anteriormente laminina-5) es una glucoproteína de la membrana basal que podría desempeñar un importante papel en la migración y movilidad celular y en la progresión e invasión tumoral en CE8–11. La laminina-332 interacciona con la integrina α6β4 y el EGFR (factor receptor de crecimiento epidérmico) e induciría la activación de la fosfatidilinositol-3-quinasa (p13K). La p13K regula varios procesos celulares como la proliferación, crecimiento y apoptosis celular, y su activación se relacionaría directamente con la invasión tumoral11–13. Por tanto, la laminina-332, mediante la activación de p13K, promueve la invasión tumoral de CE en diversas localizaciones y se correlaciona con un estadio más avanzado en la clasificación TNM y un peor pronóstico11,14, aunque no con un mayor número de metástasis ganglionares15. La tinción con laminina-332 se ha utilizado para comprobar cuándo un CE de mucosa oral evoluciona a CE invasor12–14, así como en el diagnóstico diferencial entre el carcinoma verrucoso y el CE bien diferenciado de mucosa oral16,17.
En el contexto de un estudio realizado sobre la expresión de laminina-332 en CE de mucosa oral, realizamos tinción para laminina-332 a dos QA con áreas de malignización a CE; tras observar positividad intensa en el área correspondiente al CE de estos dos casos nos planteamos estudiar un número mayor de casos, con el objetivo de evaluar si la tinción con laminina-332 es útil para distinguir entre QA y áreas de CE en QAm.
Material y métodoTodas las preparaciones histológicas fueron obtenidas del archivo de Anatomía Patológica del Hospital Universitario, Virgen de la Arrixaca, Murcia; todos los casos fueron reexaminados por dos patólogos expertos en dermatopatología, de forma independiente entre ellos y sin ningún conocimiento de datos clínicos (crecimiento rápido de las lesiones, por ejemplo).
Se realizó un estudio descriptivo, observacional, sobre la tinción inmunohistoquímica para laminina-332 en 74 lesiones, agrupadas en:
Grupo A: 20 QA en distintas fases evolutivas sin evidencia de malignización. Existían 8 casos en fase proliferativa, 4 en fase de estado y 8 en fase de regresión.
Grupo B: 20 QA con áreas evidentes, citológica e histológicamente, de transformación maligna hacia CE (QAm). Se trataba de 9 QAm en fase proliferativa, 5 en fase de estado y 6 en fase de regresión.
Grupo C: 20 CE invasores que no guardaban relación con QA, 8 de ellos con morfología crateriforme.
Grupo D: 14 casos histológicamente ambiguos o casos «problema»: QA con «dudosas» áreas de CE incipientes.
Definimos QA y CE como:
Queratoacantoma: tumoración epitelial hiperplásica, endo-exofítica, bien delimitada y crateriforme, con un cráter central lleno de queratina e hiperplasia epidérmica de los bordes de la lesión («labios epidérmicos») que sobrepasan el cráter central dándole una apariencia simétrica. Las células son grandes, con nucleolos prominentes y citoplasma eosinófilo y esmerilado1,2,6.
Carcinoma epidermoide: tumor maligno constituido por nidos o cordones de células epiteliales atípicas, con grados variables de queratinización y anaplasia. Presenta una queratinización central variable, con formación de perlas córneas según el grado de diferenciación del tumor18.
Posteriormente se realizó tinción inmunohistoquímica para laminina-332 a estas 74 lesiones mediante la técnica de inmunoperoxidasa (anticuerpos anti-laminina-5 humana, gamma-2 chain, laboratorios Dako Denmark, Clon 4G1), con los pertinentes controles externos. Se consideró positividad para laminina-332 cuando existía tinción granular citoplasmática, especificando si la positividad era débil o intensa.
Análisis estadísticoLos datos fueron procesados mediante el paquete estadístico SPSS 12.0 para Windows.
Los resultados obtenidos se estudiaron mediante un análisis de tablas de contingencia con la prueba de Chi-cuadrado de Pearson, considerando significativos los riesgos de error inferiores al 5% (p<0,05).
ResultadosLos principales resultados se pueden observar en la tabla 1.
Tinción con laminina-332 en queratoacantomas (QA) y carcinomas epidermoides (CE)
| Tinción+intensa | Tinción+débil | Comentario | |
| QA (20) | - | 20 (f) | Tinción débil y focal, en células aisladas o pequeños grupos celulares |
| CE (20) | 20 (d) | - | Tinción intensa y difusa, habitualmente en el frente invasor del CE |
| QA-CE (20) | 20 (d) | 20 (f) | Tinción intensa y difusa en el área de CE, débil y focal en el área de QA |
| QA vs CE (14) | 4 (f)4 (d) | 6 (f) | QA con CE incipiente: tinción intensa y focal (4 casos) o en frente invasor con moderada intensidad (4 casos)QA sin evidencia de CE: tinción débil y focal (6 casos) |
CE: carcinoma epidermoide; (d): tinción positiva difusa, en frente invasor; (f): tinción positiva focal; QA: queratoacantoma sin evidencia de carcinoma epidermoide (entre paréntesis n° de casos estudiados); QA-CE: queratoacantoma con áreas de transformación maligna a carcinoma epidermoide; QA vs CE: casos histológicamente ambiguos o «dudosos»; QA con discutibles áreas de CE incipiente.
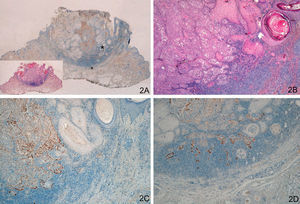
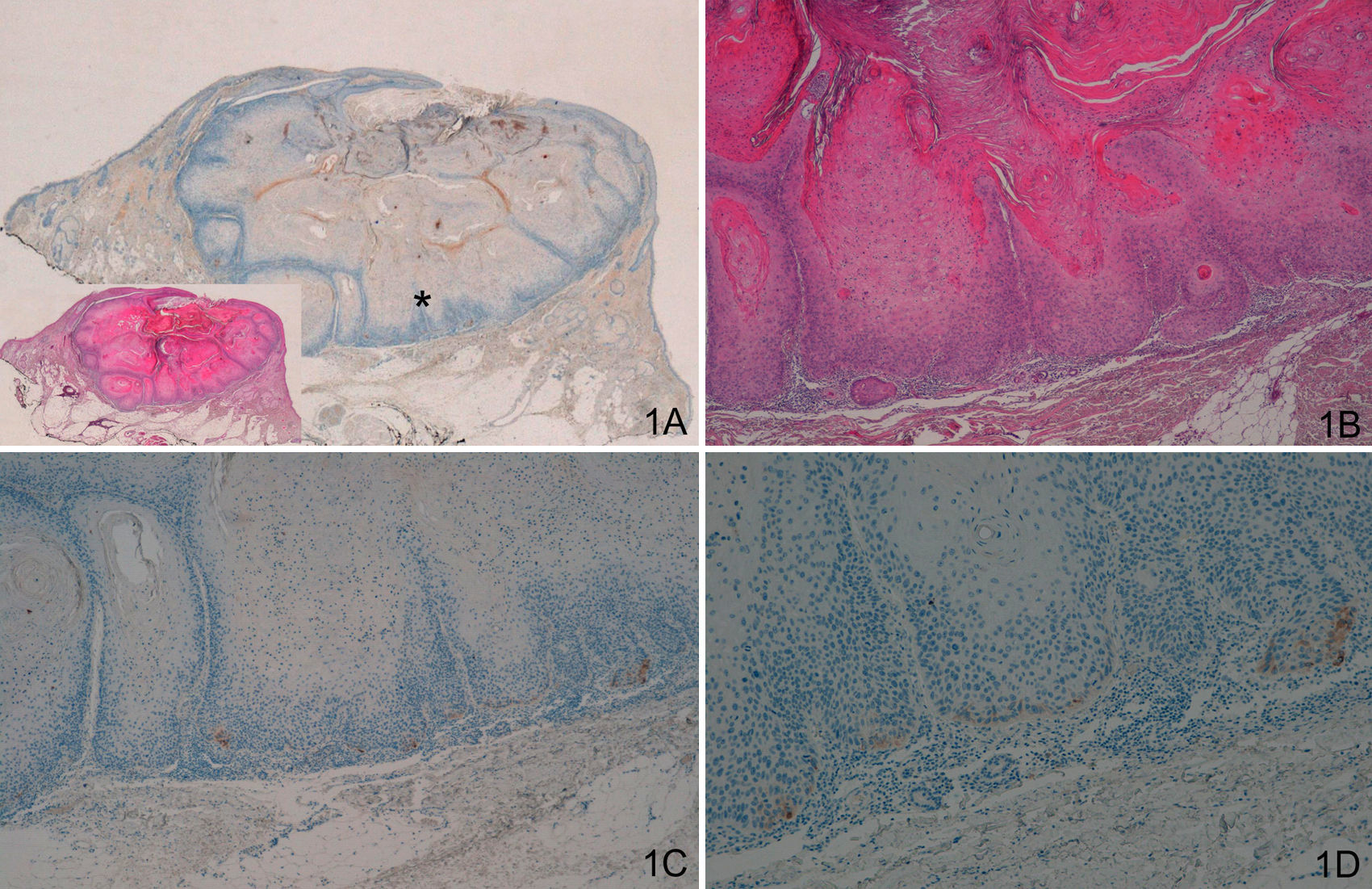
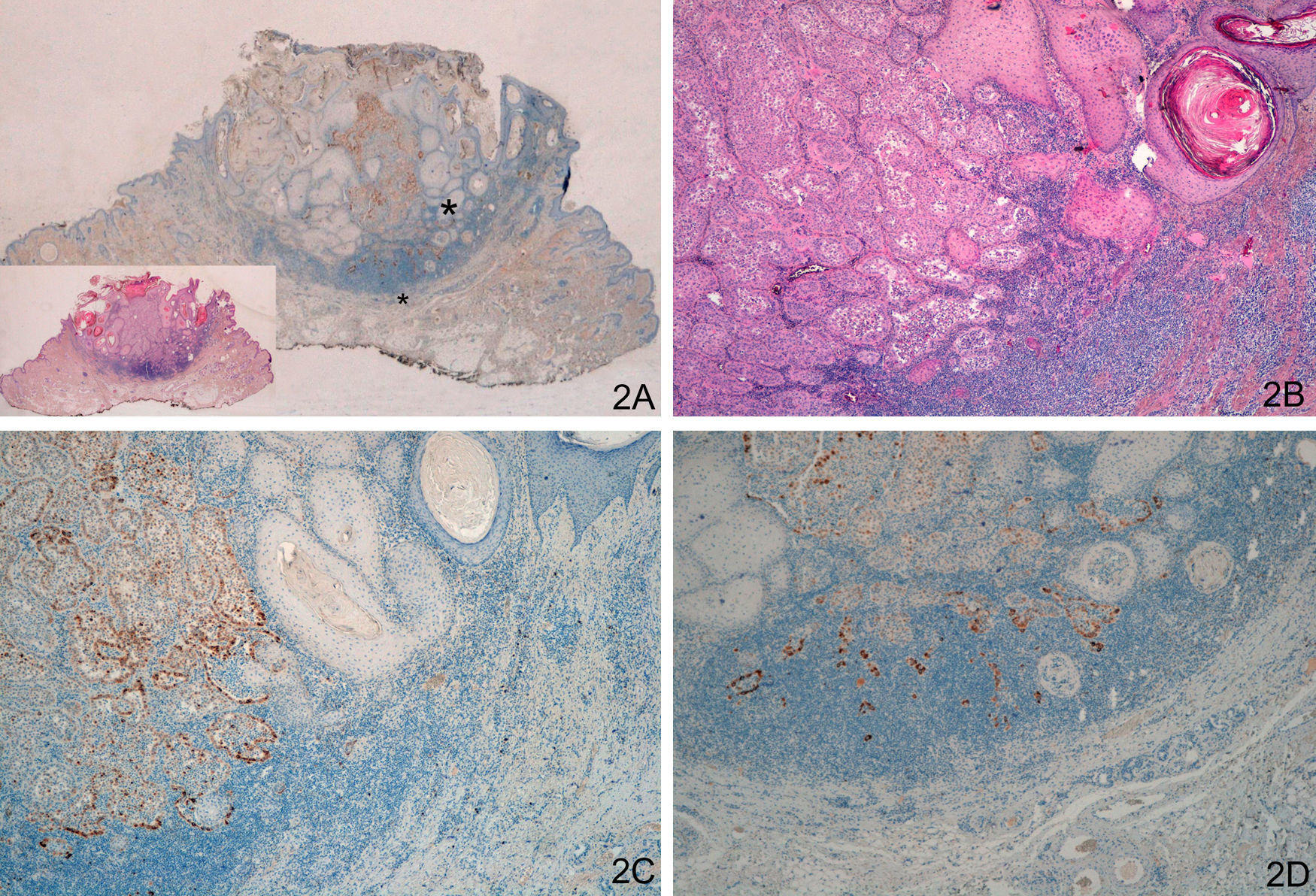
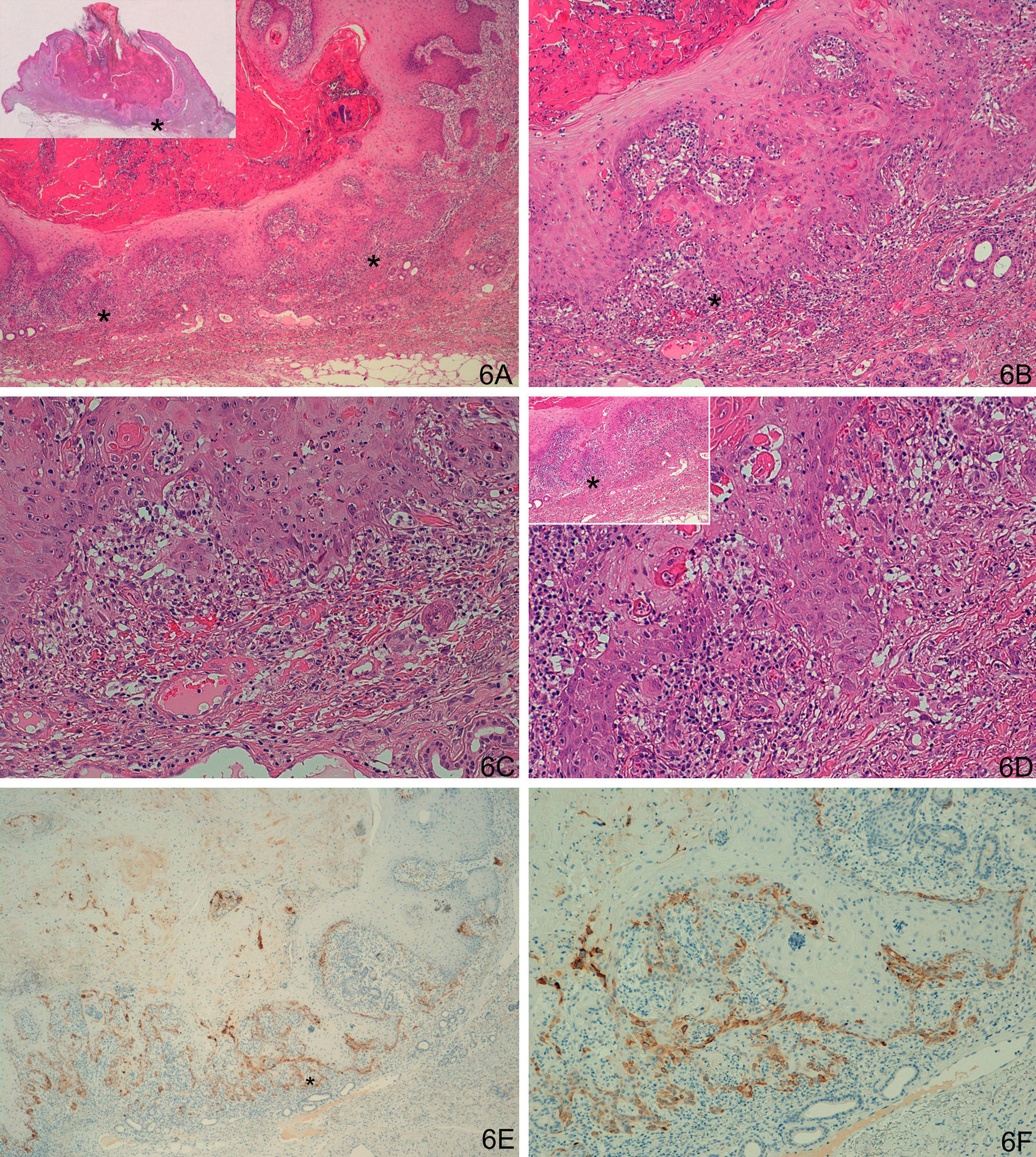
La tinción con laminina-332 fue negativa en la epidermis y anejos cutáneos normales. En el grupo de QA, grupo A, observamos positividad débil y focal, en células aisladas o pequeños grupos celulares (fig. 1). En todos los casos del grupo de QAm, grupo B, la tinción con laminina-332 fue positiva de forma intensa y continua en el área de transformación maligna a CE, habitualmente en el frente invasor del área de CE (fig. 2). La tinción con laminina-332 fue independiente de la fase evolutiva en que se encontraran tanto los QA como los QAm.
A y B. Queratoacantoma en fase proliferativa. C y D. Positividad débil y focal, en células aisladas, con la tinción para laminina-332 (A. Panorámica de laminina, panorámica de hematoxilina/eosina [H/E] en recuadro. B. H/E x40. C. Laminina x40. D. Laminina x100). *: Áreas ampliadas a mayor aumento.
A y B. Queratoacantoma (QA) con transformación maligna a carcinoma epidermoide (CE) en el centro de la lesión y en profundidad. C. Positividad intensa en frente invasor del CE (izquierda), negatividad en zona del QA (derecha). D. Positividad intensa en área de CE en profundidad del QA (A. Panorámica de laminina, panorámica de H/E en recuadro. B. H/E x40. C. Laminina x40. D: Laminina x100). *: Áreas ampliadas a mayor aumento.
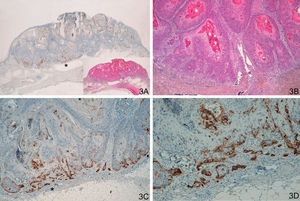
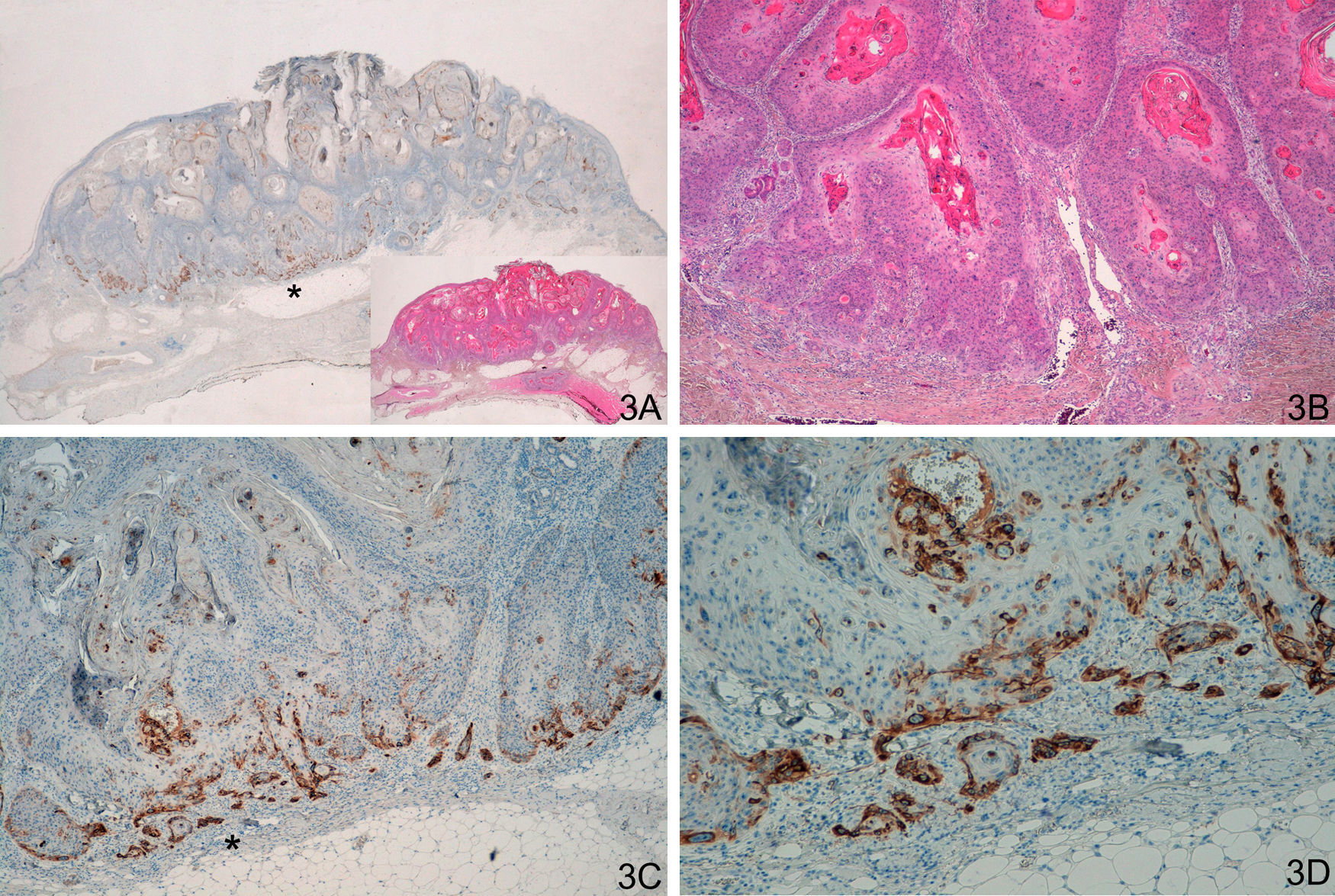
Observamos una tinción similar en los 20 casos del grupo de CE invasores, incluyendo los 8 CE con morfología crateriforme, positividad intensa, continua, «dibujando una cenefa», habitualmente en el frente invasor del CE (fig. 3). Habría que diferenciar esta tinción de algunos casos de QA que presentaban tinción positiva en la capa proliferativa, aunque en los QA se trataba de positividad débil y focal. El patrón de tinción fue diferente tanto si comparamos QA con QAm (p<0,0001) como si comparamos QA con CE invasores (p<0,0001).
A y B. Carcinoma epidermoide crateriforme. C y D. Tinción con laminina-332 intensamente positiva en frente invasor del carcinoma epidermoide (A. Panorámica de laminina, panorámica de H/E en recuadro. B. H/E x40. C. Laminina x 40. D. Laminina x100). *: Áreas ampliadas a mayor aumento.
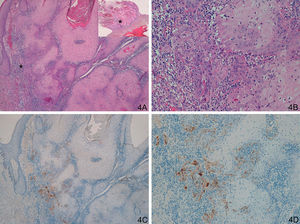
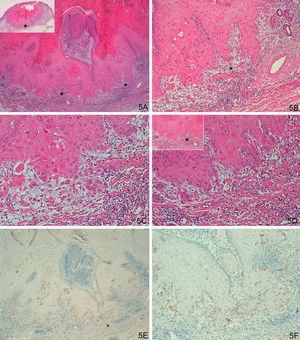
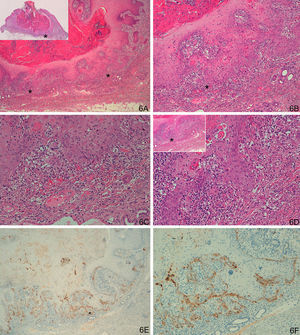
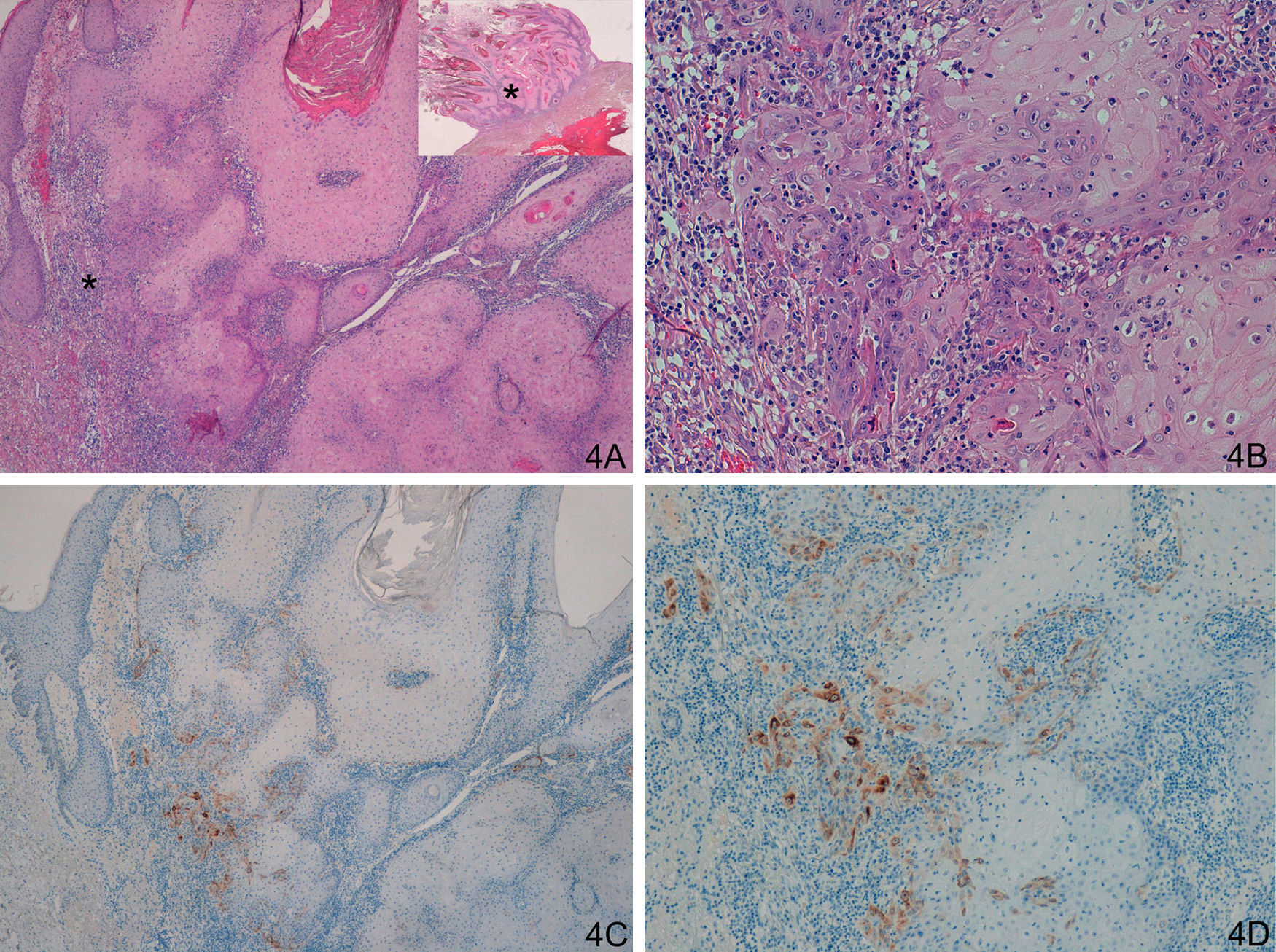
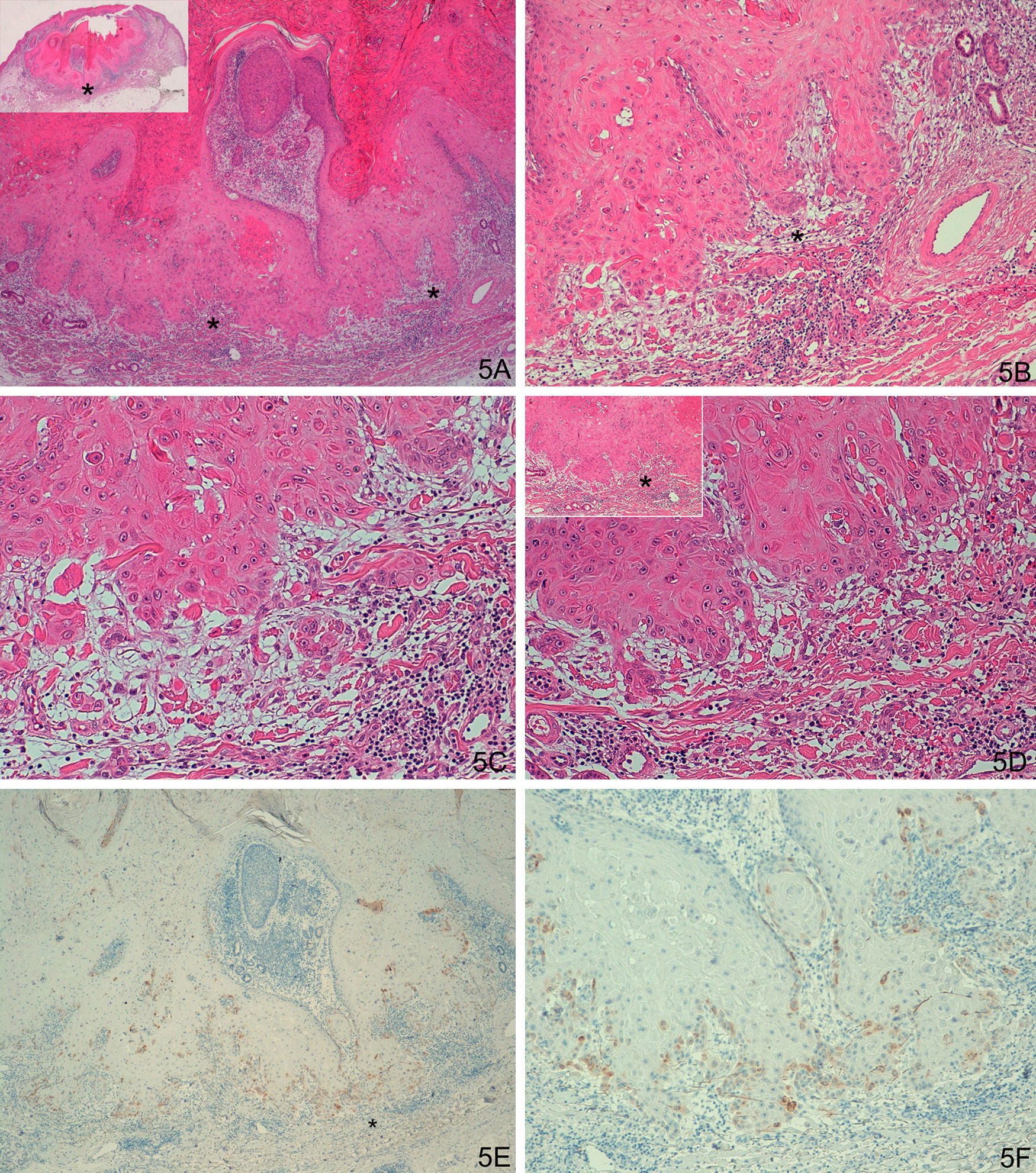
Respecto al grupo D (casos «problema» o histológicamente ambiguos), las 14 preparaciones histológicas se reexaminaron detenidamente por dos expertos en dermatopatología tras valorar los resultados con la tinción con laminina-332. Se diagnosticaron 4 casos de QA con un área pequeña de transformación maligna a CE (tinción para laminina-332 intensa de forma focal, en un área pequeña, correspondiente al área de transformación maligna a CE (fig. 4). Seis casos presentaban tinción para laminina débil, en células aisladas o pequeños focos celulares; tras reevaluar la hematoxilina-eosina se llegó a la conclusión de que se trataba de áreas proliferativas benignas de QA o áreas del QA que comienzan a regresar, pero sin evidencia histológica de CE (fig. 5). En 4 casos observamos un patrón de tinción tipo CE (positividad en frente invasor), aunque con una intensidad menos marcada que los otros casos de CE (fig. 6), que finalmente fueron diagnosticados de QA con CE incipiente.
A-D. Lesión histológicamente ambigua, queratoacantoma en fase de regresión activa con dudoso carcinoma epidermoide incipiente en algunas áreas. E-F. Positividad débil y focal, en células aisladas, similar a la de los queratoacantomas (A. H/E x40, panorámica de H/E en recuadro. B y C. H/E x100 y H/E x200. D. H/E x200, H/E x100 en recuadro. E. Laminina x40. F: Laminina x100). *: Áreas ampliadas a mayor aumento.
A-D. Dudoso carcinoma epidermoide incipiente en la profundidad de un queratoacantoma en fase de regresión activa. E-F. Positividad con tinción para laminina-332 en frente invasor tipo patrón de tinción de epidermoide, aunque con una intensidad menos marcada que los otros casos de CE (A: H/E x40, panorámica de H/E en recuadro. B y C. H/E x100 y H/Ex200. D. H/E x200, H/Ex100 en recuadro. E. Laminina x40. F. Laminina x100). *: Áreas ampliadas a mayor aumento.
Posteriormente, se revisó el comportamiento clínico de estas 74 lesiones, y solo dos lesiones (un CE del grupo C y un QA con transformación maligna a CE del grupo B) recidivaron a los 5 y 7 meses y precisaron reextirpación. No observamos metástasis ganglionares ni viscerales en ninguna lesión. Al tratarse de un estudio retrospectivo y fundamentalmente histológico, el seguimiento clínico era de menos de un año en 16 lesiones y de menos de dos años en otras 19 lesiones.
DiscusiónExisten numerosos estudios que tratan de diferenciar el QA del CE, usando tanto criterios histológicos5,6,19 como alteraciones cromosómicas20 o diversos marcadores, como p16, p53, Ki-67, VCAM (CD106), ICAM (CD54), telomerasa, COX-2 y receptores para angiotensina tipo 1, entre otros21–28. Ninguna de estas técnicas ha logrado diferenciar claramente el QA del CE.
Según los resultados de nuestro estudio la tinción con laminina-332 resulta de utilidad en la diferenciación de estos dos tumores. De este modo, la tinción con laminina-332 es totalmente distinta en los QA (tinción débil y focal) respecto a los CE y/o áreas de CE en QAm (tinción intensa y continua en el frente invasor del CE). Para el diagnóstico de los casos de CE o de QA con cambios histológicos y citológicos evidentes sería suficiente con la tinción de hematoxilina-eosina. Sin embargo, la tinción con laminina-332 podría suponer una importante ayuda en los casos de QA histológicamente ambiguos, con dudosas áreas histológicas de CE incipiente: en los casos de QAm con un área muy pequeña de CE, la tinción con laminina-332 es positiva de forma intensa, aunque solo en esa área pequeña de transformación maligna a CE. Cuando la tinción es focal pero débil no se evidenció CE. La mayor dificultad diagnóstica la encontramos en 4 lesiones histológicamente ambiguas, con discutibles o dudosas áreas de CE, que presentaban un patrón de tinción similar a los CE (positividad en frente invasor), pero con una intensidad de tinción menos marcada que los otros casos de CE. Tras reexaminar detenidamente la tinción hematoxilina-eosina, y puesto que en ningún QA habíamos observado este patrón de tinción (ni siquiera en la capa proliferativa de algunos QA), llegamos a la conclusión de que se trataba de CE muy incipientes. Habría que entender la oncogenicidad en los QA, como en la mayoría de tumores, como un proceso continuo, evolutivo, por lo que se pueden observar casos con áreas de CE totalmente desarrollados y casos con CE muy incipientes, como estas 4 lesiones.
Solamente hemos encontrado un estudio previo sobre tinción para laminina-332 en QA. Kuivanen TT et al.28 estudian 7 subtipos de metaloproteasas, laminina-5 (actualmente laminina-332) y p16 en 31 QA y en 15 CE. Respecto a sus resultados sobre la tinción para laminina, no comprendemos por qué concluyen que «en general, la laminina no es útil para diferenciar QA de CE», a pesar de que observan tinción positiva en el frente invasor de los CE, igual que en nuestro estudio.
En general, el comportamiento clínico de la mayoría de estas lesiones suele ser bueno, salvo excepciones3, siendo muy infrecuente que recidiven o produzcan metástasis2,6. En nuestro estudio solo se produjeron recidivas en dos lesiones, un CE y un QAm con transformación maligna a CE, que tuvieron que ser reextirpadas, aunque también hay que tener en cuenta que, al tratarse de un estudio histológico y retrospectivo, el seguimiento clínico fue de menos de dos años en casi la mitad de los casos. Serían necesarios más estudios para valorar el comportamiento clínico de estos CE derivados de QAm, a ser posible prospectivos, con un mayor número de pacientes y que analizasen también otros parámetros como la edad, la localización, la inmunodepresión, el tamaño y la profundidad del tumor, la invasión perineural, etc.
Existen numerosos estudios sobre la etiopatogenia y los posibles mecanismos implicados en la oncogénesis del QA1,2,5–7,21–28, y pensamos que no es el objetivo de este trabajo el análisis detallado de estos mecanismos oncogénicos. Sí que queremos resaltar que la laminina-332 podría constituir un «punto de inflexión» en la tranformación maligna de algunos QA hacia CE, aunque serían necesarios más estudios que demostrasen esta circunstancia. Según nuestros resultados, todos los QA que presentaban tranformación maligna hacia CE eran positivos de forma intensa con la tinción para laminina-332, incluso en aquellos casos en que se trataba de un área pequeña de transformación maligna o de CE muy incipientes. Clínicamente, la importancia de todo esto es que se podría utilizar como diana terapeútica10,11: se ha comprobado que la utilización de anticuerpos contra una fracción de la laminina-332 induce apoptosis tumoral y frena la proliferación, el crecimiento y/o el avance oncológico en los CE10. En el caso de los QA, si se comprueba que efectivamente la laminina-332 es necesaria para la transformación maligna hacia CE, se podrían utilizar estos anticuerpos para bloquear la transformación maligna hacia CE en algunos casos de QA (tendríamos casi la certeza de que estos QA no se iban a malignizar; podría ser muy útil por ejemplo en QA múltiples, QA gigantes o QA que por su localización pudieran dejar secuelas y/o cicatrices inestéticas).
Las limitaciones de este estudio son el número limitado de casos, que se trata de un estudio retrospectivo y la ausencia de un gold-standard en el diagnóstico histológico de QA.
En conclusión, la tinción para laminina-332 es diferente en los CE y en las áreas de CE consecuencia de la transformación maligna de algunos QAm (tinción intensa y continua, habitualmente en el frente invasor del CE), con respecto a los QA sin evidencia de CE (tinción débil y focal, en células aisladas o en pequeños grupos celulares). La tinción con laminina-332 ayudaría a diferenciar los QA de las áreas de CE, incluyendo los CE incipientes y también podría ser muy útil en el diagnóstico de lesiones histológicamente ambiguas, QA con «dudosas» áreas de CE.
Aunque serían necesarios más estudios que lo comprobasen, la laminina-332 podría ser fundamental para la transformación maligna hacia CE de algunos QA, circunstancia que habilitaría su utilidad como diana terapéutica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.



![A y B. Queratoacantoma en fase proliferativa. C y D. Positividad débil y focal, en células aisladas, con la tinción para laminina-332 (A. Panorámica de laminina, panorámica de hematoxilina/eosina [H/E] en recuadro. B. H/E x40. C. Laminina x40. D. Laminina x100). *: Áreas ampliadas a mayor aumento. A y B. Queratoacantoma en fase proliferativa. C y D. Positividad débil y focal, en células aisladas, con la tinción para laminina-332 (A. Panorámica de laminina, panorámica de hematoxilina/eosina [H/E] en recuadro. B. H/E x40. C. Laminina x40. D. Laminina x100). *: Áreas ampliadas a mayor aumento.](https://static.elsevier.es/multimedia/00017310/0000010300000004/v1_201304241404/S0001731011004741/v1_201304241404/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)