La ecografía ganglionar locorregional como parte de la estadificación previa a la biopsia del ganglio centinela (BSGC) en pacientes con melanoma no se incluye habitualmente en las guías de manejo. El objetivo de este estudio es evaluarla desde la perspectiva clínica y económica.
Pacientes y métodosEstudio retrospectivo de 384 pacientes con melanoma primario de estadios clínicos I-II, en el periodo 2004-2015, a los que se les realizó una ecografía ganglionar locorregional (±biopsia ecodirigida) previa a la BSGC. Se evaluó la fiabilidad de la técnica y se realizó un análisis de su coste efectividad.
ResultadosEn 23 pacientes (6%) se pudo evitar la realización de la BSGC mediante la técnica. La ecografía mostró una sensibilidad del 46% y una especificidad del 76% para la detección de ganglios metastásicos clínicamente no palpables. Los falsos negativos fueron significativamente más frecuentes en pacientes mayores de 60 años y con tumores <2mm. El coste unitario del proceso de estadificación mediante BSGC con ecografía-biopsia ecodirigida generó un sobrecoste de 16,30 €. El análisis coste-efectividad identificó como estrategia dominante desde ese punto de vista el protocolo de estadificación con ecografía y BSGC, con una ratio coste-efectividad inferior a la de la alternativa consistente en BSGC (8.095,24 vs. 28.605,00 €)
ConclusionesLa ecografía con biopsia ecodirigida como método diagnóstico de estadificación previo a la BSGC es una herramienta útil y coste-efectiva, que no sustituye a la BSGC, pero que permite en un porcentaje no desdeñable de casos evitar su realización.
Locoregional lymph node ultrasound is not typically included in guidelines as part of the staging process prior to sentinel lymph node biopsy (SLNB). The objective of the present study was to make a clinical and economic analysis of lymph node ultrasound prior to SLNB.
Materials and methodsWe performed a retrospective study of 384 patients with clinical stage I-II primary melanoma who underwent locorregional lymph node ultrasound (with or without ultrasound-guided biopsy) prior to SLNB between 2004 and 2015. We evaluated the reliability and cost-effectiveness of the strategy.
ResultsUse of locorregional lymph node ultrasound avoided SLNB in 23 patients (6%). Ultrasound had a sensitivity of 46% and specificity of 76% for the detection of metastatic lymph nodes that were not clinically palpable. False negatives were significantly more common in patients aged over 60 years and in tumors with a thickness of less than 2mm. The staging process using SLNB and ultrasound with ultrasound-guided biopsy produced an increase of €16.30 in the unit price. Our cost-effectiveness analysis identified the staging protocol with ultrasound and SLNB as the dominant strategy, with a lower cost-effectiveness ratio than the alternative, consisting of SLNB alone (8,095.24 vs. €28,605.00).
ConclusionsUltrasound with ultrasound-guided biopsy for the diagnostic staging of melanoma prior to SLNB is a useful and cost-effective tool. This procedure does not substitute SLNB, though it does allow to avoid SLNB in a not insignificant proportion of patients.
El melanoma es una neoplasia que, en relación con el tamaño tumoral, tiene una capacidad relativamente elevada de producir metástasis, en ocasiones de manera precoz. Su incidencia y mortalidad han aumentando de forma progresiva durante las últimas décadas, sobre todo en la población caucásica1,2.
Para establecer el pronóstico de un paciente con un melanoma cutáneo, los factores más importantes son la presencia de metástasis, el tipo y número de órganos afectos y, en su ausencia, el espesor tumoral y la presencia de ulceración3-5. La biopsia selectiva del ganglio centinela (BSGC), desde su introducción en 19926, se ha establecido como la técnica principal de estadificación locorregional que permite precisar el pronóstico de pacientes que tienen evidencia clínica y radiológica de enfermedad localizada (estadios clínicos I y II de la AJCC). A pesar de ser un método poco invasivo, no está exento de complicaciones, sobre todo locales (seroma, hematoma, infección de la herida quirúrgica, etc.) y, más raramente, linfedema. Además, a los pacientes se les aplica una anestesia general o raquimedular, con los riesgos que supone.
La realización de pruebas complementarias radiológicas es objeto de debate permanente por la baja tasa de detección de metástasis en relación con el coste que ocasionan, tanto por las propias pruebas como por la detección de «incidentalomas» (hallazgos no relacionados con el melanoma que precisan de nuevas pruebas para su caracterización) y la ansiedad que todos estos hechos originan en los pacientes. A pesar de ello, parece razonable utilizar técnicas económica y clínicamente rentables que permitan evitar la realización de la BSGC en los casos en los que no sea precisa. Existen múltiples trabajos que muestran los resultados de evaluar el papel de la ecografía tradicional, la ecografía de alta resolución, la punción aspiración con aguja fina guiada por ecografía, la ecografía con contraste y PET/TC como técnicas de estadificación previas a la BSGC, con resultados diversos7-17. Sin embargo, hay pocos trabajos que tengan en cuenta el coste-efectividad de la aplicación de estos procedimientos18.
El objetivo de este estudio es evaluar el papel de la ecografía, incluida la biopsia guiada por ecografía en los casos en los que la precisen, como método de estadificación previo a la realización de la BSGC, enfocado a valorar el porcentaje de casos en los que se evita la realización de la BSGC y su coste-efectividad en nuestro medio.
Material y métodosSe diseñó un estudio observacional retrospectivo a partir de los datos recogidos en la base de datos de melanoma de nuestro hospital.
A efectos del estudio, se seleccionaron todos los pacientes con melanoma cutáneo a los que se les había realizado una ecografía ganglionar previa a la BSGC como parte del estudio de estadificación, desde el 1 de enero de 2004 hasta el 31 de diciembre de 2015, en el Instituto Valenciano de Oncología. Se excluyeron, por lo tanto, aquellos en los que se detectaron metástasis ganglionares durante la exploración física (adenopatías palpables confirmadas histológicamente). Además, se excluyeron los melanomas de mucosas, uveales y primarios desconocidos y aquellos en los que no había información suficiente acerca del resultado de la ecografía ganglionar, de la biopsia ecodirigida o del resultado de la BSGC (se excluyó, por tanto, a los pacientes en los que no se logró identificar el GC).
El estudio fue aprobado por el Comité Ético de la institución.
En nuestro centro, se selecciona para BSGC a aquellos pacientes con melanomas de más de 0,75mm o de menor espesor y que presenten al menos alguno de los siguientes factores de riesgo: ulceración, presencia de al menos una mitosis/mm2, satelitosis microscópica/invasión vascular, regresión mayor del 50% o extirpación incompleta con margen profundo afecto (la regresión dejó de utilizarse como criterio de selección en enero de 2015 después de la demostración de la ausencia de su valor predictivo para la afectación del GC)19,20. De forma sistemática, los pacientes con melanoma cutáneo primario que cumplían criterios de realización de BSGC fueron evaluados previamente como parte del estudio de estadificación mediante ecografía ganglionar en modos B y doppler. Las ecografías fueron realizadas por 2radiólogos experimentados (C.D., M.G.). Los ganglios linfáticos fueron clasificados como benignos, indeterminados o sospechosos de malignidad de acuerdo con los criterios estándar ya descritos21.
En la exploración ecográfica se incluyeron todos los territorios de drenaje posibles según la localización. En aquellos con resultado indeterminado o sospechoso de malignidad se realizó una biopsia con aguja gruesa («tru-cut») (BAG) guiada por ecografía. El estudio histológico de las biopsias realizadas incluyó el examen con hematoxilina-eosina y con inmunohistoquímica (S100 y melan-A). En los pacientes en los que el estudio histológico de la biopsia mostró la presencia de células de melanoma, se realizó directamente una linfadenectomía terapéutica de la cuenca linfática correspondiente. En los demás casos, se procedió a la BSGC y, después, a la linfadenectomía terapéutica en los casos con células de melanoma. La técnica de evaluación del GC en nuestro centro se encuentra descrita en detalle en trabajos previos22.
A efectos del estudio se consideraron como variables respuesta: 1) el porcentaje de casos en los que mediante la ecografía y la BAG se evitó la realización de la BSGC; 2) la rentabilidad clínica de la BAG en los ganglios identificados como indeterminados y sospechosos de malignidad (juntos y por separado); 3) los falsos negativos de la ecografía; 4) la ratio coste-efectividad de la estadificación inicial de pacientes con melanoma según se realice o no ecografía ganglionar regional previa a la BSGC.
Análisis estadístico y económicoSe emplearon tablas de contingencia y se calculó la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo tanto para la capacidad de detectar metástasis de la ecografía ganglionar como de la biopsia ecodirigida. A efectos del estudio, se consideraron como verdaderos positivos los casos con ecografías indeterminadas o patológicas con confirmación histológica bien mediante la BAG, bien mediante la BSGC.
Se consideran falsos positivos las ecografías indeterminadas y patológicas, pero sin metástasis ganglionar, tanto en la BAG como en la BSGC.
Se consideran verdaderos negativos las ecografías normales con BSGC negativo y falsos negativos las ecografías normales con BSGC positiva.
Se utilizó el software SPSS 20.0 (SPSS, Illinois, Inc; EE. UU.)
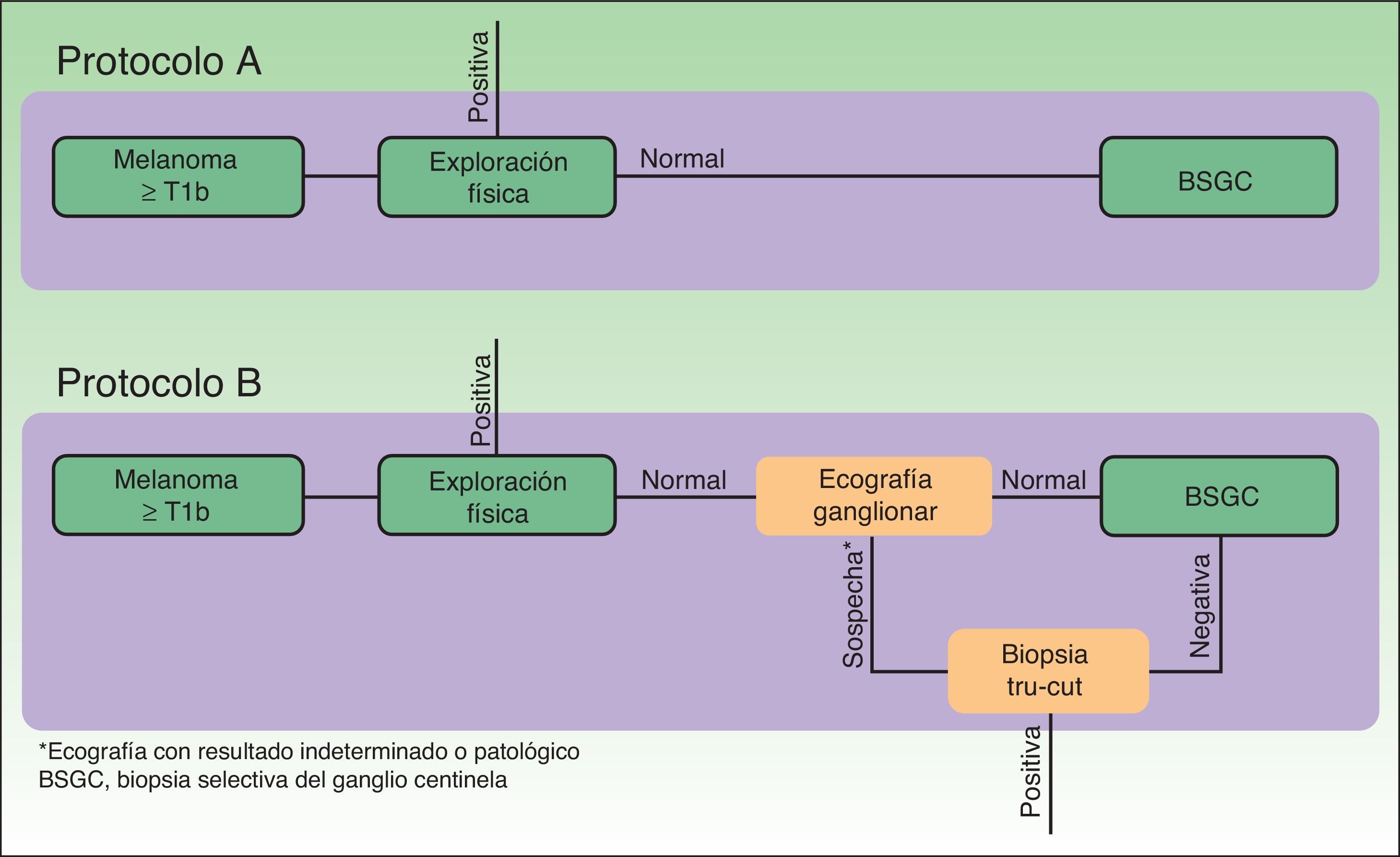
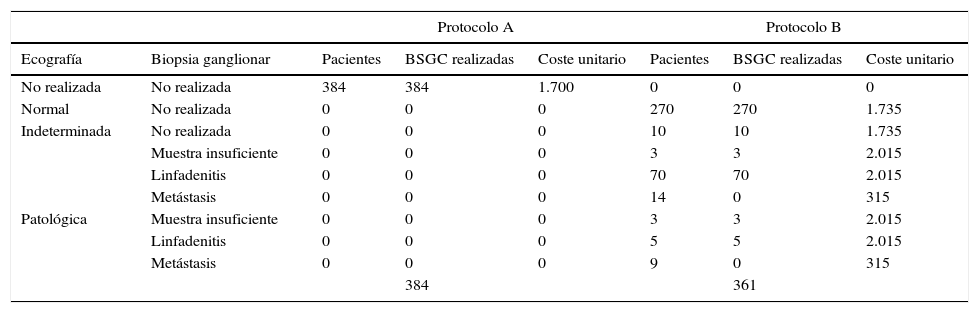
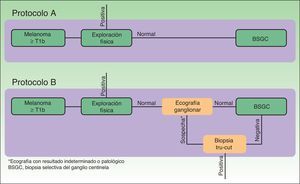
El análisis económico consistió en un estudio de coste-efectividad, desde la perspectiva del servicio de salud, mediante el que se comparó la eficiencia de 2protocolos teóricos de estadificación de pacientes con melanoma diferenciados en la realización o no de ecografía ganglionar regional en la fase inicial de la estadificación (fig. 1).
En el protocolo A no se realizó ecografía ganglionar en la estadificación inicial de los pacientes, por lo que a todos los pacientes seleccionados se les realizó una BSGC. En el protocolo B se realizó ecografía ganglionar regional a todos los pacientes, así como BAG a aquellos pacientes con ecografía ganglionar con resultado indeterminado o patológico. A los pacientes en los que la BAG confirmó la presencia de metástasis ganglionar no se les realizó BSGC (fig. 1, selección).
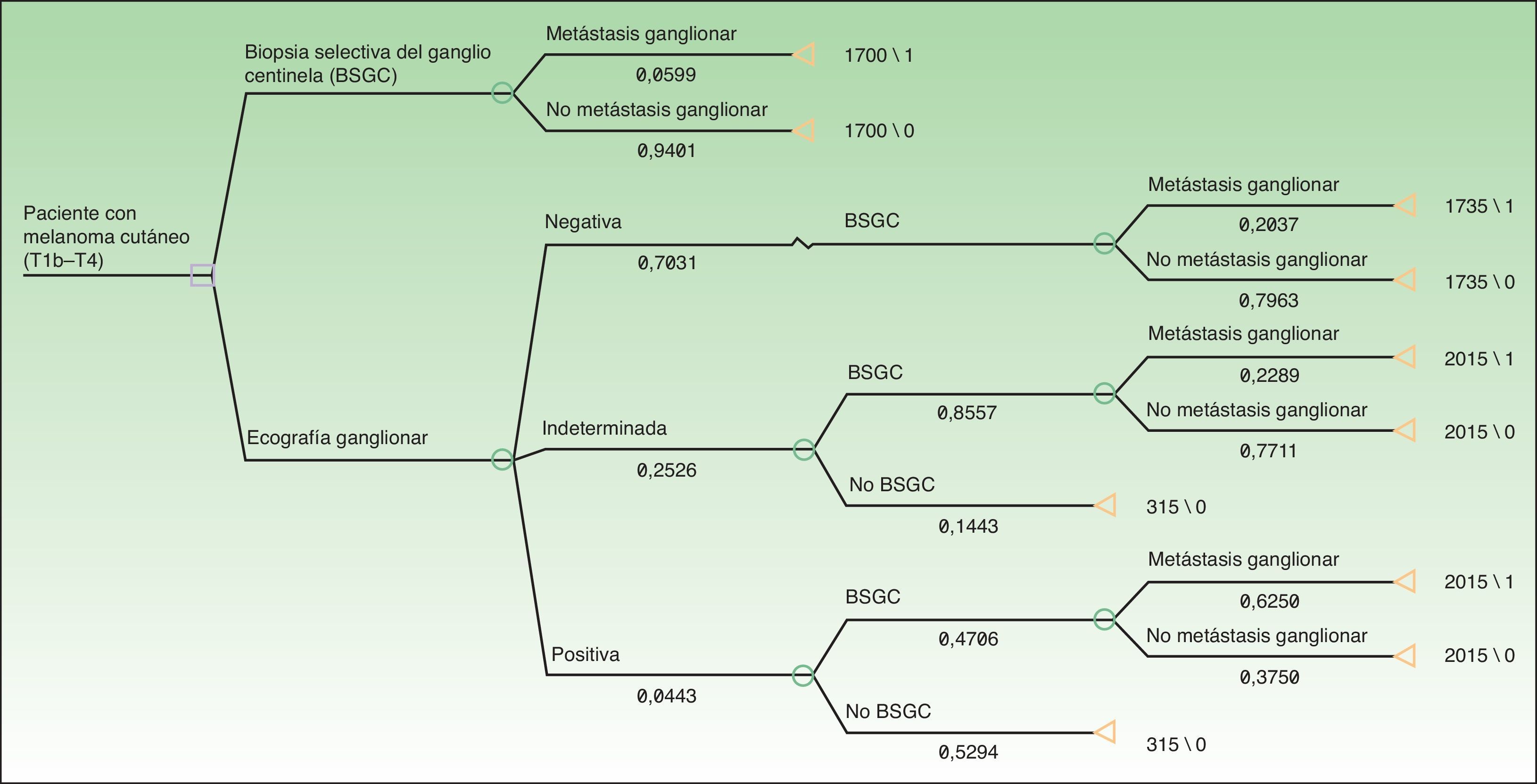
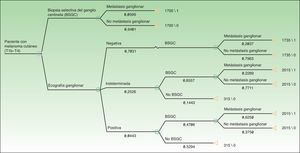
A partir del conjunto de actividades descritas en la figura 1 se aplicó una metodología ABC (costes por actividad) para imputar costes concretos a aquellas actividades realizadas en cada uno de los protocolos (ecografía ganglionar, BAG, BSGC) (fig. 1). Las actividades comunes y con resultados previsiblemente indistinguibles en ambos protocolos fueron excluidas de la asignación de costes (exploración física). Para la asignación de costes a cada actividad se aplicaron las siguientes tarifas vigentes en el sistema de salud en el que se desarrolló el estudio: ecografía ganglionar 35 €, BAG 280 €, BSGC 1.700 €. Los precios tarificados son los costes facturados a terceros por la prestación de estos servicios e incluyen los costes directos e indirectos derivados de la actividad del centro. A partir de estos costes por actividad y de la frecuencia de eventos observados (metástasis ganglionar identificada) se calcularon los costes unitarios (€/paciente) (tabla 1). A partir de estos costes y de las probabilidades de aparición de los eventos en cada protocolo se diseñó un árbol de decisión mediante el software TreeAge Pro® 2016 (TreeAge Software Inc.) para calcular la ratio coste-efectividad de cada protocolo y para identificar la estrategia dominante (fig. 2). Como medida de efectividad se consideró la frecuencia de identificación de metástasis ganglionares en cada uno de los protocolos comparados.
Procedimientos realizados, eventos (metástasis ganglionar) y costes en cada uno de los protocolos estudiados
| Protocolo A | Protocolo B | ||||||
|---|---|---|---|---|---|---|---|
| Ecografía | Biopsia ganglionar | Pacientes | BSGC realizadas | Coste unitario | Pacientes | BSGC realizadas | Coste unitario |
| No realizada | No realizada | 384 | 384 | 1.700 | 0 | 0 | 0 |
| Normal | No realizada | 0 | 0 | 0 | 270 | 270 | 1.735 |
| Indeterminada | No realizada | 0 | 0 | 0 | 10 | 10 | 1.735 |
| Muestra insuficiente | 0 | 0 | 0 | 3 | 3 | 2.015 | |
| Linfadenitis | 0 | 0 | 0 | 70 | 70 | 2.015 | |
| Metástasis | 0 | 0 | 0 | 14 | 0 | 315 | |
| Patológica | Muestra insuficiente | 0 | 0 | 0 | 3 | 3 | 2.015 |
| Linfadenitis | 0 | 0 | 0 | 5 | 5 | 2.015 | |
| Metástasis | 0 | 0 | 0 | 9 | 0 | 315 | |
| 384 | 361 | ||||||
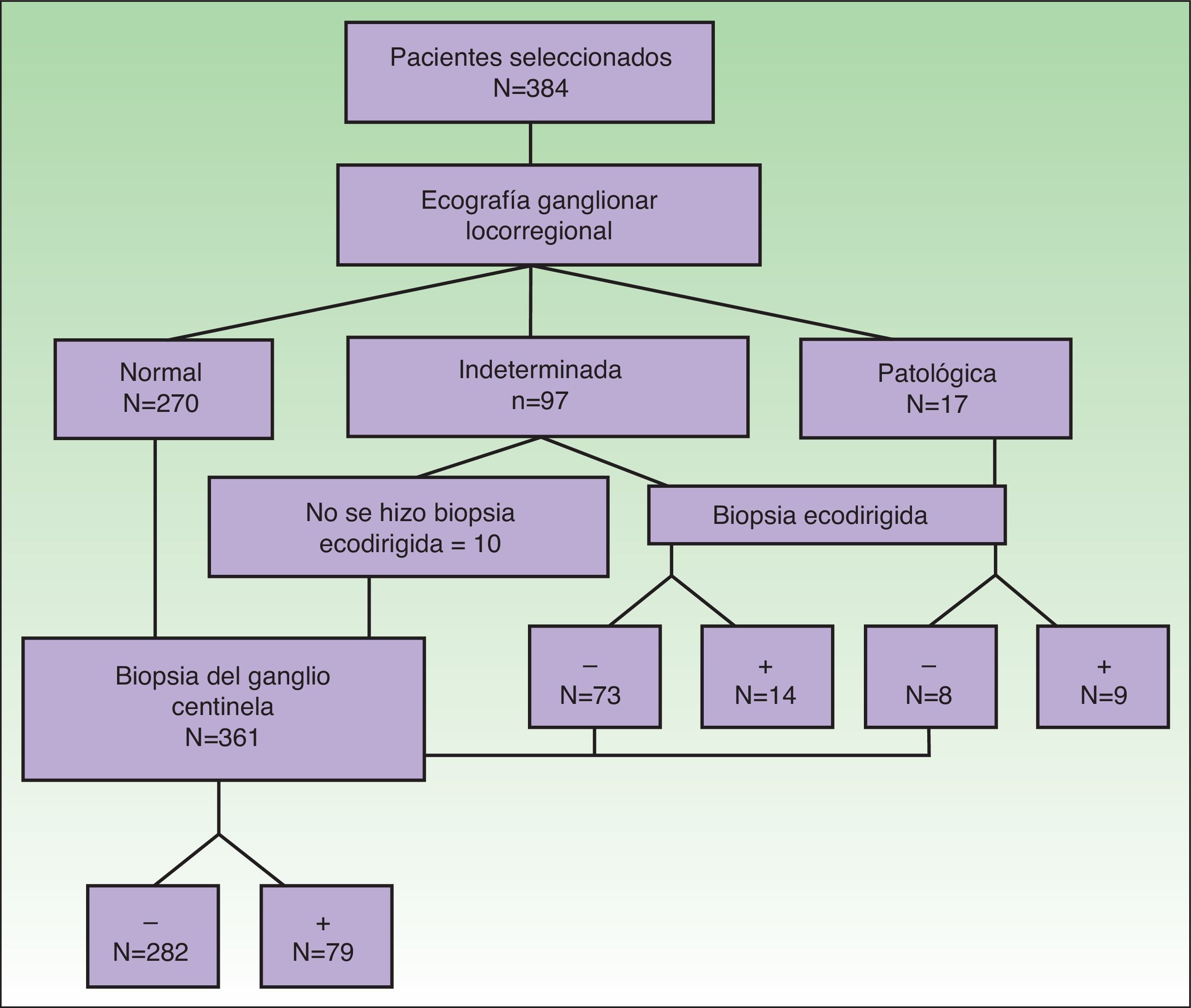
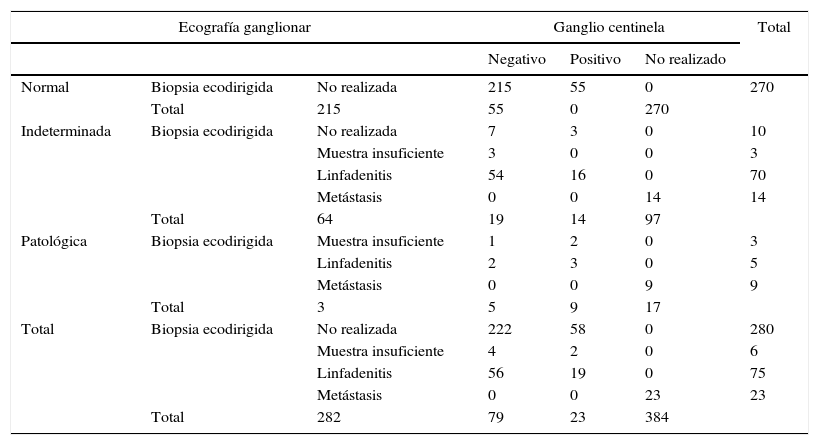
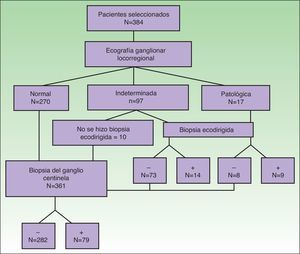
Se identificaron 384 pacientes que cumplían los criterios de selección sobre los que se realizó el estudio (fig. 3). La ecografía fue normal en 270 pacientes, indeterminada en 97 y patológica en 17 (tabla 2).
Características de los pacientes con relación a la ecografía ganglionar, la biopsia ecodirigida y el resultado de la BSGC
| Ecografía ganglionar | Ganglio centinela | Total | ||||
|---|---|---|---|---|---|---|
| Negativo | Positivo | No realizado | ||||
| Normal | Biopsia ecodirigida | No realizada | 215 | 55 | 0 | 270 |
| Total | 215 | 55 | 0 | 270 | ||
| Indeterminada | Biopsia ecodirigida | No realizada | 7 | 3 | 0 | 10 |
| Muestra insuficiente | 3 | 0 | 0 | 3 | ||
| Linfadenitis | 54 | 16 | 0 | 70 | ||
| Metástasis | 0 | 0 | 14 | 14 | ||
| Total | 64 | 19 | 14 | 97 | ||
| Patológica | Biopsia ecodirigida | Muestra insuficiente | 1 | 2 | 0 | 3 |
| Linfadenitis | 2 | 3 | 0 | 5 | ||
| Metástasis | 0 | 0 | 9 | 9 | ||
| Total | 3 | 5 | 9 | 17 | ||
| Total | Biopsia ecodirigida | No realizada | 222 | 58 | 0 | 280 |
| Muestra insuficiente | 4 | 2 | 0 | 6 | ||
| Linfadenitis | 56 | 19 | 0 | 75 | ||
| Metástasis | 0 | 0 | 23 | 23 | ||
| Total | 282 | 79 | 23 | 384 | ||
De acuerdo con los datos obtenidos (tabla 3), la ecografía, como técnica de detección de ganglios metastásicos, tiene una sensibilidad del 46%, una especificidad del 76%, un valor predictivo positivo del 41%, un valor predictivo del 79% y una tasa de falsos negativos del 20%. De los 97 pacientes con ecografía indeterminada, finalmente presentaron metástasis ganglionar 33 (34%).
El análisis de la rentabilidad de la BAG ecodirigida mostró los resultados recogidos en la tabla 2. De los 114 pacientes con ecografía indeterminada o patológica se realizó BAG a 104. De los 87 pacientes con ecografía indeterminada en los que se realizó BAG, fue negativa en 73 (83,9%) y positiva en 14 (16,1%) (sensibilidad=42%; especificidad=84,4%). De los 17 pacientes con ecografía sospechosa de malignidad y en los que se realizó biopsia ecodirigida, fue negativa en 8 (40%) y positiva en 9 (45%) (sensibilidad=64%; especificidad=66,7%). El material de biopsia fue insuficiente en 3 pacientes con ecografía indeterminada y en el mismo número de pacientes con ecografía patológica (fig. 3).
De forma global, se calculó para la BAG una sensibilidad del 22,5%, especificidad del 19,8%, valor predictivo positivo del 100% y valor predictivo negativo del 74,6%. El porcentaje de ganglios positivos en cada grupo, sobre los pacientes en los que se realizó BAG y había material para su análisis, fue del 16,6% (14/84) en el grupo de ecografía con resultado indeterminado y del 64% (9/14) en el grupo con ecografía patológica.
Se realizó BSGC en 361 pacientes, que fue negativa en 282 casos y positiva en 79. El porcentaje de ganglios centinelas positivos con BAG negativa (falsos negativos) fue del 22,8% (16/70) en el grupo de ecografía indeterminada y del 60% (3/5) en el grupo de ecografía patológica.
Se evaluaron los factores asociados a los 55 casos que resultaron ser falsos negativos de la ecografía. Se observó que había un porcentaje estadísticamente significativo de falsos negativos en pacientes mayores de 60 años y para un espesor de Breslow <2mm. El resto de los factores estudiados no resultaron estadísticamente significativos (tabla 4).
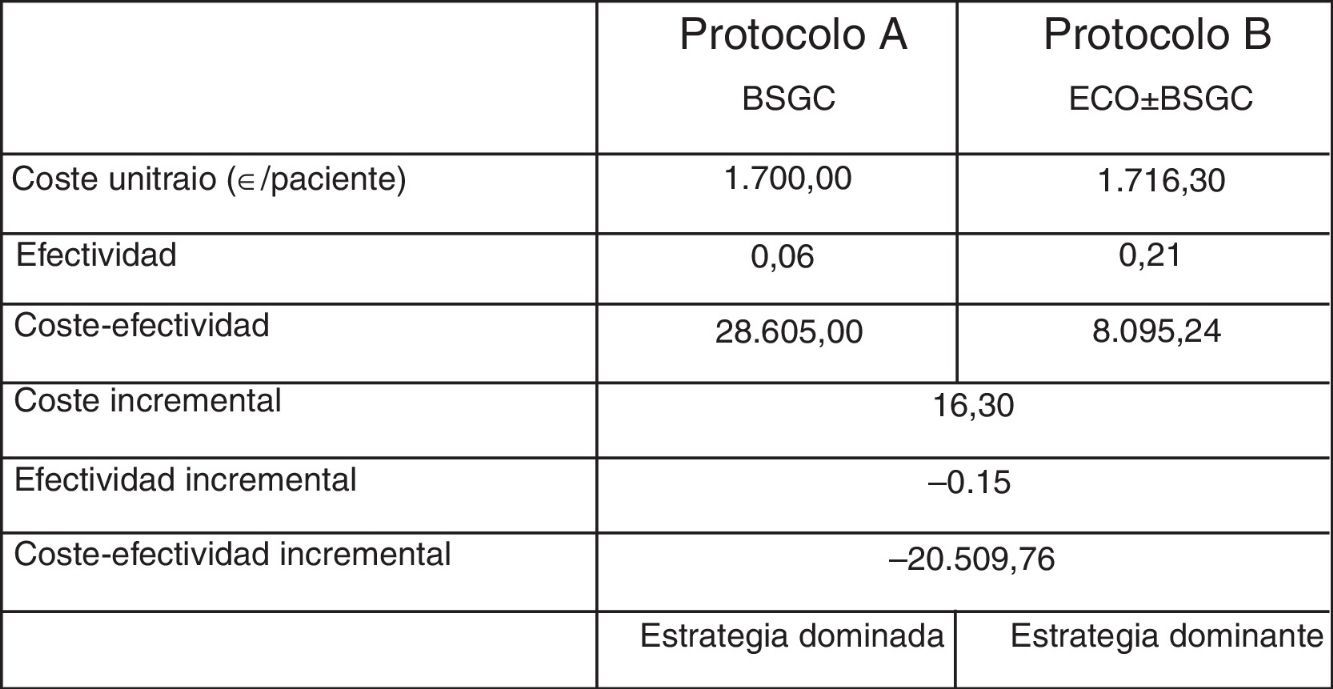
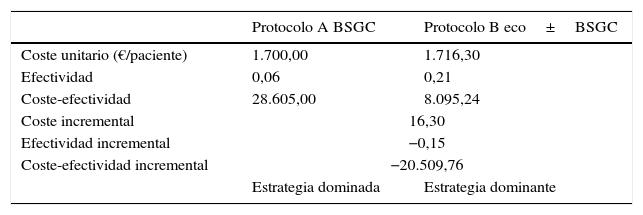
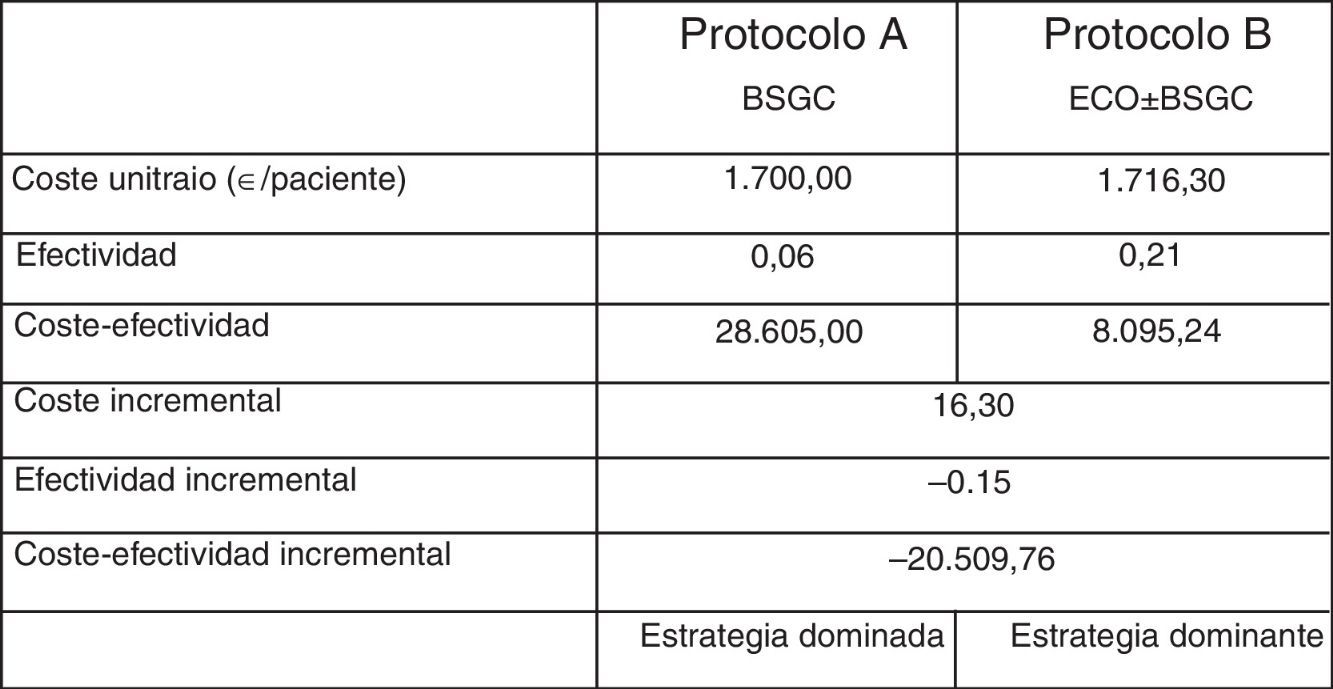
Resultados del análisis de coste-efectividad
| Protocolo A BSGC | Protocolo B eco±BSGC | |
|---|---|---|
| Coste unitario (€/paciente) | 1.700,00 | 1.716,30 |
| Efectividad | 0,06 | 0,21 |
| Coste-efectividad | 28.605,00 | 8.095,24 |
| Coste incremental | 16,30 | |
| Efectividad incremental | −0,15 | |
| Coste-efectividad incremental | −20.509,76 | |
| Estrategia dominada | Estrategia dominante | |
Finalmente, se analizaron los costes derivados de la realización de la ecografía, y la biopsia ecodirigida consecuencia de esta, previa a la biopsia del ganglio centinela (GC). De acuerdo con nuestros resultados, se evitó la realización de la BSGC en 23 pacientes (6%). La metodología ABC proporcionó un coste unitario de 1.700,00 y 1.716,30 € para cada paciente estadificado mediante BSGC y BSGC con ecografía previa, respectivamente. El análisis coste-efectividad identificó como estrategia dominante desde el punto de vista de coste-efectividad al protocolo de estadificación con ecografía y BSGC, con una ratio coste-efectividad inferior a la de la alternativa consistente en BSGC (8.095,24 vs. 28.605,00 €) (tabla 3).
DiscusiónNuestro estudio reafirma los datos observados en la literatura respecto al valor de la ecografía como método de estadificación locorregional en el melanoma: se trata de un método útil, pero no lo suficientemente preciso como para sustituir a la BSGC como técnica de elección7-17. Es importante destacar que en un 34% de los pacientes con ecografía indeterminada y, por lo tanto, con características ecográficas no definitorias de metástasis pero con rasgos que no permiten descartarlas, tenían metástasis ganglionar. Por otra parte, en los pacientes con ecografía patológica, la biopsia ecodirigida permitió detectar metástasis en más de la mitad de ellos. Dado que presenta también un porcentaje de falsos negativos, ante un resultado negativo se debe completar la estadificación mediante la BSGC.
La principal ventaja de la ecografía con biopsia ecodirigida previa a la BSGC es que hace innecesaria la realización de la BSGC en aquellos casos en los que se detecta metástasis mediante la biopsia ecodirigida. En nuestra serie esto ocurrió en 23 de los 384 pacientes (6%). Pese a no ser un gran número, para los pacientes que pueden beneficiarse de esta situación supone una ventaja importante, ya que, aunque la BSGC es un proceso poco invasivo, no está exento de complicaciones.
Por otra parte, el análisis coste-efectividad realizado demuestra que, para la casuística observada en esta serie, la realización de ecografía para la estadificación inicial de los pacientes con melanoma genera un coste adicional de 16,30 € por cada paciente estadificado. Este coste representa un incremento del 0,96% en el coste de la estadificación de cada paciente con melanoma, coste adicional que puede considerarse aceptable para la mayoría de los servicios de salud, especialmente si se tiene en cuenta la incidencia media-baja que el melanoma cutáneo tiene en España (8,76; IC 95%: 7,50-10,02)23. Así, para una hospital con una población de referencia de 500.000 habitantes, con una incidencia esperada de 40-50 casos/año y asumiendo que el 50% de los casos son diagnosticados como melanoma en estadio in situ o T1, sin indicación de BSGC, la incorporación de la ecografía en la estadificación inicial representaría un sobrecoste total anual de entre 350 y 450 €, coste adicional asumible por la mayoría de los servicios de salud23,24. Por otra parte, el coste generado por las ecografías realizadas a todos los pacientes (n=384) y las biopsias ganglionares realizadas para la confirmación de los hallazgos ecográficos sospechosos de malignidad (n=104) se compensó de forma parcial por las 23 BSGC evitadas (42.560 vs. 39.100 €). Este incremento en los costes totales se tradujo en un incremento de 150,43 € por cada BSGC evitada, el 8,85% del coste de realización de una BSGC. A pesar de la baja morbilidad de la BSGC, este coste adicional de 150 € para evitar el procedimiento podría considerarse aceptable y favorable a la implantación de la ecografía.
De la misma forma, y considerando la identificación de metástasis ganglionares como medida de efectividad, el sobrecoste unitario de 16 € fue superado por la elevada frecuencia de identificación de metástasis ganglionares en los pacientes con estudio ecográfico positivo. Esta ventaja de efectividad (0,06 vs. 0,21) generó una ratio coste-efectividad incremental que permitió identificar al protocolo de estadificación mediante ecografía y BSGC como la estrategia más coste-efectiva y, por lo tanto, dominante sobre la estadificación mediante BSGC.
Las limitaciones de nuestro estudio son la realización en un único centro y, al tratarse de un estudio retrospectivo, la ausencia de aleatorización y de grupo control. En cuanto a la BAG, hemos obtenido cifras menores de sensibilidad y especificidad respecto a otros estudios, lo que requiere el análisis de posibles causas y establecer un plan de mejora en las causas corregibles. Un posible motivo podría ser que los pacientes de nuestro estudio presentaran menores espesores de Breslow que otros, posiblemente con menos carga metastásica y mayor dificultad para obtener una muestra adecuada en la BAG; hipótesis que puede verse sustentada por el mayor porcentaje de falsos negativos encontrado en los tumores de menor espesor. Para valorarlo se precisa un análisis por subgrupos y la posterior comparación con otros trabajos.
Como conclusión de nuestro trabajo, cabe decir que la ecografía, incluyendo la biopsia ecodirigida en los casos que la requieren, como método diagnóstico de estadificación previo a la BSGC es una herramienta útil y coste-efectiva.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.