Las guías sobre el tratamiento de la psoriasis habitualmente no incluyen las recomendaciones acerca de cuál debe ser la primera línea de tratamiento sistémico o biológico. Los objetivos de este estudio fueron describir las tendencias en la prescripción del primer fármaco biológico y comparar la retirada de los fármacos y las tasas de efectos adversos a lo largo de los 10 años de seguimiento.
Material y métodosSe utilizó el registro Biobadaderm para determinar cuál fue el primer fármaco biológico indicado en pacientes con psoriasis naïve para biológicos, así como cuál es la tasa de efectos adversos y los motivos de suspensión de los fármacos. Los resultados obtenidos se compararon en tres periodos distintos de tiempo (2008-2010, 2011-2014, 2015-2018).
ResultadosLos fármacos anti-TNF fueron los biológicos prescritos con mayor frecuencia entre los años 2008 y 2010. Ustekinumab se convirtió en el tratamiento biológico más indicado a partir de 2014. El motivo principal de suspensión de los tratamientos fueron los efectos adversos, la falta de eficacia y la remisión de la enfermedad. La probabilidad de suspender los fármacos por uno de estos motivos fue cada vez menor si se compara con el periodo de tiempo previo.
ConclusionesEl presente estudio identifica cuáles fueron las tendencias en la prescripción del primer fármaco biológico en la práctica clínica habitual entre los años 2008 y 2018. Sugiere que los dermatólogos estamos cada vez más seguros en cuanto al perfil de seguridad y somos cada vez más exigentes en cuanto a la eficacia de los fármacos.
Current psoriasis guidelines do not usually include recommendations about first line classical or biologic treatment. The objectives of this study were: to describe shifts in the prescription of the first biological treatment, and to compare treatment withdrawal and rates of adverse events over ten years.
Material and methodsBiobadaderm registry was analyzed to describe: first biological prescription in bio-naïve patients, adverse events rate and reasons for drug withdrawal comparing three periods of time (2008-2010, 2011-2014, 2015-2018).
ResultsAnti-TNF drugs were the most prescribed biological drug from 2008 to 2010. Ustekinumab has become the most prescribed first biologic since 2014. The main reasons for drug discontinuation were adverse events, lack of efficacy and remission. In each period any treatment was less likely to be discontinued due to any of these three reasons comparing to the previous period.
ConclusionsThe present study identifies trends in prescription of the first biological antipsoriatic drug in clinical practice from 2008 to 2018. It suggests that we have become more comfortable with the safety profile and more exigent with the efficacy of the drugs.
La disponibilidad de nuevos fármacos biológicos y de nuevas moléculas sigue cambiando el manejo de los pacientes con psoriasis moderada a severa. Un metaanálisis reciente revisó cuáles fueron las mejores opciones para alcanzar el Psoriasis Area and Severity Index (PASI) 90 y no encontró diferencias entre el perfil de seguridad de los medicamentos1. Sin embargo, la elección del tratamiento de primera línea para la psoriasis moderada a severa en la vida real no se basará únicamente en los datos de eficacia o de seguridad.
En España, los medicamentos biológicos y el apremilast son reembolsables por el Servicio Nacional de Salud en pacientes que tengan una respuesta inadecuada o contraindicaciones para la terapia sistémica clásica. Las guías españolas y europeas no incluyen recomendaciones acerca de cuáles deben ser los tratamientos biológicos de primera línea2,3. Sin embargo, tanto la guía clínica británica como la francesa, recientemente actualizadas, han propuesto a ustekinumab o a adalimumab como tratamientos de primera línea4,5.
Los objetivos del presente estudio fueron: 1)describir los cambios en la prescripción del primer tratamiento biológico o de las nuevas moléculas pequeñas en el tratamiento de la psoriasis y 2)comparar las tasas de abandono del tratamiento y la incidencia de eventos adversos durante 10años de seguimiento.
Pacientes y métodosEn el presente estudio se utilizó el registro Biobadaderm: un registro multicéntrico prospectivo de cohortes compuesto por pacientes diagnosticados de psoriasis que recibieron tratamiento sistémico. Este registro tiene la finalidad de detectar eventos adversos relacionados con las terapias sistémicas. El formulario de recopilación de datos y la codificación del registro se han descrito en una publicación previa6.
Para describir las tendencias en los patrones de tratamiento a lo largo del tiempo los datos se clasificaron en tres ventanas de tiempo similares: a)2008-2010; b)2011-2014, y c)2015-2018. Para este análisis solo se consideraron los casos de pacientes que habían recibido monoterapia y que eran naïve para los tratamientos biológicos, ya que estos podrían reflejar de una mejor forma cuál fue la opción terapéutica de primera línea y hacer que los grupos de estudio fuesen comparables.
Los resultados se presentaron en dos cohortes: una de terapia biológica o nuevas moléculas pequeñas (apremilast), y otra de terapias clásicas.
Las características de los pacientes para cada grupo se presentaron de manera descriptiva: en números absolutos y en porcentajes para las variables cualitativas, y como mediana y rango intercuartílico para las variables asimétricas. Las diferencias entre los grupos se compararon utilizando la prueba de chi cuadrado o la prueba de Wilcoxon-Mann-Whitney.
Se usaron modelos de riesgos competitivos para comparar las funciones de incidencia acumulada de la interrupción de los tratamientos (ya sea por ineficacia como por un evento adverso, o por la remisión de la enfermedad). Los otros motivos por los cuales se interrumpió el tratamiento se consideraron como causas de censura (p.ej., pérdida de seguimiento, decisiones del paciente, embarazo planificado o deseado, etc.). También describimos las tasas de incidencia de los eventos adversos por cada 1.000 paciente-años de exposición con un intervalo de confianza (IC) del 95% por cada periodo de tiempo.
Los datos se analizaron con el software estadístico Stata, versión 14.2 (StataCorp. 2015. College Station, TX: StataCorp LP) y los valores de p<0,05 se consideraron como estadísticamente significativos.
El registro Biobadaderm fue aprobado por el Comité de Ética del Hospital 12 de Octubre (216/07) y se realizó en conformidad con la Declaración de Helsinki. Todos los pacientes dieron su consentimiento por escrito para poder participar.
ResultadosEn total 3.090 pacientes con psoriasis iniciaron un tratamiento entre el año 2008 y el 2018. De estos, 2.526 cumplieron con los criterios de inclusión (tratamiento en monoterapia y ser naïve para tratamiento biológico): 1.075 (43%) se encontraban dentro del grupo de medicamentos biológicos o de nuevas moléculas pequeñas y 1.451 (57%) en el grupo de medicamentos clásicos. De los 2.526 pacientes, el 43,4% (1.096) iniciaron el tratamiento entre los años 2008 y 2010 (periodo1), el 29,4% (743) entre 2011 y 2014 (período2) y el 27,2% (687) entre 2015 y 2018 (período3).
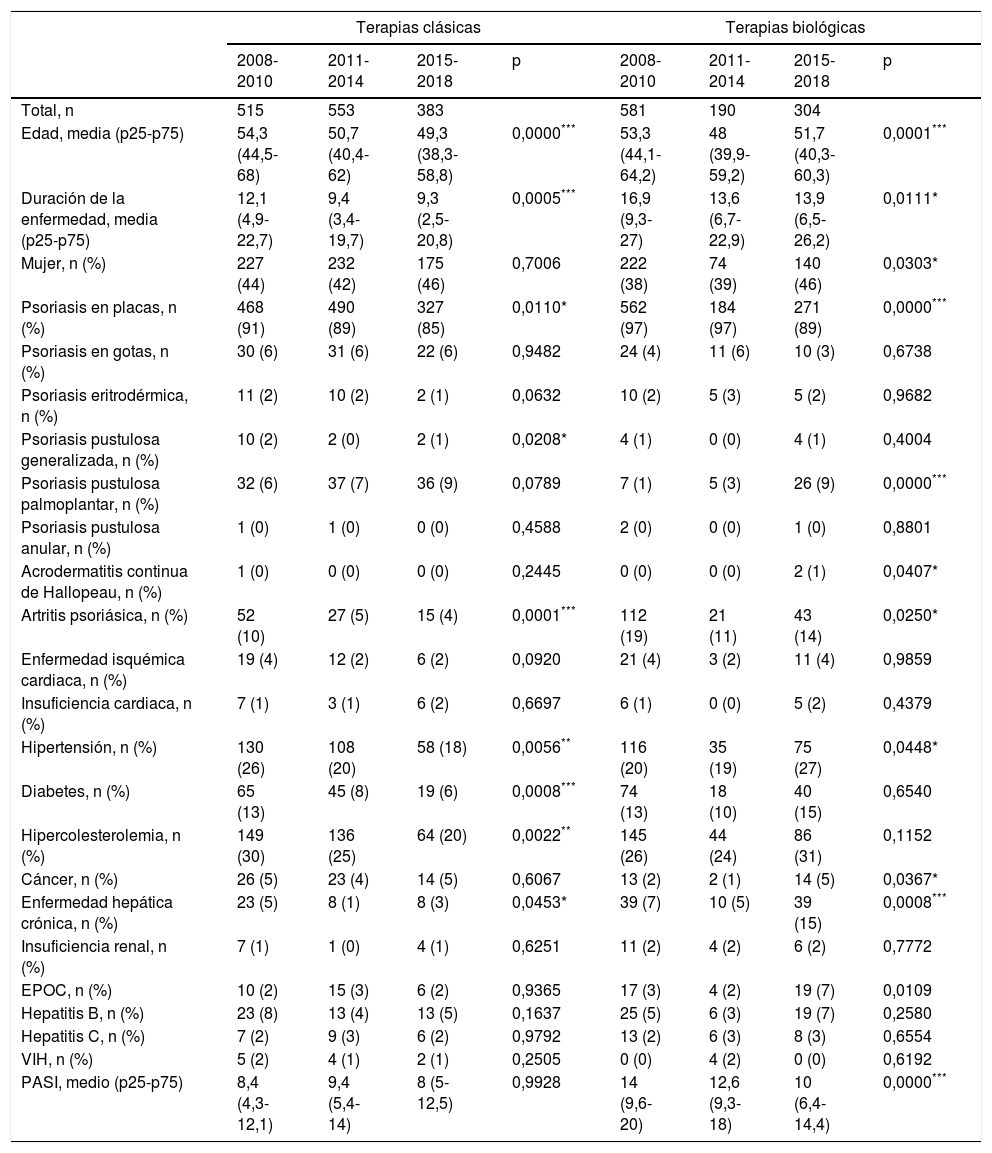
La información demográfica de la población encuestada se resume en la tabla 1. En el grupo de medicamentos clásicos se objetivaron las siguientes diferencias entre los tres periodos de tiempo: forma de presentación de la psoriasis (mayor número de pacientes con psoriasis palmoplantar y un menor número de artritis psoriásica y de psoriasis en placas), menor frecuencia de comorbilidades asociadas (hipertensión, diabetes e hipercolesterolemia), menor edad y tiempo de enfermedad en los periodos posteriores. Por otro lado, el grupo de terapias biológicas o de nuevas moléculas pequeñas se caracterizó por tener un mayor número de pacientes del sexo femenino, una mayor asociación a comorbilidades (hipertensión, cáncer, enfermedad hepática crónica y enfermedad pulmonar obstructiva crónica) y tener pacientes de menor edad, duración de la enfermedad y PASI.
Características descriptivas de los pacientes naïve para tratamientos biológicos desde el año 2008 al 2018
| Terapias clásicas | Terapias biológicas | |||||||
|---|---|---|---|---|---|---|---|---|
| 2008-2010 | 2011-2014 | 2015-2018 | p | 2008-2010 | 2011-2014 | 2015-2018 | p | |
| Total, n | 515 | 553 | 383 | 581 | 190 | 304 | ||
| Edad, media (p25-p75) | 54,3 (44,5-68) | 50,7 (40,4-62) | 49,3 (38,3-58,8) | 0,0000*** | 53,3 (44,1-64,2) | 48 (39,9-59,2) | 51,7 (40,3-60,3) | 0,0001*** |
| Duración de la enfermedad, media (p25-p75) | 12,1 (4,9-22,7) | 9,4 (3,4-19,7) | 9,3 (2,5-20,8) | 0,0005*** | 16,9 (9,3-27) | 13,6 (6,7-22,9) | 13,9 (6,5-26,2) | 0,0111* |
| Mujer, n (%) | 227 (44) | 232 (42) | 175 (46) | 0,7006 | 222 (38) | 74 (39) | 140 (46) | 0,0303* |
| Psoriasis en placas, n (%) | 468 (91) | 490 (89) | 327 (85) | 0,0110* | 562 (97) | 184 (97) | 271 (89) | 0,0000*** |
| Psoriasis en gotas, n (%) | 30 (6) | 31 (6) | 22 (6) | 0,9482 | 24 (4) | 11 (6) | 10 (3) | 0,6738 |
| Psoriasis eritrodérmica, n (%) | 11 (2) | 10 (2) | 2 (1) | 0,0632 | 10 (2) | 5 (3) | 5 (2) | 0,9682 |
| Psoriasis pustulosa generalizada, n (%) | 10 (2) | 2 (0) | 2 (1) | 0,0208* | 4 (1) | 0 (0) | 4 (1) | 0,4004 |
| Psoriasis pustulosa palmoplantar, n (%) | 32 (6) | 37 (7) | 36 (9) | 0,0789 | 7 (1) | 5 (3) | 26 (9) | 0,0000*** |
| Psoriasis pustulosa anular, n (%) | 1 (0) | 1 (0) | 0 (0) | 0,4588 | 2 (0) | 0 (0) | 1 (0) | 0,8801 |
| Acrodermatitis continua de Hallopeau, n (%) | 1 (0) | 0 (0) | 0 (0) | 0,2445 | 0 (0) | 0 (0) | 2 (1) | 0,0407* |
| Artritis psoriásica, n (%) | 52 (10) | 27 (5) | 15 (4) | 0,0001*** | 112 (19) | 21 (11) | 43 (14) | 0,0250* |
| Enfermedad isquémica cardiaca, n (%) | 19 (4) | 12 (2) | 6 (2) | 0,0920 | 21 (4) | 3 (2) | 11 (4) | 0,9859 |
| Insuficiencia cardiaca, n (%) | 7 (1) | 3 (1) | 6 (2) | 0,6697 | 6 (1) | 0 (0) | 5 (2) | 0,4379 |
| Hipertensión, n (%) | 130 (26) | 108 (20) | 58 (18) | 0,0056** | 116 (20) | 35 (19) | 75 (27) | 0,0448* |
| Diabetes, n (%) | 65 (13) | 45 (8) | 19 (6) | 0,0008*** | 74 (13) | 18 (10) | 40 (15) | 0,6540 |
| Hipercolesterolemia, n (%) | 149 (30) | 136 (25) | 64 (20) | 0,0022** | 145 (26) | 44 (24) | 86 (31) | 0,1152 |
| Cáncer, n (%) | 26 (5) | 23 (4) | 14 (5) | 0,6067 | 13 (2) | 2 (1) | 14 (5) | 0,0367* |
| Enfermedad hepática crónica, n (%) | 23 (5) | 8 (1) | 8 (3) | 0,0453* | 39 (7) | 10 (5) | 39 (15) | 0,0008*** |
| Insuficiencia renal, n (%) | 7 (1) | 1 (0) | 4 (1) | 0,6251 | 11 (2) | 4 (2) | 6 (2) | 0,7772 |
| EPOC, n (%) | 10 (2) | 15 (3) | 6 (2) | 0,9365 | 17 (3) | 4 (2) | 19 (7) | 0,0109 |
| Hepatitis B, n (%) | 23 (8) | 13 (4) | 13 (5) | 0,1637 | 25 (5) | 6 (3) | 19 (7) | 0,2580 |
| Hepatitis C, n (%) | 7 (2) | 9 (3) | 6 (2) | 0,9792 | 13 (2) | 6 (3) | 8 (3) | 0,6554 |
| VIH, n (%) | 5 (2) | 4 (1) | 2 (1) | 0,2505 | 0 (0) | 4 (2) | 0 (0) | 0,6192 |
| PASI, medio (p25-p75) | 8,4 (4,3-12,1) | 9,4 (5,4-14) | 8 (5-12,5) | 0,9928 | 14 (9,6-20) | 12,6 (9,3-18) | 10 (6,4-14,4) | 0,0000*** |
EPOC: enfermedad pulmonar obstructiva crónica; PASI: Psoriasis Area Severity Index; VIH: virus de la inmunodeficiencia humana.
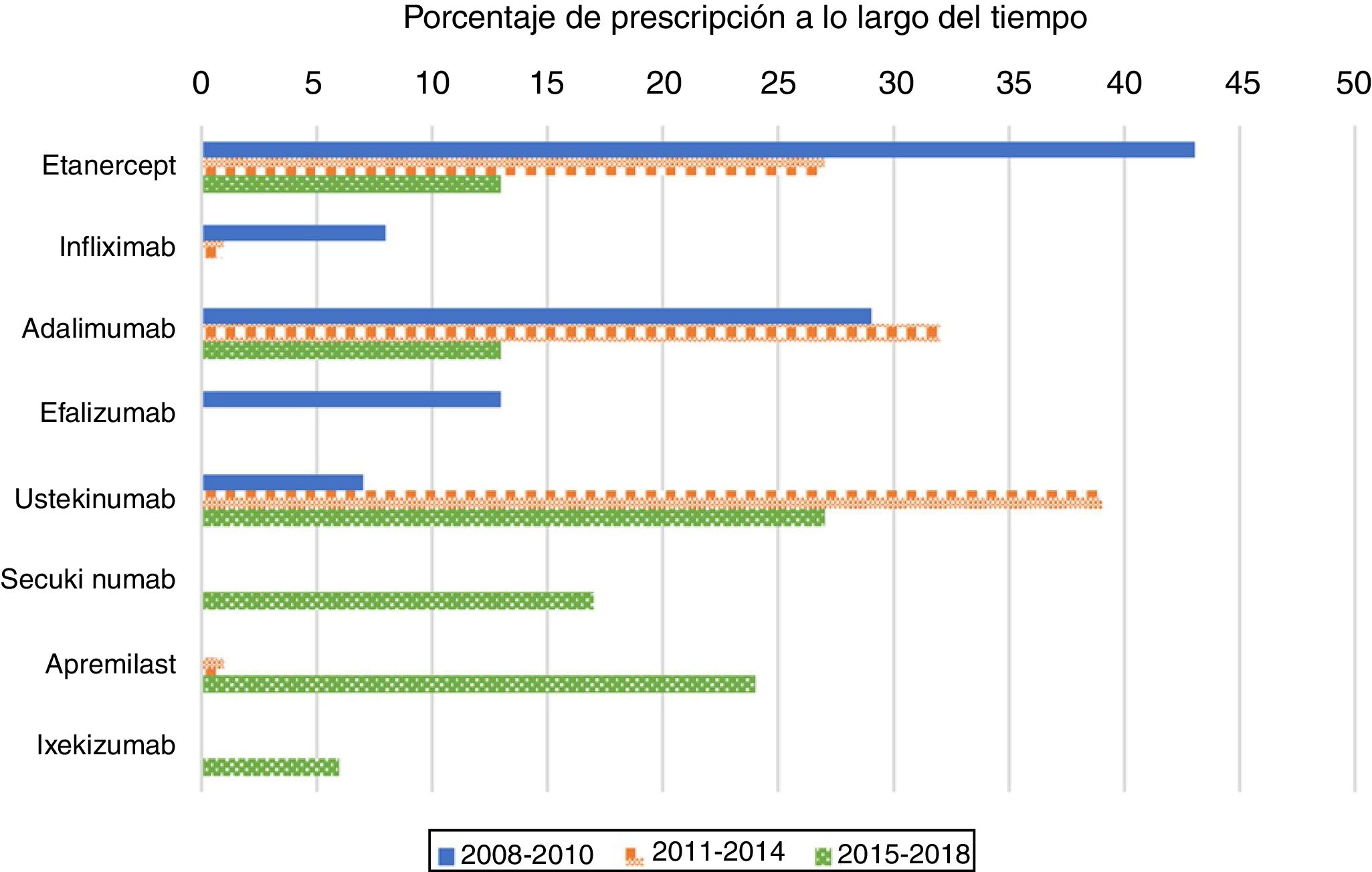
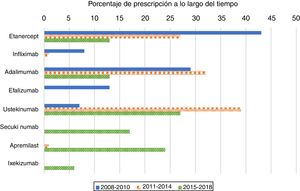
Como era de esperar, con mayor frecuencia los fármacos anti-TNF fueron el primer tratamiento biológico recetado en pacientes naïve (80%) durante el período 2008-2010 (fig. 1). Su uso como primer tratamiento disminuyó drásticamente durante el segundo y tercer periodos, representando el 60 y el 26% de los tratamientos biológicos, respectivamente. Al analizar los medicamentos anti-TNF por separado, etanercept fue el primer biológico más recetado en el primer período; el segundo medicamento recetado en frecuencia fue adalimumab. A partir del año 2011, sin embargo, tanto etanercept como adalimumab se prescribieron a un ritmo similar. La elección de infliximab como primer fármaco biológico fue excepcional después del año 2010.
El uso de ustekinumab varió significativamente con el transcurso del tiempo. Aumentó de manera significativa en el segundo periodo y disminuyó con la aparición de nuevos medicamentos después del año 2015. Secukinumab, ixekizumab y apremilast se prescribieron por primera vez en el período 2015-2018 y representaron casi la mitad de los tratamientos (47%); cada uno se prescribió en porcentajes más altos que los de etanercept y de adalimumab, pero más bajos que los de ustekinumab.
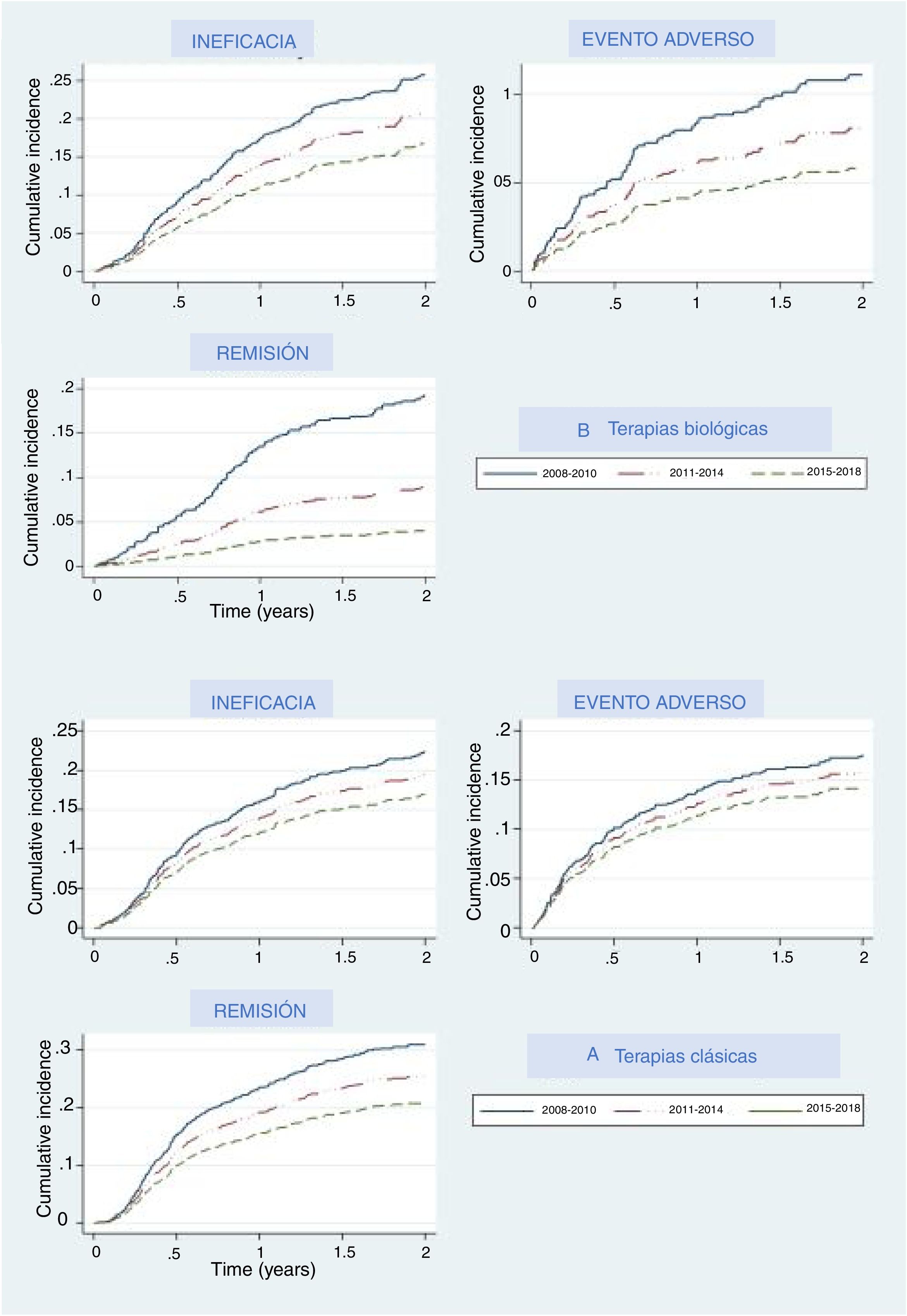
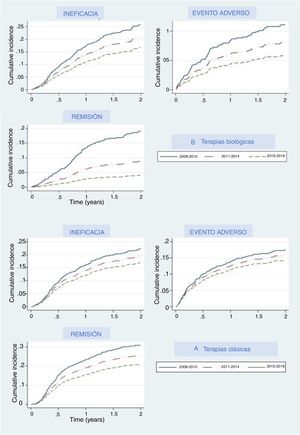
Las principales razones por las que se suspendieron los tratamientos fueron los eventos adversos, la falta de eficacia y la remisión de la enfermedad. La figura 2 representa el porcentaje acumulado de pacientes del grupo de terapias biológicas y de nuevas moléculas pequeñas que descontinuaron el primer tratamiento y cuál fue el motivo; la figura 2 muestra estos datos para el grupo de medicamentos clásico. En ambos grupos las curvas de incidencia acumulada mostraron que en los últimos años los participantes tenían menos probabilidades de interrumpir el tratamiento debido a la falta de eficacia, eventos adversos o eficacia. En cada periodo los umbrales fueron más elevados que en el periodo previo, lo que indica que los tratamientos fueron menos propensos a ser interrumpidos por cualquiera de estos motivos, en especial en relación con la remisión de la enfermedad, ya que esta variable mostraba curvas incluso más separadas. Con respecto a la terapia biológica y a apremilast, la interrupción debida a la remisión de la enfermedad mostró un aumento drástico en el umbral (disminución de la curva) en el último período (2015-2018), lo que significa que en menos pacientes esta medicación fue retirada debido a la remisión de la enfermedad. Un patrón similar, aunque menos pronunciado, se vio en la curva en relación con los eventos adversos.
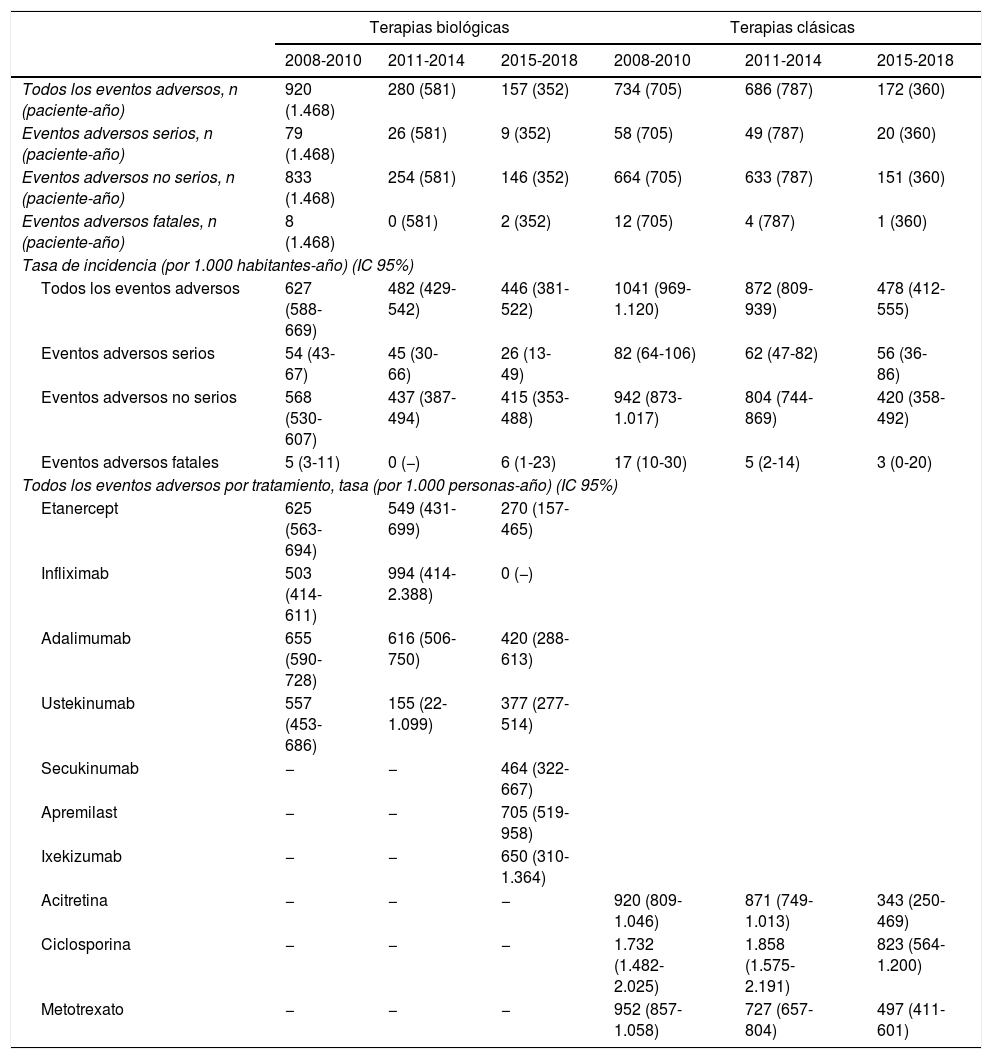
Las tasas de todos los eventos adversos en general disminuyeron con el transcurso de los años; sin embargo, las tasas específicas de los eventos adversos graves o fatales se mantuvieron estables a lo largo del tiempo (tabla 2). Con respecto al tipo de tratamiento, en el grupo de terapias biológicas y de apremilast, aparentemente, las nuevas terapias (apremilast e ixekizumab) tuvieron tasas más elevadas en comparación con las tasas de las terapias «más antiguas» (anti-TNF y ustekinumab). Estos números son comparables a los evidenciados con los anti-TNF y ustekinumab durante el primer período.
Eventos adversos que han ocurrido en pacientes naïve para biológicos entre los años 2008 y 2018
| Terapias biológicas | Terapias clásicas | |||||
|---|---|---|---|---|---|---|
| 2008-2010 | 2011-2014 | 2015-2018 | 2008-2010 | 2011-2014 | 2015-2018 | |
| Todos los eventos adversos, n (paciente-año) | 920 (1.468) | 280 (581) | 157 (352) | 734 (705) | 686 (787) | 172 (360) |
| Eventos adversos serios, n (paciente-año) | 79 (1.468) | 26 (581) | 9 (352) | 58 (705) | 49 (787) | 20 (360) |
| Eventos adversos no serios, n (paciente-año) | 833 (1.468) | 254 (581) | 146 (352) | 664 (705) | 633 (787) | 151 (360) |
| Eventos adversos fatales, n (paciente-año) | 8 (1.468) | 0 (581) | 2 (352) | 12 (705) | 4 (787) | 1 (360) |
| Tasa de incidencia (por 1.000 habitantes-año) (IC 95%) | ||||||
| Todos los eventos adversos | 627 (588-669) | 482 (429-542) | 446 (381-522) | 1041 (969-1.120) | 872 (809-939) | 478 (412-555) |
| Eventos adversos serios | 54 (43-67) | 45 (30-66) | 26 (13-49) | 82 (64-106) | 62 (47-82) | 56 (36-86) |
| Eventos adversos no serios | 568 (530-607) | 437 (387-494) | 415 (353-488) | 942 (873-1.017) | 804 (744-869) | 420 (358-492) |
| Eventos adversos fatales | 5 (3-11) | 0 (−) | 6 (1-23) | 17 (10-30) | 5 (2-14) | 3 (0-20) |
| Todos los eventos adversos por tratamiento, tasa (por 1.000 personas-año) (IC 95%) | ||||||
| Etanercept | 625 (563-694) | 549 (431-699) | 270 (157-465) | |||
| Infliximab | 503 (414-611) | 994 (414-2.388) | 0 (−) | |||
| Adalimumab | 655 (590-728) | 616 (506-750) | 420 (288-613) | |||
| Ustekinumab | 557 (453-686) | 155 (22-1.099) | 377 (277-514) | |||
| Secukinumab | − | − | 464 (322-667) | |||
| Apremilast | − | − | 705 (519-958) | |||
| Ixekizumab | − | − | 650 (310-1.364) | |||
| Acitretina | − | − | − | 920 (809-1.046) | 871 (749-1.013) | 343 (250-469) |
| Ciclosporina | − | − | − | 1.732 (1.482-2.025) | 1.858 (1.575-2.191) | 823 (564-1.200) |
| Metotrexato | − | − | − | 952 (857-1.058) | 727 (657-804) | 497 (411-601) |
Este es un estudio de tipo poblacional acerca del uso de medicamentos y de la tendencia en las prescripciones del primer tratamiento biológico y de apremilast durante un periodo de 10años. Este estudio se realizó en un entorno de práctica clínica real en pacientes con diagnóstico de psoriasis. Si bien, en comparación con adalimumab, hubo una mayor tendencia a recetar etanercept durante el periodo 2008-2010, probablemente debido a la introducción de ustekinumab en 2009, el uso tanto de etanercept como de adalimumab disminuyó significativamente, y desde entonces ambos han tenido tasas de prescripción similares y estables. En Estados Unidos etanercept en un inicio fue el medicamento biológico más indicado; sin embargo, tras recibir la aprobación para la artritis psoriásica en 2005 y para la psoriasis en 2008, el uso de adalimumab aumentó de manera gradual a partir de 20117. Según nuestro registro, adalimumab ha tenido una tendencia de prescripción diferente, presentando una clara disminución después del año 2011. Por otro lado, a partir de 2014 ustekinumab empezó a ser recetado como primer medicamento biológico con mayor frecuencia. Recientemente un metaanálisis sugirió que ustekinumab es el medicamento biológico preferido en el tratamiento de la psoriasis8. Además, las guías tanto de la asociación británica como de la francesa recomiendan ustekinumab o adalimumab como tratamientos biológicos de primera elección en pacientes con psoriasis4,5.
Los inhibidores de la IL-17 tienen una eficacia muy elevada. Este hecho, sumado a que compiten con productos biológicos «más antiguos», está cambiando las tendencias actuales de prescripción. Durante el tercer período (2015-2018) la prescripción de secukinumab como el primer fármaco biológico indicado en pacientes naïve superó a la de los anti-TNF e igualó a la de ustekinumab.
Apremilast ha demostrado una menor eficacia en comparación con los medicamentos biológicos9,10; sin embargo, su uso como terapia de primera elección fue comparable a la de secukinumab durante el período comprendido entre los años 2015 y 2018. Probablemente el perfil de seguridad de apremilast11, así como su menor coste comparado con los productos biológicos, haya jugado un papel importante. Sin embargo, algunos expertos no recomiendan su uso en monoterapia. Por ejemplo, las pautas francesas recomiendan el uso de agentes biológicos antes de iniciar el tratamiento sistémico con apremilast. A pesar de que después del año 2011 se contó con medicamentos más efectivos, tanto etanercept como adalimumab siguieron siendo los primeros medicamentos recetados en el 6-8% de los pacientes. Esto puede deberse a la presencia de artritis psoriásica y al hecho de que muchos dermatólogos se sienten más cómodos usando medicamentos «más antiguos».
En el presente estudio la pérdida de eficacia fue el principal motivo por el cual se decidió suspender el tratamiento. Estos datos ya habían sido descritos previamente tanto en nuestro registro12 como en otros estudios más amplios13,14.
El análisis que realizamos nos permitió comparar diferentes períodos de tiempo. Esto mostró que la tasa de interrupción de los tratamientos disminuyó con el paso de los años, y que un menor porcentaje de los pacientes tuvieron que dejar el tratamiento biológico o apremilast debido a una falta o pérdida de eficacia o por el desarrollo de efectos adversos. Al parecer los dermatólogos son más tolerantes a los eventos adversos de menor gravedad, lo que conlleva menores tasas de notificación e interrupción de los tratamientos. Este hecho se debe probablemente también a un mayor grado de conocimiento acerca del perfil de seguridad de estas moléculas. En un estudio reciente se pudo demostrar que las tasas de los eventos adversos en general fueron más frecuentes durante el primer año de tratamiento con todos los medicamentos15. Sin embargo, la tasa de eventos adversos graves se mantuvo estable durante el tiempo, lo que indica que los pacientes tendrán que continuar en seguimiento a lo largo del tiempo.
De manera curiosa, si se compara con los periodos previos, hoy en día la remisión de la enfermedad será más difícil de lograr. Así mismo, las tasas de interrupción de los tratamientos también han disminuido. Esto puede deberse, en parte, al grado de insatisfacción de los pacientes después de tener una recaída leve de la enfermedad. El cambio en las expectativas de los pacientes buscando conseguir un PASI 90-100 es cada vez más frecuente, lo que ha generado en la práctica clínica menores tasas de interrupción de los tratamientos debido a una remisión de la enfermedad16.
En conclusión, el presente estudio ha identificado el comportamiento y la tendencia en la tasa de prescripción de los fármacos biológicos y de las nuevas moléculas pequeñas (apremilast) utilizados como primera línea en la práctica clínica en pacientes diagnosticados de psoriasis entre los años 2008 y 2018 en España. Además, nos sugiere que los dermatólogos han modificado sus pautas de prescripción, probablemente debido a que se sienten más cómodos con el perfil de seguridad de los medicamentos; así mismo, son más exigentes con la eficacia de los tratamientos, por lo que se evidenciaron tasas más bajas de interrupción de los tratamientos.
FinanciaciónEl proyecto BIOBADADERM fue promovido por la Fundación Piel Sana de la Academia Española de Dermatología y Venereología, y recibe apoyo financiero de la Agencia Española de Medicamentos y Productos Sanitarios y de compañías farmacéuticas (Abbott/Abbvie, Pfizer, MSD, Novartis, Lilly, Janssen y Almirall).
Las compañías farmacéuticas colaboradoras no participaron en el diseño y la realización del estudio; tampoco en la recopilación, gestión, análisis e interpretación de datos, ni en la preparación, revisión o aprobación del manuscrito y decisión de enviar el manuscrito para su publicación.
Conflicto de interesesLa Dra. Ruiz-Genao ha sido remunerada por Pfizer, Janssen, Celgene, AbbVie, Novartis y Leo Pharma por servicios de asesoramiento y conferencias.
El Dr. Carretero ha sido remunerado por Janssen, Abbvie, Novartis, Pfizer, MSD y Celgene por servicios de asesoramiento y conferencias.
La Dra. Rivera ha actuado como consultora y/o ponente y/o ha participado en ensayos clínicos como IP para AbbVie, Almirall, Celgene, Janssen, Leo Pharma, Lilly, Novartis, MSD y Pfizer-Wyeth.
El Dr. Ferrándiz ha participado como consultor y/o ponente remunerado y/o ha participado en ensayos clínicos patrocinados por compañías farmacéuticas del ámbito de la psoriasis, incluidas AbbVie, Amgen, Celgene, Janssen-Cilag, LEO Pharma, Lilly, Merck, Sharp & Dohme, Novartis Pfizer y Almirall.
El Dr. Daudén ha actuado como consultor para Abbott, Amgen, Astellas, Centocor Ortho Biotech Inc, Galderma, Glaxo, Janssen-Cilag, Leo Pharma, Novartis, Pfizer, MSD y Celgene; ha recibido honorarios de Abbott, Amgen, Janssen-Cilag, Leo Pharma, Novartis, Pfizer, MSD, Celgene; ha participado en una oficina de conferenciantes para Abbott, Pfizer, MSD y Janssen, y recibió subvenciones de Pfizer, Abbott, Janssen y MSD.
El Dr. de la Cueva ha actuado como consultor y/o ponente para Janssen-Cilag, AbbVie, MSD, Pfizer, Novartis, Lilly, Almirall, UCB, Biogen, Celgene, Amgen, Sandoz, Sanofi y Leo-Pharma.
La Dra. Belinchón ha actuado como ponente y/o asesora de Janssen Pharmaceuticals, Almirall, Lilly, AbbVie, Novartis, Celgene, Biogen Amgen, Leo-Pharma, Pfizer-Wyeth y MSD.
El Dr. Herrera-Acosta ha participado como consultor y/o ponente en Leo Pharma, Novartis, Janssen, Lilly, Celgene y AbbVie.
El Dr. López-Estebaranz ha participado como AB y ha recibido becas educativas de Janssen, Abbvie, MSD, Lilly, Novartis, Leo Pharma y Pfizer.
La Dra. Ferrán-Farrés ha participado como ponente y/o asesora de Janssen, Lilly, Novartis, Pfizer, MSD, Abbvie Celgene y Almirall.
La Dra. Alsina ha participado dando charlas de expertos para Merck-Schering Plough, Pfizer, Janssen, Novartis y Abbott.
La Dra. Baniandrés-Rodríguez ha actuado como consultora y/o ponente para Janssen-Cilag, AbbVie, Pfizer, Novartis, Lilly, Celgene, Leo Pharma y Almirall.
El Dr. Sánchez-Carazo ha participado como AB de Janssen, Novartis y Leo Pharma.
El Dr. Sahuquillo ha participado como consultor y/o ponente remunerado y/o ha participado en ensayos clínicos patrocinados por compañías farmacéuticas que desarrollan medicamentos para la psoriasis, incluidas AbbVie, Celgene, Janssen-Cilag, Leo Pharma, Lilly, Novartis y Pfizer.
La Dra. Rodríguez Fernández-Freire ha actuado como consultora y ponente para Janssen-Cilag, AbbVie, MSD, Pfizer, Novartis, Lilly, Almirall, Celgene y Leo Pharma.
El Dr. Vilar-Alejo ha participado como AB de Janssen, Novartis, AbbVie, Almirall y Celgene.
La Dra. García-Donoso ha participado como AB de AbbVie, Almirall y ponente de Janssen, Lilly y Celgene.
El Dr. Carrascosa ha participado como ponente y/o asesor de Celgene, Janssen, Lilly, Novartis, Leo Pharma, Pfizer, MSD, Abbvie, Biogen Amgen.
La Dra. Llamas ha actuado como consultora y ponente para Janssen-Cilag, AbbVie, Celgene, Pfizer, Novartis, Lilly, Almirall y Leo-Pharma, y ha participado en ensayos clínicos.
El Dr. Herrera-Ceballos ha participado como consultor y/o conferencista y/o en ensayos clínicos como IP y ha sido patrocinado por la industria farmacéutica, incluyendo AbbVie, Janssen-Cilag, Leo Pharma, Lilly, Novartis y Pfizer.
El Dr. Botella ha participado como consultor y/o ponente remunerado y/o ha participado en ensayos clínicos patrocinados por la industria farmacéutica, incluidas AbbVie, Celgene, Janssen-Cilag, Leo Pharma, Lilly, Novartis y Pfizer.
El Dr. García-Doval ha recibido ayudas para congresos de Abbvie, MSD y Pfizer.
Ninguno de los otros autores tiene algún conflicto de intereses que declarar.[ll1]
Este estudio ha sido realizado en el marco del grupo de trabajo BIOBADADERM Study Group. Los siguientes miembros han participado en la adquisición de datos y en la revisión del manuscrito:
Esteban Daudén, Mar Llamas-Velasco (Hospital Universitario de la Princesa).
Gregorio Carretero, Jaime Vilar-Alejo (Hospital Universitario de Gran Canaria Dr. Negrín).
Raquel Rivera, Carmen García-Donoso (Hospital Universitario 12 de Octubre).
Carlos Ferrándiz, José Manuel Carrascosa, Ferrán Ballescá (Hospital Universitari Germans Trias i Pujol).
Pablo de la Cueva (Hospital Universitario Infanta Leonor).
Isabel Belinchón (Hospital General Universitario de Alicante).
Fran J. Gómez-García, Rafael Jiménez (Hospital Universitario Reina Sofía).
Enrique Herrera-Ceballos, Enrique Herrera-Acosta (Hospital Universitario Virgen de la Victoria).
José Luis López-Estebaranz, Diana Patricia Ruiz-Genao (Fundación Hospital de Alcorcón).
Marta Ferrán Farrés (Hospital del Mar, Parc de Salut Mar de Barcelona).
Mercè Alsina (Hospital Clínic de Barcelona).
Ofelia Baniandrés, Lula Nieto (Hospital General Universitario Gregorio Marañón).
José Luis Sánchez-Carazo (Hospital General Universitario de Valencia).
Antonio Sahuquillo-Torralba, Rafael Botella-Estrada, Conrad Pujol Marco (Hospital Universitario La Fe de Valencia).
Lourdes Rodríguez Fernández-Freire (Hospital Universitario Virgen del Rocío de Sevilla).
Almudena Mateu Puchades (Hospital Universitario Dr. Peset).
Ángeles Flórez Menéndez, Laura Salgado, Beatriz González Sixto (Complexo Hospitalario Universitario de Pontevedra).
Noemí Eiris (Complejo Asistencial Universitario de León).
Ignacio García-Doval, Miguel Ángel Descalzo Gallego, Marina de Vega Martínez (Fundación Piel Sana AEDV).