Las moléculas de adhesión celular (MAC) desempeñan un papel fundamental en la localización de los linfocitos T en la piel. El presente estudio cuantifica la expresión de MAC en pacientes con linfoma cutáneo de células T (LCCT) y lo compara con la observada en otras dermatosis.
Material y métodosSe dispuso de material congelado de 42 pacientes distribuidos en 5 grupos: LCCT iniciales, micosis fungoide en fase de mácula y placa (11 pacientes); LCCT avanzados (n=7): micosis fungoide y síndrome de Sézary; enfermedades cutáneas inflamatorias (n=12): psoriasis y dermatitis atópica; dermatosis crónicas persistentes en placas que no cumplen criterios histológicos de micosis fungoide (pre-LCCT) (n=8) y pacientes sanos (n=4). Se ha estudiado la expresión de los antígenos LFA-1, ICAM-1, ICAM-3, CLA, selectina E, VLA-4, VCAM-1, αE β7 y cadherina E.
ResultadosLos parámetros de inmunotinción valorados no han permitido demostrar diferencias estadísticamente significativas entre los grupos LCCT inicial y avanzado, pero sí con respecto a otras dermatosis. La expresión de CD103 e ICAM-3 por campo epidérmico de 400× puede emplearse como variable para distinguir entre los distintos subgrupos estudiados, salvo en el caso de la comparación entre LCCT y pre-LCCT. Estos dos últimos grupos presentan diferencias estadísticamente significativas en la observación de la expresión de selectina E a 400× y la determinación del patrón en forma de panal de ICAM-1 en los queratinocitos epidérmicos.
ConclusiónLa expresión de MAC que participan en los fenómenos de adhesión y trasmigración de los linfocitos en la piel no difiere significativamente entre las fases inicial y avanzada de los LCCT.
Cell adhesion molecules play a pivotal role in the establishment of T-cell populations in the skin. In this study, we quantify the expression of cell adhesion molecules in patients with cutaneous T-cell lymphoma (CTCL) and compare it with the expression found in other skin diseases.
Material and methodsFrozen material was obtained from 42 patients in 5 different groups: early CTCL, comprising patients with patch- and plaque-stage of mycosis fungoides (n=11); advanced CTCL (n=7), comprising patients with mycosis fungoides (n=3) and Sézary syndrome (n=4); inflammatory skin disease (n=12), comprising patients with psoriasis (n=9) and atopic dermatitis (n=3); chronic skin diseases with persistent plaques that do not fulfil the histological criteria for mycosis fungoides (pre-CTCL) (n=8); and healthy volunteers (n=4). Expression of the following cell adhesion molecules was analyzed: lymphocyte function-associated antigen 1, intercellular adhesion molecule 1 (ICAM-1), ICAM-3, cutaneous lymphocyte-associated antigen, E-selectin, very late antigen 4, vascular cell adhesion molecule 1, alphaEbeta7 integrin, and E-cadherin.
ResultsThe immunohistochemical analyses used here revealed statistically significant differences between CTCL and other skin diseases but not between early and advanced CTCL. The expression of alphaEbeta7 integrin and ICAM-3 in the epidermis per high-power field (400× magnification) allowed the different groups to be distinguished from each other, except for advanced CTCL and pre-CTCL. There were statistically significant differences between advanced CTCL and pre-CTCL in terms of the expression of E-selectin at 400× magnification and the expression of ICAM-1 in a honeycomb pattern in epidermal keratinocytes.
ConclusionsThe expression of cell adhesion molecules involved in the adhesion and migration of lymphocytes in the skin does not differ significantly between initial and advanced stages of CTCL.
En los últimos años se ha avanzado de forma significativa en el conocimiento de las relaciones intercelulares con el objetivo de explicar cómo y porqué las células acuden a un determinado foco, inflamatorio o tumoral. Esto ha sido posible gracias a la identificación de las citocinas y a un grupo de moléculas que, expresándose en la superficie celular de manera constitutiva o inducida, permiten el reconocimiento y unión entre las células y entre estas y la matriz extracelular. Este grupo de moléculas se ha denominado moléculas de adhesión celular (MAC) y desempeñan un papel fundamental en los procesos de migración y diferenciación celular fisiológicos y patológicos, como son la embriogénesis, la respuesta inmune y la diseminación metastásica en el cáncer1,2.
Estas MAC se clasifican, según su estructura y homología secuencial, en varias familias que incluyen las selectinas, las integrinas, la superfamilia de las inmunoglobulinas y las cadherinas. La distribución tisular, estructura, ligandos y función de las moléculas de adhesión celular han sido descritas con detalle en las dos últimas décadas1,3.
En particular resulta de interés su participación en la migración hacia diversos compartimentos funcionales del sistema inmune (ej.: ganglios linfáticos) desde el torrente circulatorio. Este proceso mediante el cual los linfocitos se dirigen a zonas predeterminadas en relación con la expresión de receptores y contrarreceptores específicos se denomina en inglés «homing». Se trata de un fenómeno en cascada de captación selectiva en el que participan las MAC y que puede dividirse en cuatro fases: rodamiento, activación, adhesión firme y migración4.
La piel es la barrera entre el cuerpo y el entorno, siendo una de sus funciones la vigilancia inmunológica. El tráfico linfocitario regulado es esencial para el control e integración de las respuestas inmunes sistémicas. La interacción linfocito-endotelio es un punto regulador central en el sistema inmune, controlando el acceso de subgrupos especializados de linfocitos a tejidos determinados e influenciando la naturaleza de la respuesta inmune o inflamatoria local5. Existe un subgrupo de células T memoria que poseen esta capacidad de circular preferentemente por la piel que se pueden identificar mediante el marcador denominado cutaneous lymphocyte antigen (CLA). Este subgrupo de células se produce tras estimulación de linfocitos situados en los ganglios linfáticos que recogen la linfa de la piel y es reclutado durante la inflamación6. Además de su papel en la respuesta inmunológica frente a las agresiones externas, se han implicado en la patogenia de los linfomas cutáneos de células T, en la enfermedad del injerto contra-huésped tras transplante alogénico de médula ósea y median en muchas de las enfermedades cutáneas inflamatorias como la dermatitis alérgica de contacto, la psoriasis, la dermatitis atópica y el liquen plano7.
La molécula de adhesión CLA es la que inicia el proceso de extravasación de los linfocitos T desde la sangre a la piel. La selectina E constituye el ligando endotelial de CLA y se expresa constitutivamente en nivel bajo en los microvasos cutáneos, incrementándose su expresión durante la inflamación. Esta interacción es necesaria, pero requiere la activación de células T por quimiocinas y la firme adhesión entre las células T al endotelio mediante integrinas y moléculas de adhesión tisulares para completar la migración de las células T a través de la pared vascular. La unión de quimiocinas a receptores específicos de las células T modifica la estructura de la integrina αLβ2 o lymphocyte function associated antigen-1 (LFA-1) y de la integrina α4β1 o very late antigen-4 (VLA-4) y así pueden unirse a intercellular adhesion molecule-1 (ICAM-1) y vascular-cell adhesion molecule-1 (VCAM-1) respectivamente. Una vez concluida la extravasación, las células pueden responder a los gradientes quimiotácticos. Además, la liberación de citocinas por las células T puede modificar y expandir el infiltrado inflamatorio2.
Los mecanismos de recirculación leucocitaria constituyen los principios de las interacciones de las células malignas de los linfomas con otras células, ya que los receptores de adhesión que regulan el tráfico normal de los linfocitos también se hallan presentes en su variante maligna8. En este sentido, la migración preferencial de células neoplásicas en los linfomas cutáneos podrían seguir una mecánica similar al de la migración selectiva de linfocitos en condiciones normales.
Los linfomas cutáneos de células T (LCCT)9 constituyen un conjunto heterogéneo de entidades patológicas entre los que se incluyen la micosis fungoide (MF), la forma más frecuente de LCCT, y el síndrome de Sézary (SS). Las células neoplásicas muestran habitualmente un fenotipo de célula T cooperadora madura CD4+, pero su comportamiento biológico es diferente, mientras la MF se considera un linfoma de bajo grado, el SS es un LCCT agresivo.
La MF clásica evoluciona de forma secuencial en diversas fases a lo largo de los años. En las fases precoces del proceso, con lesiones en forma de máculas y placas, se observa una migración epidérmica de células CD4+, lo que se conoce como epidermotropismo, ya sea en forma de células aisladas o de agregados celulares (microabscesos de Pautrier). Posee un curso indolente durante muchos años en el que puede abarcar múltiples áreas cutáneas e incluso generalizarse en forma de eritrodermia. La enfermedad en su progresión suele desarrollar lesiones tumorales y pérdida del epidermotropismo, coincidiendo con un curso clínico agresivo y avanzado; en el que puede existir diseminación extracutánea a sangre periférica, ganglios linfáticos, médula ósea u otros órganos viscerales. Sin embargo establecer el diagnóstico definitivo puede ser difícil en sus estadios iniciales por la superposición de características con enfermedades inflamatorias benignas y la falta de criterios suficientes para su diagnóstico10.
Las células inflamatorias de dermatosis benignas mediadas por linfocitos T y las células neoplásicas de los LCCT utilizan mecanismos comunes de adhesión para su interacción con otras células y la matriz extracelular. Sin embargo, la variabilidad en cuanto al entorno de citocinas que encontramos en estas patologías y las características propias de las células neoplásicas (capacidad de diseminación e invasión) posiblemente condicionan diferencias cualitativas y/o cuantitativas en la expresión de moléculas de adhesión en las propias células linfoides y en el tejido con el que interaccionan.
Con el objetivo de valorar la expresión de diversas moléculas de adhesión en lesiones precoces y avanzadas de LCCT, en patología inflamatoria y en dermatosis crónicas inespecíficas se ha estudiado la expresión de antígenos de captación y sus ligandos (LFA-1, ICAM-1, ICAM-3, CLA, selectina E, VLA-4, VCAM-1, αEβ7 y cadherina E) en un grupo de pacientes afectos de estas patologías.
Material y métodosSe incluyeron 42 pacientes atendidos en el Servicio de Dermatología del Hospital Clínic de Barcelona (1 junio de 2002 a 31 de diciembre de 2003).
El diagnóstico se basó en parámetros clínicos e histológicos. Se realizaron la evaluación clínica, biopsias cutáneas, pruebas de laboratorio y procedimientos de estadificación acordes al diagnóstico. Ninguno de los pacientes estaba siendo tratado por via tópica o sistémica cuando las muestras fueron recogidas y ninguno de ellos había recibido previamente tratamientos sistémicos por su patología cutánea.
Los pacientes se dividieron en cuatro grupos clínicos: 1) LCCT inicial (LCCTi): MF, con lesiones en fase de mácula y placa (11 pacientes IA, IB: t1=6, t2=5); 2) LCCT avanzado (LCCTa) (n=7): MF tumoral (un paciente, IIB), MF eritrodérmica (dos pacientes, III) y SS (4 pacientes); 3) enfermedades cutáneas inflamatorias (D. inflamatorias) (n=12): psoriasis (9 pacientes) y dermatitis atópica (3 pacientes), y 4) enfermedades cutáneas que pueden evolucionar a LCCT (pre-LCCT) (n=8): parapsoriasis (4 pacientes) y dermatitis crónica inespecífica (4 pacientes).
El grupo pre-LCCT incluye pacientes con dermatitis crónicas, persistentes, en forma de placas eritematosas y a menudo descamativas que aunque clínicamente sugestivas de Mf no cumplían los criterios histológicos de MF10. Además, no existía ningún desencadenante conocido (evidencia de reacción alérgica o de enfermedad del tejido conectivo). El estudio anatomopatológico fue compatible con parapsoriasis o dermatitis crónica inespecífica.
El grupo control se obtuvo a partir de cuatro muestras de piel procedentes de los bordes de extirpaciones de lesiones no tumorales. Se obtuvo el consentimiento informado de todos los individuos incluidos en este estudio, que fue aprobado previamente por el comité ético del centro.
Se obtuvieron muestras (punch 4mm) destinándose un fragmento, fijado en formol, para procesamiento y estudio histopatológico convencional y otro fragmento, colocado en suero fisiológico, fue congelado mediante inmersión metilbutano y mantenido a −80°C para su posterior estudio inmunohistoquímico en congelador Hurcoa Ezco (Forma Scientific).
El material congelado se incluyó en compuesto O.C.T.™ Tissue-Tek® (Sakura). Se practicaron cortes de tejido congelado de 5μm con criostato (Reichberg-Yung 2500 Frigocut) a −26°C. Las secciones obtenidas fueron congeladas a −80°C hasta el momento de su uso.
Para el estudio inmunohistoquímico de biopsias cutáneas en material congelado se fijaron los cortes con acetona a 4°C durante 10min y se realizó secado a temperatura ambiente. Posteriormente se realizaron las siguientes técnicas: rehidración de los cortes en «phosphate-buffered saline» (PBS) (10min), bloqueo de la peroxidasa endogena con solución «Peroxidase-Blocking Solution» de DAKO durante 7min y posteriormente lavados con PBS (varios lavados de 5min).
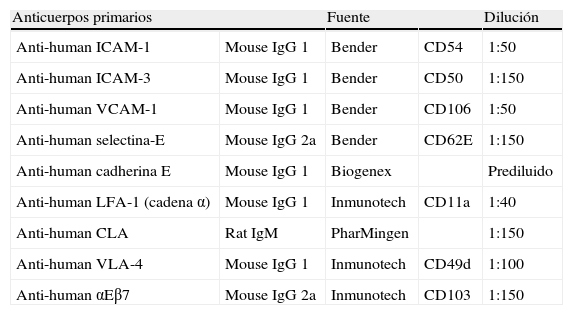
La detección de los antígenos se realizó usando los anticuerpos relacionados en la tabla 1 mediante técnica Envision™ de DAKO (DAKO diagnósticos, S.A, Barcelona, España).
Anticuerpos primarios utilizados en el presente estudio
| Anticuerpos primarios | Fuente | Dilución | ||
| Anti-human ICAM-1 | Mouse IgG 1 | Bender | CD54 | 1:50 |
| Anti-human ICAM-3 | Mouse IgG 1 | Bender | CD50 | 1:150 |
| Anti-human VCAM-1 | Mouse IgG 1 | Bender | CD106 | 1:50 |
| Anti-human selectina-E | Mouse IgG 2a | Bender | CD62E | 1:150 |
| Anti-human cadherina E | Mouse IgG 1 | Biogenex | Prediluido | |
| Anti-human LFA-1 (cadena α) | Mouse IgG 1 | Inmunotech | CD11a | 1:40 |
| Anti-human CLA | Rat IgM | PharMingen | 1:150 | |
| Anti-human VLA-4 | Mouse IgG 1 | Inmunotech | CD49d | 1:100 |
| Anti-human αEβ7 | Mouse IgG 2a | Inmunotech | CD103 | 1:150 |
La reacción enzimática fue detectada con 3-amino-9-etilcarbazol (AEC) como sustrato cromógeno. Las preparaciones fueron contrateñidas con hematoxilina acuosa y finalmente montadas con acuatex (Merck).
Las concentraciones de anticuerpo utilizadas fueron las óptimas para mostrar una tinción específica máxima con mínima tinción inespecífica o de fondo. La dilución adecuada fue determinada tras la realización de pruebas a diferentes títulos en piel lesional congelada correspondiente a patologías inflamatorias.
En cada biopsia cutánea se estudió el marcaje de los anticuerpos por parte de las células de diversa estirpe. Las células positivas fueron valoradas mediante estimación visual de secciones seriadas por dos investigadores de forma independiente.
Para la lectura de los resultados se ha utilizado el criterio citomorfológico y las intensidades de tinción se han clasificado semicuantitativamente. También se ha realizado la estimación del porcentaje positivo de células del infiltrado dérmico en los casos de expresión de la molécula por el mismo. En el caso de los linfocitos intraepidérmicos, estos han sido evaluados mediante la observación con microscopio óptico (Olimpus® BH-2). Cada campo fue cuantificado a 400× incluyendo toda la epidermis. Se registró la media del contaje de células inmunoreactivas por campo en cada una de las preparaciones.
El estudio inmunohistoquímico se completó con el marcador Ulex europaeus i (DAKO), una glicoproteína lectina que se une a grupos terminales fucosil unidos a oligosacáridos. Esta aglutinina tiñe la mayoría de células endoteliales de vasos de todos los calibres así como queratinocitos epidérmicos y anejos; permite apreciar el número de vasos presentes en la muestra y mediante comparación de cortes seriados valorar el número y localización de los vasos que expresan las moléculas de adhesión. Se valoró el número de estructuras vasculares teñidas por campo de 400×.
Métodos de análisis de resultadosLos datos obtenidos se almacenaron en una base de datos y se analizaron mediante el programa Statistical Package for the Social Sciences SPSS 9.0 (SPSS Inc, Chicago, IL, EE.UU.). Para la comparación de grupos de variables cualitativas se utilizaron tablas de contingencia y cálculo del estadístico Gi-cuadrado. Para las variables ordinales y cuantitativas se emplearon pruebas no paramétricas test de Kruscal-Wallis, para comparar los 5 grupos colectivamente y posteriormente U de Mann-Whitney si el primer test demostraba presencia de diferencias estadísticamente significativas. Los valores de p menores a 0,05 se consideraron significativos.
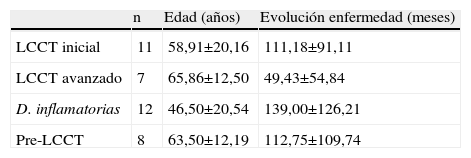
ResultadosLa edad y tiempo de evolución de la enfermedad de los pacientes se hallan resumidos en la tabla 2. La relación mujer/varón fue para LCCT inicial de 2/9; en el avanzado de 3/4; dermatosis inflamatorias de 9/3; pre-LCCT de 3/5 y en los sujetos sanos de 2/2. La superficie corporal afectada en los pacientes con dermatosis inflamatorias fue 30,8%±19,65% (rango 3–60%). Durante el periodo de seguimiento de los pacientes, media 11±3,6 meses, se produjeron 2 exitus (4,3% de los pacientes) que correspondieron al grupo de LCCT avanzado (28,6% de los pacientes con este diagnóstico).
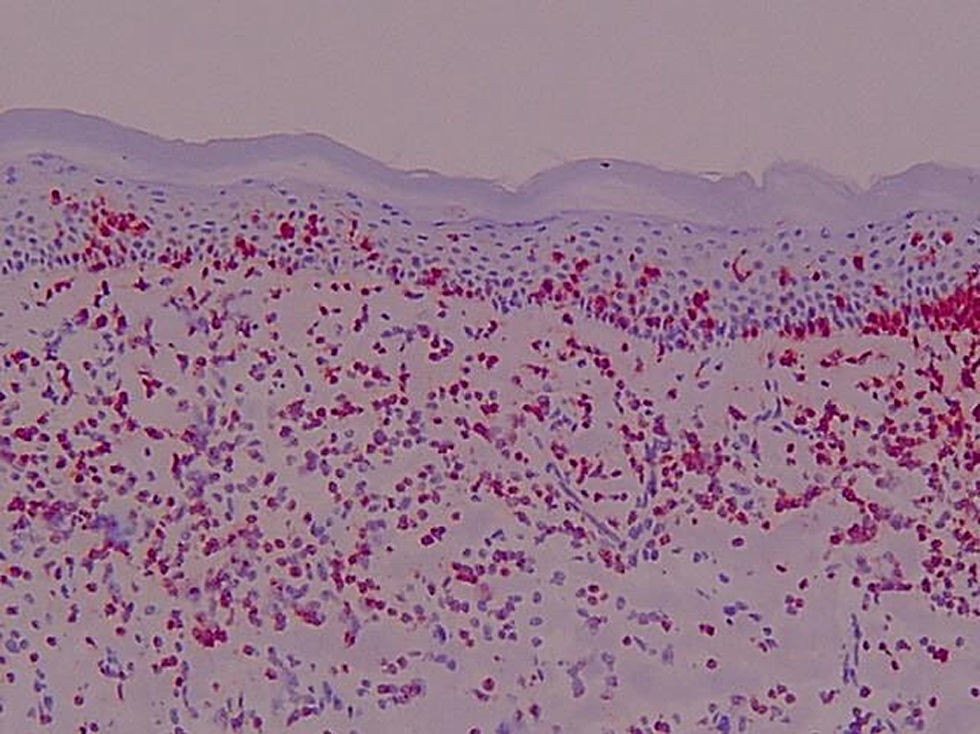
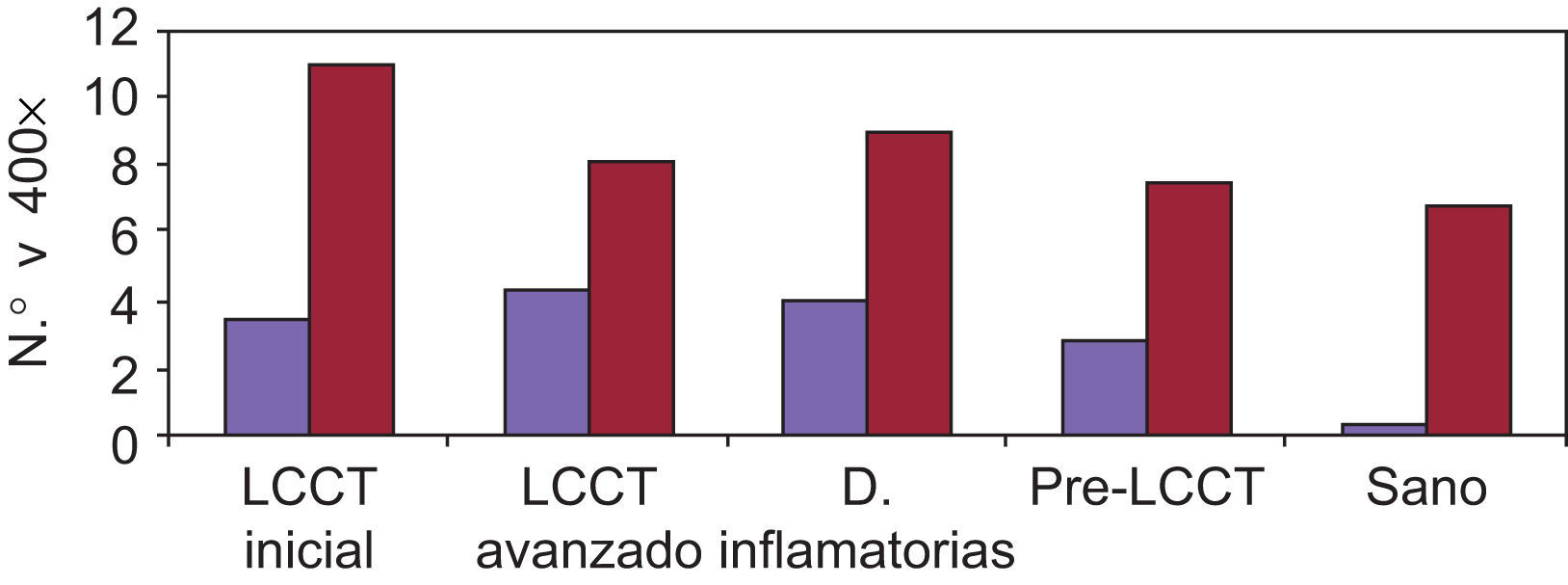
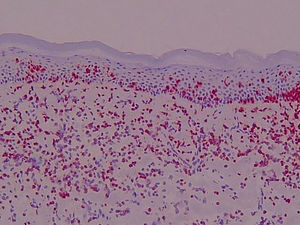
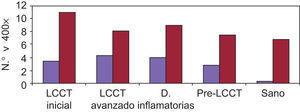
Expresión de moléculas de adhesión en biopsias cutáneasAntígeno ICAM-3 (CD50) (fig. 1)En la piel sana se observó marcaje de células dendríticas epidérmicas (células de Langerhans) y en la dermis expresión en células de estirpe linfomonocitaria, representando un porcentaje variable del total de células (media 15,25%). Las células endoteliales fueron completamente negativas y en los folículos se apreció expresión en forma de células dendríticas.
En el resto de procesos, el marcaje para CD50 mostró en epidermis marcaje intenso de células dendríticas así como del infiltrado linfocitario epidermotropo. La expresión en células de estirpe linfomonocitaria de los infiltrados dérmicos representaron un porcentaje elevado del total de células. Se apreció expresión en forma de células dendríticas distribuidas aisladamente en la dermis y en células situadas en áreas perivasculares. Además, la intensidad de expresión de ICAM-3 en los linfocitos que infiltran la piel fue uniforme en las diferentes dermatosis.
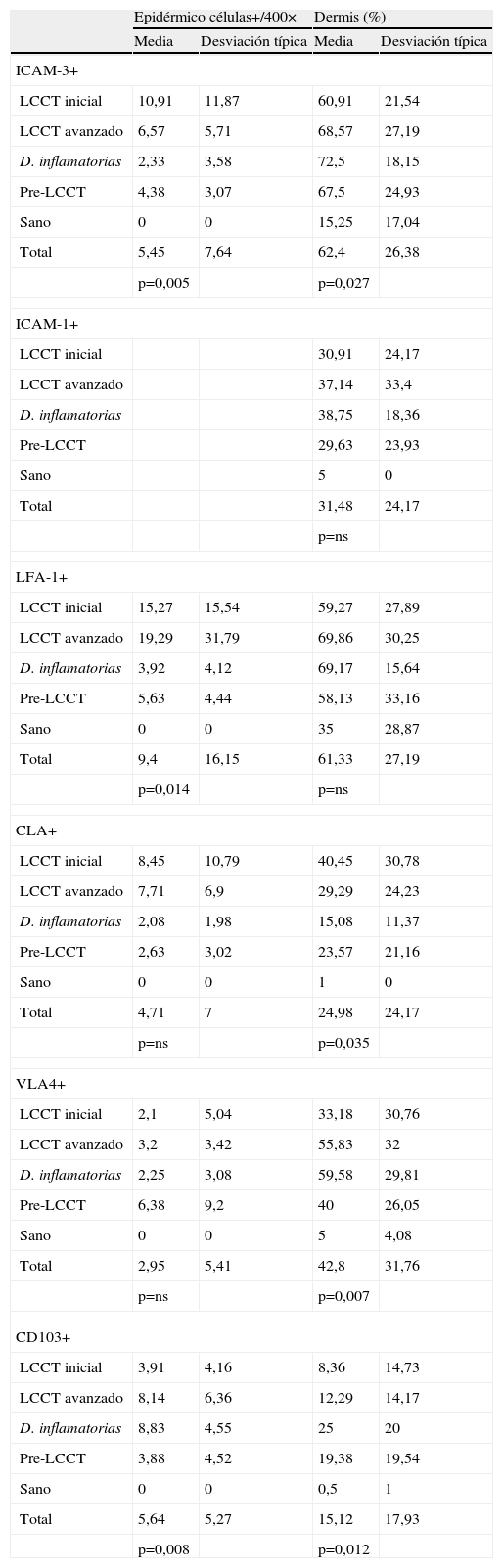
Se valoró de manera independiente el número de linfocitos intraepidérmicos ICAM-3 positivos por campo lineal epidémico a 400× y el porcentaje del infiltrado dérmico ICAM-3 positivo. La tabla 3 presenta las medias y desviación estándar en la observación de la tinción en células de estirpe linfocitaria y la tabla 4 los valores de p<0,05 en el análisis comparativo entre los diferentes grupos.
Tinción en células de estirpe linfocitaria
| Epidérmico células+/400× | Dermis (%) | |||
| Media | Desviación típica | Media | Desviación típica | |
| ICAM-3+ | ||||
| LCCT inicial | 10,91 | 11,87 | 60,91 | 21,54 |
| LCCT avanzado | 6,57 | 5,71 | 68,57 | 27,19 |
| D. inflamatorias | 2,33 | 3,58 | 72,5 | 18,15 |
| Pre-LCCT | 4,38 | 3,07 | 67,5 | 24,93 |
| Sano | 0 | 0 | 15,25 | 17,04 |
| Total | 5,45 | 7,64 | 62,4 | 26,38 |
| p=0,005 | p=0,027 | |||
| ICAM-1+ | ||||
| LCCT inicial | 30,91 | 24,17 | ||
| LCCT avanzado | 37,14 | 33,4 | ||
| D. inflamatorias | 38,75 | 18,36 | ||
| Pre-LCCT | 29,63 | 23,93 | ||
| Sano | 5 | 0 | ||
| Total | 31,48 | 24,17 | ||
| p=ns | ||||
| LFA-1+ | ||||
| LCCT inicial | 15,27 | 15,54 | 59,27 | 27,89 |
| LCCT avanzado | 19,29 | 31,79 | 69,86 | 30,25 |
| D. inflamatorias | 3,92 | 4,12 | 69,17 | 15,64 |
| Pre-LCCT | 5,63 | 4,44 | 58,13 | 33,16 |
| Sano | 0 | 0 | 35 | 28,87 |
| Total | 9,4 | 16,15 | 61,33 | 27,19 |
| p=0,014 | p=ns | |||
| CLA+ | ||||
| LCCT inicial | 8,45 | 10,79 | 40,45 | 30,78 |
| LCCT avanzado | 7,71 | 6,9 | 29,29 | 24,23 |
| D. inflamatorias | 2,08 | 1,98 | 15,08 | 11,37 |
| Pre-LCCT | 2,63 | 3,02 | 23,57 | 21,16 |
| Sano | 0 | 0 | 1 | 0 |
| Total | 4,71 | 7 | 24,98 | 24,17 |
| p=ns | p=0,035 | |||
| VLA4+ | ||||
| LCCT inicial | 2,1 | 5,04 | 33,18 | 30,76 |
| LCCT avanzado | 3,2 | 3,42 | 55,83 | 32 |
| D. inflamatorias | 2,25 | 3,08 | 59,58 | 29,81 |
| Pre-LCCT | 6,38 | 9,2 | 40 | 26,05 |
| Sano | 0 | 0 | 5 | 4,08 |
| Total | 2,95 | 5,41 | 42,8 | 31,76 |
| p=ns | p=0,007 | |||
| CD103+ | ||||
| LCCT inicial | 3,91 | 4,16 | 8,36 | 14,73 |
| LCCT avanzado | 8,14 | 6,36 | 12,29 | 14,17 |
| D. inflamatorias | 8,83 | 4,55 | 25 | 20 |
| Pre-LCCT | 3,88 | 4,52 | 19,38 | 19,54 |
| Sano | 0 | 0 | 0,5 | 1 |
| Total | 5,64 | 5,27 | 15,12 | 17,93 |
| p=0,008 | p=0,012 | |||
CLA: cutaneous lymphocyte antigen; ICAM-3: intercellular adhesion molecule-3; ICAM-1: intercellular adhesion molecule-1; LCCT: linfoma cutáneo de células T; LFA-1: lymphocyte function associated antigen-1; p=ns: p no significativa; VLA-4: very late antigen-4.
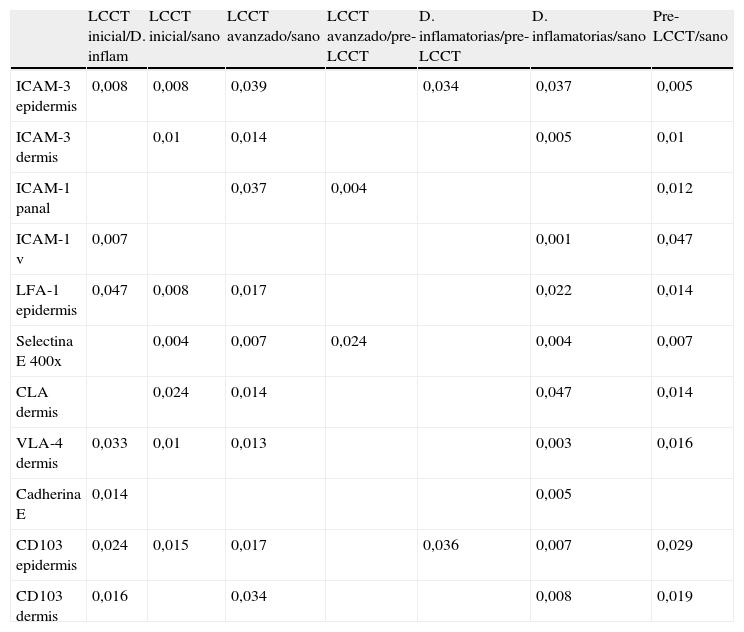
Análisis comparativo de la expresión de moléculas de adhesión en piel entre los diferentes grupos (p significativas)
| LCCT inicial/D. inflam | LCCT inicial/sano | LCCT avanzado/sano | LCCT avanzado/pre-LCCT | D. inflamatorias/pre-LCCT | D. inflamatorias/sano | Pre-LCCT/sano | |
| ICAM-3 epidermis | 0,008 | 0,008 | 0,039 | 0,034 | 0,037 | 0,005 | |
| ICAM-3 dermis | 0,01 | 0,014 | 0,005 | 0,01 | |||
| ICAM-1 panal | 0,037 | 0,004 | 0,012 | ||||
| ICAM-1 v | 0,007 | 0,001 | 0,047 | ||||
| LFA-1 epidermis | 0,047 | 0,008 | 0,017 | 0,022 | 0,014 | ||
| Selectina E 400x | 0,004 | 0,007 | 0,024 | 0,004 | 0,007 | ||
| CLA dermis | 0,024 | 0,014 | 0,047 | 0,014 | |||
| VLA-4 dermis | 0,033 | 0,01 | 0,013 | 0,003 | 0,016 | ||
| Cadherina E | 0,014 | 0,005 | |||||
| CD103 epidermis | 0,024 | 0,015 | 0,017 | 0,036 | 0,007 | 0,029 | |
| CD103 dermis | 0,016 | 0,034 | 0,008 | 0,019 |
ICAM-3: intercellular adhesion molecule-3; ICAM-1: intercellular adhesion molecule-1; CLA: cutaneous lymphocyte antigen; LFA-1: lymphocyte function associated antigen-1; VLA-4: very late antigen-4.
Se observaron diferencias estadísticamente significativas entre el número de linfocitos intraepidérmicos (p=0,005) y el porcentaje de células dérmicas (p=0,027) en los diferentes grupos de pacientes. Estas diferencias se presentaban entre todos y cada uno de los grupos patológicos considerados LCCT inicial, LCCT avanzado, enfermedades inflamatorias y pre-LCCT con el grupo sano. En el caso de los linfocitos epidérmicos ICAM-3 positivos también se observaron diferencias entre los grupos LCCT inicial y las enfermedades inflamatorias y entre este último y el grupo pre-LCCT. Los valores más elevados correspondieron al grupo LCCT inicial seguido por el avanzado y del pre-LCCT. El porcentaje medio de células del infiltrado dérmico ICAM-3+ fue mayor en el grupo de las enfermedades inflamatorias.
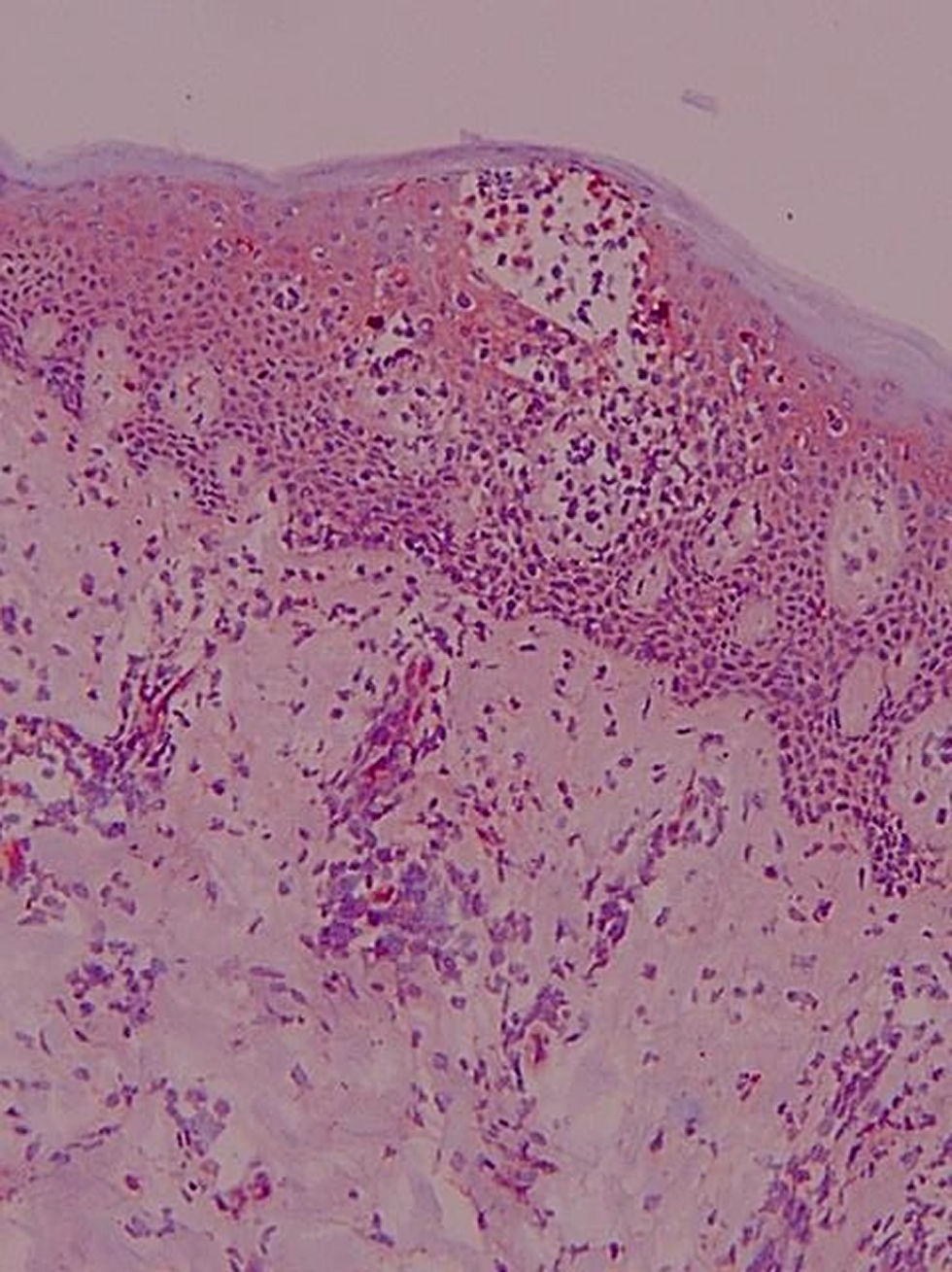
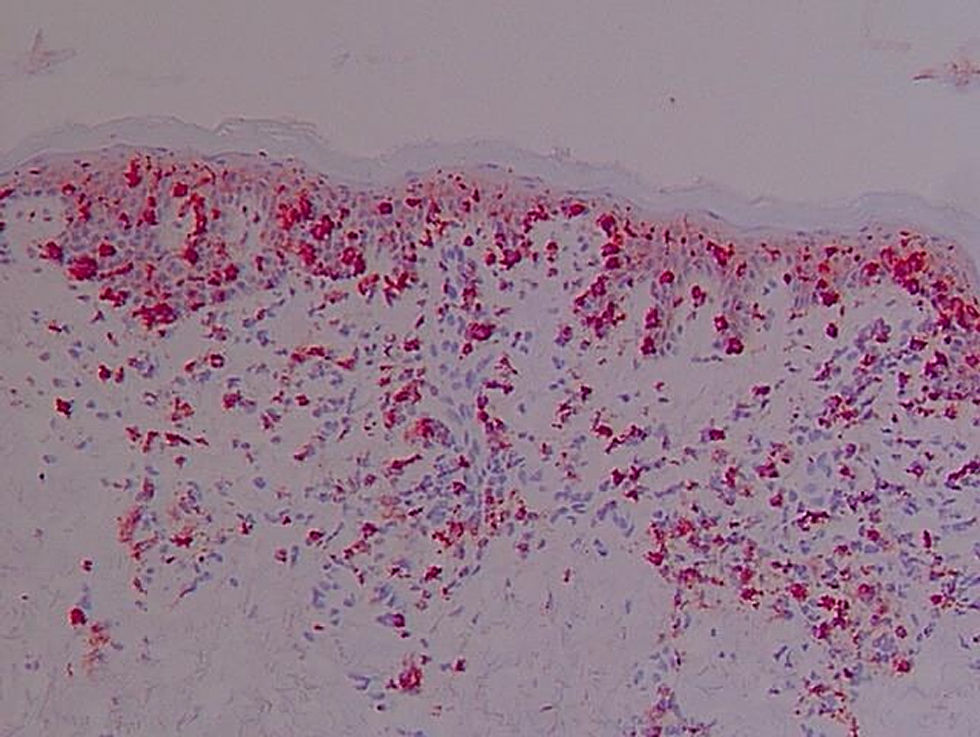
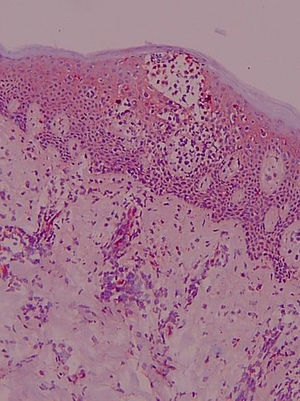
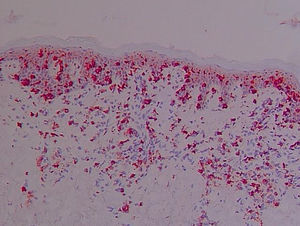
Antígeno ICAM-1 (CD54) (fig. 2)La lectura de estas preparaciones resultó ardua por la expresión de esta molécula de adhesión por varios tipos celulares. Su expresión constitutiva se hallaba limitada en la piel normal al endotelio. Sin embargo, en el resto de los grupos clínicos los queratinocitos mostraron una expresión variable. Se observó en una de las laminillas la presencia de un microabsceso con marcaje positivo para esta molécula de adhesión. En la dermis se apreció marcaje en vasos y de algunas células elongadas, además de la expresión en células de estirpe linfomonocitaria.
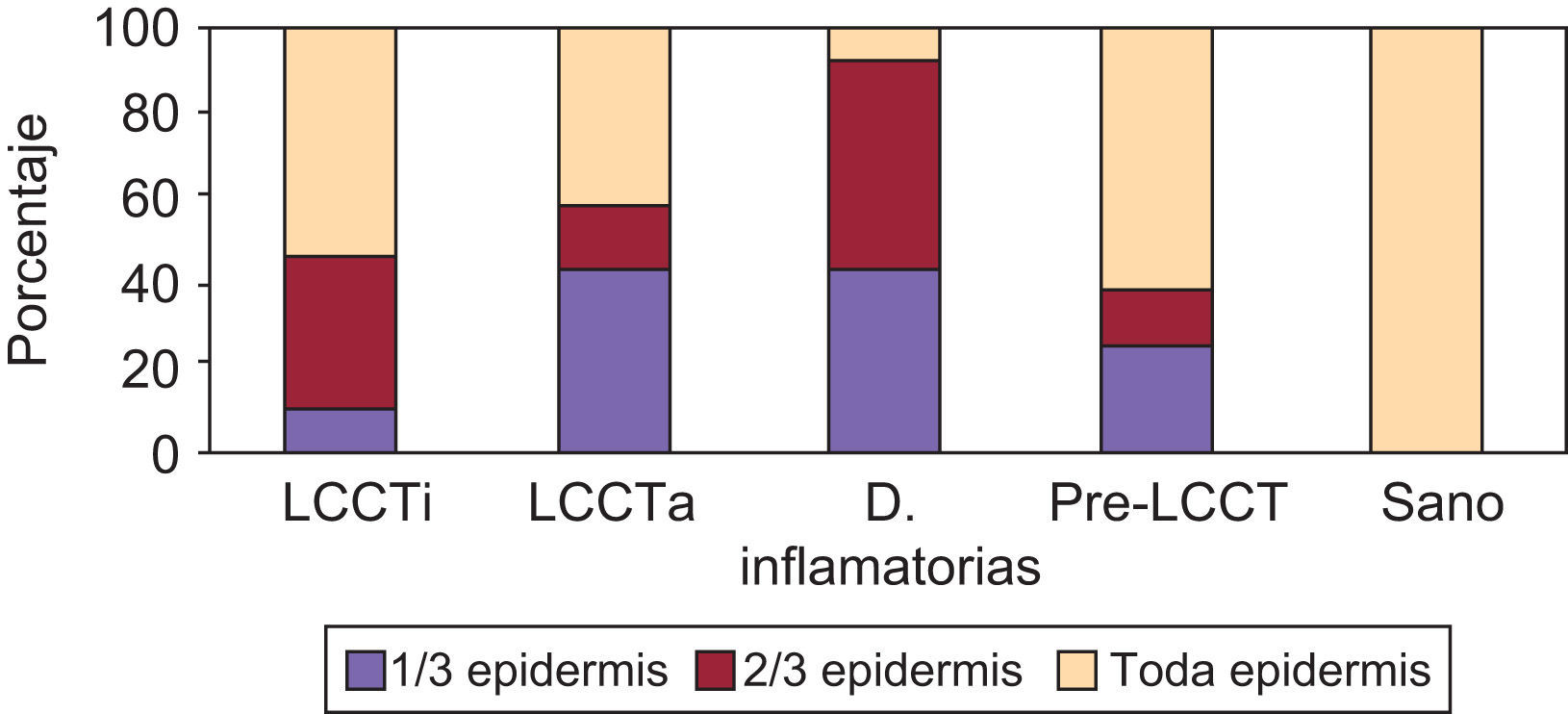
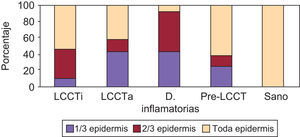
En la expresión de CD54 se cuantificó separadamente: 1) Localización de la tinción ICAM-1+ epidérmica (ausencia de tinción, 1/3 inferior, 2/3 inferiores, toda la epidermis); 2) Presencia de tinción ICAM-1+ en forma de panal (ausencia de tinción en forma de panal, +, ++ y +++); 3) Porcentaje de células ICAM-1+ en el infiltrado dérmico; 4) Expresión de ICAM-1 en vasos (+, ++, +++).
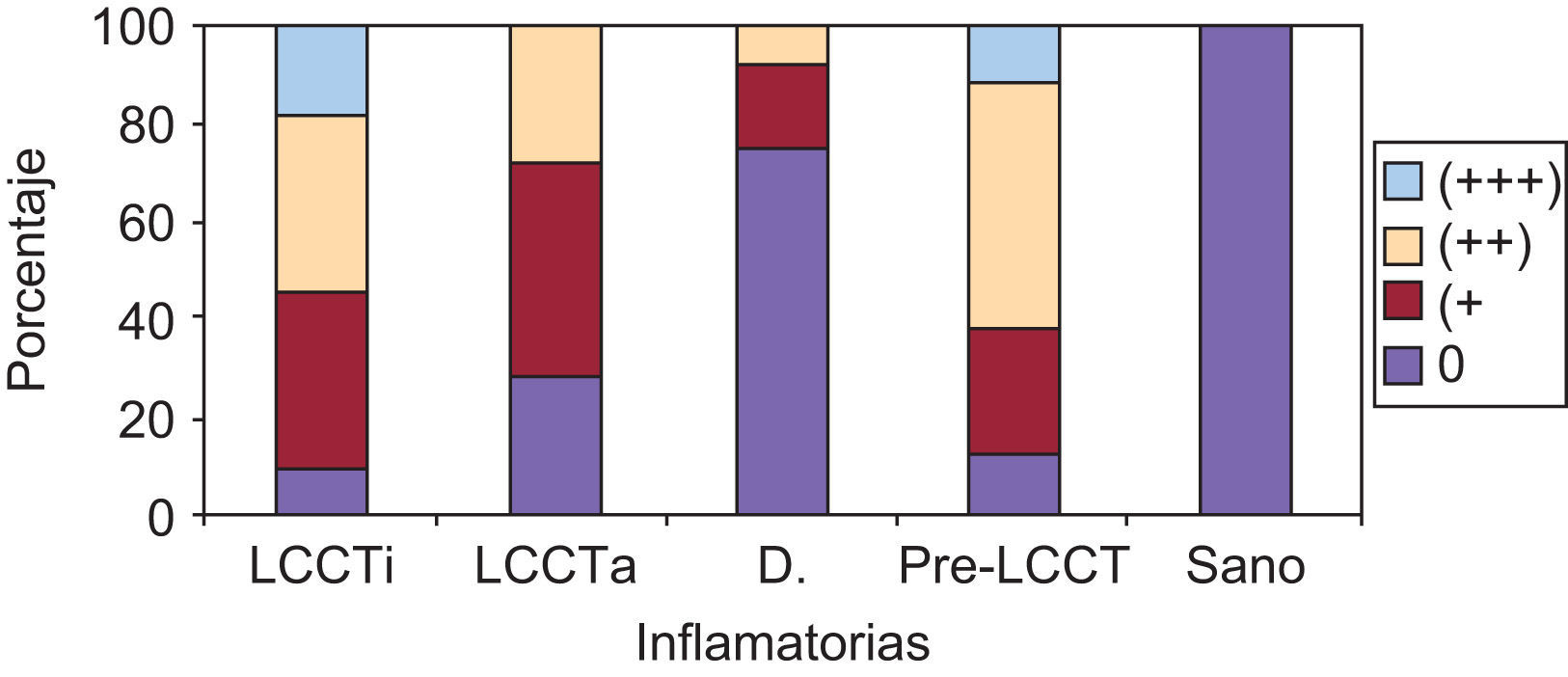
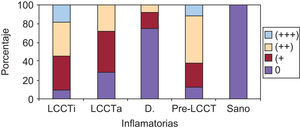
La tinción epidérmica de los queratinocitos adoptaba una morfología en panal de abeja, pudiendo ser esta focal, aislada, multifocal aislada o difusa epidérmica y abarcar mayor o menor espesor epidérmico, no encontrándose diferencias significativas (datos no mostrados). Sin embargo, sí se han hallado diferencias estadísticamente significativas (p=0,01) en la gradación con respecto a la presencia de tinción ICAM-1+ en forma de panal entre los grupos LCCT avanzado y pre-LCCT con el grupo sano y del grupo dermatosis inflamatorias con pre-LCCT (fig. 3).
No se ha observado la pérdida de expresión en pacientes con SS en esta serie, pero sí la presencia de una mayor gradación de la tinción en forma de panal +++ en los grupos pre-LCCT y LCCT estadios iniciales en un 12,5% y 18,2% de los casos respectivamente.
El porcentaje medio de células linfoides del infiltrado dérmico que expresaron ICAM-1 representaron un porcentaje del total de células menor que la expresión de ICAM-3, y aunque la expresión de CD54 fue mayor en las dermatosis inflamatorias y en los linfomas avanzados, respecto a los valores iniciales, esta diferencia no fue estadísticamente significativa.
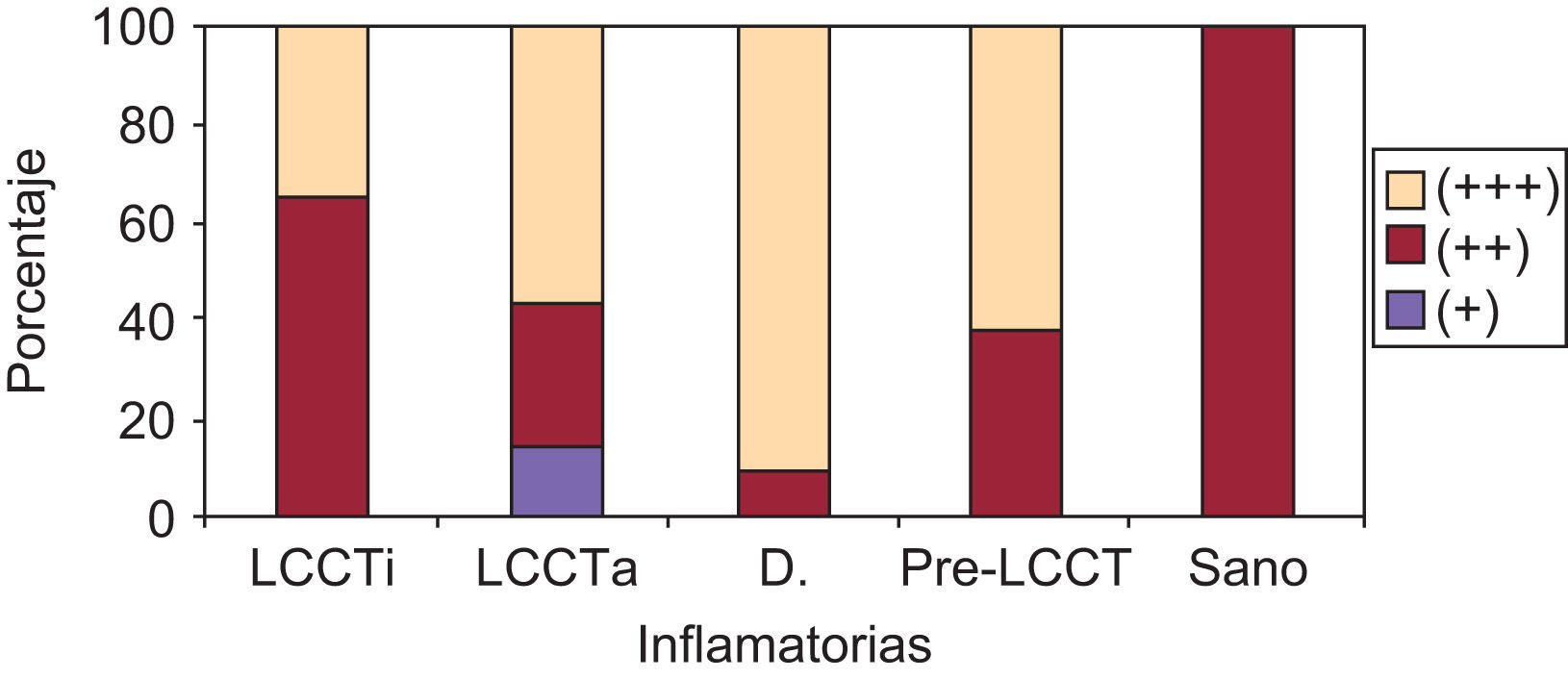
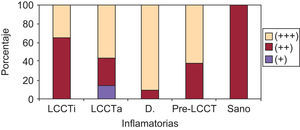
En la expresión de ICAM-1 en vasos (+, ++, +++) (p=0,016) se han observado diferencias estadísticamente significativas entre los grupos a LCCT inicial respecto a las dermatosis inflamatorias y de estas y los pre-LCCT con los sanos. Presentaron una mayor expresión las dermatosis inflamatorias mostrando una tinción +++ el 91,7% de estos pacientes (fig. 4).
Antígeno LFA-1En la piel sana se observó expresión de esta molécula de adhesión en las escasas células linfocitarias existentes en la zona perivascular y perianexial. En las muestras correspondientes a otras dermatosis, en la epidermis se apreció marcaje variable de las células linfocitarias intraepidérmicas y de algunas células de aspecto dendrítico. En la dermis se demostró expresión de LFA-1 por parte de células del infiltrado tumoral y el situado en áreas perivasculares.
Se valoraron independientemente la presencia en el interior de la epidermis de células linfoides y en el infiltrado dérmico.
No se hallaron diferencias en el porcentaje de células positivas del infiltrado dérmico entre los diferentes grupos, pero sí en el número de linfocitos intraepidérmicos (p=0,014); en los grupos LCCT, entre dermatosis inflamatorias y pre-LCCT respecto al sano y entre dermatosis inflamatorias y los LCCT iniciales. No obstante este estudio no podido demostrar diferencias en el porcentaje de células LFA-1 positivas entre fases avanzadas y precoces de LCCT.
Antígeno selectina-EEn las muestras valoradas únicamente se apreció tinción endotelial. Se valoró el número de vasos a 400× selectina-E+ (p=0,06). Considerando la observación de la tinción a 400× se pueden apreciar diferencias estadísticamente significativas de todos los grupos con respecto a los controles y diferencias entre los grupos de LCCT avanzado y las dermatosis inflamatorias (media 4,29 vs 3,91 respectivamente). Esta molécula se expresa en menos del 50% de los endotelios marcados con Ulex siendo aún menor la expresión para el grupo control (fig. 5).
Antígeno CLA (fig. 6)La piel sana mostró marcaje por células de morfología dendrítica epidérmicas, células de Largerhans, por células histiocitarias dérmicas y algunas células perianexiales.
En el resto de grupos, en la epidermis se observó expresión de abundantes células dendríticas y del infiltrado linfocitario intraepidérmico. La expresión por las células del infiltrado dérmico, de manera aislada y en acúmulos fue variable, aunque en la mayoría de casos representó un porcentaje del 50 al 75% de las células.
Se consideró por separado la expresión de CLA por los linfocitos intraepidérmicos, el porcentaje de células CLA+ del infiltrado dérmico y la expresión de la molécula en células grandes de morfología dendrítica en la dermis (dato no mostrado).
Únicamente se han podido demostrar diferencias estadísticamente significativas en el porcentaje de células CLA+ del infiltrado dérmico (p=0,035) de todos los grupos respecto al control, siendo el valor medio más elevado el correspondiente a linfomas iniciales. El número de linfocitos intraepidérmicos fue mayor en los LCCT iniciales sin poderse demostrar diferencias estadísticamente significativas entre los diversos grupos.
Antígeno VCAM-1Destaca en las muestras valoradas la escasa tinción para esta molécula de adhesión. No se observó tinción endotelial en las muestras correspondientes a piel normal.
Se ha observado en algunas de las muestras, correspondientes al resto de dermatosi la captación de anti-VCAM-1 por células de aspecto dendrítico situadas entre los queratinocitos epidérmicos y en el epitelio folicular. Dado el carácter ocasional de la observación, esta positividad no fue considerada para el estudio. Además se apreció la expresión ocasional por células elongadas perivasculares situadas en dermis.
Se valoró la presencia de expresión de esta molécula de adhesión en los vasos y se contabilizó el número de vasos positivos en toda la pieza, no apreciándose diferencias entre los diferentes grupos. La mayor expresión se objetivó en el grupo de dermatosis inflamatorias.
Antígeno VLA-4No se apreció expresión de esta molécula de adhesión en la epidermis de la piel normal. Solo expresaron esta molécula un porcentaje muy escaso de las células situadas en la dermis de piel normal. En el resto de dermatosis se observó el marcaje de células linfocitarias epidermotropas y la presencia de expresión en el infiltrado dérmico, siendo diferente entre las células aisladas situadas en la dermis papilar y las dispuestas en las áreas perivasculares situadas más profundas en la dermis. La variabilidad del marcaje fue amplia en las distintas muestras. Se consideró de forma independiente la expresión de VLA-4 en el infiltrado dérmico general, VLA-4+ en los acúmulos del infiltrado dérmico y la presencia de células VLA-4+ por campo epidérmico de 400x. El bajo número de pacientes, tres, con datos respecto al porcentaje de células VLA-4+ en los acúmulos del infiltrado dérmico hizo que se descartase para su análisis comparativo.
Se demostraron diferencias estadísticamente significativas en el porcentaje de células del infiltrado dérmico general (p=0,007), siendo estas entre todos y cada uno de los grupos patológicos y el sano y del grupo LCCT inicial y las dermatosis inflamatorias. El mayor porcentaje de positividad corresponde a las dermatosis inflamatorias (media 59,58%), aunque el valor máximo absoluto (90%) se observó en tres grupos patológicos.
Antígeno cadherina EEn las muestras correspondientes a piel normal se observó expresión de cadherina E en los queratinocitos epidérmicos y en el folículo piloso y los epitelios glandulares. También se apreciaron algunas células de aspecto dendrítico dispuestas de forma aislada en la dermis superficial y en el área perivascular.
En el resto de grupos clínicos se marcaron queratinocitos epidérmicos, siendo variable la intensidad de la tinción en los diferentes estratos de la epidermis en las diferentes muestras. En la dermis, se apreció marcaje de células dérmicas aisladas de morfología dendrítica, así como dispuestas en áreas perivasculares. También se observó presencia de tinción en los folículos pilosos y epitelios de glándulas sudoríparas.
Se valoró la gradación de la intensidad de tinción en epidermis (+, ++, +++) y la presencia de células de morfología dendrítica en dermis (no tinción, muy escasas, escasas, moderadas, abundantes y muy abundantes) (datos no mostrados) y la tinción de cadherina E en epidermis (1/3 inferior, 2/3 inferiores, toda la epidermis) (p=0,027) (fig. 7).
Se detectaron diferencias en la expresión de cadherina E entre los LCCT iniciales, las dermatosis inflamatorias y entre estas y el grupo control. Los grupos con mayor expresión correspondieron al grupo control y LCCT en fases iniciales, limitándose la expresión a los estratos más profundos de la epidermis en otras dermatosis.
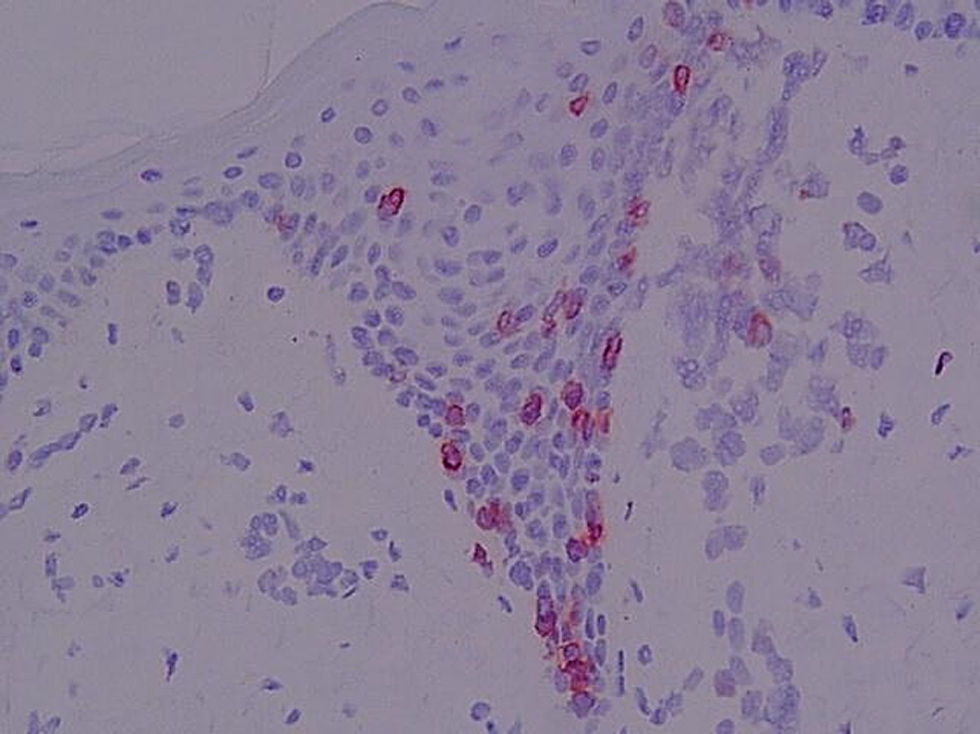
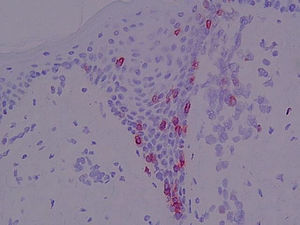
Antígeno αEβ7 (CD103) (fig. 8)En la piel normal se observó la tinción de alguna célula aislada perifolicular en la dermis y la ausencia de tinción epidérmica. En el resto de muestras se evidenciaron porcentajes variables de células CD103+ en la dermis y en la epidermis.
En algunas biopsias únicamente se apreciaron algunas células intraepidérmicas aisladas. Las células intraepidérmicas se distribuían a lo largo de la unión dermo-epidérmica, aunque los microabscesos de Pautrier fueron CD103−.
Se consideró el porcentaje de células CD103+ en la dermis (p=0,012) y el número de células linfoides CD103+ por campo epidérmico a 400× (p=0,008). En ambos parámetros se detectaron diferencias entre los LCCT iniciales y las dermatosis inflamatorias y entre LCCT avanzados, pre-LCCT y dermatosis inflamatorias con los sanos. En el caso de la expresión de CD103 en epidermis también se diferencia entre LCCT y sanos y dermatosis inflamatorias y pre-LCCT.
En este estudio se evidenció la presencia de CD103+ en el 83,3% de los infiltrados dérmicos observándose los mayores porcentajes en pacientes con atopia y psoriasis, al igual que ocurrió en el caso del contaje células intraepidérmicas CD103+.
En el caso de los LCCT en fases iniciales, se observó que los pacientes con contajes elevados de células CD103 en epidermis presentaron porcentajes bajos de expresión en el infiltrado dérmico, mientras que los pacientes con pre-LCCT presentan porcentajes elevados de positividad en el infiltrado dérmico.
DiscusiónLa localización de los linfocitos T en la piel es fundamental en la vigilancia inmune, la patogenia de las enfermedades inflamatorias cutáneas y de los linfomas cutáneos de células T. Los receptores de adhesión que regulan el tráfico de los linfocitos también se expresan y son funcionalmente activos en los linfomas no Hodgkin5,8.
ICAM-3, también denominada CD50, es una glicoproteína transmembrana tipo i de 120kDa. ICAM-3 se expresa constitutivamente en los leucocitos (linfocitos, monocitos y neutrófilos) y en las células de Langerhans11–13. ICAM-3 es el ligando de LFA-1 y alfaD beta2 y se une con gran afinidad a una lectina DC-SIGN que se halla en las células dendríticas. Existe una expresión relativamente uniforme en la intensidad de expresión de ICAM-3 en los linfocitos que infiltran la piel en las diferentes dermatosis. Esto estaría de acuerdo con la observación in vitro de que esta molécula no parece estar a una regulación significativa. La presencia y distribución de ICAM-3 en los diferentes grupos parece estar relacionada con la distribución de los leucocitos en las diversas dermatosis y muestran un patrón concordante con el publicado en la literatura12.
Se ha observado la presencia de expresión de ICAM-3 en pequeños vasos de neoplasias linfoides y en otros tumores que se ha asociado a la neoangiogénesis necesaria para la supervivencia tumoral14. En nuestro estudio que incluyó pacientes con MF en diferentes estadios, que no presentaban diseminación sistémica, y pacientes con SS no se ha observado la expresión de ICAM-3 en endotelios vasculares. La ausencia de tinción en los endotelios también ha sido observada en 15 casos de pseudolinfoma y linfoma cutáneos13 y en 5 pacientes con MF eritrodérmica12. Únicamente en un estudio se detectó la expresión en el endotelio, en algunas biopsias cutáneas de linfomas cutáneos con enfermedad sistémica, en 1 caso de 10 con MF, 6 con afectación sistémica conocida y en dos casos de seis con SS15. La significación biológica de estos hallazgos es desconocida y serán necesarias investigaciones adicionales y su confirmación en series más amplias de pacientes.
ICAM-1 o CD54 es una glicoproteína inducible y tras estimulación con determinadas citocinas (TNFα e INFγ), se expresa en los queratinocitos, las células de Langerhans, las células endoteliales y los fibroblastos16. ICAM-1 se une a LFA-1 expresado por leucocitos y a Mac-1, que se halla en los monocitos. Nickoloff et al observaron en un paciente con SS que los queratinocitos epidérmicos prácticamente no expresaban ICAM-1 y en pacientes con MF se ha comprobado una progresiva disminución de la expresión de ICAM-1 por los queratinocitos a medida que la enfermedad evoluciona a estadios más avanzados. Esto propiciaría que los linfocitos perdieran su unión LFA-1/ICAM-1 y perdieran su tropismo por la piel17.
No se ha observado la pérdida de expresión en pacientes con SS en esta serie al igual que otros autores18,19. Pero sí expresión en espesor epidérmico más amplio en pacientes con LCCT inicial coincidiendo con la observación de la expresión de ICAM-1 es más marcada en MF que en otras enfermedades16.
Por otro lado, el porcentaje medio de células linfoides del infiltrado dérmico es mayor en las dermatosis inflamatorias y en los linfomas avanzados respecto a los iniciales pero sin mostrar diferencias estadísticamente significativas. Pujol et al, también observaron que si bien la expresión del antígeno CD54+ era variable en el infiltrado, existía un mayor número de células CD54+ en estadios avanzados de la enfermedad18.
La integrina αLβ2 o LFA-1 «lymphocyte function associated antigen 1» es un antígeno de activación que se expresa en linfocitos, neutrófilos y monocitos. Esta molécula se une a las células endoteliales y/o a queratinocitos activados20. Los ligandos de LFA-1 son ICAM-1, ICAM-2 e ICAM-3. Las clonas epidermotropas en los LCCT expresan preferentemente este antígeno por lo que se ha sugerido que las células que no expresan estas moléculas escaparían al mecanismo de inmunovigilancia fisiológico, lo que podría implicar una evolución agresiva. Se ha observado que la mayoría de linfomas de bajo grado LFA-1+ negativizaban la expresión de esta MA durante la evolución de la enfermedad21 y otros autores detectaron la pérdida de este antígeno hasta en el 26% de pacientes con MF/SS, considerándola una posible alteración fenotípica frecuente. En este estudio no hemos podido demostrar diferencias en el porcentaje de células LFA-1 en fases avanzadas y precoces de LCCT.
La «Endotelial Leukocyte Adhesion Molecule 1» o selectina-E es expresada por los endotelios activados y se une a carbohidratos. Se expresa a nivel máximo a las 2–4h tras la activación celular y se une a oligosacáridos que contengan sLex aunque otros ligandos pueden ser lactosaminoglicanos sialilados o fucosilados22. En el presente estudio esta molécula se expresó en menos del 50% de los endotelios marcados con Ulex, siendo aún menor la expresión para el grupo control. Esta expresión pone de manifiesto que la activación de esta molécula de adhesión refleja la activación del endotelio, sin mostrar un patrón definido diferencial entre las diferentes patologías.
«Cutaneous Lymphocyte Antigen» (CLA) es expresado por un subgrupo de células T memoria que poseen la capacidad de circular preferentemente en la piel y constituyen el 10–15% de estas células. CLA es un antígeno carbohidratado relacionado con el antígeno sLex. Consiste en una modificación inducible de carbohidratos de P-selectin glycoprotein ligand-1 (PSGL-1) que se expresa constitutivamente en todas las células T circulantes y su ligando es la selectina-E6,7,23.
Se han observado diferencias estadísticamente significativas en el porcentaje de células CLA positivas en la dermis de todos los grupos respecto al control, demostrando el reclutamiento de este tipo de células en la inflamación y las enfermedades cutáneas, siendo los valores más elevados en el grupo LCCT inicial.
VCAM-1 o CD106, es una glicoproteína endotelial inducible que une leucocitos distintos a los neutrófilos y que también se halla presente en los macrófagos y las células dendríticas perivasculares, los fibroblastos de médula ósea y los mioblastos24. Normalmente VCAM-1 muestra una expresión luminal baja en los endotelios no estimulados. Los ligandos de esta molécula son las integrinas VLA-4 y α4β7. Se observaron de forma ocasional células de aspecto dendrítico intraepiteliales y perivasculares que no fueron consideradas para el estudio. Se ha sugerido que la expresión de VCAM-1 por células dendríticas perivasculares debe ser importante en el mantenimiento de la población linfoide residente en la piel no inflamada25.
Los cortes seriados de piel marcados con Ulex, selectina-E e ICAM-1 demostraron que la mayoría de los vasos que expresaban estas moléculas de adhesión eran VCAM-1 negativas, sugiriendo la regulación independiente de estas moléculas y su participación inespecífica en las patologías a estudio.
La integrina «very late antigen 4» (VLA-4) está compuesta por una subunidad alfa4 de mayor tamaño, y por una subunidad beta1. Pueden expresar VLA-4 la mayoría de los leucocitos a excepción de los neutrófilos. VLA-4 se une a VCAM-1 a través de los dominios 1.o y 4.o, a fibronectina y a sí misma. La valoración de la expresión de VLA-4 en el infiltrado dérmico permite diferenciar grupos patológicos respecto a sanos y LCCT iniciales respecto a las dermatosis inflamatorias en las que el porcentaje es más elevado.
En el posicionamiento de los linfocitos en la epidermis y en su interacción con los queratinocitos se ha implicado a αEβ7; habiéndose observado en estadios avanzados de MF con pérdida de epidermotropismo, la disminución en la expresión de αEβ726.
La integrina αEβ7 (CD103) es un antígeno de activación/proliferación y se expresa en células linfoides y macrófagos activados y en células de la tricoleucemia. Fue inicialmente descrito como específico de las células intraepiteliales de los linfomas intestinales y en linfocitos de la lámina propia y se expresa en menos del 2% de los linfocitos T circulantes. La expresión de CD103 ha sido estudiada en piel lesional de psoriasis apreciándose la expresión preferencial por parte de las células CD8+27,28. CD103 puede unirse a la cadherina E de las células epiteliales y mediar el posicionamiento de los linfocitos en el epitelio aunque otros autores han postulado que este ligando es independiente de cadherina E27,29.
En este estudio se ha observado presencia de contajes elevados de células intraepidérmicas CD103+ en los LCCT avanzados, debido a la presencia de numerosas células positivas en la unión dermo-epidérmica. El antígeno CD103 parece ser un marcador de células T con tropismo epitelial neoplásicas o no y su expresión en epidermis permite diferenciar todos los grupos entre sí excepto las fases de LCCT inicial y avazando.
Cadherina E es una molécula de adhesión transmembrana de 120kDa. Su dominio extracelular se halla implicado en uniones homotípicas reguladas por calcio. Su domino intracelular conecta con el citoesqueleto de actina a través de cateninas. En la piel sana se observa expresión de cadherina E en los queratinocitos epidérmicos y en el folículo piloso y epitelios glandulares30. En este estudio se ha apreciado una disminución en el grosor del estrato epidérmico que expresa cadherina E de LCCT inicial y pacientes sanos a aquellos con LCCT avanzado.
En este trabajo los parámetros de inmunotinción valorados en las biopsias cutáneas no han permitido demostrar diferencias estadísticamente significativas entre los grupos LCCT inicial y avanzado, pero sí con respecto a otras dermatosis. Los parámetros más informativos son el número de linfocitos CD103+ e ICAM-3+ por campo epidérmico de 400×. Estos permiten diferenciar a los grupos restantes a excepción de LCCT avanzado y pre-LCCT. Estos dos grupos presentan diferencias estadísticamente significativas en la observación de la expresión de selectina-E a 400× y la determinación del patrón en forma de panal de ICAM-1 en los queratinocitos epidérmicos. Estos hallazgos sugieren que la expresión de las MAC implicadas en la adhesión y trasmigración de los linfocitos a través del endotelio de los vasos dérmicos no difiere significativamente entre las fases inicial y avanzada de los LCCT, aunque estos datos deberían ser confirmados en series más amplias de pacientes.
FinanciaciónEste estudio ha sido financiado por becas de la Fundación Agustí Pedro i Pons e Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.