La leishmaniasis, infección endémica en España, está causada por protozoos del género Leishmania. Durante los años 2010-2012 hubo un brote de leishmaniasis cutánea y visceral en Fuenlabrada, Madrid.
ObjetivosDescribir los casos de leishmaniasis cutánea (LC) diagnosticados durante 17 meses en el Servicio de Dermatología del Hospital de Fuenlabrada.
Material y métodosEstudiamos variables epidemiológicas, clínicas, histológicas, microbiológicas y terapéuticas de cada caso.
ResultadosSe recogieron 149 pacientes. Encontramos una incidencia similar en varones que en mujeres, la edad más frecuente fue entre 46-60 años. El tiempo de evolución presentaba un pico de máxima frecuencia entre los 2 y 6 meses. La forma clínica más habitual fue la de pápulas y placas eritematosas sin costra (52%). En el 57% de los casos las lesiones eran múltiples. La localización más común fue en áreas fotoexpuestas. El estudio histológico mostró en el 67% de los pacientes una dermatitis granulomatosa no necrotizante sin parásitos con tinciones habituales. La reacción en cadena de la polimerasa (PCR) para Leishmania confirmó el diagnóstico en el 98% de los casos. En los demás el estudio histológico de la piel identificó cuerpos de leishmanias. Los antimoniales pentavalentes intralesionales fueron los fármacos más empleados (76%), con resultado satisfactorio.
ConclusionesPresentamos una serie amplia de casos de LC en el contexto de un brote. La forma más habitual fue la aparición de múltiples pápulas, y la forma histológica la dermatitis granulomatosa no necrotizante, en la que no se observaron leishmanias. La PCR en piel fue la prueba más importante para alcanzar el diagnóstico.
Leishmaniasis, an endemic infection in Spain, is caused by protozoan parasites of the Leishmania genus. Between 2010 and 2012, there was an outbreak of cutaneous and visceral leishmaniasis in Fuenlabrada, Madrid.
ObjectivesTo describe the cases of cutaneous leishmaniasis diagnosed over a 17-month period at the dermatology department of Hospital de Fuenlabrada.
Material and methodsWe analyzed the epidemiological, clinical, histological, and microbiological features of each case and also evaluated the treatments administered and outcomes.
ResultsWe studied 149 cases. The incidence of cutaneous leishmaniasis showed a peak in the age range between 46 and 60 years and was similar in men and women. At the time of consultation, the lesions had been present for between 2 and 6 months in the majority of patients. The most common clinical presentation was with erythematous plaques and papules without crusts (52% of cases). Lesions were most often located in sun-exposed areas and were multiple in 57% of patients. In 67% of cases, the histological study showed non-necrotizing granulomatous dermatitis with no evidence of parasites using conventional staining methods. Diagnosis was confirmed by polymerase chain reaction (PCR) in 98% of patients. In the remaining cases, the histological study revealed Leishman-Donovan bodies in the skin. Intralesional pentavalent antimonials were the most commonly used drugs (76% of cases) and produced satisfactory results.
ConclusionsWe have presented a large series of cases of cutaneous leishmaniasis diagnosed in the context of an outbreak. Multiple papules were the most common clinical presentation, with histology that showed non-necrotizing granulomatous dermatitis with no evidence of parasites. PCR of skin samples was the test that most frequently provided the diagnosis.
La leishmaniasis es una parasitosis causada por más de 20 especies de protozoos del género Leishmania. La transmisión se produce por la picadura de un díptero hematófago hembra del género Phlebotomus (Viejo Mundo) y Lutzomya (Nuevo Mundo). El reservorio y fuente de infección suelen ser animales domésticos y salvajes (zoonosis), pero también se describe la transmisión de humano a humano (antroponótica)1. Es una enfermedad endémica en más de 80 países de Latinoamérica, Asia, África y el Sur de Europa. En España la mayor parte de los casos, tanto de leishmaniasis cutánea (LC) como visceral (LV), están producidos por L. infantum y se distribuyen por la costa mediterránea, Aragón y centro de la Península. Es una enfermedad de declaración obligatoria1 que, sin embargo, probablemente esté infradeclarada.
La presentación clínica típica de la LC aguda en España es conocida como botón de Oriente. Consiste en una pápula asintomática, o discretamente pruriginosa, localizada en áreas expuestas que evoluciona hacia una placa infiltrada o una lesión nodular eritematosa que se ulcera en el centro en la mitad de los casos y se cubre con una costra seropurulenta1.
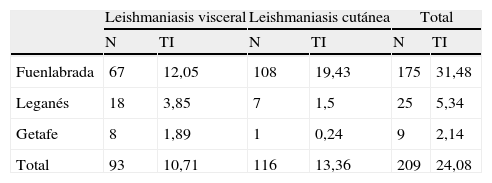
Los hallazgos del estudio histológico de la LC dependen del momento evolutivo de la lesión: en fases iniciales se suele observar un infiltrado inflamatorio denso y difuso en la dermis compuesto por linfocitos, células plasmáticas e histiocitos. Estos últimos contienen amastigotes en su interior. Conforme evoluciona la lesión se forma un infiltrado inflamatorio granulomatoso y se produce una disminución en el número de amastigotes, dificultando su identificación1. Durante los años 2010 y 2011 se detectó un aumento en el número de casos de LC y LV en la Comunidad de Madrid2. La mayoría de estos pertenecían a los municipios de Leganés y Fuenlabrada2. Así, entre julio de 2009 y diciembre de 2011 el número de casos de LV en Fuenlabrada fue de 67 (tasa de incidencia acumulada anual de 12,05) y de LC de 108 (tasa de incidencia acumulada anual de 19,43) (tabla 1)2. La mayoría de ellos vivía o había frecuentado la zona noroeste del centro urbano de Fuenlabrada, limítrofe con el término municipal de Leganés3.
Notificaciones de leishmaniasis entre julio de 2009 y diciembre de 2011 en los municipios de Fuenlabrada, Leganés y Getafe
| Leishmaniasis visceral | Leishmaniasis cutánea | Total | ||||
| N | TI | N | TI | N | TI | |
| Fuenlabrada | 67 | 12,05 | 108 | 19,43 | 175 | 31,48 |
| Leganés | 18 | 3,85 | 7 | 1,5 | 25 | 5,34 |
| Getafe | 8 | 1,89 | 1 | 0,24 | 9 | 2,14 |
| Total | 93 | 10,71 | 116 | 13,36 | 209 | 24,08 |
N: número de pacientes; TI: tasa de incidencia.
Fuente: Tomada de Brote comunitario de leishmaniasis en los municipios de Fuenlabrada, Leganés y Getafe (2009-2011)2.
La hipótesis inicial para explicar el aumento de casos de leishmaniasis en estos municipios es la existencia de una o varias zonas de riesgo para picaduras de Phlebotomus infectados, sobre todo durante los últimos meses de verano del año 2010, y como consecuencia de ello se produce una agrupación temporoespacial de personas enfermas3. Los reservorios que se han investigado son perros, gatos, ratas negras, liebres y conejos4. Dado que se obtuvo un resultado positivo para la enfermedad en un 7% de los perros investigados, se concluyó que estos no permitían por sí mismos explicar el incremento de casos en humanos5. Por ello, se decidió estudiar otras fuentes de alimentación de los vectores como las liebres, conejos, gatos y ratas5. Los resultados publicados de los que disponemos hasta ahora indican que un 30% de las liebres estudiadas están parasitadas por Leishmania, quedando por analizar algunas muestras y pendiente de asignación definitiva de subtipo de L. infantum5.
Presentamos 149 casos de LC diagnosticados en el Servicio de Dermatología del Hospital Universitario de Fuenlabrada (Madrid).
Material y métodoSe recogieron los casos de LC (con o sin afectación visceral y/o ganglionar) diagnosticados en el Servicio de Dermatología del Hospital Universitario de Fuenlabrada en un periodo de 17 meses (octubre de 2010-febrero de 2012). La población de referencia fue de 222.500 habitantes aproximadamente, incluyendo los municipios de Fuenlabrada, Moraleja del Enmedio y Humanes de Madrid. El diagnóstico se realizó por visualización directa del parásito en biopsia cutánea o PCR de Leishmania positiva en muestra de piel en fresco o en parafina. En cada caso se recogieron los siguientes parámetros: edad, sexo, lugar de residencia, animales de compañía en el domicilio, antecedentes de inmunosupresión, tratamientos previos realizados, tiempo de evolución de las lesiones desde su aparición hasta el momento de la consulta, presentación clínica (morfología de las lesiones, número, localización, tamaño), síntomas asociados, hallazgos en el estudio histológico cutáneo, resultado de la PCR para Leishmania realizada sobre muestra de piel, otras pruebas complementarias realizadas (analítica, radiografía de tórax, cultivos microbiológicos, etc.), afectación sistémica (adenopatías, fiebre, sudoración, pérdida de peso, hepato o esplenomegalia...), tratamiento efectuado y respuesta al mismo.
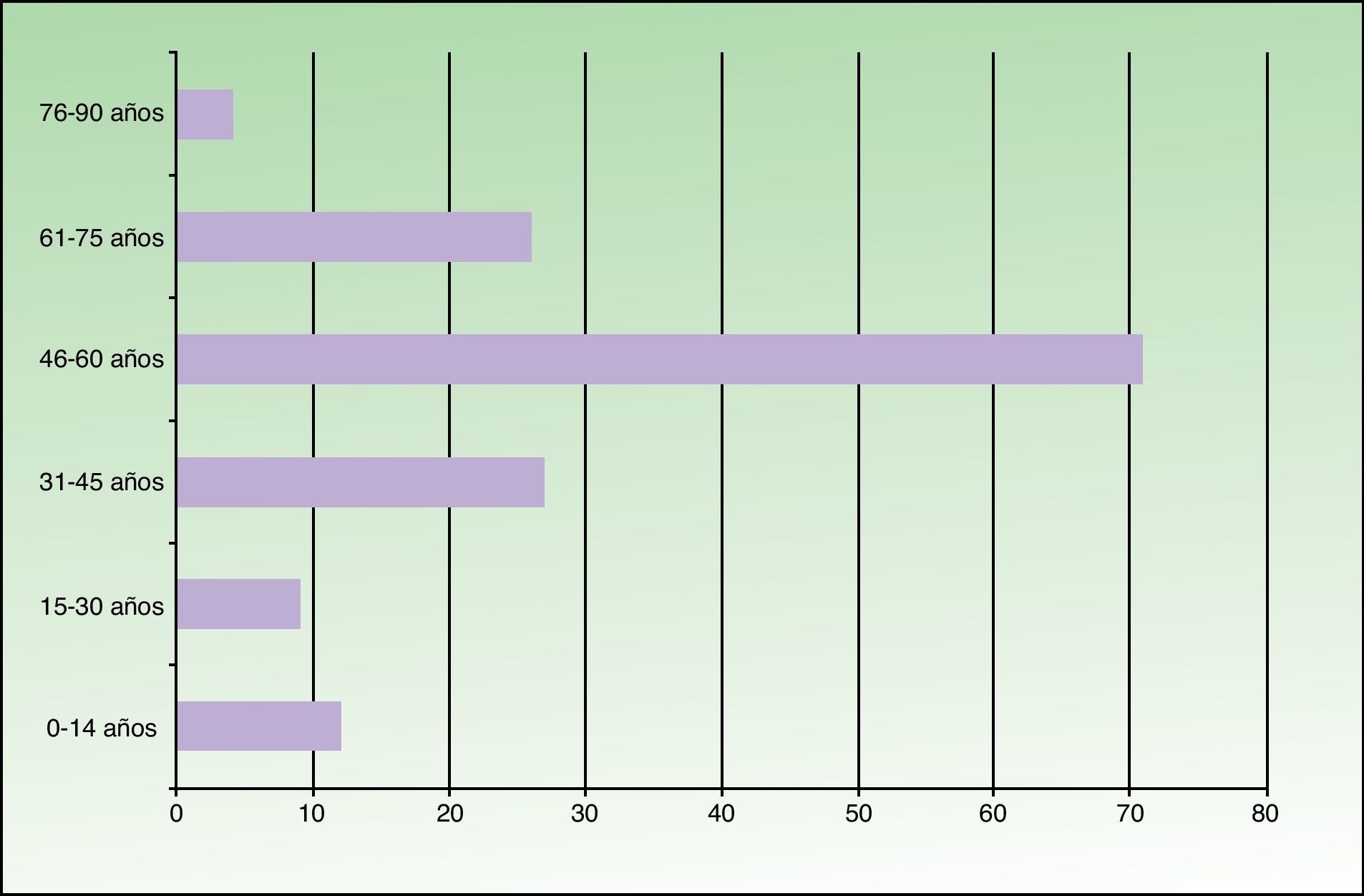
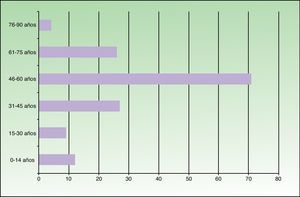
ResultadosDe los 149 pacientes estudiados 78 eran varones (52%) y 71 mujeres (48%). La edad oscilaba entre 6 meses y 81 años, con una media de 49,2. Se encontró un pico de máxima frecuencia (71 casos) en el grupo de 46-60 años. Doce pacientes eran menores de 14 años (fig. 1). El lugar de residencia habitual de 71 pacientes (48%) se situaba en el norte de Fuenlabrada, limítrofe con el municipio de Leganés. Más de la mitad de la población estudiada frecuentaba zonas verdes recreativas (parque de la Paz, parque de Polvoranca, Bosque Sur) y estaciones de transporte público (tren de cercanías) que se localizan en esta área. Diez pacientes tenían un perro en su domicilio.
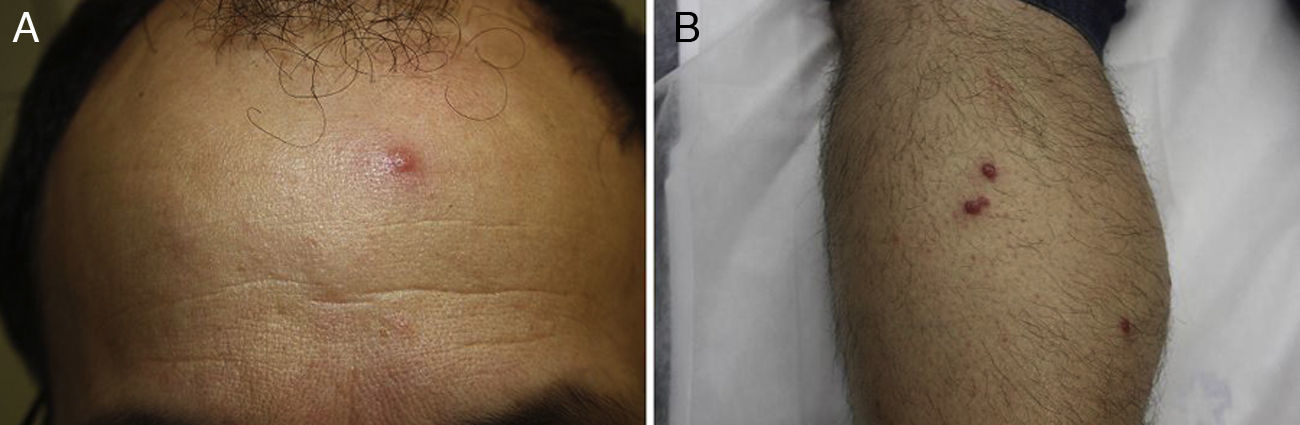
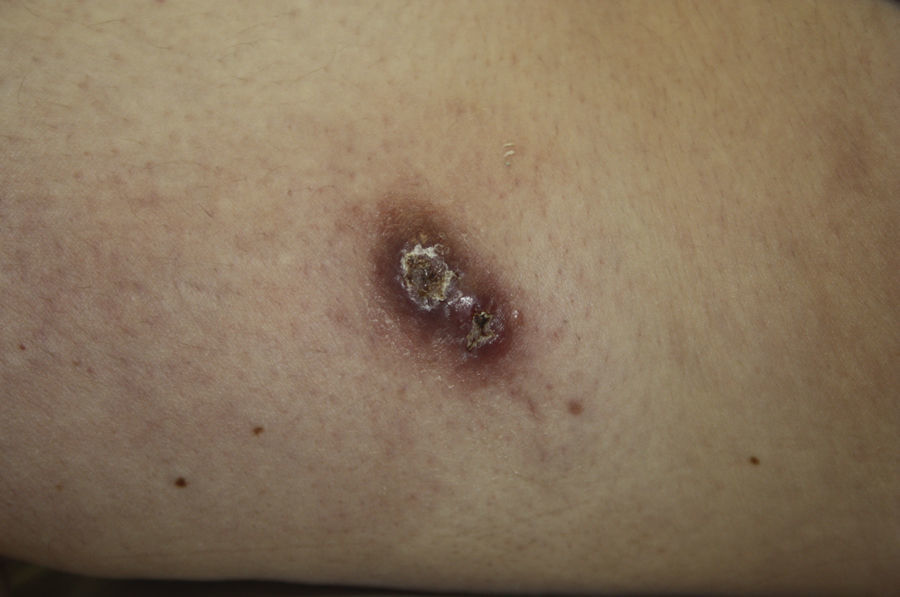
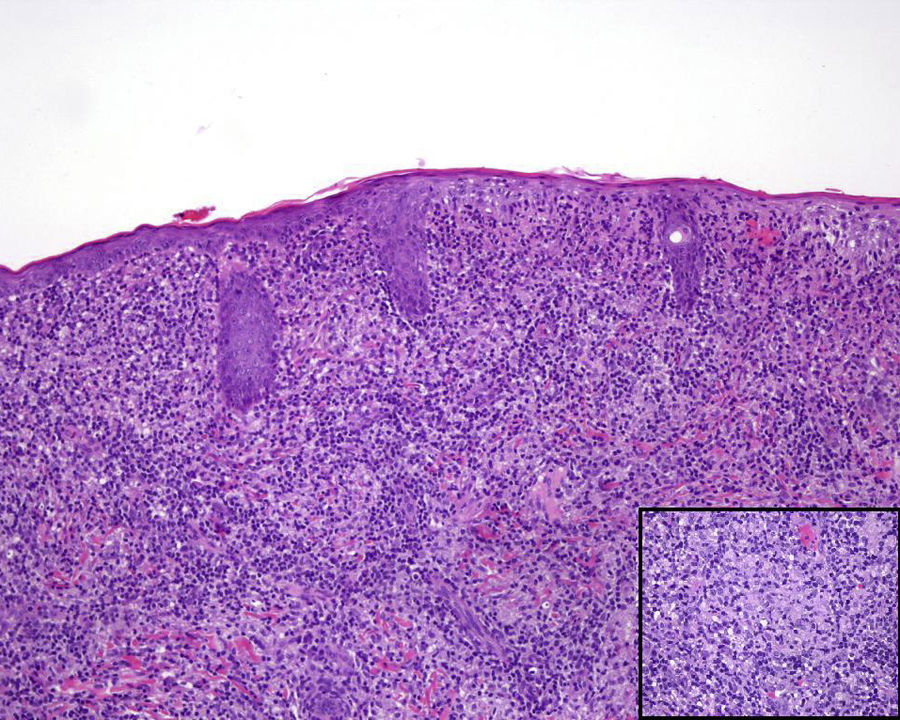
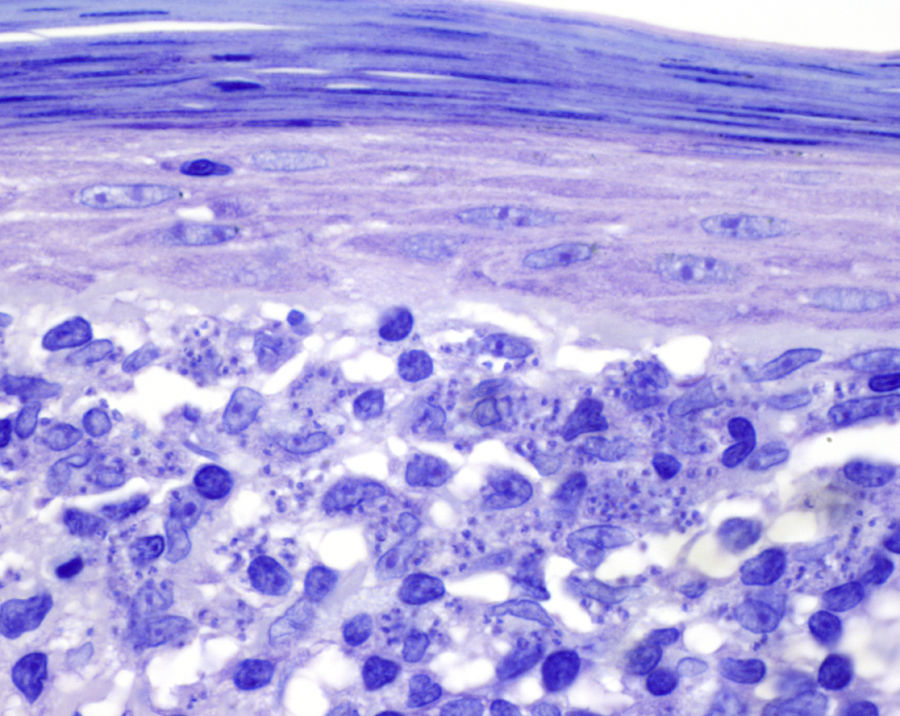
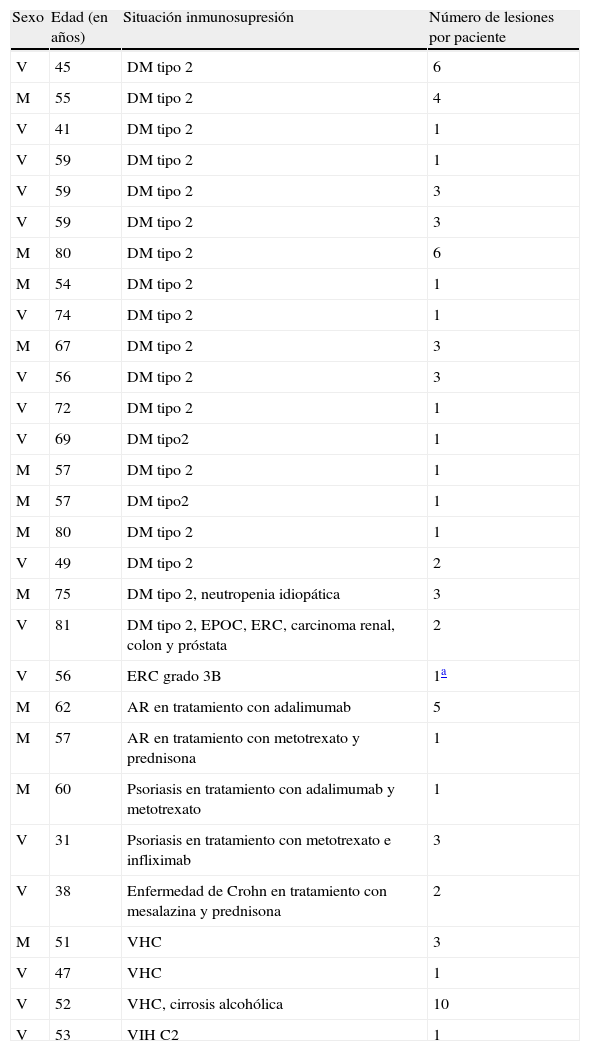
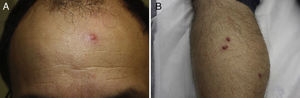
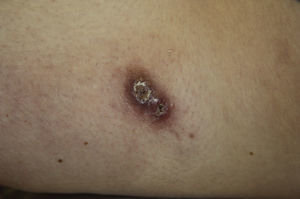
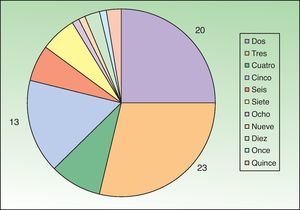
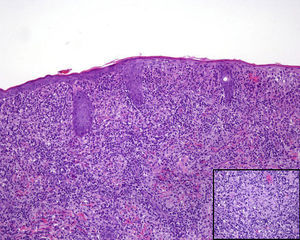
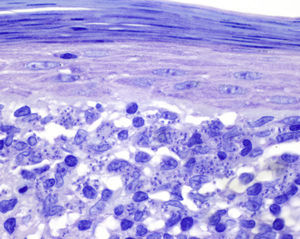
Encontramos antecedentes personales que podían suponer una situación de inmunosupresión en 29 pacientes (19%). La distribución según el tipo de afección se recoge en la tabla 2, siendo la más frecuente la diabetes mellitus tipo 2 en 17 casos. Además, había 3 pacientes en tratamiento con fármacos biológicos: una mujer de 62 años con artritis reumatoide tratada con adalimumab, un varón de 31 años con psoriasis que recibía metotrexato e infliximab y otra mujer de 60 años con psoriasis en tratamiento con metotrexato y adalimumab. Habían realizado tratamiento previo de las lesiones 46 pacientes (31%); en 26 de los casos fue con corticoide de alta potencia y/o antibiótico tópico. El tiempo transcurrido desde que apareció la lesión hasta que se realizó la consulta médica osciló entre medio mes y 42 meses. Hubo un pico de máxima frecuencia entre los 2 y los 6 meses (85 pacientes, 57%). De acuerdo a su morfología, clasificamos las lesiones en pápulas o placas eritematosas de superficie lisa o descamativa sin formación de costra, lesiones papulonodulares eritematosas con costra en superficie (botón de Oriente), lesiones eritematoanaranjadas (lupoides), lesiones psoriasiformes y un grupo aislado de casos (9%) con varias presentaciones clínicas o que no se podían encuadrar en los grupos anteriores y que recogemos en la tabla 3. Hubo 78 pacientes (52%) con pápulas o placas eritematosas de superficie lisa o descamativa sin formación de costra (fig. 2A), 50 (33%) con lesiones tipo botón de Oriente (fig. 3), 7 (5%) con lesiones lupoides y uno (1%) con lesiones psoriasiformes. En 64 pacientes (43%) la lesión era única y en 85 (57%) se identificaron lesiones múltiples (fig. 2B). Dentro de este último grupo lo más frecuente (43 casos) fue encontrar 2 o 3 lesiones por cada paciente, pero hubo 2 con hasta 15 lesiones (fig. 4). El tamaño de las lesiones en el momento de la consulta oscilaba entre 2 y 80mm. En 49 pacientes (33%) el diámetro lesional fue de 2-5mm. Las lesiones se localizaron preferentemente en las extremidades: en 51 individuos (34%) en las superiores y en 34 (23%) en las inferiores. En 27 (18%) se situaron en la cabeza y en 13 (9%) en el tronco. En 24 de los casos estudiados (16%) con lesiones múltiples estas se encontraron en más de una región anatómica que, además, estaban alejadas unas de otras (por ejemplo en extremidades inferiores y cara o en extremidades superiores e inferiores). En 115 pacientes (77%) las lesiones eran asintomáticas mientras que 34 de ellos (23%) tenían algún síntoma: 30 pacientes con prurito, 3 con dolor local y uno con sangrado. En el estudio histopatológico de las lesiones cutáneas en 100 de los casos (67%) se evidenció en la dermis superficial y profunda un infiltrado inflamatorio linfohistiocítico difuso, acompañado de células plasmáticas. Los histiocitos tenían morfología epitelioide y se disponían formando granulomas no necrotizantes (fig. 5). Con tinciones de Ziehl-Neelsen, Giemsa y PAS no se identificaron micobacterias, leishmanias ni hongos. Estos hallazgos correspondían a una dermatitis granulomatosa no necrotizante (DGNN). En 46 pacientes (31%) la biopsia cutánea mostró un denso infiltrado inflamatorio en la dermis superficial y profunda, constituido por linfocitos, células plasmáticas, histiocitos y algunas células gigantes multinucleadas. El citoplasma de algunos histiocitos contenía leishmanias (fig. 6). El resultado del estudio histológico de un paciente fue compatible con úlcera inespecífica, en otro con una dermatitis crónica linfohistocitaria y en otro con una dermatitis granulomatosa de tipo sarcoideo. Solicitamos la PCR para Leishmania sobre muestras cutáneas frescas o incluidas en parafina en 133 pacientes (89%). De ellos, en 131 (98%) el resultado fue positivo, identificándose L. infantum como la especie responsable de las lesiones. Los 2 casos (2%) en los que la PCR fue negativa tenían una biopsia previa en que se habían identificado cuerpos de Leishmania en el interior de los histiocitos, por lo que el resultado de la PCR lo interpretamos como un falso negativo. No se realizó la PCR en 16 sujetos (11%) debido a que el estudio histológico había sido diagnóstico al visualizar leishmanias en el interior de los histiocitos. En 20 casos se solicitó cultivo de muestras cutáneas. En 11 de estos se aisló L. infantum. El resto de muestras no se cultivaron, puesto que la realización de la PCR nos permitió llegar al diagnóstico de una forma más rápida.
Características de los pacientes con antecedentes de inmunosupresión
| Sexo | Edad (en años) | Situación inmunosupresión | Número de lesiones por paciente |
| V | 45 | DM tipo 2 | 6 |
| M | 55 | DM tipo 2 | 4 |
| V | 41 | DM tipo 2 | 1 |
| V | 59 | DM tipo 2 | 1 |
| V | 59 | DM tipo 2 | 3 |
| V | 59 | DM tipo 2 | 3 |
| M | 80 | DM tipo 2 | 6 |
| M | 54 | DM tipo 2 | 1 |
| V | 74 | DM tipo 2 | 1 |
| M | 67 | DM tipo 2 | 3 |
| V | 56 | DM tipo 2 | 3 |
| V | 72 | DM tipo 2 | 1 |
| V | 69 | DM tipo2 | 1 |
| M | 57 | DM tipo 2 | 1 |
| M | 57 | DM tipo2 | 1 |
| M | 80 | DM tipo 2 | 1 |
| V | 49 | DM tipo 2 | 2 |
| M | 75 | DM tipo 2, neutropenia idiopática | 3 |
| V | 81 | DM tipo 2, EPOC, ERC, carcinoma renal, colon y próstata | 2 |
| V | 56 | ERC grado 3B | 1a |
| M | 62 | AR en tratamiento con adalimumab | 5 |
| M | 57 | AR en tratamiento con metotrexato y prednisona | 1 |
| M | 60 | Psoriasis en tratamiento con adalimumab y metotrexato | 1 |
| V | 31 | Psoriasis en tratamiento con metotrexato e infliximab | 3 |
| V | 38 | Enfermedad de Crohn en tratamiento con mesalazina y prednisona | 2 |
| M | 51 | VHC | 3 |
| V | 47 | VHC | 1 |
| V | 52 | VHC, cirrosis alcohólica | 10 |
| V | 53 | VIH C2 | 1 |
AR: artritis reumatoide; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; M: mujer; V: varón; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
Lesiones cutáneas no clasificables
| Morfología de las lesiones | Número de pacientes |
| Pápulas o placas eritematosas erosivas | 4 |
| Varias placas eritematosas con y sin costra en la superficie | 4 |
| Pápulas eritematomarronáceas | 3 |
| Pápulas de color piel normal | 1 |
| Pápula eritematosa con erosión central y pápula eritematosa sin costra | 1 |
En pacientes con antecedentes personales de inmunosupresión y/o manifestaciones sistémicas se completó el estudio. Así, en 39 casos se realizó una analítica que incluía hemograma, bioquímica y autoinmunidad. No se encontraron alteraciones relevantes, salvo en una mujer con artritis reumatoide con anticuerpos antinucleares (ANA) y anticuerpos anti ADN positivos, un varón infectado por el VIH con neutropenia y una mujer con antecedentes personales de neutropenia idiopática, donde se evidenciaron neutropenia, anti Ro 60 y ANA positivos. Se realizó una radiografía de tórax a 16 pacientes. En una mujer de 43 años se identificó un granuloma pulmonar. En otro varón de 48 años sin antecedentes personales de interés, con una intradermorreacción de Mantoux mayor de 10mm a las 72 horas, no se visualizaron alteraciones en la prueba de imagen. Encontramos manifestaciones sistémicas en 6 sujetos: un varón de 47 años con pérdida de peso que no se consideró secundaria a la infección por Leishmania, puesto que no tenía otras alteraciones en la exploración física (no se objetivaron adenopatías ni organomegalias abdominales), ni en las pruebas complementarias y 5 pacientes (4 varones y una mujer) con adenopatías de localización en la cabeza y el cuello. De ellos solo se encontraron antecedentes personales de inmunosupresión en un varón con enfermedad renal crónica grado 3B. La morfología de las lesiones cutáneas de los pacientes con adenopatías fue en 3 de tipo papulonodular eritematosa con costra en superficie y en los otros 2 se objetivaron pápulas eritematosas sin costra. Uno con este segundo tipo de lesiones presentó hasta 11, el resto tenían lesiones únicas. En 4 de los casos, los grupos ganglionares afectados correspondían a territorios de drenaje de la zona donde se situaban las lesiones cutáneas de leishmaniasis. En la analítica y en la ecografía abdominal no se encontraron alteraciones. El estudio patológico ganglionar realizado mediante punción aspiración con aguja fina (4 pacientes) o mediante análisis de una adenopatía resecada (un paciente), no evidenció alteraciones en un caso, en otro fue compatible con una linfadenitis reactiva inespecífica y en los otros 3 mostró hallazgos compatibles con una linfadenitis por Leishmania. Recibieron tratamiento específico de las lesiones 103 pacientes (69%). En 78 de estos se empleó el antimoniato de meglumina intralesional (il). El número de infiltraciones realizadas por lesión y sujeto osciló entre una y 8, con un intervalo de una semana entre dosis. La cantidad de fármaco empleado en cada sesión fue de entre 0,5 y 1 cc/lesión. Se logró la curación de 62 pacientes (79%) y los 16 restantes están pendientes de completar tratamiento, pero presentan buena evolución de las lesiones. Destacamos la aparición de reacción inflamatoria perilesional secundaria al tratamiento en 9 casos (6%). Catorce pacientes realizaron pautas de tratamiento combinado con antimoniato de meglumina il y otras terapias. Las formas detalladas de tratamiento empleadas se recogen en la tabla 4. Se obtuvo la resolución de las lesiones en todos los casos. La crioterapia se usó con éxito en monoterapia en 9 pacientes. El número de sesiones aplicadas sobre cada lesión osciló entre una y 3. Dos de los pacientes con linfadenitis por Leishmania recibieron anfotericina B liposomal intravenosa (3mg/kg/día, 5 dosis), con curación de las lesiones. La otra paciente con linfadenitis por Leishmania curó de forma espontánea, tanto de las lesiones cutáneas como de las adenopatías; el paciente con linfadenitis reactiva recibió 3 infiltraciones de antimoniato de meglumina il con resolución de las lesiones, y el que presentaba adenopatías laterocervicales con estudio citológico normal, curó después de cuatro infiltraciones de antimoniato de meglumina il. Hubo 32 individuos (21%) que no recibieron tratamiento específico. De ellos 9 se perdieron en el seguimiento y dejaron de acudir a consultas, 15 presentaron resolución espontánea y en 8 la biopsia cutánea resultó diagnóstica y terapéutica.
Pacientes que recibieron tratamiento combinado
| Pautas de tratamiento | Número de pacientes |
| Crioterapia en una lesión y resolución espontánea del resto | 3 |
| Resolución con biopsia de una lesión e infiltración con antimoniato de meglumina il en el resto | 1 |
| Antimoniato de meglumina il×2+crioterapia | 4 |
| Antimoniato de meglumina il×3+crioterapia | 2 |
| Antimoniato de meglumina il×4+extirpación | 1 |
| Antimoniato de meglumina il×9+2 sesiones de terapia fotodinámica+itraconazol 100mg cada 24 h oral por 10 días | 1 |
| Itraconazol 100mg/12h oral, crioterapia×1 | 1 |
| IL×5 abdomen,×6 piernas, anfotericina B liposomal (3mg/kg/día iv total de 10 días)a | 1 |
Por último, hay 14 pacientes (10%) que están pendientes de iniciar tratamiento de las lesiones.
DiscusiónLa serie de casos que presentamos destaca por el elevado número de pacientes con LC para un tiempo de 17 meses y un lugar determinado. En series publicadas previamente en España el número de casos es menor y los periodos de seguimiento mayores6–9. En otros trabajos hubo un discreto predominio en la población femenina8,9, que difiere con la ligera mayor incidencia, no significativa, en varones que hubo en nuestra serie. Además, destaca la baja incidencia de LC en edad pediátrica (8% en menores de 14 años), a diferencia de series previas en que encontramos cifras de 56% de los casos en menores de 5 años7, 38% en menores de 12 años8 o 30% en menores de 14 años9. Los autores explican la mayor incidencia en la infancia por una inmadurez del sistema inmune, mayor penetrabilidad de la piel y más prolongada exposición al vector.
Los casos mostraron una marcada agrupación geográfica en torno a la zona norte del municipio de Fuenlabrada. En este lugar ha habido cambios medioambientales recientes importantes, que probablemente hayan contribuido a la proliferación de los vectores originando focos de leishmaniasis, como la creación de un espacio protegido que alberga una superpoblación de lepóridos o la existencia de parques o áreas recreativas10. El hecho de que se hayan detectado liebres infectadas en zonas colindantes a la población afectada, y que no se haya encontrado un aumento proporcional de la prevalencia de enfermedad o infección en el perro, hace que en este brote se puedan considerar a las liebres como reservorios10. De este modo, existiría un ciclo de transmisión silvestre, no descrito hasta ahora en nuestro medio10 y que condicionaría cambios en las medidas de control epidemiológico a adoptar.
El tiempo de evolución de las lesiones cuando los pacientes consultaron fue discretamente inferior (2-6 meses) a lo observado en otros trabajos (media de entre 6-8 meses)7–9. El tamaño de las lesiones más frecuente en nuestra serie (2-5mm) fue ligeramente menor a lo encontrado en estudios previos, en los que la media de las lesiones tenía en torno a 1cm de diámetro7–9. La forma de presentación clínica de la LC más frecuente en nuestro trabajo fue la de pápulas o placas eritematosas de superficie lisa o descamativa, sin formación de costra y con lesiones múltiples. Este hallazgo difiere con el de otras series6–9 en que la morfología de las lesiones más habitual fue la de lesión única papulonodular con costra (botón de Oriente). En los últimos años se observan con mayor frecuencia en la práctica clínica diaria formas atípicas de LC. Una de ellas es la que se presenta con lesiones múltiples11. Se caracteriza por la presencia de varias pápulas o nódulos eritematosos asintomáticos, muy similares entre sí salvo por el tamaño. Las lesiones se pueden localizar próximas o alejadas unas de otras11. El desarrollo de estos cuadros puede explicarse por la interacción de varios factores: unos dependientes de Leishmania (especie, tropismo, capacidad infectiva, patogenicidad y virulencia), otros dependientes del vector (número de picaduras del mosquito, especie y composición de la saliva) y otros dependientes del huésped (situación inmunitaria y susceptibilidad genética)1. A diferencia de otras revisiones publicadas7–9, en nuestra serie la localización más frecuente de las lesiones fueron las extremidades. Esto se podría explicar porque, probablemente, la mayor parte de las picaduras se produjesen en los meses de verano, cuando por el tipo de vestimenta las extremidades están descubiertas. En aproximadamente dos terceras partes de la muestra estudiada el estudio histológico de las lesiones cutáneas fue compatible con una DGNN y, por tanto, no resultó concluyente por sí mismo. En estos casos la realización de PCR para Leishmania a partir de biopsias cutáneas fue decisiva para llegar al diagnóstico definitivo de LC. La PCR es un método diagnóstico de alta sensibilidad (75-77% a 100%) y especificidad (100%) para la detección del ADN del parásito en frotis de exudados12 o en tejidos biopsiados13. La PCR sobre muestras de exudados ha demostrado ser una herramienta diagnóstica útil que evitaría otros procedimientos cruentos como la biopsia12. De acuerdo con la literatura revisada12–17 resulta útil en lesiones con escaso o nulo número de parásitos y hallazgos compatibles con dermatitis granulomatosa en la microscopia convencional. La técnica puede realizarse tanto en tejidos frescos12,13,17 como en tejidos incluidos en parafina14–16. Además, permite la identificación de la especie de Leishmania utilizando cebadores específicos15,17. Los autores proponen que la realización de la PCR para Leishmania debería incluirse de forma rutinaria en el estudio de dermatitis granulomatosas inespecíficas, aunque el paciente presente lesiones clínicas atípicas o poco sospechosas de LC14–16. Tres pacientes desarrollaron linfadenitis por Leishmania. En esta se produce la inflamación de un territorio ganglionar, asociada o no a lesiones cutáneas18–20. No implica la afectación sistémica. Su patogenia no está bien explicada, pero se propone que podría ocurrir por diseminación de macrófagos con amastigotes a los ganglios linfáticos o por el transporte de antígenos de Leishmania por células de Langerhans de la piel a los ganglios linfáticos18–20. En ocasiones se desarrolla después de realizar tratamiento de las lesiones cutáneas de forma intralesional18–20. Los objetivos del tratamiento de la LC son: acelerar el proceso de curación, minimizar el riesgo de cicatriz residual antiestética y prevenir la progresión de la enfermedad21,22. Se han empleado múltiples modalidades terapéuticas, incluyendo fármacos tópicos, intralesionales, sistémicos y métodos físicos1,9,21,22. Sin embargo, no hay ensayos clínicos bien diseñados para cada uno de ellos, por lo que el nivel de evidencia no está bien establecido21,22. En España se utiliza el antimoniato de meglumina il como fármaco de primera elección en el tratamiento de LC con lesiones únicas y de pequeño tamaño (menores de 4cm), aunque también hay casos descritos en la literatura con lesiones múltiples o de mayor tamaño en que se ha utilizado este fármaco con buenos resultados9. La forma de administración es la inyección desde la periferia de la lesión hasta su completo blanqueo9. Las dosis y pautas empleadas son variables9. En nuestro estudio el tratamiento de elección en 78 pacientes fue el antimoniato de meglumina il, logrando la resolución de las lesiones en el 79% de los casos, con resultados estéticos aceptables y escasa toxicidad sistémica. En las series previas8,9 también se utilizó este fármaco en la mayoría de los pacientes, logrando la curación de los mismos. La crioterapia con nitrógeno líquido se emplea fundamentalmente en niños y es, en general, eficaz y carente de riesgos1,9,21. En pieles de tonalidad oscura puede dejar hipopigmentación residual. De manera similar a lo empleado en nuestros pacientes, se puede utilizar de forma aislada o en combinación con otros tratamientos como el antimoniato de meglumina il9. La terapia fotodinámica se emplea cada vez con más frecuencia para la LC, con resultados cosméticos excelentes21. Las dosis requeridas no están bien definidas, pero en algunos de los artículos revisados se describe una sesión semanal durante un mes21. Su mecanismo de acción parece derivar de la destrucción tisular y de los macrófagos21. Además, se puede combinar con otros tratamientos21. En uno de nuestros pacientes, que presentaba una placa eritematosa con costra en la pierna derecha, empleamos la terapia fotodinámica como tratamiento después de haber fracasado el antimoniato de meglumina il que inyectamos en 9 ocasiones. Dado que después de 2 sesiones no observamos mejoría, decidimos iniciar itraconazol oral (100mg/24 horas durante 10 días), obteniéndose la curación. En lesiones aisladas y de pequeño tamaño se ha empleado la exéresis quirúrgica como alternativa terapéutica1,8,9. Así, en 8 de nuestros pacientes se empleó la biopsia-extirpación como técnica diagnóstica y, a la vez, terapéutica.
El imiquimod tópico al 5% se ha empleado, con resultados variables, en los últimos años en combinación con el antimoniato de meglumina en casos de LC que no responden a solo este último fármaco23,24. También encontramos casos de LC tratadas con éxito con imiquimod tópico después del fracaso de anfotericina B liposomal25. Aunque son necesarios más estudios, parece que este agente actuaría estimulando la respuesta inmune local e induciría la activación de macrófagos, que conllevaría el control de la enfermedad24. En la literatura revisada algunos de los criterios para iniciar tratamiento sistémico en la LC son los que aparecen recogidos en la tabla 526,27. Durante años los fármacos de elección dentro de esta modalidad terapéutica han sido los antimoniales pentavalentes. Sin embargo, debido a su importante toxicidad renal y cardiaca y a sus efectos adversos (artralgias, mialgias, fiebre, vómitos, elevación de enzimas hepáticas), en los últimos años se está sustituyendo por la anfotericina B liposomal con menor número de complicaciones21,22,26,27. Esta se emplea a dosis de 1-1,5mg/kg/día iv durante 21 días o 3mg/kg/día durante 10 días21,22,26,27. En los 2 pacientes de nuestra serie en los que usamos este fármaco no se produjeron efectos adversos y se logró la curación. Los azoles (ketoconazol e itraconazol) actúan inhibiendo la síntesis de ergosterol en la membrana del parásito. Las dosis a las que se han empleado son variables y los resultados contradictorios1,9. En algunas ocasiones la LC del Viejo Mundo es autorresolutiva en un periodo de meses, como ocurrió en 15 de nuestros pacientes. Sin embargo, en general, se debe tratar porque afecta a áreas expuestas cosméticamente importantes, por el riesgo de envolver a mucosas y por el riesgo de diseminación1,9. Para concluir, queremos destacar que en la serie de pacientes con LC que presentamos, tanto el ciclo de transmisión silvestre (liebres como reservorio) como la forma clínica de las lesiones (múltiples pápulas eritematosas sin costra) no son los habituales en los casos de LC en España. Además, de acuerdo a nuestra experiencia, creemos que la determinación de la PCR de Leishmania se debería incluir en el estudio de pacientes con DGNN sin otros hallazgos en áreas endémicas.
Indicaciones de tratamiento sistémico en la leishmaniasis cutánea
| Lesiones de gran tamaño (>4 cm)Múltiples lesiones (>5)Falta de respuesta a tratamiento tópicoDatos de diseminación locorregionalPacientes inmunodeprimidos (VIH)Lesiones en cara, orejasLesiones en manos y piesLesiones localizadas en zonas que puedan originar déficit funcionales |
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado verbal para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de la correspondencia.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses